Морфологические изменения, характерные для апоптоза, отмечены в ядерных слоях развивающейся сетчатки (Young et al., 1984). Такие наблюдения включают обнаружение ядерной конденсации, пикноз и фагоцитоз в GCL во время первой недели жизни. Биохимические техники для измерения фрагментации ДНК и изменений плазматических мембран, ассоциированных с апоптозом, подтвердили, что механизмом онтогенетической гибели RGC преимущественно является апоптоз. Причина такой клеточной гибели в развивающихся ретинальных ганглиолярных клетках является соответствующей её назначению в общем созревании млекопитающих: её целью является удаление ненужных структур (филогенетический апоптоз), она предназначена для контроля количества клеток (гистонгенетический апоптоз) и упомянутая ранее роль в скульптурировании сетчатки (морфогенетический апоптоз) (Cecconi et al., 1998).
Митохондрии играют важную роль в апоптозе (Fig. 5). В дополнение их повседневной роли как силовой станции клетки, эти органеллы с двойными мембранами содержат также множество белков, которые обладают caspase зависимыми и независимыми ролями, включая cytochrome c, apoptosis inducing factor (AIF), Smac/Diablo, endonuclease G и Omi/HtrA2.
Вторая группа состоит из мультидоменовых про-апоптических белков Bax, Bak и Bcl-XS, которые обладают BH1, 2 и 3 доменами. Значение Bax и Bak белков было продемонстрировано Bax/Bak двойными нокаутами. Большинство Bax/Bak дефицитных животных не подвергаются достаточному онтогенетическому апоптозу и погибают перинатально (Lindsten et al., 2000). Mouse
embryonic fibroblasts (MEFs), изолированные от таких эмбрионов не способны к MMP и последующему апоптозу (Wei et al., 2001). После олигомеризации эти BCL-2 белки затем вставляются в наружную митохондриальную мембрану, образуя поры, позволяющие проходить белкам в цитозоль.
Третья группа, группа с единственным BH3 доменом, включает Bim,
Bid, Bik, Bad, DP5/Hrk, Spike, Puma и Noxa (Danial and Korsmeyer, 2004). Эти белки действуют выше MMP как стражи специфических апоптических стимулов. BH3-only могут регулироваться как на транскрипционном, так и пост-трансляционном уровнях в нейронах, чтобы индуцировать апоптоз (Ham et al., 2005, Ley et al., 2005, Willis and Adams 2005). Путем устранения определенных членов анти-апоптического Bcl-2 семейства, которые связывают Bax/Bak, белки BH3 способствуют высвобождению Bax, разрешая ему индуцировать проницаемость митохондрий (Chen et al., 2005, Letai et al., 2002). Это позволяет Bax/Bak олигомеризоваться и индуцировать митохондриальную проницаемость. Было продемонстрировано, что ингибирование анти-апоптических белков достаточно, чтобы индуцировать апоптоз несмотря на присутствие непосредственного активатора Bax или Bak, таких как Bid or Bim (Kuwana et al., 2005). Кстати, исследования нокаута показали, что ни один из BH3-only белков не достаточен для возникновения клеточной гибели в нервной системе, указывая тем самым, что может быть определенный уровень перекрывания среди белков во время этого периода (Akhtar et al., 2004).
Про- и анти-апоптические Bcl-2 белки дифференциально экспрессируются в развивающейся и зрелой ЦНС. Bax экспрессируется на высоком уровне при начале развития клеточной гибели, с последующим подавлением в зрелых нервных тканях (Vekrellis et al., 1997). Исследования
bax нокаутных мышей продемонстрировало, что отсутствие этого гена, способствующего гибели, во время развития, оказывает слабый, но различимый эффект на взрослую сетчатку, приводя к утолщению внутреннего слоя нейробластов и увеличению количества клеток в GCL (Pequignot et al., 2003). Было сообщено, что обильная клеточная гибель наблюдается с E11.5 в развивающихся слоях как дикого типа, так и
Bax-/- мышей и продолжается вплоть до P1 (White et al., 1998). Однако, это исследование в дальнейшем установило, что TUNEL позитивные клетки по существу отсутствуют в RGC слое у Bax нулевых мышей между P1 и P4, приводя к более
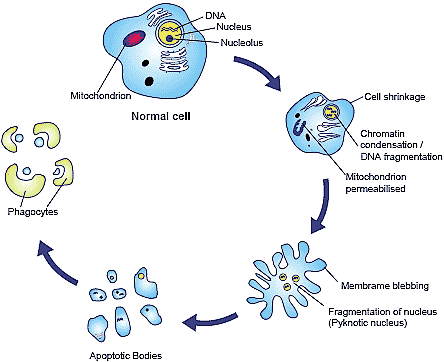 Fig. 4. Cell undergoing apoptosis. Apoptosis is marked by distinctive biochemical and morphological characteristics. These include chromatin condensation, cell shrinkage, blebbing of the plasma membrane, DNA and nuclear fragmentation and finally, cell fragmentation into
membrane bound vesicles termed "apoptotic bodies", which are then phagocytosed by macrophages or neighbouring cells.
Fig. 4. Cell undergoing apoptosis. Apoptosis is marked by distinctive biochemical and morphological characteristics. These include chromatin condensation, cell shrinkage, blebbing of the plasma membrane, DNA and nuclear fragmentation and finally, cell fragmentation into
membrane bound vesicles termed "apoptotic bodies", which are then phagocytosed by macrophages or neighbouring cells.
в двое большему количеству RGCs в постмитотической сетчатке. Очевидно, что эмбриональная онтогенетическая гибель клеток со ст. E11.5 является Bax-независимойt, Bax, по-видимому, необходим для онтогенетической гибели RGC в постнатальной сетчатке. Эти находки проливают свет не только на фундаментальное значение PCD для конструкции нормальной, функциональной сетчатки, но и также убеждают в вовлечении Bax в процесс онтогенетической гибели RGC (Mosinger Ogilvie et al., 1998, Pequignot et al. 2003,
White et al., 1998). У
Bax-/-Bak-/- двойных нокаутных мышей, гистология выявляет повышенные количества нейронов внутри GCL из зрелой сетчатки по сравнению с диким типом (Hahn et al., 2003). В самом деле, на ст. P7, периоде пика онтогенетического апоптоза, было выявлено, что имеется почти полное отсутствие TUNEL позитивных апоптических клеток в сетчатке этих нокаутных моделей. Bcl-2 экспрессируется также на высоком уровне во время эмбрионального и постнатального развития ЦНС, включая GCL, но снижение экспрессии совпадет со зрелостью (Chen et al., 2004, Isenmann et al., 1997, Levin et al., 1997). Мыши, дефицитные по Bcl-2 жизнеспособны при рождении и некоторые могут доживать до взрослого периода, но большинство погибает до ст. P14 (Michaelidis et al., 1996). Bcl-2 дефицитные мыши обнаруживают потерю примерно трети своих RGCs после периода естественно возникшей гибели клеток (Cellerino et al., 1999), указывая тем самым на важную роль Bcl-2 в выживании нейронов после периода онтогенетической PCD, но не для самой онтогенетической PCD. Мыши, дефицитные по анти-апоптическому гену,
Bcl-XL, испытывают эмбриональную летальность со ст. E13 из-за массивного апоптоза недоразвитых нейронов (Motoyama et al., 1995). Т.к. нет описаний фенотипа сетчатки, то эти находки указывают на критическую роль Bcl-XL в модуляции онтогенетического нейронального апоптоза.
Executioners of retinal ganglion cell death
Семейство cysteine aspartyl-specific proteases, наз. caspases, которых существует 15 у млекопитающих, является центральным регулятором апоптоза. Эти энзимы присутствуют в клетках в виде неактивных зимогенов и становятся активными в результате протеолитического процессинга или индуцированной близости (proximity). Каспазы, будучи активированными, участвуют в упорядоченном каскаде, кульминацией которого является протеолиз ключевых структурных и ядерных компонентов и в кончнои итоге деструкция клетки (Earnshaw et al., 1999). Идентифицированы два пути, которые активируют один из крупных исполнителей клеточной гибели, caspase-3. Они включают внешний путь, с вовлечением способствующих гибели рецепторов и лигандов и внутренний путь, который регулируется серией специфических способствующих гибели молекул, высвобождаемых в митохондриях (Fig. 5).
Внешний (death receptor) путь связан с активацией death рецепторов на клеточной поверхности, которые являются членами сверхсемейства tumour
necrosis factor (TNF) рецепторов. Эти рецепторы содержат цитоплазматический death домен, который будучи активированным путем связывания внешнего фактора, формирует смерть-индуцирующий сигнальный комплекс
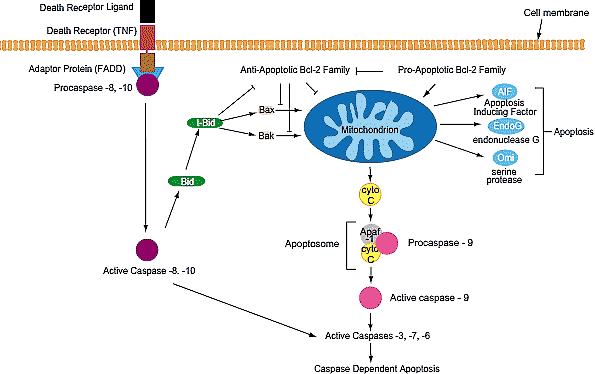
Fig. 5. Pathways of apoptosis. There are two major apoptotic pathways in the cell. The extrinsic pathway (left) involves the binding of extracellular ligands to death-promoting receptors, resulting in the formation of a death inducing complex (DISC). DISC, through the adaptor Fas-associated death domain (FADD) protein, then recruits procaspase-8, which in turn activates caspase-8. The intrinsic pathway (centre) is regulated by a series of specific death-promoting molecules released from the mitochondrion. Pro and anti-apoptotic BCL-2 family members compete at the mitochondrion surface to control the release of cytochrome-c. Once released, cytochrome-c associates with Apaf-1 and procaspase-9, in a dATP dependent manner, to form the apoptosome, which then activates caspase-9. The extrinsic and intrinsic pathways share a common end point at the level of caspase-3 activation. Interaction between these pathways is provided by caspase-8 triggered cleavage of Bid. Interaction of Bid with Bax or Bak at the mitochondrial outer membrane results in cytochrome-c release. The anti-apoptotic BCL-2 family can prevent such release by direct interaction with Bax and/or Bak. Further caspase-independent pathways (right) may occur through the release of apoptogenic molecules such as Apoptosis-Inducing Factor (AIF), Endonuclease G (EndoG) and Omi/HtrA2.
(DISC) в клетках (Ashkenazi and Dixit, 1998). Этот комплекс может
активировать procaspase-8 с помощью димеризации посредством адапторной молекулы Fas activated death domain (FADD) (Boatright et al., 2003).
Активированная caspase-8 может затем расщеплять и запускать исполнительную
procaspase-3 (Ashkenazi and Dixit, 1998).
Внутренне присущий (митохондриальный) путь активируется с помощью различных апоптических стимулов и использует высвобождение cytochrome-c из митохондрий в цитозоль, которая в свою очередь активирует протеолитический каскад (Li et al., 1997). Cytochrome c взаимодействует с C-терминальными WD-40 повторами адапторной молекулы Apaf-1, вызывая конформационные изменения, которые делают возможным связывание dATP/ATP. Возникший в результате мультимерный комплекс затем рекрутирует caspase-9, чтобы сформировать активный голоэнзим, apoptosome (Jiang and Wang, 2004,
Acehan et al., 2002). Caspase-9 расщепляет каспазы убийцы, такие как caspase-7 и caspase-3. Активированная caspase-3 расщепляет caspase-2 и caspase-6, при этом caspase-6 оказывается способной расщеплять caspase-8 и -10 (Slee et al., 1999).
Взаимодействие между внешними и внутренними путями обеспечивается с помощью укороченных Bid молекул посредством действия caspase-8. Этот энзим, как было установлено, расщепляет Bid, приводя к последующей транслокации С-терминального конца в митохондрии и способствуя высвобождению cytochrome-c посредством активации Bax (Li et al., 1998, Luo et al., 1998). Активация каспаз может быть эндогенно ингибирована за счет действия inhibitor of apoptosis proteins (IAPs), среди которых XIAP, c-IAP1 и c-IAP2 могут непосредственно ингибировать каспазы. Путем использования разных механизмов, XIAP ингибирует caspases -3, -7 и -9 посредством их baculovirus IAP repeat (BIR) доменов (Salvesen and Duckett, 2002). IAPs сами по себе могут противодействовать своему действию посредством IAP antagonist белков, таких как Smac, его мышиного гомолога DIABLO и serine protease Omi/HtrA2. Эти белки, которые высвобождаются вместе с cytochrome c из ставших проницаемыми митохондрий, могут высвобождать каспазы от IAPs путем соединения с BIR доменами посредством AVP (I/S) связывающего мотива (Du et al., 2000, Verhagen et al., 2000, Suzuki et al., 2001, Salvesen and Duckett, 2002).
Каспазы играют жизненно важную роль в некоторых случаях гибели взрослых RGC (McKinnon et al., 2002, Kermer et al., 1999). Имеется также множество доказательств, подтверждающих центральную роль каспаз в клеточной гибели в GCL. Анализ нокаутных животных оказался фундаментальным в идентификации роли Apaf-1 и членов семейства каспаз в онтогенетическом апоптозе нейронов in vivo. Apaf-1 нулевые мыши характеризуются гиперплазией сетчатки и изменениями хрусталика (Cecconi et al., 1998), тогда как caspase-9 нулевые мыши обнаруживают избыточное накопление большинства клеток ЦНС (Hakem et al., 1998). Мыши. лишенные caspase-3, характеризуются пониженным апоптозом в нейронах ЦНС, что приводит к гипертрофии головного мозга и преждевременной гибели (Kuida et al., 1996). Пока это делает невозможным изучение эффектов устранения caspase-3 в зрелой ЦНС сетчатке и в отношении онтогенетического апоптоза. Недавнее исследование Zeiss с коллегами роли caspase-3 в постнатальном развитии сетчатки (Zeiss et al., 2004) показало, что активные caspase-3 иммуно-позитивные клетки обнаруживаются в развивающемся GCL новорожденных caspase-3 достаточных мышей. Однако, отмечено, что сходное окрашивание отсутствует в GCL caspase-3-/- мышей, несмотря на присутствие погибающих клеток. Отмечается также, что устранение caspase-3 не полностью ингибирует онтогенетический апоптоз, а вызывает лишь временную задержку, указывая тем самым на существование альтернативного, возможно компенсаторного, caspase-3 независимого пути. Было также обнаружено, что каспазы необходимы для развития RGC в эмбриональной сетчатке кур. Исследования ранней PCD в нейроэпителии сетчатки у эмбрионов кур на ст. E2-E6
предоставили доказательства в пользу роли caspase-3 в онтогенетическом апоптозе (Mayordomo et al., 2003). В этом исследовании TUNEL-позитивные клетки окрашивали на активную caspase-3 и использовали каспазные ингибиторы z-DEVD-fmk и Boc-Dfmk, наблюдалось уменьшение количества TUNEL позитивных клеток на 50% спустя 6 ч. Продолжение воздействия этих ингибиторов приводило к незначительному расширению центральной части нейральной сетчатки с одновременным увеличением GCL и повышением количества RGC. Эти результаты демонстрируют появление зависимой от каспазы PCD в раннем эмбриональном развитии сетчатки. Более того, анализ выявил присутствие на P2-6 расщепленной caspase-3 и -9 в TUNEL позитивных клетках развивающегося ганглиолярного слоя клеток у мышей (McKernan et al., 2006) (Fig. 6 (i)). Т.о., очевидно, что прирожденные митохондриальный путь активируется во время постнатального развития.
Интересно, что чувствительность RGCs к апоптозу индуцируется с помощью axotomy в зависимости от возраста. Сообщалось, что в то время как гибель RGC у взрослых крыс
in vivo после axotomy не обнаруживается вплоть до 3 после операции и не достигает пика вплоть до 7-го дня, гибель RGC в сетчатке новорожденных после удаления superior colliculus наивысшая спустя 24 ч и завершается спустя 48 ч (Spalding et al., 2005). Исследования в этой лаб. не только выявили возраст-зависимую чувствительность к онтогенетической гибели клеток в GCL мыши в модели эксплантов сетчатки, но и установили сходную чувствительность к гибели после
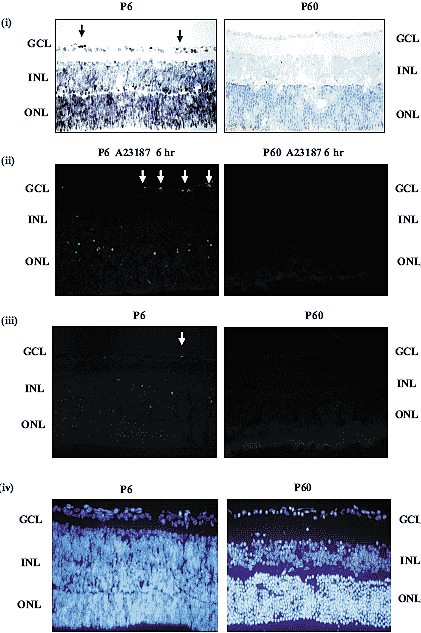 Fig. 6. Developmental apoptosis and differential susceptibility of the mouse ganglion cell layer (GCL) to cell death. (i) Immunohistochemical staining of P6 retinal sections for cleaved caspase-3 shows evidence of the active caspase fragment (black arrows) in the GCL. However this staining is not present within the GCL at P60. (ii) Positive TUNEL staining indicates that P6 cells in the GCL are markedly more susceptible to apoptotic cell
death following 6 hours of treatment with 1 мM calcium ionophore A23187 (white arrows), than A23187 treated P60 cells. (iii) Spontaneous developmental cell death occurs in the GCL of the P6 retinas, as evidenced by the presence of TUNEL positive cells (white arrows). However this developmental death is absent at P60. (iv) Hoechst stained nuclei of P6 and
P60 retinal sections are shown.
Fig. 6. Developmental apoptosis and differential susceptibility of the mouse ganglion cell layer (GCL) to cell death. (i) Immunohistochemical staining of P6 retinal sections for cleaved caspase-3 shows evidence of the active caspase fragment (black arrows) in the GCL. However this staining is not present within the GCL at P60. (ii) Positive TUNEL staining indicates that P6 cells in the GCL are markedly more susceptible to apoptotic cell
death following 6 hours of treatment with 1 мM calcium ionophore A23187 (white arrows), than A23187 treated P60 cells. (iii) Spontaneous developmental cell death occurs in the GCL of the P6 retinas, as evidenced by the presence of TUNEL positive cells (white arrows). However this developmental death is absent at P60. (iv) Hoechst stained nuclei of P6 and
P60 retinal sections are shown.
axotomy и внешних цитотоксических стимулов в этой модели (McKernan
et al., 2006) (Fig. 6(ii)). Более того, мы установили, что приблизительно 90% изолированных RGCs крыс внутри культуры диссоциированных клеток сетчатки на ст. P6 чувствительны к апоптической гибели
in vitro после воздействия calcium ionophore, A23187, в течение 24-час. периода. Однако, их взрослые аналоги оказались более резистентными к таким стимулам (unpublished data). Эти различия в восприимчивости коррелируют с онтогенетическим подавлением про-апоптических белков, включая Apaf-1 и caspase-3 во взрослом GCL (McKernan et al., 2006). Сходный феномен был отмечен у модельных крыс с травматическими повреждениями головного мозга, где эти белки заметно уменьшались в зрелом кортексе (Yakovlev et al., 2001). Т.о., реактивация этих генов необходима для апоптических повреждений нейронов во взрослом головном мозге. Эти результаты, сходные с находками этой Лаб., подтверждают, что появляются развивающиеся RGCs, предназначенные умереть в соответствии с адекватным физиологическим развитием в GCL (Fig. 6(iii)). Однако, как только это развитие завершается, то этот default апоптический путь закрывается и взрослые нейроны затем адоптируют защитный механизм против любых повреждающих ударов (Benn and Woolf, 2004).
В то время как caspases четко играют центральную роль во многих примерах апоптоза, накапливаются доказательства, что апоптоз может возникать при определенных условиях caspase-независимым способом. В то время как ряд альтернативных протеаз вызывает разрушение клеток, приводя к альтернативной морфологии по отношению к обычной зависимой от каспаз клеточной гибели, редки доказательства сходного проявления в онтогенетической гибели RGC (Leist and Jaattela, 2001, Tezel and Yang, 2004). Недавнее исследование Spalding et al. показало, что устранение superior colliculus у новорожденных крыс (P4) вызывает заметную гибель RGC в течение 24 ч. Т.к. эта гибель не блокируется специфическими или общими ингибиторами каспаз, то авт. предположили присутствие независимого от каспаз пути гибели у новорожденных мышей (Spalding et al., 2005).
Conclusion
The retina represents one of the most accessible aspects of the
central nervous system for analysis and research and recent
years have witnessed the elucidation of many of the pathways
central to neurogenesis and developmental apoptosis within the
nascent RGC population. However certain fundamental areas still
remain to be explored in full and future investigations will need to
examine the roles of both neurotrophins and caspase independent
pathways, in order to gain a more transparent perspective on
RGC growth patterns.
Summary
This review examines the maturation of the retinal ganglion cell
(RGC) population within the nascent retina. Apoptosis, a form of
programmed cell death prevalent throughout the developing
central nervous system (CNS), is evident in the growth of RGCs
within the ganglion cell layer. These cells provide an accessible
and illuminating platform to elucidate the apoptotic pathways
present in the developing CNS and the role this form of cell death
plays in RGC growth. This article focuses on the seminal stages
of RGC development and the role played by neurotrophic factors
and apoptosis in this process.
Сайт создан в системе
uCoz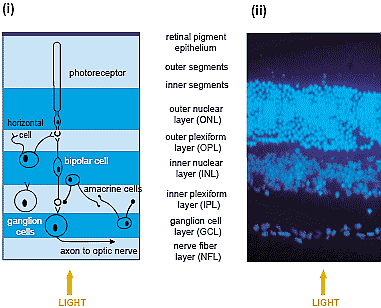 Fig. 2. (i) Schematic of the adult rat retina at P60, with (ii) corresponding Hoechst stained nuclei of the adult rat retina at P60. Three of the layers within the rat adult rat retina contain cell bodies, including the ganglion cell layer (GCL), which is the innermost nucleated layer of the retina. Though mostly containing retinal ganglion cells (RGCs), up to 50% of the cells within the rat GCL may be amacrine cells.
Conversely, the somata of some RGCs are displaced from the GCL to the inner
plexiform layer. RGCs form synaptic connections with neighbouring bipolar and amacrine cells. Axonal projections from RGCs, constituting the Nerve Fibre Layer (NFL), travel to the optic disc where they converge to form the optic nerve.
Fig. 2. (i) Schematic of the adult rat retina at P60, with (ii) corresponding Hoechst stained nuclei of the adult rat retina at P60. Three of the layers within the rat adult rat retina contain cell bodies, including the ganglion cell layer (GCL), which is the innermost nucleated layer of the retina. Though mostly containing retinal ganglion cells (RGCs), up to 50% of the cells within the rat GCL may be amacrine cells.
Conversely, the somata of some RGCs are displaced from the GCL to the inner
plexiform layer. RGCs form synaptic connections with neighbouring bipolar and amacrine cells. Axonal projections from RGCs, constituting the Nerve Fibre Layer (NFL), travel to the optic disc where they converge to form the optic nerve. 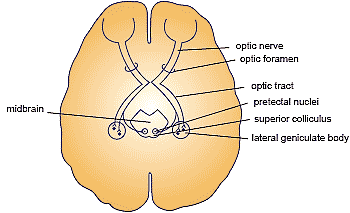 Fig. 3. Retinotectal projections of retinal ganglion cells (RGCs) in the
vertebrate. RGCs process and project information from the retina along
the optic nerve and optic tract to visual centres such as the superior
collicullis, with 30% of RGCs in the rat sending collaterals to the lateral
geniculate nucleus. These retinal projections map the distinct topography
of the retina to the visual centres.
Fig. 3. Retinotectal projections of retinal ganglion cells (RGCs) in the
vertebrate. RGCs process and project information from the retina along
the optic nerve and optic tract to visual centres such as the superior
collicullis, with 30% of RGCs in the rat sending collaterals to the lateral
geniculate nucleus. These retinal projections map the distinct topography
of the retina to the visual centres.  Fig. 4. Cell undergoing apoptosis. Apoptosis is marked by distinctive biochemical and morphological characteristics. These include chromatin condensation, cell shrinkage, blebbing of the plasma membrane, DNA and nuclear fragmentation and finally, cell fragmentation into
membrane bound vesicles termed "apoptotic bodies", which are then phagocytosed by macrophages or neighbouring cells.
Fig. 4. Cell undergoing apoptosis. Apoptosis is marked by distinctive biochemical and morphological characteristics. These include chromatin condensation, cell shrinkage, blebbing of the plasma membrane, DNA and nuclear fragmentation and finally, cell fragmentation into
membrane bound vesicles termed "apoptotic bodies", which are then phagocytosed by macrophages or neighbouring cells. 
 Fig. 6. Developmental apoptosis and differential susceptibility of the mouse ganglion cell layer (GCL) to cell death. (i) Immunohistochemical staining of P6 retinal sections for cleaved caspase-3 shows evidence of the active caspase fragment (black arrows) in the GCL. However this staining is not present within the GCL at P60. (ii) Positive TUNEL staining indicates that P6 cells in the GCL are markedly more susceptible to apoptotic cell
death following 6 hours of treatment with 1 мM calcium ionophore A23187 (white arrows), than A23187 treated P60 cells. (iii) Spontaneous developmental cell death occurs in the GCL of the P6 retinas, as evidenced by the presence of TUNEL positive cells (white arrows). However this developmental death is absent at P60. (iv) Hoechst stained nuclei of P6 and
P60 retinal sections are shown.
Fig. 6. Developmental apoptosis and differential susceptibility of the mouse ganglion cell layer (GCL) to cell death. (i) Immunohistochemical staining of P6 retinal sections for cleaved caspase-3 shows evidence of the active caspase fragment (black arrows) in the GCL. However this staining is not present within the GCL at P60. (ii) Positive TUNEL staining indicates that P6 cells in the GCL are markedly more susceptible to apoptotic cell
death following 6 hours of treatment with 1 мM calcium ionophore A23187 (white arrows), than A23187 treated P60 cells. (iii) Spontaneous developmental cell death occurs in the GCL of the P6 retinas, as evidenced by the presence of TUNEL positive cells (white arrows). However this developmental death is absent at P60. (iv) Hoechst stained nuclei of P6 and
P60 retinal sections are shown.