|
"В МИРЕ НАУКИ", октябрь 2003 № 10, С. 30=37 | |||
|
|
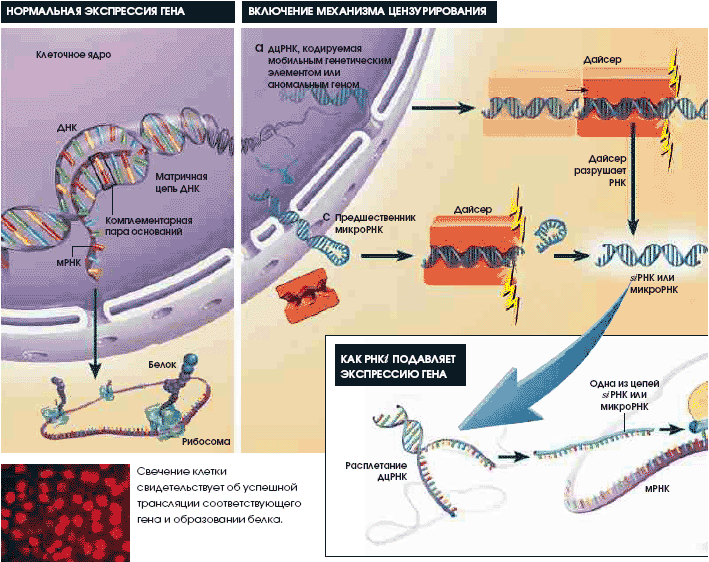
Биологи с изумлением обнаружили, что большинство животных и растительных клеток обладает механизмом избирательного подавления экспрессии генов с помощью коротких двухцепочечных РНК, гомологичных данному гену. Биотехнологические компании уже размышляют над практическим применением этого механизма.
Геномная ДНК любой растительной или животной клетки содержит тысячи генов. Если бы транскрипционная машина была предоставлена самой себе, то все они экспрессировались бы одновременно: раскручивалась бы вся двойная спираль ДНК, транскрибировался бы каждый ген, образовывались бы мириады матричных РНК (мРНК), и на них синтезировалось бы несметное количество белков. Такой какофонии не выдержала бы ни одна клетка, а потому природа распорядилась так, что в каждый определенный момент большинство генов молчит, и слышны лишь единицы...
Геномная ДНК любой растительной
или животной клетки содержит тысячи генов. Если бы транскрипционная
машина была предоставлена самой себе, то все они экспрессировались бы
одновременно: раскручивалась бы вся
двойная спираль ДНК, транскрибировался бы каждый ген, образовывались
бы мириады матричных РНК (мРНК),
и на них синтезировалось бы несметное количество белков. Такой какофонии не выдержала бы ни одна клетка,
а потому природа распорядилась так,
что в каждый определенный момент
большинство генов молчит, и слышны
лишь единицы. Как правило, ген «подает голос» (начинает транскрибиро-
ваться с образованием мРНК) только
после того, как вблизи него на регуляторном участке ДНК появляется «дирижер» – комплекс специфических
белков.
Однако есть гены, которых лучше
лишить «права голоса» – настолько
опасны они для клетки. Если бы гены
мобильных генетических элементов
могли беспрепятственно отправлять
свои мРНК-послания, то в клетке
возник бы хаос и, как следствие, рак.
Аналогично, если бы экспрессия вирусных генов осуществлялась бесконтрольно, то клеточная белоксинтезирующая машина переключилась
бы на производство вирусных белков.
У клеток есть способ избежать такого развития событий – синтезировать
интерферон в ответ на проникновение вируса в организм. Этот универ-
сальный защитный механизм выключает все чужеродные гены без разбора.
Однако недавно обнаружилось, что у
животных и растительных клеток есть
гораздо более изящная, прицельная и
мощная система внутренней безопасности, играющая роль цензора, – РНК-
интерференция (РНКi). Когда в клетку
попадает какой-нибудь опасный для
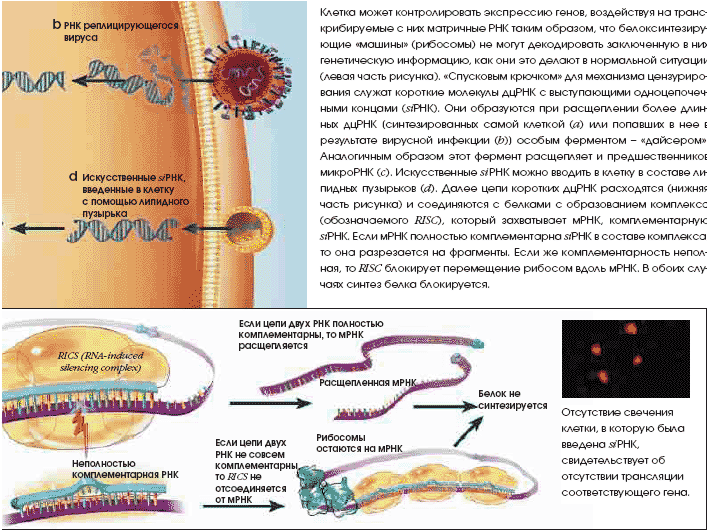
нее ген, система заставляет его замолчать, распознавая и уничтожая кодируемую им мРНК и не трогая мРНК других генов. Выяснив механизм действия и запуска РНКi-системы, можно выключать гены, ассоциированные с различными заболеваниями.
Ученые, исследующие механизм
действия системы геномного цензурирования у растений, червей, мух и
других организмов, научились подавлять экспрессию почти любого гена. Странное молчание Впервые с РНКi-феноменом исследователи столкнулись 13 лет назад. Ричард Йоргенсен (Richard A. Jergensen)
из Аризонского университета и Йозеф
Мол (Joseph Mol) из Амстердамского
свободного университета независимо
друг от друга провели эксперимент:
они встроили в геном петунии с фиолетовыми цветками дополнительные
копии гена, детерминирующего данный цвет. Ожидалось, что окраска цветков станет интенсивнее, однако вместо
этого на них появились белые пятна.
Йоргенсен и Мол пришли к выводу,
что лишние копии гена запускают
процедуру цензурирования, «вычеркивающую» из генома все гены этого
типа, в том числе и изначально в нем
присутствующие, что приводит к появлению растений-альбиносов. Феномен двойного цензурирования (ко-супрессия) был обнаружен чуть
позже у грибов, дрозофилы и других
организмов.
Спустя несколько лет Уильям Доэрти
(William G. Dougherty) из Орегонского
университета исследовал растения табака, в геном которых было встроено
несколько копий СР-гена (ген белка
оболочки) вируса гравировки табака.
Растения, инфицированные вирусом,
оказались к нему устойчивыми. Ученый предположил, что в основе лежит
ко-супрессия. Генетически модифицированные растения «выработали иммунитет» к чужеродным СР-генам, который проявился, как только в них
попал вирус. При этом для «иммунного
ответа» клеткам не нужен был вирус-
ный белок оболочки, устойчивость к
инфекции возникала на уровне РНК,
транскрибируемой с СР-генов.
Доэрти также показал, что специфические вирусные гены перестают экспрессироваться не только под действием «иммунного ответа» растения, их может заставить замолчать сам вирус.
У некоторых растений табака супрессия встроенных СР-генов не происхо-
дила, и инфицировавший их вирус
беспрепятственно размножался. При
этом количество мРНК, транскрибированной со встроенных СР-генов ин-
фицированных растений, уменьшалось, т.е. вирусная инфекция вызвала
их инактивацию.
Параллельно проводились эксперименты по инактивации генов с исполь-
зованием «антисмысловой» РНК у нематоды Caenorhabditis elegans, крошечного прозрачного червя. РНК должна была
спариваться с определенной мРНК с образованием двухцепочечной молекулы
аналогично тому, как спариваются комплементарные цепи ДНК. Каждая цепь
РНК и ДНК состоит из азотистых оснований аденина (A), цитозина (C), гуанина (G) и урацила (U) (у РНК) и тимина
(T) (у ДНК). С всегда образует пару с G,
а А – с U или Т. Одноцепочечная «антисмысловая» РНК связывается с комплементарной мРНК и образует двухцепочечную молекулу, на которой не может
синтезироваться полноценный белок.
Эксперименты с «антисмысловыми»
РНК проводились на различных организмах уже давно, но без особого успеха. Первые обнадеживающие результаты были получены на червях,
однако смущало то, что введение
«смысловой» РНК тоже инактивировало гены, чего не должно было происходить, поскольку ее нуклеотидная
последовательность в точности совпадает с нуклеотидной последовательностью соответствующей мРНК, а не
комплементарна ей.
Решающий эксперимент пять лет назад провели Эндрю Файер (Andrew Z.
Fire) из Института Карнеги в Вашингтоне и Крейг Мелло (Craig C. Mello) из Медицинской школы Массачусетского
университета. Они предположили, что
использовавшиеся ранее препараты
«антисмысловой» и «смысловой» РНК
были недостаточно чистыми и содержали в следовых количествах двухцепочечную РНК (дцРНК), которая могла
влиять на работу «цензора». Чтобы
проверить эту гипотезу, ученые ввели
нематодам одноили двухцепочечные
РНК, отвечающие гену unc-22, который контролирует мышечное сокращение. Относительно большое количество одноцепочечных РНК мало
сказывалось на поведении нематод.
Даже нескольких молекул двухцепочечной unc-22-РНК было достаточно,
чтобы у червя и даже у его потомков
возникли непроизвольные подергива-
ния, однозначно указывающие на сбой
в экспрессии гена unc-22. Аналогичный эффект наблюдался у всех исследованных генов, в том числе контролирующих плодовитость и жизнестойкость. Файер и Мелло назвали это явление «РНК-интерференция», чтобы подчеркнуть центральную роль дцРНК
во включении механизма цензурирования.
| ||