Эпителий образует непрерывные клеточные слои, состоящие из поляризованных клеток, которые слипаются др. с др., так что диффузия в околоклеточных пространствах ограничивается. Эпителиальная межклеточная адгезия в первую очередь обеспечивается апикальными соединительными комплексами, которые состоят из плотных (tight) и слипчивых (adherens) соединений, а также десмосом. Обзор сконцентрирован на tight junctions (TJs), которые вносят вклад в биогенез эпителия и функционируют путем регуляции клеточной пролиферации и дифференцировки, а также путем образования регулируемых и полупроницаемых барьеров для околоклеточной диффузии. Посмотрим роль TJs в регуляции клеточной пролиферации и дифференцировки, т.к. их барьерной роли недавно уже были посвящены обзоры [1,2].
TJs формируют морфологическую и функциональную границу между апикальным и базолатеральными доменами клеточной поверхности, ограничивающую перемешивание апикальных и базолатеральных липидов в экзоплазматическом листке плазматической мембраны. TJs обладают сходной молекулярной архитектурой с др. слипчивыми комплексами (Figure 1) [3-5]. Они состоят из трансмембранных белков, таких как claudins, occludin и JAMs, которые обеспечивают адгезию и формирование барьера, а также избирательную околоклеточную диффузию. Эти мембранные белки взаимодействуют с цитоплазматическими бляшками, состоящими из соединительных адапторов, таких как ZO белки, которые содержат множественные домены для межбелкового взаимодействия. Эти соединительные
(junctional) адапторы формируют белковую сеть, которая связывает соединения с актиновым цитоскелетом и рекрутирует различного типа сигнальные белки, которые регулируют сборку соединений, а также эпителиальную пролиферацию и дифференцировку. Взаимодействия с актиновым цитоскелетом, как полагают, является важным для регуляции свойств проницаемости соединений и для процессов необходимой реорганизации соединений.
Regulation of epithelial polarisation
TJs обладают двумя эволюционно законсервированными сигнальными комплексами, которые регулируют поляризацию клеток: CRB3/Pals1/PATJ комплекс и Cdc42-interacting Par3/Par6/aPKC (atypical protein kinase C) комплекс. Компоненты обоих комплексов важны для генерации полярности различных типов клеток и для регуляции сборки эпителиальных соединений.
CRB3/Pals1/PATJ или crumbs комплекс был впервые идентифицирован у Drosophila, где он состоит из crumbs, stardust и Drosophila PATJ, и локализуется в субапикальном комплексе (маргинальной зоне), наиболее апикальной соединительной структуре у мух [6]. Crumbs играют роль в морфогенезе эктодермального эпителия и в регуляции биогенеза апикальных мембран. Млекопитающие экспрессируют три разных гомолога crumbs; один из низ, CRB3, экспрессируется на апикальной мембране эпителиальных клеток и ассоциирует с TJs, где они формируют комплекс с Pals1, гомологом stardust, и PATJ [7,8]. Эксперименты, базирующиеся на избыточной экспрессии и деплеции с помощью RNA interference (RNAi) трех белков подтверждают, что CRB3/Pals1/PATJ комплекс регулирует сборку соединения, когда были изуены с помощью Ca2+ переключения в сливающихся монослоях [7,9,10,11]. Дефекты поляризации наблюдались только в экспериментах с коллагеновым гелем, которые следовали за формированием поляризованных кист, но не в монослоях, подтверждая тем самым, что кинетика сборки соединений может быть критическим детерминантом для поляризации эпителия в культуральной системе, которая нуждается в более строгой координации между пролиферацией, сборкой соединений и дифференцировкой.
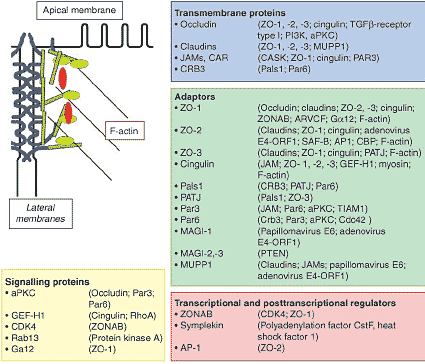 Рис. 1. Composition of tight junctions (TJs). The schematic drawing of a TJ indicates the four major classes of TJ-associated proteins: transmembrane
proteins, adaptors, signalling proteins, and transcriptional and posttranscriptional regulators. Actin filaments are also indicated as many TJ proteins interact with F-actin. The boxes show examples of the four classes of TJ proteins and, in parenthesis, direct interactions they are
known to engage in. Note, only proteins mentioned in this review are indicated.
Рис. 1. Composition of tight junctions (TJs). The schematic drawing of a TJ indicates the four major classes of TJ-associated proteins: transmembrane
proteins, adaptors, signalling proteins, and transcriptional and posttranscriptional regulators. Actin filaments are also indicated as many TJ proteins interact with F-actin. The boxes show examples of the four classes of TJ proteins and, in parenthesis, direct interactions they are
known to engage in. Note, only proteins mentioned in this review are indicated.
Комплекс Par3/Par6/aPKC первоначально был идентифицирован у C. elegans благодаря его роли в асимметричных клеточных делениях [12]. В эпителии млекопитающих, комплекс Par3/Par6/aPKC ассоциирует с TJs и регулирует сборку соединений и поляризацию [13,14]. Par3 взаимодействует с цитоплазматическими доменами JAMs и, следовательно, обеспечивает рекрутирование комплекса в соединение [15,16]. Par6 взаимодействует с
GTP-связанным Cdc42 (cell-division control protein 42, a
Rho GTPase), консервативным регулятором клеточной полярности, который активируется после индукции межклеточной слипчивости [14]. Соединение Par6 с Cdc42 обусловливает активацию aPKC, которая необходима для образования самостоятельных плотных и слипчивых соединений (Figure 2) [17].
Компоненты комплекса Par3/Par6/aPKC влияют на несколько сигнальных механизмов, которые регулируют поляризацию эпителия. Одним из субстратов aPKC является Par1b/MARK2/EMK1, протеин киназа, которая регулирует полярность эпителия путем организации сети микротрубочек и поляризованного membrane traffic [18-20]. Par3 регулирует также сборку TJ посредством Par6/aPKC-независимого механизма, путем регуляции активации Rac1 посредством TIAM1, guanine nucleotide exchange factor (GEF) [21]. Напротив, Par6 связан с потерей эпителиального фенотипа: TGFβ-индуцированным epithelial-mesenchymal transition (EMT), необходимым для фосфорилирования Par6 с помощью TGFβ рецептора типа II [22]. Фосфорилирование запускает взаимодействие с ubiquitin лигазой Smurf1, которая, как полагают, соединяется с junction-ассоциированным RhoA для деградации, следовательно, для индукции дезинтеграции соединительного комплекса (Figure 2).
Комплексы CRB3/Pals1/PATJ и Par3/Par6/aPKC не являются независимыми, а взаимодействующими путями. Par6 связывает Pals1 и CRB3, a взаимодействие между Par6 и Pals1 регулируется с помощью Cdc42 [10,23]. У Drosophila, aPKC фосфорилирует и тем самым активирует crumbs [24]. Т.о., два TJ-ассоциированых polarity комплекса, по-видимому, функционируют как сигнальные модули, которые координируют сборку соединений и поляризацию.
Regulation of epithelial proliferation and
gene expression
TJs регулируют эпителиальную пролиферацию с помощью разных молекулярных механизмов, которые в целом супрессируют пролиферацию (и, следовательно, сбрку TJ) с повышением плотности клеток . Экспрессия некоторых TJ белков нарушается при определенных карциномах;
однако, неясно являются ли эти альтерации причиной или следствием
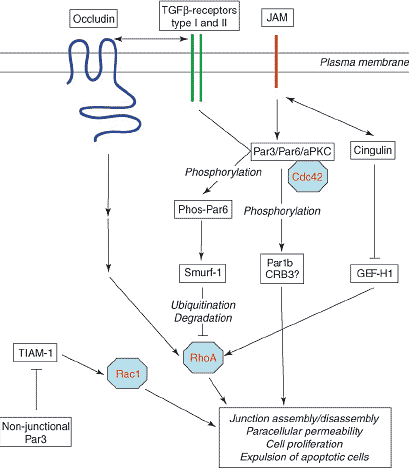 Рис. 2. RhoGTPases and tight junctions (TJs). The schematic drawing shows the principal pathways by which Cdc42, Rac1 and RhoA regulate tight
junctions as well as how TJ-associated proteins regulate activation of these GTPases. These pathways regulate TJ assembly and disassembly,
cell proliferation, paracellular permeability and modulation of the actin cytoskeleton during expulsion of apoptotic cells from epithelia.
Double-headed arrows indicate interactions of which the functional consequence is not known.
Рис. 2. RhoGTPases and tight junctions (TJs). The schematic drawing shows the principal pathways by which Cdc42, Rac1 and RhoA regulate tight
junctions as well as how TJ-associated proteins regulate activation of these GTPases. These pathways regulate TJ assembly and disassembly,
cell proliferation, paracellular permeability and modulation of the actin cytoskeleton during expulsion of apoptotic cells from epithelia.
Double-headed arrows indicate interactions of which the functional consequence is not known.
канцерогенеза. Не смотря на это ассоциированные с TJ адапторные белки ZO-2, MAGI-1 и MUPP1 могут связывать и инактивировать вирусные онкогенs, а онкогены и супрессоры опухолей локализуются в TJs, указывая на то, что
модуляция экспрессии TJ белков вносит вклад в канцерогенез [25]. TJs влияют на пролиферацию и экспрессию генов с помощью двух типов механизмов:
модуляцией сигнальных каскадов и секвестрацией транскрипционных факторов и регуляторов клеточного цикла.
Regulation of signalling cascades
В большой пропорции раковых опухолей потеря эпителиальной дифференцировки коррелирует с дерегуляцией передачи сигналов Ras. Хорошо известными эффекторами Ras являются Raf kinases, которые стимулируют вступление в клеточный цикл посредством активации ERK/MAP kinase. TJs, как известно, связаны с передачей сигналов Raf-1, т.к. избыточная экспрессия мембранного белка соединений occludin вызывает реверсию Raf-1-обусловленной трансформации линии клеток слюнных желез [26]. Подавление передачи сигналов Raf-1 нуждается во второй внеклеточной петле occludin, которая также модулирует TGFβ-индуцированный EMT путем связывания TGFβ рецептора типа I [27,28]. Т.к. активация ERK пути важна для TGFβ- индуцированного EMT [29], то вполне возможно, что occludin не только супрессирует Raf-1, но и также важен для его активации и может, следовательно, координировать передачу сигналов Raf в TJs. Делеции гена occludin у мышей затрагивают дифференцировку некоторых эпителиальных типов клеток, это сравнимо с выполняемой occludin ролью в модуляции внутриклеточных сигнальных путей [30].
Осcludin также связан с передачей липидных сигналов, т.к. он взаимодействует с phosphatidylinositol-3 kinase [31,32]. Продукт phosphatidylinositol-3 киназы гидролизуется с помощью супрессора опухолей PTEN (phosphatase and tensin homolog), который соединяется с TJ адапторами MAGI-2 и -3 [33,34]. Это взаимодействие, как предполагается, обеспечивает рекрутирование PTEN в соединения, обеспечивая дефосфорилирование phosphatidylinositol phosphates, а , следовательно, ингибирование передачи сигналов с помощью protein kinase B/Akt, ключевого регулятора путей передачи сигналов с помощью ростовых факторов и интегринов [35,36].
Регуляция RhoA также связана с occludin. Клетки MDCK, в которых occludin истощалися с помощью RNAi, не способен активировать RhoA в ответ на определенные стимулы (Figure 2) [37]. Пока неизвестно, как occludin стимулирует активацию RhoA, но процесс может вовлекать члена семейства Dbl онкогенов, GEF-H1/Lfc, GEF для RhoA, который располагается на TJs и регулирует ход фазы G1/S в клетках MDCK [38,39]. GEF-H1/Lfc подавляется с помощью KIT ингибитора и противо-опухолевого лекарства Gleevec, указывая тем самым, что этот GEF является физиологически и патологически важным регулятором хода клеточного цикла [40]. GEF-H1/Lfc взаимодействует с TJ белком cingulin, который ингибирует его GEF активность и, следовательно, ход клеточного цикла (Figure 2). Следовательно, наблюдаемые эффекты, которые являются результатом частичных делеций в гене cingulin, на экспрессию некоторых TJ белков и транскрипцию факторов, специфицирующих энтодермальную дифференцировку, могут быть частично обусловлены эффектами на передачу сигналов RhoA signalling [41]. Т.к. усиление активности cingulin коррелирует с арестом клеточного цикла и дифференцировкой [39,42], то формирование TJ вносит вклад в подавление активации и передачи сигналов RhoA в эпителиальных клетках высокой плотности путем ингибирования GEF-H1/Lfc. Важно установить, какого типа регулирующие пролиферацию RhoA эффекторный(е) путь(и)) стимулируются с помощью GEF-H1/Lfc и может ли его активация вовлекать др. сигнальные пути.
Direct regulation of transcription factors
Описаны некоторые белки, которые локализуются в TJs , а также в ядре, это привело к предположению, что они регулируют экспрессию генов [36]. Одним из таких белков является ZO-2, который взаимодействует с ZO-1 и принадлежит к тому же самому семейству генов, которое включает также Drosophila Discslarge tumour suppressor (DlgA). ZO-2 проникает в ядро пролиферирующих клеток, взаимодействует с hnRNP белком SAF-B и соединяется и ингибирует транскрипционные факторы AP-1 и C/EBP [43,44]. ZO-2 неправильно регулируется в разных типах аденокарцином [45], подтверждая, что его эффект на транскрипцию важен для регуляции пролиферации и дифференцировки эпителия. В ответ на изменения межклеточной слипчивости ZO-2 и ZO-1 регулируют также накопление в ядре ARVCF, члена семейства p120(ctn), который ассоциирует со слипчивыми соединениями:
ZO-2 способствует привлечению в ядро, в то время как ZO-1 обеспечивает ассоциацию с плазматической мембраной [46]. Отражают ли эти ZO-2-взаимодействующие белки родственные функции, не известно.
Первый идентифицированный TJ белок, ZO-1, регулирует пролиферацию MDCK клеток [47]. Эта функция картируется в SH3 домене, который взаимодействует с Y-box транскрипционным фактором ZONAB, белком, который необходим для нормальной скорости пролиферации [47,48]. Соединение ZO-1 с ZONAB происходит в цитоплазме и ингибирует транскрипционный фактор с помощью цитоплазматической секвестрации. by cytoplasmic sequestration. Человеческий гомолог собачьего ZONAB, DbpA, является геном мишенью для E2F1, а его избыточная экспрессия обнаруживается в разных типах карцином [49]. Избыточная экспрессия и деплеция ZONAB и ZO-1 затрагивает не только пролиферацию, но и финальную плотность клеток в полностью слившихся MDCK монослоях [47] (K Matter and M S Balda, unpublished). Однако, имеются различия между разными линиями клеток, так, мышиные эпителиальные клетки молочных желез, дефицитные по экспрессии ZO-1, пролиферируют с той же скоростью, что родительская клеточная линия [50]. Эти различия вряд ли обусловлены различиями в типе клеток, т.к. манипуляции с ZO-1 и ZONAB также затрагивают пролиферацию в линиях эпителиальных клеток из молочных желез людей (K Matter and M S Balda, unpublished).
ZONAB регулирует ход G1/S фазы с помощью двух разных механизмов. Во-первых, он взаимодействует с регулятором G1/S фазы CDK4; следовательно, цитоплазматическая секвестрация ZONAB с помощью ZO-1 дает в результате снижения ядерной CDK4 [47]. Во-вторых, ZONAB участвует в транскрипционной регуляции регуляторов клеточного цикла (K Matter and M S Balda, unpublished). Т.о., цитоплазаматическая секвестрация ZONAB и CDK4 приводит в результате к ко-регуляции двух разных механизмов, которые затрагивают фазу перехода G1/S.
В TJs, ZONAB взаимодействует также с малой GTPase RalA [51]. Хотя RalA может быть активирована с помощью Ras, активация RalA в нормальных MDCK клетках Ras-независима. Т.к. в случае ZO-1, связывание RalA ингибируется транскрипционной активностью ZONAB. Также на количество активного RalA не влияет плотность клеток, взаимодействие с ZONAB происходит только в плотно упакованных клетках, указывая тем самым, что RalA не прямо влияет на локализацию, а скоре активацией состояния ZONAB. Также возможно, что это взаимодействие важно для регуляции цитоплазматических функций ZONAB, т.к. Y-box факторы, как было предположено, регулируют оборот РНК и трансляцию
[52].
Conclusions and perspectives
TJs have two important functions in the establishment of
epithelial barriers: first, they regulate formation of the
barriers by modulating cell proliferation, differentiation
and polarisation, and second, they control barrier function
by restricting paracellular diffusion. Although many TJ associated
proteins have now been identified that affect epithelial polarisation and much is known about how they interact with each other, we still know very little about how these polarity complexes actually signal and stimulate
polarisation, and how they interact with other signalling pathways that regulate junction assembly, such as the rab13/PKA-based and G-protein/src-based mechanisms [53,54]. In Drosophila, many of the evolutionarily conserved polarity complexes function as tumour
suppressors; however, the roles of these proteins in mammalian
tumorigenesis as well as whether and how they
influence TJ-associated pathways that do affect proliferation
are still largely unknown. Similarly, junctional adaptor
proteins have now been shown to regulate different
types of transcription factors, but it is not clear how these
different pathways are activated or to which external
stimuli they respond, or how these different pathways
are coordinated with one another or with other signalling
pathways that control cell proliferation and differentiation.
Moreover, the identification of TJ-associated proteins
such as symplekin, which participates in nuclear as
well as cytoplasmic polyadenylation [55–57], suggests
that TJs might contribute to as yet unexplored functions,
such as regulation of mRNA stability and localisation.
Сайт создан в системе
uCoz  Рис. 1. Composition of tight junctions (TJs). The schematic drawing of a TJ indicates the four major classes of TJ-associated proteins: transmembrane
proteins, adaptors, signalling proteins, and transcriptional and posttranscriptional regulators. Actin filaments are also indicated as many TJ proteins interact with F-actin. The boxes show examples of the four classes of TJ proteins and, in parenthesis, direct interactions they are
known to engage in. Note, only proteins mentioned in this review are indicated.
Рис. 1. Composition of tight junctions (TJs). The schematic drawing of a TJ indicates the four major classes of TJ-associated proteins: transmembrane
proteins, adaptors, signalling proteins, and transcriptional and posttranscriptional regulators. Actin filaments are also indicated as many TJ proteins interact with F-actin. The boxes show examples of the four classes of TJ proteins and, in parenthesis, direct interactions they are
known to engage in. Note, only proteins mentioned in this review are indicated.  Рис. 2. RhoGTPases and tight junctions (TJs). The schematic drawing shows the principal pathways by which Cdc42, Rac1 and RhoA regulate tight
junctions as well as how TJ-associated proteins regulate activation of these GTPases. These pathways regulate TJ assembly and disassembly,
cell proliferation, paracellular permeability and modulation of the actin cytoskeleton during expulsion of apoptotic cells from epithelia.
Double-headed arrows indicate interactions of which the functional consequence is not known.
Рис. 2. RhoGTPases and tight junctions (TJs). The schematic drawing shows the principal pathways by which Cdc42, Rac1 and RhoA regulate tight
junctions as well as how TJ-associated proteins regulate activation of these GTPases. These pathways regulate TJ assembly and disassembly,
cell proliferation, paracellular permeability and modulation of the actin cytoskeleton during expulsion of apoptotic cells from epithelia.
Double-headed arrows indicate interactions of which the functional consequence is not known.