Overview of Wnt signalling
Семейство Wnt из 19 секретируемых гликопротеинов контролирует разнообразные онтогенетические процессы, включая спецификацию судьбы, пролиферацию, полярность и миграцию клеток. Соответственно, неправильная регуляция передачи сигналов Wnt во время эмбрионального развития вызывает пороки развития, тогда как дефекты передачи сигналов Wnt во взрослых тканях приводят к развитию различных болезней [1]. Т.к. Wnt-s выполняют разнообразные роли в регуляции функций клеток, то передача сигналов Wnt является предсказуемо сложной. Члены семейства Wnt соединяются с рецепторами клеточной поверхности, называемыми Frizzleds (Fz) и запускающими внутриклеточные сигнальыне каскады. 10 Fz белков являются членами семейства seven-loop трансмембранных рецепторов и кодируются 9 генами. Сборка активного рецепторного комплекса также нуждается в присутствии ко-репрессора low density lipoprotein related protein (LRP) 5/6.
Имеются, по крайней мере, три сигнальных пути, участвующих в передаче сигналов: канонический или зависимый от β-catenin, и два не канонических: polar cell polarity (PCP) или c-Jun N-terminal kinase (JNK)/ activating protein (AP) 1 зависимый и Ca2+ или protein kinase C (PKC)/Calmodulin kinase (CaMK) II/ nuclear factor of activated T cells (NFAT) зависимый сигнальный путь. Передача сигналов Wnt модулируется с помощью многочисленных регуляторных молекул [1, 2]) и с помощью частых взаимодействий среди самих путей [3]. Wnt молекулы были сгруппированы как активаторы канонического (Wnt1, Wnt3, Wnt3a, Wnt7a, Wnt7b, Wnt8) и не-канонических путей (Wnt5a, Wnt4, Wnt11) [4]. Способность двух групп запускать канонические или не-канонические сигнальные каскады, однако, не абсолютна. Разнородность Wnt-s и их рецепторов является признаком этого онтогенетически и патологически важного семейства гликопротеинов, что затрудняет изучение передачи сигналов Wnt.
Canonical Wnt-pathway
Канонический или β-catenin/Tcf зависимый Wnt путь был обнаружен первым и изучен лучше остальных [5, 6]. Коротко, в отсутствии передачи сигналов Wnt, glycogen synthase kinase (GSK-3) активна и фосфорилирует β-catenin в комплексе каркасных белков из adenomatous polyposis coli (APC) и axin [7, 8]. Фосфорилированный β-catenin направляется на ubiquitination и 26S протеосомами-обусловленную деградацию, тем самым снижается цитозольный уровень β-catenin [9, 10] (Figure 1).
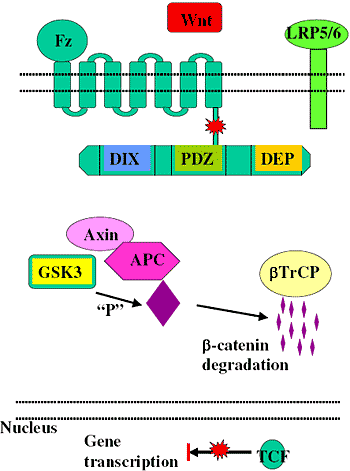 Figure 1 Activation of canonical Wnt signalling pathway in the presence of Wnt signals.
Figure 1 Activation of canonical Wnt signalling pathway in the presence of Wnt signals.
Комплекс Wnt-Fz-LRP6 формируется в присутствии Wnt-s, что ведет к фосфорилированию трех доменов в Dishevelled (Dvl), семействе цитозольных сигнал передающих молекул [11]. Активация Dvl всегда ведет к фосфорилированию, а, следовательно, ингибированию GSK-3. Этот процесс суммирован на Figure 2. Ингибирование GSK3 ведет к стабилизации, а, следовательно, к накоплению в цитозоле β-catenin (Figure 2). Накопленный β-catenin транслоцируется в ядро, где он формирует активный транскрипционный комплекс с членами семейства T Cell Factor (LEF1, TCF1, TCF3, TCF4) транскрипционных факторов [12, 13] и инициатором транскрипции p300 [14]. Успешная сборка транскрипционного комплекса ведет к целенаправленной активации генов. Гены мишени канонического β-catenin пути включают matrix metalloproteinases (MMP2, MMP3, MMP7, and MMP9) [15], cyclin D1 [16, 17], Cox-2 [18], c-myc [19], c-jun [20],
Fra-1 [20], VEGFR [21] и т.д. (См. Nusse's Wnt website:
http://www.stanford.edu/~rnusse/wntwindow.html).
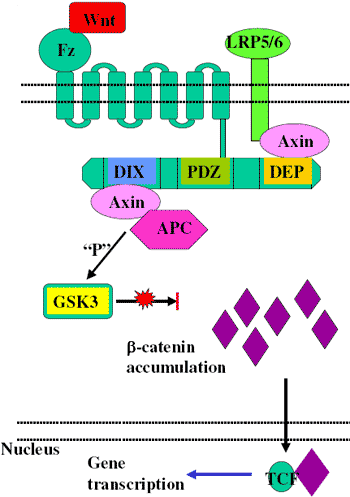 Figure 2 Inhibition of canonical Wnt signalling pathway in the absence of Wnt signals.
Figure 2 Inhibition of canonical Wnt signalling pathway in the absence of Wnt signals.
Non-canonical Wnt-pathways
Не-канонические Wnt пути, JNK/AP1 зависимый, PCP и
PKC/CAMKII/NFAT зависимый Ca2+ путь (точно такой же как канонический Wnt путь) активируются вследствие связывания Wnt-Fz рецептор [22, 23]. Не-канонические пути отличаются от β-catenin пути своей зависимостью от типа G-белков [24], необходимых для активации. Ещё ниже стоящий Dvl является критическим для сигнальной трансдукции в обоих [25], но в противоположность канонической передаче сигналов Wnt, фосфорилирование всех трех доменов Dvl, не обязательно [26]. Хотя Dvl семейство давно уже считается семейством базирующихся в цитозоле сигнальных трансдукторов для трех Wnt-путей, недавние исследования показали способность Dvl транслоцироваться в ядро, где он регулирует внутриядерную стабильность β-catenin [27, 28]. Как эта новая функция Dvl согласуется с более традиционной ролью ждет дальнейших исследований.
Не смотря на этот ниже стоящий цитозольный Dvl, два не-канонических Wnt могут активировать разные сигнальные каскады и запускать транскрипцию разных наборов генов, хотя может также происходить активация перекрестных путей, сигнальная интеграция и последующая модификация экспрессии генов посредством образования комплексов между NFAT и AP1 [29]. Не-канонические пути суммированы на figure 3 и 4.
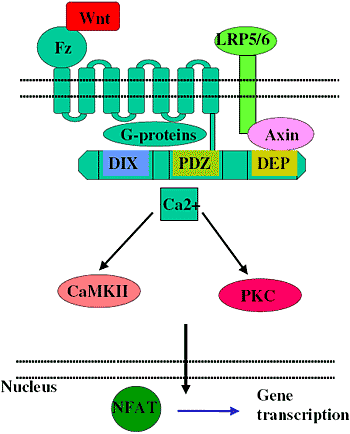 Figure 3 Activation of non-canonical Wnt signalling
Figure 3 Activation of non-canonical Wnt signalling
Ca2+ pathway
Вследствие активации Dv, Ca-зависимый путь передачи сигналов Wnt активирует несколько нижестоящих мишеней. включая protein kinase C (PKC), Ca-Calmodulin kinase II (CaMKII) и Ca чувствительную фосфатазу, calcineurin [30] до активации NFAT [31]. NFAT является семейством транскрипционных факторов, которые регулируют активацией индуцированную транскрипцию многих иммунологически важных генов, включая
interleukin(IL)-2, IL-4, IFN-γ, и TNF-α [32]. Регулируются ли гены, перечисленные выше, непосредственно Ca2+ зависимыми Wnt сигналами, еще предстоит выяснить. Интересный член активаторов не-канонического пути Wnt, Wnt 5a, недавно был связан с продукцией про-воспалительных цитокинов (IL6, IL8, IL15) [33] с привлечением в этот процесс PKC и NFκB [34], хотя роль и PKC и NFκB нуждается ещё в дальнейшем подтверждении.
JNK/AP1 dependent PCP pathway
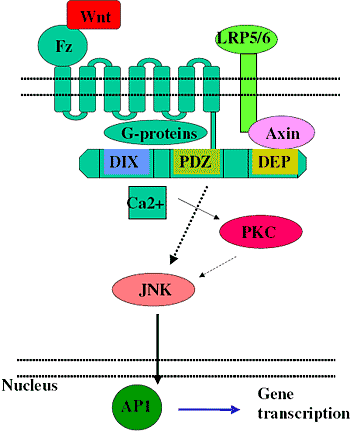 Figure 4 Activation of non-canonical Wnt signalling
Figure 4 Activation of non-canonical Wnt signalling
В PCP пути активация Dvl ведет к JNK, и затем, в свою очередь, к активации AP1 [35]. AP1 не является одним белком, а комплексом из малых белков, которые могут формировать гомо- и гетеродимеры. Основными компонентами AP1 являются cJun, JunB, JunD, cFos, FosB, Fra1, Fra2, ATF2, и CREB. Состав AP1 комплекса является решающим фактором в выборе генов, предназначенных к активации. Следовательно, регуляция индивидуальных компонентов AP1 является столь же важной как и активация или ингибирование вышестоящих членов пути. cJun и Fra1, два важных члена комплекса AP1, были идентифицированы в качестве генов мишеней канонического сигнального пути Wnt [20], указывая тем самым на еще один потенциал для перекрестной регуляции между каноническим и не-каноническими Wnt путями.
Некоторые гены, включая cyclin D1 [36], MMP-3 [37], Bim [38], GMCSF [39], которые также были описаны как гены мишени для Wnt, активируются с помощью AP1. Хотя идентификация от Wnt сигнала зависимых AP1 генов мишеней ожидает дальнейших исследований, недавняя работа подтвердила участие cyclin D1 и MMP-3 в качестве непосредственных мишеней JNK-зависимой передачи сигналов Wnt [40]. Интересно, что активация транскрипции гена D1 запускается с помощью cFos и cJun гетеродимера из AP1 комплекса [41], в котором cJun является геном мишенью в каноническом β-catenin
пути. Определенно возникает возможность, что регуляция экспрессии D1
с помощью PCP пути также испытывает косвенное влияние со стороны канонической передачи сигналов Wnt.
Regulation of Wnt signalling.
Чрезвычайно сложные пути передачи сигналов Wnt являются центральными в регуляции широкого круга клеточных функций и поэтому тонко контролируются. Армада секретируемых внеклеточных (DKK-s [42], sFRP-s [43, 44], WIF [45], Cer [46]) и внутриклеточных, как цитозольных (ICAT [47-49], Nkd [50]) так и ядерных (Sox17 [51]), сигнальных модуляторов делает передачу сигналов Wnt трудной для расшифровки. В отношении же индивидуальных ингибиторов, также имеется перекрестное общение между разными Wnt сигнальными путями. Не-канонические пути, напр., также могут действовать как регуляторы канонической передачи сигналов Wnt, часто путем вмешательства в фосфорилирование, а, следовательно, в состояние активации GSK (одного из главных энзимов канонического Wnt пути) [52, 53].
Более того, описаны также ингибиторы Fz путей. Fz1 [54, 55]
ингибирует передачу сигналов Wnt посредством зависимого от G-белка способом. Др. ингибирующий Fz, Fz6, [56], подавляет Wnt зависимую транскрипцию генов путем активации Ca зависимого сигнального каскада с вовлечением TAK1 и Nemo-Like Kinase (NLK) [57, 58], и заканчивая фосфорилированием членов семейства TCF. Возникающие в результате структурные изменения в TCF-s ингибируют связывание β-catenin TCF и, следовательно, активацию транскрипции гена [57] (Figure 5).
Wnt signalling in the developing lung
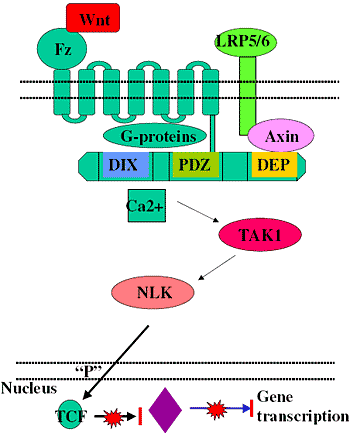 Figure 5 Inhibition of Wnt signalling by a Fz-dependent pathway
Figure 5 Inhibition of Wnt signalling by a Fz-dependent pathway
Модуляция экспрессии Wnt в легких эмбрионов и взрослых мышей указывает на то, что Wnt пути важны для предопределения клеточных судеб и дифференцировки типов легочных клеток. Вовлечение канонической передачи сигналов Wnt в развитие легких было подтверждено несколькими способами. TCF промотор-LacZ репортерная система показала, что каноническая передача сигналов Wnt активна в течение всего развития легких у эмбрионов мышей [59]. Центральная молекула β-catenin канонического Wnt пути, как было показано, локализуется в цитоплазме и часто также в ядрах недифференцированного primordial epithelium (PE), дифференцирующегося alveolar epithelium (AE) и соседней мезенхимы[60]. Используя условную нокаутную систему для β-catenin у мышей было установлено, что β-catenin зависимая передача сигналов является центральной для формирования периферических воздушных путей легких, ответственных за обеспечение газообмена, но он безразличен для формирования проксимальных воздушных путей [61]. Постоянная активация канонического Wnt пути с использованием β-catenin-Lef1 слитого белка продуцирует сходный эффект [59]. Хотя проксимальные воздушные пути развиваются, легкие уменьшены в размерах и лишены альвеол [59].
Недавние исследования были связаны в частности с продукцией Wnt специфическими типами легочных клеток. Wnt2 [62], напр., картируется преимущественно в мезенхиме, Wnt11 в эпителии и мезенхиме [63], тогда как Wnt7b экспрессируется исключительно в эпителии легких [64]. Дополнительные исследования показали, что активность промотора Wnt7b регулируется с помощью гомеодоменового транскрипционного фактора, TTF1, который существенен для дифференцировки легочного эпителия, и особенно важен для высоко специализированных Type II альвеолярных эпителиальных клеток [65]. Т.к. TTF1 нулевые мыши имеют летальный легочный фенотип с повышенной эпителиальной и мезенхимной пролиферацией, которая у новорожденных приводи к повышенному содержанию мезенхимы и отсутствию функциональных альвеол [65], возможно, что отсутствие функциональных альвеол является результатом дисрегуляции передачи сигналов Wnt7b [64].
Помимо β-catenin и Wnt-s, мРНК Fz-1, -2 и -7 и некоторых внутриклеточных молекул, включая Tcf-1, -3, -4, Lef1 и secreted Fz related proteins (sFrp-1, -2 and -4) были найдены экспрессирующимися в развивающихся легких [60] в виде специфических пространственно-временных паттернов [60]. Передача сигналов Wnt, как было установлено, является важной для регуляции пространственного и дистального ветвления (branching) легких [61].
Если важность канонической передачи сигналов Wnt для развития легких установлена, то роль не-канонической передачи сигналов Wnt менее ясна. Исследования по нокауту Wnt5a показали, что не-каноническая передача сигналов Wnt также важна. У Wnt5a-/- животных легкие морфологически меньше, чем у дикого типа [66] и имеется утолщенная мезенхима. Более того, развитие альвеол задержано, хотя и не устраняется [66]. Легкие у Wnt5a нокаутных животных также имеют повышенную экспрессию FGF10 и Shh [66, 67], это указывает на то, что морфологические изменения могут быть связаны с дисрегуляцией др. сигнальных путей, модулируемых с помощью передачи сигналов Wnt.
Wnt-s in adult lung
Первичная легочная ткань и клеточные линии, происходящие из легочной ткани взрослых, экспрессируют широкий спектр Wnt-s, включая Wnt-3, -4, -5a, -7a, -7b, -10b, и -11 [68], а также Fz-3, -6 и -7 [68], Dvl [69] и Dkk [70]. Т.к. в целом передача сигналов Wnt удерживает клетки в состоянии низкой дифференцировки, то роль передачи сигналов Wnt во взрослой ткани не столь ясна. Если мы предположим, что поддержание взрослых органов зависит от стволовых клеток и что стволовые клетки полагаются на передачу сигналов β-catenin и Tcf/Lef, чтобы поддерживать необходимый низкий уровень дифференцировки, то роль Wnt сигналов во взрослой ткани становится непонятной. Существуют ниши стволовых клеток в проксимальных и дистальных воздушных путях [71, 72], также как в кишечнике, волосяных фолликулах и дермисе, a передача сигналов Wnt необходима, чтобы они были способны выполнить свою роль по поддержанию структуры взрослых легких.
Wnt in lung carcinoma
Т.к. рак легких является одной из ведущих причин гибели от рака во всем мире [73,74], но данные относительно роли Wnt путей при раке легких у людей всё ещё ограничены. Наиболее изученными путями мутаций при раке являются наследуемые и спорадические мутации в опухолевом супрессоре adenomatous polyposis coli (APC) и β-catenin. Т.к. APC является частью деградационного каркаса (scaffold) для β-catenin, то мутации APC могут вызывать уменьшение деградации и увеличение накопления в ядрах β-catenin, ведущего к активации генов мишеней, таких как онкогены cyclin D1 и c-myc [75]. Деградация резистентного β-catenin оказывает сходный эффект на активацию генов мишеней [59]. Хотя повышенные уровни β-catenin были отмечены в различного типа рака легких [76, 77], мутации APC [78] и β-catenin [79, 80] редки при раке легких. Однако, выявляется устойчивая дисрегуляция специфических Wnt молекул, ведущая к передаче онкогенных сигналов. Так, частые потери мРНК Wnt7a продемонстрированы в некоторых исследованиях в линиях легочных опухолевых клеток и первичных опухолях [81], повышенные уровни Wnt1 [82] и Wnt2 [83] отмечены при non-small-cell раке легких. Пониженные уровни Wnt7a показывают, что Wnt7a может функционировать как опухолевый супрессор при раке легких. В подтверждение этой концепции, клетки non-small-cell рака легких трансформируются с помощью Wnt7a, обнаруживая ингибирование независимого от прикрепления роста [68]. Тогда член канонической группы, Wnt7a ингибирует пролиферацию и индуцирует дифференцировку посредством JNK/AP1 зависимого PCP сигнального пути [68]. Роль не-канонической передачи сигналов Wnt в развитии рака легких остается спорной, несмотря на последние находки. Хотя активатор не-канонического пути Wnt5a является важным регулятором развития легких и в целом является ингибитором канонической передачи сигналов Wnt, описаны повышенные уровни Wnt5a в легочных метастазах саркомы у людей [84] и т.о., оказывается под вопросом роль не-канонической передачи сигналов как общего ингибитора рака легких. На метастатической стадии любые опухоли, включая и легочные карциномы у людей, epithelial-mesenchymal transformation (EMT) является обычной [85] и в целом связана с повышенной передачей β-catenin зависимых сигналов [86]. Т.к. мутации β-catenin при раке легких относительно редки [79, 80, 87], то д. иметь место др. механизм, который регулирует EMT, а, следовательно, и опухолевые метастазы в легкие. Определенно, non-canonical Wnt5a именно та молекула, которая, как недавно сообщалось, регулирует экспрессию fibroblast growth factor (FGF) 10 и sonic hedgehog (Shh) [67], обнаружена в повышенных количествах в легочных метастазах [84]. FGF-s и hedgehog семейство являются хорошо известными модуляторами эпителиально-мезенхимных взаимодействий [88] и эпителиально-мезенхимных трансформаций (EMT) [89-91]. Нарушение регуляции передачи сигналов FGF и Shh определенно открывает возможность того, что Wnt5a и вообще не-каноническая передача сигналов Wnt в целом, является непрямым регулятором метастазирования легочных опухолей.
Изучение развития легких подтвердило вовлечение канонической передачи сигналов Wnt в рак легкого. Конституитивная активация канонического пути в развивающихся легких приводит к недифференцированному легочному фенотипу, напоминающему рак [59]. Гены мишени канонического и PCP Wnt путей включают matrix metalloproteinases, которые существенны для ремоделирования ткани и увеличены в количестве в инвазивных раковых опухолях [92, 93], тем самым предоставляются дополнительные доказательства вовлечения передачи сигналов Wnt в возникновение рака легких.
Избыточная экспрессия Dvl, позитивного регулятора пути передачи сигналов Wnt, описана в 75% выборок non-small-cell-lung-cancer по сравнению с аутологичной нормальной тканью [94] . Подавление антагонистов Wnt пути, подобных Dkk3 [70], WIF [95, 96] и sFRP [97] также отмечается в разных типах рака легких, что предоставляет дополнительные доказательства роли этого сложного пути.
Wnt in lung inflammation
Кстати, не существует прямых доказательств вовлечения передачи сигналов Wnt в воспаление центральных воздушных путей. Однако, исходя из общих свойств воспалительного заболевания и доказательств, что Wnt регулируемая передача сигналов участвует в воспалении суставов [34], предполагаем возможное потенциальное участие передачи сигналов Wnt и в воспалительных болезнях легких.
Повышенные уровни про-воспалительных и воспалительных цитокинов, таких как IL1,IL6, IL8, и IL15, monocyte chemotactic protein-1 (MCP-1), TNFα и intercellular adhesion molecule-1 (ICAM-1) являются общими признаками воспаления. Повышенная экспрессия ICAM в эпителии важна для рекрутирования, адгезии и удержания лейкоцитов [98], тогда как IL8, секретируемый бронхиальным эпителием [99], является, как полагают, центральным в привлечении нейтрофилов. Нейтрофилы вместе с макрофагами вносят вклад в патогенез повреждения воспаленной ткани за счет реактивных метаболитов кислорода и высвобождения proteinase. Повышенные уровни тканевых matrix metalloproteinases (MMP-s) являются признаком воспалительных состояний и могут вносить вклад в общую эволюцию индуцированной воспалением деструкции ткани. Некоторые легочные клетки, включая резидентных альвеолярных макрофагов, нейтрофилов, паренхимные клетки (в том числе интерстициальные фибробласты), type II эпителиальные клетки и сосудистые эндотелиальные клетки, способны вырабатывать MMPs
[100], a многочисленные MMP-s, включая MMP3 и MMP9, рассматриваются как выполняющие важную про-воспалительную роль при острых воспалениях легких [101]. Активация транскрипции гена MMP приписывается про-воспалительным цитокинам [102,103] и канонической передаче сигналов Wnt [15], но всё ещё неясно, влияют ли они на конкуренцию или на интимность соединений, чтобы регулировать транскрипцию генов MMP. Определенно, активатор канонического пути Wnt-1 связан со стимуляцией транскрипции pro-MMP3 [104], которая участвует в воспалении легких [105]. Понимание взаимодействий сигнальных путей поэтому важно для изучения патогенетических процессов и, следовательно, модуляции болезней.
Изучение ревматоидного артрита предоставило доказательства, что Wnt5a-Fz5 опосредованная передача сигналов может вносить существенный вклад в продукцию про-воспалительных цитокинов (IL6, IL8, IL15) [33] и что избыточная экспрессия Wnt5a ведет к повышению уровней про-воспалительных цитокинов. Более того, доминантные негативные и антисмысловые Wnt5a и анти-Fz-5 антитела блокируют передачу сигналов Wnt5-Fz5, что ведет к снижению продукции цитокинов [33]. Кроме того, индукция воспалительных цитокинов с помощью Wnt5a также участвует в подавлении уровней Shh в легких [67]. Повышенная передача сигналов Shh установлена в регуляции воспалительного и фиброзного процессов в кишечнике и легких [91]. Это указывает на роль Wnt5a, но необходимы дальнейшие исследования для выяснения этого в центральных воздушных путях - в воспалении легких.
Wnt in lung fibrosis
Легочные заболевания вызывают тканевые повреждения, активирующие защитный механизм для репарации повреждений. Тканевые повреждения может быть результатом некоторых острых и хронических стимулов, включая воспаления, вызываемые инфекциями, аутоиммунными реакциями (asthma, allergic alveolitis), а также лекарствами и токсинами (bleomycin, asbestos) или механическими повреждениями (хирургические вмешательства и облучение). Любая репарация ткани включает скоординированную клеточную инфильтрацию вместе с отложением внеклеточного матрикса и соответ. ре-эпителизацией. Первой ступенью регенерации является замещение поврежденных клеток клетками того же самого типа, затем нормальная паренхима замещается соединительной тканью, что ведет к фиброзу. Обычно обе ступени необходимы для выздоровления, однако, если фибротическая ступень становится неконтролируемой и патогенетической, то процесс может приводить к недостаточности и гибели органа. Интерстициальная болезнь легких (ILD) включает широкий набор повреждений, среди которых воспаление и фиброз легких являются обычным финальным путем.
В целом любое активированное состояние репарации такни нуждается в стимуляции сигнальных путей, участвующих в пролиферации, миграции и дифференцировке клеток. Поэтому понятно, что фиброзный процесс зависит от комбинации ростовых факторов (таких как TGFβ, FGF) и молекул клеточной адгезии, таких как integrins. Модуляция экспрессии ростовых факторов, потеря E-cadherin и активация β-catenin, зависимые от генной транскрипции, ведут к эпителиально-мезенхимному переходу (EMT), который также является важным свойством процесса образования фиброза. Прямое участие канонической передачи сигналов Wnt в EMT подтверждено в исследованиях, использовавших избыточную экспрессию Wnt1 и Lef-1 [106].
Более того, во время клеточной миграции, которая является важным фактором в репарации ткани, протеолитическая деградация внеклеточного матрикса необходима, чтобы сделать возможной миграции. фибробластов через внеклеточный матрикс к месту повреждения. Протеолитическая деградация внеклеточного матрикса нуждается в plasminogen и matrix metalloproteinases [107,108]. Генная транскрипция MMP-s регулируется с помощью передачи сигналов Wnt как по каноническому, так и не-каноническим путям. Metalloproteinase matrilysin (MMP7), ген мишень пути канонической переачи сигналов Wnt [109], был недавно идентифицирован как ключевой регулятор легочного фиброза [110, 111]. Во многих случаях идиопатического легочного фиброза, уровни ядерного β-catenin повышены [112], также как и уровни генов мишеней для β-catenin, cyclin D1 и MMP-s [112]. Т.к. Wnt-s участвуют также в модуляции пролиферации и дифференцировки многих легочных клеток [59, 60, 66], то роль передачи сигналов Wnt в регуляции клеточной пролиферации и дифференцировки во время идиопатического легочного фиброза, по-видимому, является центральной, чем следствием болезни.
В заключение, передача сигналов Wnt может быть также центральной во всех случаях легочного фиброза и нуждается в дальнейшей оценке.
Interaction of Wnt pathways with FGF, TGFβ/BMP/Smad pathways.
Хотя детальное обсуждение взаимодействий Wnt с др. сигнальными путями не является целью данного обзора, важно подчеркнуть некоторые регуляторные взаимодействия, которые могут играть роль в развитии и контроле легочных заболеваний. Определенно, активатор не-канонического пути Wnt5a участвует в регуляции нескольких сигнальных путей. У Wn5a-/- нокаутных животных обнаруживается повышенная экспрессия FGF10 и BMP4 [66], подтверждая ключевую роль Wnt5a в регуляции обоих факторов. Т.к. FGF10 стимулирует пролиферацию и ветвление в развивающихся легких, а также индуцирует задержку экспрессии дистальным эпителием BMP4, который в конечном счете ингибирует рост легочных зачатков [113], Wnt5a, по-видимому, является ключевым регулятором клеточной пролиферации в легких. Продемонстрирован эффект Wnt-s в качестве сигнальных модуляторов и др. сигнального пути. Напр., ингибитор канонического пути Wnt, ICAT [47], регулирует экспрессию ингибитора BMP пути, BAMBI (BMP and activin membrane-bound inhibitor) [114]. Т.к. ICAT действует, блокируя сайты связывания TCF-s и p300 доменов armadillo в β-catenin [47] и, следовательно, ингибируя зависимую от β-catenin экспрессию генов, то это указывает на то, что BAMBI не только непосредственно контролируется с помощью BMP4 [115], но и таже с помощью канонической передачи сигналов Wnt.
Более того, и TGFβ и BMP пути нуждаются в Smad-s (rev.116) для сигнальной трансдукции, но Smad-зависимая транскрипция генов может также модулироваться с помощью β-catenin [117, 118], соединяясь с Smad-ядерными комплексами. Роль Smad-системы как активатора TGFβ1 в легочном фиброгенезе была недавно подтверждена [119]. Было показано, что TGFβ1 выполняет непосредственную роль в регуляции EMT, способствуя переходу альвеолярных эпителиальных клеток в форму мезенхимных клеток с фенотипом. сходным с myofibroblast. Т.к. передача сигналов TGFβ и β-catenin индуцирует EMT, то Wnt/TGF сигнальное взаимодействие становится очевидным, хотя нужны дальнейшие исследования для выявления деталей сигнальной трансдукции и пути координации для полного понимания процесса EMT.
Т.к. FGF, Shh, TGFβ, и BMP сигнальные пути важны для тканевой репарации, фиброза и роковой инвазии, то очевидно, что передача сигналов Wnt может модулировать течение болезни как прямо, так и косвенно путем активации транскрипции генов и модуляции перекрестно-регулируемых сигнальных путей.
Summary
The involvement of Wnt signalling in lung development, maintenance, cancer, and repair (including idiopathic pulmonary fibrosis) is supported by evidence, while based on indirect evidence a role for Wnt signalling in inflammatory lung diseases can also be postulated. Certainly, better understanding of Wnt signalling in the lung is likely
to be important and provide information central to new treatment approaches for a wide variety of lung diseases.
Сайт создан в системе
uCoz  Figure 1 Activation of canonical Wnt signalling pathway in the presence of Wnt signals.
Figure 1 Activation of canonical Wnt signalling pathway in the presence of Wnt signals.  Figure 2 Inhibition of canonical Wnt signalling pathway in the absence of Wnt signals.
Figure 2 Inhibition of canonical Wnt signalling pathway in the absence of Wnt signals.  Figure 3 Activation of non-canonical Wnt signalling
Figure 3 Activation of non-canonical Wnt signalling  Figure 4 Activation of non-canonical Wnt signalling
Figure 4 Activation of non-canonical Wnt signalling  Figure 5 Inhibition of Wnt signalling by a Fz-dependent pathway
Figure 5 Inhibition of Wnt signalling by a Fz-dependent pathway