Wnt/β-Catenin Signaling in Development and Disease | |
|
Установлена важная связь между транскрипционными и эпигенетическими механизмами в стволовых клетках эпителия молочных желез. Было показано, что активация транскрипции β-catenin, звена передачи сигналов Wnt, может регулироваться эпигенетически посредством хроматин ремоделирующего фактора Pygo2 (Gu B.P., et al. J.Cell Biol. - 2009.- V.185. P. 811-826).
Pygopus (Pygo) genes were first identified in Drosophila melanogaster as one mechanism that controls Wnt/β-catenin signaling. In Drosophila, Pygo proteins control β-catenin-Lef-Tcf transcriptional complexes through regulation of either β-catenin nuclear translocation or by binding to β-catenin via the adapter protein BCL9 (Belenkaya et al., 2002: Kramps et al., 2002: Parker et al., 2002; Thompson, 2004). Pygo proteins also contain a plant homeo domain (PHD; Fiedler et al.. 2008) that binds to methylated residues on lysine 4 of histone H3 (H3K4me), an epigenetic mark linked to active transcription (Santos-Rosa et al.. 2002). However, the biological relevance of Pygo's binding to methylated histone residues or how these interactions function to regulate Wnt signaling was unclear.
Now Gu et al. (see p. 811 of this issue) make the first link between Pygo expression and regulation of Wnt signaling in a mammalian tissue. Two pygo genes exist in mammals. mPygol and mPygo2. with the latter having a broader expression pattern (Li et al., 2004). Examination of the phenotype of Pygo2 deletion in mammary epithelium revealed reduced formation of mammary placodes during embryogenesis caused by decreased progenitor proliferation. In epithelial-specific Pygo2-null mice, postnatal mammary development that does progress to form ductal networks exhibits reduced ductal elongation and a lack of TEB structures (Fig. 1). Analysis of the number and function of mammary stem cells (Lin-CD24+/CD29High) in these mutant ductal structures revealed reductions in both stem cell number and the ability to form mammary structures in transplantation assays, thus confirming a role for Pygo2 in mammary stem cell self-renewal. Furthermore, Wnt signaling is reduced in Pygo2-null mammary epithelium. Thus, Pygo2 controls proliferation and self-renewal of embryonic mammary epithelial progenitors and postnatal stem cells through the promotion of Wnt signaling (Fig. 1).
How does Pygo2 regulate Wnt signaling and progenitor proliferation in the mammary gland? Using biochemistry, cell biology, and mouse genetics, Gu et al. (2009) demonstrate that Pygo2 promotes Wnt signaling in mammary epithelium through its synergistic interactions with di- and trimethylated histones and the recruitment of β-catenin-BCL9 complexes to promoters of β-catenin target genes. Pygo2 expression in mammary epithelium is required for Lef 1 expression and Wnt signaling reporter activation similar to its role in Drosophila and Xenopus laevis. Furthermore, loss of Pygo2 can suppress overgrowth in mammary glands expressing activating mutations of β-catenin (Fig. 1). The regulation of mammary cell proliferation requires Pygo2's ability to interact with trimethylated K4 residues of histone H3 and its interaction with BCL9-β-catenin complexes at β-catenin target genes. Together, these data support the key role of Pygo2 as a link between activated chromatin and the recruitment of β-catenin to its target genes. The regulation of developmental processes by proteins that bind to and activate НЗ K4 methylation has been described for other PHD-containing proteins, including WDR5. Interestingly, WDR5 also regulates Xenopus development and murine osteoblast formation (Wysocka et al., 2005; Gori et al., 2006) and can have specificity by regulating Wnt signaling (Zhu et al., 2008). Additional chromatin regulators have been shown to link epigenetic and transcriptional control of gene expression, as shown for MLL1 at Hox genes (Guenther et al., 2005). However, the regulatory mechanisms that link these epigenetic regulatory factors to transcription are not clear. Future insights into how proteins that recognize activating or repressive epigenetic histone marks through their recruitment of specific transcription factors will further extend our knowledge of the important link between epigenetic and transcriptional regulation of gene expression.
Beyond its function in regulating gene expression, Pygo's role in the proliferation of mammary progenitors reveals several interesting aspects of mammary biology. First, common mechanisms that regulate embryonic mammary progenitors and adult mammary stem cells have not been identified;,The data presented Qgg* by Gu et al. (2009) suggest that Pygo2 regulates proliferation of m both embryonic mammary progenitors and postnatal mammary stem cells of the TEB, revealing the first mechanism of shared regulation by these pools of mammary progenitor populations. Furthermore, the control of proliferation by Pygo2 suggests that blocking Pygo2 may serve as a potential therapeutic target given its striking ability to block mammary overgrowth with Wnt hyperactivation (Fig. 1). Future studies identifying molecules or proteins that regulate the activity or the interactions of Pygo2 may serve as potent mammary tumor inhibitors.
|
Ген wnt1 мышей первоначально названный Int-1 был идентифицирован в 1982 Nusse и Varmus в качестве преимущественного места интеграции для Mouse Mammary Tumor Virus в индуцированных вирусами опухолях груди (Nusse, Varmus, 1982). После секвенирования Wnt1 протоонкогена стало ясно, что он кодирует секретируемый белок, который богат цистеином. Потом было установлено, что wingless (wg) Drosophila, который контролирует полярность сегментов во время личиночного развития (Nusslein-Volhard, Wieschaus, 1980) является мышиным гомологом Wnt1 (Rijsewijk et al., 1987). Сегментация эпидермиса у мутантов wg мутантных эмбрионов мух тяжело нарушена, как показывают аномалии лежащей поверх вентральной кутикулы. Эмбрионы мух, несущие мутации генов porcupine, dishevelled и armadillo, обладают сходными аномалиями кутикулы, в то время как мутации в shaggy/zeste-white 3 вызывают противоположный фенотип, голую кутикулу. Эпистатический анализ структуры кутикулы у двойных мутантов показал. что эти гены составляют стержень нового каскада сигнальной трансдукции (Siegfried et al., 1992; Noordermeer et al., 1994; Peifer et al., 19940.
В 1989 McMahon и Moon (1989) наблюдали удвоение оси тела у Xenopus после и инъекции мышиной Wnt1 мРНК в вентральные бластомеры эмбрионов 4-клеточной стадии. Это наблюдение подтвердило мнение, что передача сигналов Wnt одинакова у позвоночных и беспозвоночных. Удвоение оси индуцируется также Dishevelled (Dsh), β-catenin (гомолог armadillo у позвоночных) и доминантно-негативная версия glycogen synthase kinase 3 (GSK3), гомолог shaggy/zeste-white 3 у позвоночных (Dominguez et al., 1995; Guer, Gumbiner, 1995; He et al., 1995). Давно ускользающий, специфический Wnt сигнал, который запускает образование оси у Xenopus, был идентифицирован как Wnt11 (Tao et al., 2005).
Наблюдения на дрозофиле и Xenopus выявили высоко законсервированный сигнальный путь, активируемый секретируемыми Wnt белками. Независимо от этих исследований был открыт ген adenomatous polyposis coli (APC) при наследственном раковом синдроме, названном familial adenomatous polyposis (FAP) (Kinzler et al., 1991; Nishisho et al., 1991). Затем вскоре было установлено, что крупный цитоплазматический белок АРС взаимодействует с β-catenin (Rubinfeld et al., 1993; Su et al., 1993). Это наблюдение предоставило первое указание на связь между путем Wnt и раком у людей.
Секвенирование генома показало. что виды млекопитающих имеют приблизительно 20 секретируемых Wnt белков, которые могут быть подразделены ена 12 законсервированных Wnt подсемейств. Из них только 6 подсемейств имеют своих аналогов у ecdysozoan животных, таких как Drosophila и Caenorhabditis. Напротив, по крайней мере 11 из Wnt подсемейств обнаруживаются в геноме cnidarian ( морских анемон Nematostella vectensis). Эти находки указывают на то, что некоторые подсемейства Wht были потеряны во время эволюции ветви ecdysozoan, но что более важно. что комплекс списка факторов Wnt присутствовал у многоклеточных организмов ещё до Кэмбрийского взрыва (550 миллионов лет назад). Т.о., сравнительный анализ геномов подчеркивает критическую роль, которую гены Wnt играют в формировании организменного паттерна во всем царстве животных (Kusserow et al., 2005).
Сегодня, как полагают, существуют три пути активации Wnt рецепторов: канонический Wnt/β-catenin каскад, неканонический planar cell polarity (PCP) путь и Wnt/Ca2+ genm/ Из них канонический изучен лучше всего и является главным предметом данного обзора (Katoh, 2005; Kohn, Moon, 2005). 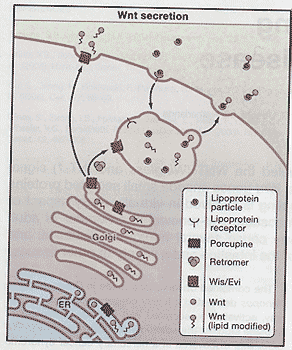 Figure 1. Wnt Secretion
To be secreted, Wnt proteins in the endoplasmic reticulum (ER) need to be palmitoylated by the action of Porcupine. Wnt proteins also require Wntless (Wls/Evi) in order to be routed to the outside of the cell. Loading onto lipoprotein particles may occur in a dedicated endo/ex-ocytic compartment. The retromer complex may shuttle Wis between the Golgi and the endo/exocytic compartment. Figure 1. Wnt Secretion
To be secreted, Wnt proteins in the endoplasmic reticulum (ER) need to be palmitoylated by the action of Porcupine. Wnt proteins also require Wntless (Wls/Evi) in order to be routed to the outside of the cell. Loading onto lipoprotein particles may occur in a dedicated endo/ex-ocytic compartment. The retromer complex may shuttle Wis between the Golgi and the endo/exocytic compartment. Wnt Protein Secretion Wnt белки характеризуются высоким количеством законсервированных остатков цистеина. Хотя Wnt белки несут N-терминальный сигнальный пептид и секретируются они довольно мало растворимы. Это связано с определенной модификацией белка, palmitoylation цистеина, которое является существенным для функции Wnt (Willert et al., 2003). Hofmann (2000) сообщил, что ген Drosophila, необходимый в клетках, секретирующих Wnt, названный porcupine, обнаруживает гомологию с acyl-transferases, энзимом. который ацетилирует разные субстраты в эндоплазматическом ретикулеме. Т.о., porcupine и его гомолог у червей mom-1, как полагают. кодируют энзим, который отвечает за palmitoylation Wnt (Zhai et al., 2004).
Недавно Banziger et al. (2006) и Bartscherer et al., (2006) открыли у дрозофилы др. законсервированный ген, который существенен для секреции Wnt, названный wntless (wls) и evenness interrupted (evi), соотв. Ген кодирует 7 раз пронизывающий мембрану белок, который законсервирован от червей (mom-3) до человека (hWLS). В отсутствие Wls/evi Wnts сохраняются вне клеток, которые его продуцируют. Белок Wntless располагается прежде всего в аппарате Гольджи, где он ко-локализуется и физически взаимодействует с Wnts. Генетический скрининг у C.elegans показал, что retromer, мультибелковый комплекс участвует во внутриклеточном переносе и законсервирован от дрожжей до человека, он также существенен для секреции Wnt и для создания градиента Wnt (Coudreuse et al., 2006). Привлекательной гипотезой является та, согласно которой retromer комплекс участвует в рециклинге рецептора Wnt груза (такого как Wntless) между самопроизвольным секреторным путем и компартментом, предназначенным для секреции Wnt (Рис. 1).
Wnt, как полагают, действует как морфоген (т.е., дальнодействующий сигнал, чья активность является зависимой от концентрации) (Logan, Nusse, 2004). Однако, неясно, как эти дально-действующие градиенты генерируются. Возможно, что palmitoyl половинка препятствует движению прочь от мембран или липидных частиц. Т.о., Wnts могут быть привязаны к внутриклеточным транспортным пузырькам или липопротеиновым частицам (Panakova et al., 2005). Альтернативно Wnts могут быть транспортированы с помощью цитонем, которые являются длинными тонкими филопоидными отростками. Кроме того, исследования на дрозофиле подтвердили роль внеклеточного heparan sulfate proteoglicans (HSPG) в транспорте или стабилизации белков Wnt. Напр.. мухи, несущие мутации в Dally, GPI-закрепленных HSPG, или в генах, кодирующих энзимы, которые модифицируют HSPGs, напоминают мутантов wingless (Lin, 2004). Receptors, Agonists, and Antagonists for Wnt Wnts связывает Frizzled (Fz) белки, которые являются 7 раз пронизывающими мембрану рецепторами с внеклеточным N- терминальным cystein-rich domen (СКВ) (Bhanot et al., 1996). Wnt-Fz взаимодействие кажется разнородным тем. что одиночный Wnt может связывать множественные Frizzled белки и наоборот. После связывания Wnt, Fzs кооперируют с одно-проходной трансмембранной молекулой семейства LPR , известной как Arrow у Drosophila (Wehrli et al., 2000) и LPR5 и LPR6 у позвоночных (Prinson et al., 2000; Tamai et al., 2000). Транспорт Arrow/LPR5/6 на поверхность клетки зависит от хаперона, наз. Boca у Drosophila и Mesd у мышей (Culi, Mann, 2003; Hsieh et al., 2003). Это согласуется с ролью Boca/Mesd шаперона в транспорте Arrow/LPR5/6, мутации в Boca и Mesd напоминают потерю Arrow/LPR5/6. Хотя это и не было продемонстрировано формально, что Wnt молекулы формируют трехмерные комплексы с LPR5/6 и Frizzled, экспрессия на поверхности обоих рецепторов необходима, чтобы инициировать сигнал Wnt.
Derailed, рецептор трансмембранной тирозин киназы из подсемейства RYK, является необычным Wnt рецептором. Цте5 дрозофилы контролирует наведение аксонов в ЦНС. Эмбрионы, лишенные Dwnt-5, напоминают таковых, без Derailed, т.е. они генерируют аберрантные проэкции нейронов через срединную линию (Yoshikawa et al., 2003)/ Derailed связывает DWnt-5 посредством своего внеклеточного WIF(Wnt inhibitory factor) домена. Передача сигналов ниже этого альтернативного Wnt рецептора остается неизвестной. Довольно неожиданно то. что киназные домен Derailed может быть безразличным к передаче сигналов. Lu et al.,(2004) предположили, что в отличие от Drosophila Ryk гомолога Derailed, Ryk млекопитающих функционирует как ко-рецептор вместе с Fz. Ryk млекопитающих связывает Dishevelled, чтобы активировать канонический сигнальный путь Wnt/β-catenin. Др. тирозин киназный рецептор, Ror2, обладает Wnt связывающим СКВ мотивом. Wnt5a может задействовать Ror2, чтобы ингибировать каноническую передачу сигналов Wnt, хотя парадоксально, но Wnt5a может также активировать канонический путь непосредственно используя Fz4 (Mikels, Nusse, 2006) иbFz5 (He et al., 1997).
По крайней мере, два типа белков. которые неродственный Цте факторам, активируют Frizzled/LRP рецепторы. Одним из таких факторов является cysteine-knot белок Norrin, который мутантен при болезни Norrie, онтогенетическом нарушении, характеризующимся сосудистыми аномалиями в глазах и слепотой. Norrin соединяется с высоким сродством с Fz4 и активирует канонический сигнальный путь LRP5/6-зависимым способом (Xu et al., 2004). Др. факторы,которые активируют канонический сигнальный путь Wnt, являются R-spondins, которые являются белками, содержащими thromospondin домен. У Xenopus R-spondin-2 является Wnt агонистом, который действует синергично с Wnts, чтобы активировать β-catenin (Kazanskaya et al., 2004). Человеческий R-spondin-1 сильно улучшает пролиферацию клеток крипт кишечника, процесс, который использует стабилизацию β-catenin (Kim et al., 2005). В самом деле, исследования культивируемых клеток продемонстрировали, что R-spondins могут физически взаимодействовать с внеклеточными доменами LRLRP6 и Fzd8 и активировать Wnt репортерные гены (Nam et al., 2006).
Секретируемые Dickkopf (Dkk) белки ингибируют передачу сигналов Wnt путем непосредственного связывания LRP5/6 (Glinka et al., 1998). Благодаря этому взаимодействию Dkk1 поперечно связывает LRP6 с др. классом трансмембранных молекул, Kremens (Mao et al., 2002), способствуя тем самым интернализации и инактивации LRP6. Неродственный секретируемый Wnt ингибитор, Wise, также действует путем соединения с LRP (Itasaki et al., 2003), как это делает член семейства WISE SOST (Li et al., 2005; Semenov et al., 2005).
Soluble Frizzled-Related Proteins (SERPs) напоминают лигандом связываемый CRD домен рецепторов Wnt семейства Frizzled (Hoang et al., 1996). WIF белки являются секретируемыми молекулами со сходством с внеклеточной частью Derailed/RYK класса трансмембранных Wnt рецепторов (Hsieh et al., 1999). SFRPs и WIFs, как полагают, действуют как внеклеточные ингибиторы Wnt (rev.Logan, Nusse, 2004), но в зависимости от контекста, они могут также способствовать передаче сигналов за счет стабилизации или облегчения Wnt секреции или транспорта. Canonical Wnt Signaling Будучи вязанным своими однокоренными лигандами, Fz/LRP ко-рецепторный комплекс активирует канонический сигнальный путь (Рис. 2). Fz может физически взаимодействовать с Dsh, цитоплазматическим белком, который функционирует иерархически выше β-catenin и киназы GSK-3. Передача сигналов Wnt контролирует фосфорилирование Dsh (rev. Wallingford, Habas, 2005). Однако, остается неясным, регулирует ли связывание Wnt с Fz непосредственно Fz-Dhs взаимодействие и неясно, как фосфорилирование Dsh контролируется или как фосфорилированный Dsh функционирует в сигнальной трансдукции Wnt. 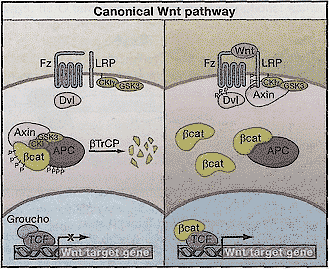 Figure 2. Canonical Wnt Signaling
(Left panel) When Wnt receptor complexes are not bound by ligand, the serine/threonine kinases, CK1 and GSK3a/p, phosphorylate β-catenin. Phosphorylated β-catenin is recognized by the F box/WD repeat protein p-TrCP, a component of a dedicated E3 ubiquitin ligase complex. Following ubiquitination, p-catenin is targeted for rapid destruction by the proteasome. In the nucleus, the binding of Groucho to TCF (T cell factor) inhibits the transcription of Wnt target genes. (Right panel) Once bound by Wnt, the Frizzled(Fz)/LRP coreceptor complex activates the canonical signaling pathway. Fz interacts with Dsh, a cytoplasmic protein that functions upstream of (3-catenin and the kinase GSK3p. Wnt signaling controls phosphorylation of Dishevelled (Dsh). Wnts are thought to induce the phosphorylation of LRP by GSK3P and casein kinase l-y (CK1y), thus regulating the docking of Axin. The recruitment of Axin away from the destruction complex leads to the stabilization of β-catenin. In the nucleus, p-catenin displaces Groucho from Tcf/Lef to promote the transcription of Wnt target genes. Figure 2. Canonical Wnt Signaling
(Left panel) When Wnt receptor complexes are not bound by ligand, the serine/threonine kinases, CK1 and GSK3a/p, phosphorylate β-catenin. Phosphorylated β-catenin is recognized by the F box/WD repeat protein p-TrCP, a component of a dedicated E3 ubiquitin ligase complex. Following ubiquitination, p-catenin is targeted for rapid destruction by the proteasome. In the nucleus, the binding of Groucho to TCF (T cell factor) inhibits the transcription of Wnt target genes. (Right panel) Once bound by Wnt, the Frizzled(Fz)/LRP coreceptor complex activates the canonical signaling pathway. Fz interacts with Dsh, a cytoplasmic protein that functions upstream of (3-catenin and the kinase GSK3p. Wnt signaling controls phosphorylation of Dishevelled (Dsh). Wnts are thought to induce the phosphorylation of LRP by GSK3P and casein kinase l-y (CK1y), thus regulating the docking of Axin. The recruitment of Axin away from the destruction complex leads to the stabilization of β-catenin. In the nucleus, p-catenin displaces Groucho from Tcf/Lef to promote the transcription of Wnt target genes. Недавние результаты показали, что ко-рецептор LRP5/6 взаимодействует с Axin посредством пяти фосфорилированных PPP(S/T)P повторов в цитоплазматическом хвосте LRP (Davidson et al., 2005; Zeng et al., 2005). Wnts, как полагают, индуцируют фосфорилирование цитоплазматического хвоста LRP, тем самым регулируя стыковку с Axin. GSK3 фосфорилирует PPP(S/T)P мотив, в то время как casein kinase 1-γ (CK1γ) фосфорилирует множественные мотивы, близкие к сайту GSK3. CK1γ является уникальной в семействе СК1 тем, что она прикреплена к мембране посредством С-терминальной palmitoylation. Обе киназы существенны для инициации сигнала. Продолжаются споры, контролирует ли Wnt GSK3-обусловленное фосфорилирование LRP5/6 (Zeng et al., 2005) или может ли СК1γ киназа регулироваться с помощью Wnt (Davidson et al., 2005). Связанные со своими соотв. мембранными рецепторами Dsh и Axin могут кооперативно обусловливать нижестоящие события активации за счет гетеродимеризации посредством своих соотв. DIX (Dishevelled-Axin) доменов. 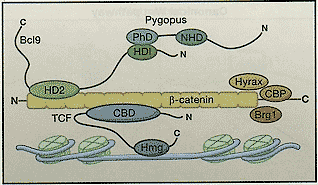 Figure 3. Transactivation of Wnt Target Genes
The β-catenin/Tcf complex interacts with a variety of chromatin-remod-eling complexes to activate transcription of Wnt target genes. The recruitment of β-catenin to Tcf target genes affects local chromatin in several ways. Bcl9 acts as a bridge between Pygopus and the N terminus of p-catenin. Evidence suggests that this trimeric complex is involved in nuclear import/retention of p-catenin (Townsley et al., 2004), but it may also be involved in the ability of β-catenin to activate transcription (Hoffmans et al., 2005). The C terminus of β-catenin also binds to coactivators such as the histone acetylase CBP, Hyrax, and Brg-1 (a component of the SWI/SNF chromatin-remodeling complex). Figure 3. Transactivation of Wnt Target Genes
The β-catenin/Tcf complex interacts with a variety of chromatin-remod-eling complexes to activate transcription of Wnt target genes. The recruitment of β-catenin to Tcf target genes affects local chromatin in several ways. Bcl9 acts as a bridge between Pygopus and the N terminus of p-catenin. Evidence suggests that this trimeric complex is involved in nuclear import/retention of p-catenin (Townsley et al., 2004), but it may also be involved in the ability of β-catenin to activate transcription (Hoffmans et al., 2005). The C terminus of β-catenin also binds to coactivators such as the histone acetylase CBP, Hyrax, and Brg-1 (a component of the SWI/SNF chromatin-remodeling complex). The Cytoplasmic Destruction Complex. Центральным игроком в каноническом Wnt каскаде является β-catenin, цитоплазматический белок, чья стабильность регулируется с помощью деструкционного комплекса. Опухолевый супрессорный белок Axin действует как каркас для этого комплекса, т.к. он непосредственно взаимодействует со всеми др. компонентами - β-catenin, опухолевым супрессорным белком АРС и двумя семействами киназ (СК1α, -δ, ε и GSK3α и β [Price,2006]}. Когда WNT рецепторные комплексы не задействованы, то СК1 и GSK3α/β последовательно фосфорилируют β-catenin по серии высоко законсервированных Ser/Thr остатков вблизи N конца (Рис. 2). Фосфорилированный β-catenin затем распознается с помощью белка с F box/WD повторами β-TrCP, компонентом, относящимся к Е3 ubiquitin Ligase комплексу. Как следствие β-catenin убиквитинируется и направляется на быструю деструкцию с помощью протеасом (Aberie et al., 1997). Отметим, что СК1 и GSK3 киназы выполняют парадоксальные роли на пути Wnt. На уровне LRP ко-рецептора они действуют как агонисты, тогда как в деструкционном комплексе они действуют как антагонисты.
Хотя генетические наблюдения выявляют существенную роль АРС в деструкционном комплексе, нет согласия в отношении его специфической молекулярной активности. АРС имеет серию из 15-20 аминокислотных повторов, с помощью которых он взаимодействует с с β-catenin. Три Axin-связывающих мотива разбросаны между этими β-catenin-связывающими мотивами. Повышенная экспрессия Axin в раковых клетках, которые лишены АРС, восстанавливает активность деструктивного комплекса, указывая тем самым. что АРС существенен только, когда уровни Axin ограничены. Количественно, Axin в самом деле, по-видимому, является лимитирующим фактором (Lee et al., 2003) и может быть ключевой каркасной молекулой, которая способствует быстрой сборке и разборке деструктивного комплекса.
Учитывая, что СК1, Dsh, β-TrCP и GSK3 участвуют в др. сигнальных путях, низкие уровни Axin могут обособлять путь Wnt от изменений в количестве или активности этих сигнальных компонентов. Предполагается. что АРС необходим для эффективной автоматической смены (shuttling) и загрузки/разгрузки β-catenin в цитоплазматический деструктивный комплекс. И АРС и Axin могут сами фосфорилироваться с помощью ассоциированных киназ, которые изменяют своё сродство к др. компонентам деструктивного комплекса. Наше понимание значения этих событий фосфорилирования в регуляции передачи сигналов Wnt остается неполным (Price, 2006).
β-catenin играет и др. роль в простом эпителии, являясь компонентом слипчивых соединений. Он является важным связывающим партнером для цитоплазматических хвостов различных кадхеринов, таких как E-cadherin (Peifer et al., 1992). В отличие от сигнального пула β-catenin, пул, который связывается со слипчивыми соединениями высоко стабилен. Сегодня неясно, взаимосвязаны ли свойства адгезивного и сигнального β-catenin. Возможен сценарий, когда вновь синтезированный β-catenin сначала насыщает пул, который является частью адгезивных соединений, который никогда не становится пригодным для передач сигналов. "Избыток" свободных цитоплазматических белков β-catenin затем эффективно деградирует с помощью АРС комплекса. Только этот второй, высоко нестабильный пул является предметом регуляции с помощью сигналов Wnt. В подтверждение этой модели две функции β-catenin отдельно переделаны с помощью разных β-catenin гомологов у C.elegans (Korswagen et al., 2000).
После активации рецепторов с помощью WNT лигандов, внутренне присущая киназная активность комплекса АРС в отношении β-catenin ингибируется. Неясно, как это происходит, но скорее всего это связано с Wnt-индуцированным рекрутированием Axin, чтобы фосфорилировать хвост LRP и/или Fz-связанный Dsh. Как следствие, стабильный не фосфорилированный β-catenin накапливается и транслоцируется в ядро, где он соединяется с N концом транскрипционного фактора LEF/TCF (lymphoid enhancer factor/T cell factor) (Behrens et al., 1996; Molenaar et al., 1996; van de Wetwring et al., 1997).
Было предположено, что протеин фосфатазы могут регулировать стабильность β-catenin, как антагонисты серин киназ (rev.Price, 2006). Напр., гетеротримерная РР2А необходима для повышения уровней β-catenin, которые зависят от Wnt. Более того, РР2А может связывать Axin и АРС, указывая тем самым, что она может функционировать, дефосфорилируя GSK3 субстраты. Как активность РР2А регулируется с помощью Wnt сигналов пока неизвестно.
Кристаллографические исследования предоставляют информацию о структуре деструкционного комплекса. Центральная область β-catenin (с которым связано большинство партнеров) стала первым компонентом кристаллизации. Она состоит из 12 armadillo повторов, которые принимают поверхностную форму с базовой бороздой, идущей вдоль их длины. Затем были визаулизованы структурные взаимодействия Axin, APC, E-cadherin и TCF с β-catenin (Choi et al., 2006). APC, E-cadherin и TCF соединяются с центральной частью базовой борозды практически исключительным способом. Несмотря на очень ограниченную консервацию первичных последовательностей в соотв. доменах взаимодействия, способ соединения структурно очень сходен. Axin использует спираль, которая занимает борозду, формируемую третьим и четвертым повторами armadillo в β-catenin. Связывание Axin предваряется одновременным взаимодействием с др. β-catenin партнерами в данной области. Исходя из этого наблюдения, было предположено, что ключевой функцией АРС является удаление фосфорилированного β-catenin с активного сайта комплекса (Xing et al., 2003). В дальнейших исследованиях структура Axin, связанного с АРС была установлена (Spink et el.,2000). Но отсутствуют пока исследования деструктивного комплекса в разных состояниях активации.
Nuclear Events. После стабилизации с помощью сигналов Wnt β-catenin вступает в ядро, чтобы репрограммировать соотв. клетки (Рис. 3). Нет согласия относительно механизма. с помощью которого β-catenin перемещается между цитоплазмой и ядром. Во многих случаях, клетки, которые осуществляют передачу сигналов Wnt, могут действительно демонстрировать общее увеличение белка β-catenin без четкого предпочтения ядер. Импорт в ядро β-catenin независим от системы Nuclear Localization Signal/importin. β-catenin сам по себе относительно близок к importin/karyopherins и непосредственно взаимодействует с компонентами ядерных пор. Два белка, Tcf и Pygopus, как полагают, прикрепляют β-catenin в ядре, хотя β-catenin всё еще может проникать в ядро в отсутствие любого из них (rev. Staedeli et al,m 2006). β-catenin может также активно транспортироваться обратно в цитоплазму или за счет прирожденного экспортного сигнала или в качестве груза Axin (Cong, Varmus, 2004) или АРС (Rosin-Arbesfeld et al., 2000), которые снуют между цитоплазмой и ядром.
В отсутствие Wnt сигналов Tcf действует как транскрипционный репрессор, формируя комплекс с Groucho/Grg/TLE белками (Cavallo et al., 1998; Roose et al., 1998). Взаимодействие β-catenin с N концом Tcf (Behrens et al., 1996; Molenar et al., 1996; van de Wetering et al., 1997) временно превращает его в активатор, транслирующий Wnt сигнал во временную транскрипцию Tcf генов мишеней. В соответствии с этим β-catenin физически смещает Groucho из Tcf/Lef (Daniels and Weis, 2005). Рекрутирование β-catenin на Tcf гены мишени влияет на локальный хроматин несколькими способами. Их С концы являются потенциальными транскрипционными активаторами (van de Wetering et al., 1997). Они связывают коактиваторы, такие как гистон ацетилаза СВР и Brg-1, компонент комплекса ремоделирования хроматина SWI/SNF (rev. Staedeli et al., 2006). Недавно установлено, что гомологи у человека и мух дрожжевого Cdc37 (Parafibromin и Hyrax соотв.) также взаимодействуют с С терминальным транскрипционным доменом β-catenin, чтобы активировать транскрипцию генов мишеней (Mosimann et al., 2006), Cdc37 является компонентом комплекса PAF. У дрожжей комплекс PAF непосредственно взаимодействует с РНК полимеразой II, чтобы регулировать транскрипционную инициацию и элонгациию.
Два подходящих партнера TCF/β-catenin комплекса, Legless/Bcl9 и Pygopus найдены при генетическом скрининге Drosophila (Kramps et al., 2002; Parker et al., 2002; Thompson et al., 2002). Мутации в этих генах вызывают фенотипы, сходные с wingless, а избыточная экспрессия обоих генов способствует активности TCF/β-catenin в клетках млекопитающих. Bcl9 связывает Pygopus с N концом β-catenin. Формирование этого тримерного комплекса участвует в ядерном импорте/удержании β-catenin (Townsley et al., 2004), но может также непосредственно вносить вклад в способность β-catenin трансактивировать транскрипцию (Hoffmans et al., 2005). Хотя большинство, если не все, Wnt сигнальные события у дрозофилы, по-видимому, зависят от Bcl9 и Pygopus. Пока неясно верно ли это и для развития позвоночных. 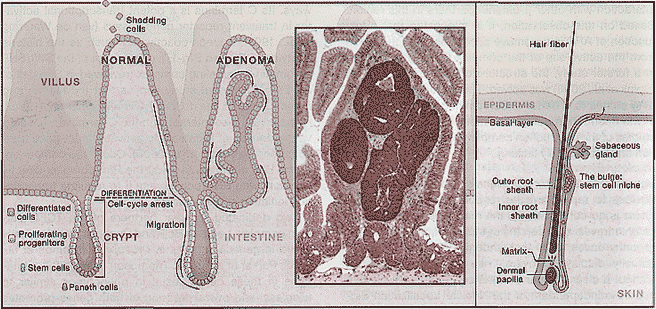 Figure 4. Self-Renewing Tissues in the Adult Mammal (Left) In the intestinal epithelium, proliferating crypt precursors and differentiated villus cells form a contiguous sheet of cells that is ir ze petual upward motion. Stem cells, which produce the transit-amplifying progenitor cells, reside near the bottom of the crypt and es: = :-this flow. Evidence suggests that Wnt signaling is required for the establishment of the progenitor compartment in the intestinal epithelium Wnt proteins also promote the terminal differentiation of Paneth cells at the base of the crypt. A small adenoma carrying a mutation in APC grows inside the right-hand villus. As a consequence of the loss of APC, β-catenin protein accumulates to high levels in the adenoma, (h>-set)iA section of a mouse small intestine displaying crypts, villi, and a growing adenoma. Staining for β-catenin (brown) reveals its presence in adhesion junctions as well as a modest accumulation at the bottom of the crypts due to local Wnt signaling. Photo by Daniel Pinto. (Right) Wnt signaling in hair follicles activates bulge stem cells, promotes entry into the hair lineage, and recruits the cells to the transit-amplifying matrix compartment. Tcf сам себя может регулировать с помощью фосфорилирования. МАР киназе рдственый белок киназа NLK/Nemo (Ishitani et al., 1999) фосфорилирует Tcf, понижая тем самым ДНК-связывающую способность комплекса Tcf/β-catenin и ингибируя транскрипционную регуляцию Wnt генов мишеней у C.elegans. LIT-1/NLK-зависимое фосфорилирование приводит к POP-5/14-3-3- и CRM-1-зависимому ядерному экспорту POP-1/Tcf (Meneghini et al., 1999; Lo et al., 2004). И, наконец, подтверждено. что АРС, независимо от своей роли в цитоплазматическом деструктивном комплексе, действует на хроматин, чтобы облегчить CtBP-обусловленную репрессию Wnt генов мишеней в нормальных, но не в колоректальных раковых клетках (Sierra et al., 2006). Wnt Target Genes Потеря компонентов Wnt пути может вызывать драматические фенотипы, которые затрагивают широкий круг органов и тканей. Передачу сигналов Wnt связывают с поддержанием или активацией стволовых клеток (Reya, Clevers, 2005). Цте сигналы могут способствовать клеточной пролиферации и тканевой экспансии, но контролируют также детерминацию судеб или терминальную дифференцировку постмитотических клеток. Иногда эти несопоставимые события, пролиферация и терминальная дифференцировка, могут быть активированы с помощью Wnt в разных типах клеток внутри одной и той же структуры, такой как волосяной фолликул или кишечная крипта (Reya, Clevers, 2005).
Многочисленные Tcf гены мишени были идентифицированы в разных биологических системах. Эти исследования имеют тенденцию фокусироваться на генах мишенях, участвующих в канцерогенезе, напр., широкий интерес проявляется к Wnt генами мишеням cMyc и Ciclib D1 (http://www.stanford.edu/~rnusse/wntwindow.html). Путь Wnt имеет самостоятельные транскрипционные исходы, который детерминируются с помощью онтогенетических качественных особенностей отвечающих клеток скорее, чем за счет природы сигнала. Др. словами, большинство Wnt генов мишеней, по-видимому, специфично для типа клеток. Пока неясно, существуют ли "универсальные" Wnt/Tcf гены мишени. Наилучшими кандидатами у позвоночных являются Axin2/conductin (Jho et al., 2002) и SP5 (Weidinger et al., 2005). Как отмечалось (Logan, Nusse, 2004), передача сигналов Wnt авторегулируется на многих уровнях. Экспрессия разнообразных позитивных и негативных регуляторов пути, таких как Frizzled, LRP и HSPG, Axin2 и TCF/Lef, контролируется комплексом TCF/β-catenin. Wnt Signalling in Self-Renewing Tissue in Adult Mammals Передача сигналов Wnt не только признак многих онтогенетических процессов; в некоторых само-обновляющихся тканях у млекопитающих она остается существенной в течение всей жизни.
Gut. Абсорбтивный эпителий тонкого кишечника представлен многочисленными ворсинками и криптами. Он состоит из очень быстро само-обновляющейся ткани у взрослых млекопитающих. У мышей эпителий обновляется полностью в течение 3-5 дней. Высокая скорость продукции клеток с помощью "transit-amplifying" компартментов крипт компенсируется за счет апоптоза на кончиках ворсинок. Пролиферирующие предшественники крипт и клетки дифференцированных ворсинок формируют непрерывный слой клеток, которые находятся в постоянном перемещении вверх. Стволовые клетки располагаются вблизи дна крипт и избегают подобного перемещения. Эти медленно делящиеся клетки продуцируют transit-amplifying клетки предшественники, которые способны дифференцироваться в направлении всех эпителиальных клонов. Стволовые клетки само-обновляются в течение всей жизни и регенерируют эпителий после повреждения (Рис. 4). Предетерминированное потомство прекращает свои клеточные циклы и дифференцируется, когда они достигают соединения крипта-ворсинка (rev. Reya, Clevers, 2005).
Имеющиеся доказательства указывают на то, что Wnt каскад является доминирующей силой по контролю клеточных судеб вдоль оси крипта-ворсинка. У новорожденных мышей, лишенных Tcf4, эпителий дифференцированных ворсинок, по-видимому, не затронут, но компартмент предшественников крипт полностью отсутствует (Korinek et al., 1998). Это указывает на то. что физиологическая передача Wnt сигналов необходима для становления этого компартмента предшественников. Ингибирование передачи сигналов Wnt с помощью трансгенной экспрессии Dkk-1 у взрослых мышей индуцирует полную потерю крипт, указывая, что Wnt является доминантным митогеном для клеток предшественников крипт в течение всей жизни (rev. Reya, Clevers, 2005). Трансгенная экспрессия Wnt агониста R-spondin-1 приводит к массивной гиперпролиферации кишечных крипт, что подтверждает это мнение (Kim et al., 2005). Wnt белки физиологически экспрессируются эпителиальными клетками крипт скорее, чем окружающей мезенхимо1 (Gregorieff et al., 2005). Эти Wnt белки не только стимулируют пролиферацию предшественников крипт, но и способствуют также терминальной дифференцировке клеток Paneth, располагающихся на дне крипт (van Es et al., 2005).
Hair Follicle. Мультипотентные эпидермальные стволовые клетки располагаются в области выпячиваний волосяных фолликулов (Рис. 4). Выпячивания стволовых клеток могут генерировать все клоны волоса, но и также sebocytes и даже стволовые клетки межфолликулярного эпидермиса (Alonso, Fuchs, 2003). Для формирования волоса клетки мигрируют вниз из выпячивания через наружный корневой слой. В основании волоса клетки вступают в transit-amplifying компартмент, называемый germinative матриксом , где они подвергаются терминальной дифференцировке в прекортикальный компартмент волоса.
Передач сигналов Wnt необходима для становления волосяного фолликула. Мыши с мутациями в Lef1 имеют мало волосяных фолликулов (van Genderen et al., 1994). Напротив, избыточная экспрессия трансгена Lef1 ведет к de novo образованию волосяных фолликулов в эпидермисе. Сходным образом, избыточная экспрессия трансгенной конституитивно стабильной ("онкогенной") формы β-catenin индуцирует дополнительные волосяные фолликулы (rev. Alonso, Fuchs, 2003).
Внутри установившегося волосяного фолликула Wnt каскад остается критическим в течение всей жизни. Сигналы Wnt играют ключевую роль в активации выпячиваний стволовых клеток, чтобы стимулировать образование волоса и этот сигнал опосредуется с помощью β-catenin и Lef1 (Lowery et al., 2005). Условные делеции гена β-catenin или трансгенная экспрессия доминантно-негативного Lef1 в установившемся волосяном фолликуле нарушает процесс, с помощью которого стволовые клетки в выпячивании дают клон предшественников волоса (Ргудылут уе al., 2001). Вместо этого мутантные клетки воспринимают эпидермальную или sebocyte судьбу. В свою очередь, передача сигналов Wnt в волосяном фолликуле осуществляется посредством Lef1, активируя стволовые клетки выпячиваний, способствуя их вступлению в клон волоса и рекрутируя клетки в transit-amplifying матричный компартмент.
Множественные гены кератинов волос несут связывающие Tcf сайты в своих промоторах (Zhou et al., 1995), подтверждая предположение, что передача сигналов Wnt в матриксе? передаваемая через β-catenin и Lef1, не только контролирует экспансию клеток предшественников, но и также управляет терминальной дифференцировкой клона волоса. Эта ситуация напоминает терминальную дифференцировку клеток Paneth с помощью Wnt в криптах.
Hematopoietic System. Гематопоэтические стволовые клетки (HSCs) наиболее изученные у млекопитающих. В ряде исследований было установлено, что путь передачи сигналов Wnt является важным регулятором гематопоэтических стволовых клеток и клеток предшественников. HSCs сами по себе, также как и микроусловия костного мозга могут продуцировать Wnt белки. В самом деле Tcf репортеры активны в HSCs в своих нативных микроусловиях. In vitro растворимые Wnt белки способствуют пролиферации и ингибируют дифференцировку гематопоэтических предшественников мышей. Кроме того, избыточно экспрессируемый β-catenin, также как и стимуляция очищенными Wnt белками поддерживает само-обновление HSCs мыши и человека in vitro. Такие обработанные HSCs усиливают свою способность восстанавливать гематопоэтическую систему у летально облученных мышей (Кунф уе al., 2003). Передача сигналов Wnt участвует также в детерминации судеб внутри Т-лимфоидного клона, т.к. мыши, лишенные или только Tcf1 или Tcf1 и Lef1, обнаруживают тяжелые редукции в компартментах самых ранних предшественников тимоцитов (Okamura et al., 1998).
В свете этих наблюдений стало неожиданным, что условные делеции β-catenin у мышей не затрагивают гематопоэтическую/ лимфоидную систему (Cobas et al., 2004). Однако, возможно, что потеря β-catenin компенсируется в гематопоэтической системе его гомологом γ-catenin/plakoglobin.
Bone. В постнатальной и взрослой жизни остеобласты продуцируют костный матрикс, тогда как остеокласты резорбируют матрикс. Плотность кости предопределяется относительными активностями этих двух типов клеток. Мутации избыточной функции в гене человека LPR5 приводят к болезням костей, указывая, что канонический сигнальный путь Wnt может регулировать костную массу. Это наблюдение индуцировало генетические исследования на мышиных моделях, которые в целом подтвердили важность этого сигнального пути в гомеостазе костей, прежде всего как позитивного регулятора клона остеобластов. Сходным образом c людьми, несущими мутацию избыточной функции LRP5G171V, трансгенные мыши, экспрессирующие этот аллель в остеобластах обнаруживают повышенную плотность костей и повышенные количества активных остеобластов (rev. Hartman, 2006). В согласии с этим, мыши с отсутствием Lrp5 обнаруживают уменьшение костной массы и дефекты в пролиферации и созревании остеобластов (Kato et al., 2002). Кроме того, потеря гена SOST, продуцирующего sclerostin, ведет к sclerosteosis, болезни человека, характеризующейся высокой костной массой. Две группы недавно продемонстрировали, что SOST/Sclerostin является секретируемым Wnt ингибитором, который соединяется и блокирует LRP5/6 (Li et al., 2005; Semenov et al., 2005).
Некоторые др. мышиные модели подтверждают мнение, что активированная передача сигналов Wnt ведет к постнатальному увеличению костной массы, как у трансгенных мышей, экспрессирующих Wnt10b в жировой ткани и костном мозге и мышей, лишенных Wnt антагониста Sfrp1 (Hartmann, 2006). Мыши, лишенные Axin2 характеризуются краниосиностозом в результате усиленной пролиферации предшественников остеобластов в черепных швах (Нг уе al., 2005). Эти генетические исследования указывают на то. что созревание и активность остеобластов индуцируется каноническим путем Wnt. Wnt Signalling in C ancer Colon Cancer. Ген АРС был первым клонирован среди опухолевых супрессоров. Мутации АРС в зародышевой линии являются причиной наследственного ракового синдрома Familiar Adenomatous Polyposis (FAP) (Kinzler et al., 1991; Nishisho et al., 1991). FAP пациенты, наследующие один дефектный АРС аллель, характеризуются большим количеством аденом или полипов в толстом кишечнике в раннем взрослом периоде. Полипы являются злокачественными, клональными разрастаниями эпителиальных клеток, в которых второй аллель АРС инактивирован. К сожалению некоторые из этих полипов прогрессируют в злокачественную аденокарциному. Потеря обоих аллелей АРС происходит в огромном большинстве спорадических колоректальных раков (Kinzler, Vogelstein, 1996). Мутационное инактивирование АРС ведет к несоответствующей стабилизации β-catenin (Кгиштаудв уе al., 1996; Рис. 4). В самом деле, Tcf репортерная конструкция обычно транскрибируется в АРС мутантных раковых клетках, благодаря действию коституитивных комплексов между β-catenin и членом семейства кишечных TCF, Еса4 (Korinek et al., 1997). В редких случаях колоректальных раков, когда АРС не является мутантным, обнаруживаются мутации Axin2 (Liu et al., 2000) или активирующие (онкогенные) точковые мутации в β-catenin, удаляющие его N-терминальный Ser/Thr деструктивный мотив (Lammi et al., 2004).
В кишечных эпителиальных клетках, в которых АРС мутантны, конституитивный β-catenin/Tcf4 комплекс активирует генетическую программу в стволовых и клетках предшественниках в криптах (van de Wetering et al., 2002). В криптах градиент сигналов Wnt управляет экспрессией этой генетической программы, чтобы поддерживать пролиферацию клеток предшественников. Градиент Wnt также контролирует экспрессию EphB/EphrinB сортирующих рецепторов и лигандов (Battle et al., 2002). Возникающий в результате контр-градиент EphB/EphrinB устанавливает границы между криптами и ворсинками, а также позицию Paneth клеток в основании крипт. Некоторые EphB гены первоначально позитивно регулируются как гены мишени Wnt/Tcf4 в ранних аденомах, но их экспрессия теряется после прогрессирования рака., возможно в результате селективного процесса. Активирование мутаций Wnt пути не ограничено раковыми опухолями в кишечнике. Мутации потери функции в Axin обнаружены также в гепатоцеллюлярных карциномах, в то время как онкогенные мутации β-catenin обнаруживаются в широком круге солидных опухолей (rev. Reya, Clevers, 2005).
Некоторые животные модели предложены для FAP. Dove с коллегами описали multiple intestinal neoplasia (min) у мышей, несущих стоп-кодон в АРС (APCmin). В отличие от FAP пациентов. мыши APCmin формируют аденомы преимущественно в тонком кишечнике (Su et al., 1992). Некоторые дополнительные Арс нокаутные модели получены на мышах. Такие мыши всегда формируют неопластические повреждения, но они могут отличаться по показателю опухолей и типу ткани, в которой впервые возникает опухоль. Wnt каскад мутационно активируется у взрослых мышей с помощью условной делеции Apc (Sansom et al., 2004). В течение нескольких дней ворсинки почти целиком замещаются характерными для крипт клетками, демонстрируя прямую связь между активной передачей сигналов Wnt и пролиферацией предшественников крипт, которые, если не ограничиваются, вызывают рак. Рыбки данио, которые мутантны по Арс, напоминают мышиные модели, у которых гетерозиготные мутации приводят к аденомам в органах энтодермального происхождения, включая кишечник (Haramis et al., 2006)
Hair Follicle Tumors. Компартмент transit-amplifying матрикса волосяного фолликула, по-видимому, является мишенью злокачественной трансформации за счет мутационной активации каскада Wnt. Конституитивно активные онкогенные β-catenin трансгены индуцируют pilomatricoma-подобные повреждения (Gat et al.,1998), опухоли, чья внешняя сторона плотно упакованных клеток напоминает матрикс волосяного фолликула. Tamoxifen-индуцибельный трансген β-catenin индуцирует др. опухоль волосяного фолликула, т.наз. trichofolliculoma (Lo Celso et al., 2004). Более того, большинство спонтанных pilomatricomas у людей несут активированные мутации в β-catenin (Chan et al., 1999). Подобно аденомам кишечника, эти pilomatricomas и trichofolliculomas ниспровергают процесс, с помощью которого Wnt управляет физиологической экспансией предшественников волос в matrix/precortex области волос.
Watt с коллегами описали первые инактивирующие мутации пути Wnt при раке у людей. Одна треть из серии человеческих sebaceous опухолей, несущих мутации LEF1, связана с нарушением связывания LEF1 с β-catenin и с активацией транскрипции. Это наблюдение сравнимо с моделью, согласно которой приобретение ранними предшественниками судьбы волоса нуждается в передаче сигналов Wnt посредством Lef1. В отсутствие такой передачи сигналов предшественники могут ошибочно перенаправляться в сторону судьбы sebocyte (Takeda et al., 2006).
Leukemia Вытягивание параллелей между само-обновлением раком в кишечнике и волосяных фолликулах и эффектами компонентов Wnt пути в гематопоэтических предшественниках предсказывает, что дерегуляция Wnt может вносить вклад в гематологическое озлокачествление. В самом деле недавние сообщения указывают на то, что лейкемический рост как миэлоидного, таки и лимфоидного ростка зависит от передачи сигналов Wnt. Предшественники гранулоцитов-макрофагов от пациентов с Chronic Myelogenous Leukemia и клетки blast crisis от пациентов, резистентных к терапии, обладают активной передачей сигналов Wnt, что демонстрируется по активности Tcf репортера и накоплению в ядре β-catenin (Jamieson et al., 2004). Природа аберрантного Wnt пути действительно не решена, не выявлено Wnt пути мутаций при гематологических озлокачествлениях.
Future Challenges Over the last 20 years, a detailed outline of the canonical Wnt pathway has emerged. Althhough it is likely that most core components of the pathway have now been identified much remains to be learned about the biochemical events that connect these components. Many of the gaps in our knowledge are due to the notorious difficulties in the production of purified Wnt proteins. Few zzod Wnt antibodies exist and, 25 years after the cloning of Wnt1, its structure remains unknown. The routing and the coincident posttranslational modifications of Wnt proteins in the secreting cell are incompletely understood. And the rules that dictate the movement of Wnt proteins between cells remain uncertain. However, a procedure to produce soluble Wnt has recently been ze. eloped (Willert et al., 2003), which creates avenues tc address many of these issues.
The components of the destruction complex have been long known, yet the biochemistry of its activity has femained elusive. APC is an essential component of the destruction complex, but what is its biochemical activity? How relevant is Dsh for the coupling of Wnt receptors to the destruction complex? And what mechanism ihibits the phosphorylation of β-catenin by the destruction complex when a Wnt signal is being transduced?
In addition, a multitude of proposed pathway components, not discussed here, may activate, modify, or inhibit Wnt signaling or may be involved in crosstalk to other pathways. An updated, comprehensive list of these putative components and interactions appears on http://www.stanford.edu/~rnusse/wntwindow.html. (Often based on single studies, these candidate components remain to be independently confirmed.
Wnt signaling ultimately controls developmental fates though the transcription of cell type-specific programs of Tcf target genes. Recent developments in array-based technology allow detailed analysis of the nuclear transcriptional response to Wnt signals. With these technologies, it is expected that the dissection of the gene programs in various developmental or pathological events will provide a wealth of insight into the biology of these processes. Such insights will be crucial for the development of targeted therapies for diseases related to the Wnt pathway. To date, the development of such therapies has unfortunately been lagging behind the rapid progress made in our fundamental understanding of this pathway. Small-molecule inhibitors of the Wnt pathway have proven difficult to develop but should hold great promise for the treatment of cancer. Agonists of the pathway have become available, such as small-molecule inhibitors of GSK-3 and soluble Wnt or R-spondin proteins. These may be used to support renewal or repair of tissues such as bone, hair, or damaged intestinal epithelia.
The rapidly maturing Wnt field unites an unusually broad and effective spectrum of scientific disciplines. It can be expected that many of the outstanding questions in the field will be answered in the foreseeable future.
|