Developmental Origin of a Bipotential Myocardial and Smooth Muscle Cell Precursor in the Mammalian Heart | |
|
|
Сердце млекопитающих формируется благодаря серии точно скоординированных событий и содержит три основных клона - миокардиальные, эндотелиальные и гладкомышечные клетки. Онтогенетические предшественники миокардиальных клеток описываются наиболее часто в кардиогенной мезодерме, возникающей из клеток первичной полоски (Garcia-Martinez, Dchoenwolf, 1993; Hatada, Stern, 1994). Эти клетки мигрируют билатерально в антерио-латеральную мезодерму , чтобы сформировать первичное поле сердца, приобрести серпообразную форму и слиться по срединной линии, образовав линейную сердечную трубку, состоящую из наружного эпителиального миокарда и внутреннего эндотелия (Rosenquist, DeHaan, 1966; Srivastava, Olson, 2000). Последующие события дают зрелое четырехкамерное сердце.
Происхождение эндокарда неясно. Ранние исследования на курах подтвердили существование самостоятельной популяции клеток предшественников внутри первичной полоски для миокарда и эндокарда до их миграции в кардиогенную мезодерму (Cofflin, Poole, 1988). Более недавние исследования потенциала генной экспрессии и дифференцировки мезодермальных эксплантов подчеркнули существование бипотенциальных предшественников (Eisenberg, Bader, 1995). Используя технику ретровирусного мечения, чтобы пометить одиночные клетки в ранней мезодерме Cohen-Gould и Mikawa (1996) не обнаружили одновременно метящихся эндокардиальных и миокардиальных клеток на стадии прямой сердечной трубки. Всё это указывает на раннее разделение эндокардиального и миокардиального клонов в развивающемся сердце кур, или непосредственно перед или во время гаструляции.
Развитие эмбриональных сосудистых гладкомышечных клеток происходит позднее, чем миокардиальных или эндокардиальных клеток. Как таковые разные тканевые источники, как было описано, дают гладкомышечные клетки в разных органах (Stavros, Majevsky, 1996). Напр., аортальные гладкомышечные клетки имеют двойное происхождение из нервного гребня и латеральной пластинки мезодермы (Le Lievre, Le Duran, 1975; Waldo, Kirby, 1993; Hungerford et al., 1996). Проэпикардиальный орган, дорсо-мезодермальная структура, дающая эпикард, ткань, которая подвергается эпителиально-мезенхимной трансформации, чтобы генерировать эндотелиальные и гладкомышечные клетки коронарных артерий (Mikawa, Gourdie, 1996). Очевидно, что гладкомышечные клетки имеют менее определенное онтогенетическое происхождение в целом и рекрутируются локально из мезенхимных предшественников и дифференцируются в ответ на специфические тканевые сигналы.
Недавние исследования предположили существование мультипотенциальных предшественников для мезодермального клона. Используя редкие события рекомбинации в генетически маркированных одиночных клетках в развивающихся эмбрионах Esner et al.,(2005) продемонстрировали общие предшественники для скелетных мышц и аортальных гладкомышечных клеток. Сходным образом, клетки краниальной фарингеальной мезодермы, популяция, которая обычно дает мускулатуру головы, может вносить вклад в развивающийся кардиальный тракт оттока (Tirosh-Finkei et al., 2006). Более того клетки предшественники, способные дифференцироваться в эндокардиальные и гладкомышечные клетки, были недавно описаны (Ema et al., 2003). Детальный клональный анализ гладкомышечных клеток в основании аорты и легочной артерии выявил неожиданное происхождение из вторичного поля сердца, недавно описанной популяции клеток, возникающей дорсо-медиально по отношению первичному полю сердца и благодаря этому дающее только миокард тракта оттока, правого желудочка и межжелудочковой перегородки (Verzi et al., 2005; Waldo et al., 2005). Более того эти предшественники сосудистых гладкомышечных клеток экспрессируют Nkx2.5, клональный маркер ассоциирующий с миокардиальными клетками предшественниками. В самом деле, клональный анализ предшественников Nkx2.5+ клеток, с использованием локус-специфической Cre recombinase показал, что множественные типы клеток (включая гладкомышечные клетки тракта оттока и эндотелиальные клетки желточного мешка) экспрессируют этот ген (Moses et al., 2001; Stanley et al., 2002). Всё это делает возможным, что онтогенетическая мультипотентность является более распространенной, чем полагалось ранее. Ни одно из этих исследований не пыталось определить качественные особенности этих предполагаемых клеток предшественников.
Чтобы исследовать взаимоотношения между онтогенетической судьбой и потенциалом эмбриональных кардиальных клеток предшественников мы выделяли ранние клетки, экспрессирующие Nkx2.5, из развивающегося сердца мышей и продемонстрировали из дифференцировку как в сокращающиеся кардиомиоциты, так и гладкомышечные клетки. Чтобы установить, действительно ли бипотенциальная дифференцировка происходит на уровне единичной клетки, мы выделяли Nkx2.5+ клетки из in vitro дифференцированных эмбриональных клеток (ES) и показали, что с-kit+ субпопуляция обладает повышенной способностью к экспансии in vitro и бипотенциальной дифференцировке из одиночной клетки, чтобы использовать эти базирующиеся на ES клетках находки в эмбриологическом контекста мы выделяли с-kit+ Nkx2.5+ клетки из развивающихся мышиных эмбрионов и продемонстрировали их способность подвергаться как миокардиальной, так и гладкомышечной дифференцировке in vivo . Всё это подтвержадет дивергенцию гладкомышечного и мышечного клонов из общего кардиоваскулярного предшественника в развивающемся поле сердца.
DISCUSSION Итак, мы продемонстрировали, что с-kit+ Nkx2.5+ популяция дифференцируется спонтанно в миокардиальные и гладкомышечные клетки, как это было установлено с помощью in vitro дифференцировки ES клеток и с помощью эмбриональных трансплантаций. Эти бипотенциальные предшественники, по-видимому, неспособны давать гематопоэтические, нейрональные или скелетно-мышечные клетки, следовательно, они представляют популяцию которая ограничена в отношении др. клонов. Всё это подтверждает новую парадигму для сердечно-сосудистого развития, связанного с дивергенцией миокардиального и гладкомышечного клонов из общего предшественника в примордиальном поле сердца. Relationship between Nkx2.5+ Cells and other Embryonic Progenitor Cells Прежде исследований по отслеживанию клонов у мышей было продемонстрировано разнообразие онтогенетических источников для сосудистых гладкомышечных клеток. В частности, кардиальный нервный гребень может давать сосудистые гладкомышечные клетки аортальных дуг, а также коронарных сосудов (Le Lievre, Le Douarin, 1975; Waldo, Kirby, 1993; Hungerford et al., 1996; Hutson, Kirby, 2003; Stoller, Epstein, 2005). Помимо этого клетки из вторичного поля сердца , как было установлено, генерируют кардиомиоциты тракта оттока, а также сосудистые гладкомышечные клетки аортального кольца (Verzi et al., 2005; Waldo et al., 2005). Вклад этих клеток во множественные клоны указывает или на широкий онтогенетический потенциал общего предшественника или на существование множественных линейно-детерминированных предшественников в том же самом анатомическом месте.
В этой связи интересно, что Moretti et al (2006) сообщили об идентификации isl+ клеток предшественников способных к мультиклональной дифференцировке in vitro в гладкомышечные клетки, кардиомиоциты, а также в эндотелиальные клетки. Взаимоотношения между этими isl1+ предшественниками и с-kit+Nkx2.5+ клетками, которые мы описали, еще предстоит выяснить. Учитывая, что клетки как первичного, так и вторичного поля сердца экспрессируют Nkx2.5, в то время как isl1 экспрессируется исключительно во вторичном поле сердца, две популяции клеток предшественников могут или полностью самостоятельны (если с-kit+Nkx2.5+ клетки происходят целиком из первичного поля сердца) или родственны ( если isl1-экспрессирующие клетки во вторичном поле сердца являются производными мезодермальных с-kit+ клеток). Конечно, наш анализ эмбрионов Е10.5 выявляет eGFP+ клетки в тракте оттока, которые ко-локализуются с isl1+ клетками (Рис. 1С, Е10.5). Эти клетки располагаются во вторичном поле сердца в области, которую Waldo et al., (2005) постулировали, как место, где бипотенциальные клетки предшественники гладкомышечных и миокардиальных клеток могут возникать. Дальнейшие эксперименты с использованием дважды меченных isl1 и Nkx2.5 клеток помогут определить взаимоотношения между этими популяциями. Relationship between c-Kit+Nkx2.5+ и с-Kit+ Cardiac Stem Cells Взрослые с-kit+ кардиальные стволовые клетки характеризуются экспрессией с-kit в отсутствие клональных маркеров, таких как Nkx2.5 (Beltrami et al., 2003). Онтогенетический потенциал этих взрослых с-kit+ клеток также, по-видимому, более широкий. Эти с-kit+ клетки могут представлять собой онтогенетические остатки от популяции мультипотентных мезодермальных клеток, которые персистируют в сердце во время всего эмбрионального и постнатального развития. Альтернативно, эти с-kit+ клетки могут быть "itinerant" (странствующими) мезодермальными остатками, располагающимися в костном мозге и мобилизируемые в ответ на повреждения миокарда. Эти клетки, хотя специфически и не запрограммированы на дифференцировку миокарда, как было показано улучшают кардиальную функцию при повреждениях и восстановлении миокарда (Fazel et al., 2006). Необходимы дальнейшие исследования, чтобы установить исходные взаимоотношения между c-Kit+Nkx2.5+ клетками, описанными здесь и взрослыми кардиальными стволовыми клетками с-kit+.
Во время развития с-kit скорее всего несущественны для пролиферации и дифференцировки миокардиальных и гладкомышечных клеток. Исследования спонтанных мутаций W локуса показали не существенную роль с-kit в середчно-сосудистом развитии или формировании гематопоэтических стволовых клеток несмотря на установленную роль этого гена как маркера стволовых клеток (Reith et al., 1990). Мы полагаем, что экспрессия с-kit служит как указатель онтогенетического потенциала в разных органных системах и в сочетании с Nkx2.5 предопределяет бипотенциальную популяцию клеток кардиоваскулярных предшественников. The Existence of Bipotential Myogenic Precursor Cell Supports a New Developmental Paradigm for Cardiogenesis Наши данные подтверждают существование общего предшественника для миокардиальных и гладкомышечных клеток у развивающихся эмбрионов. Это согласуется с in vivo исследованиями, продемонстрировавшими ко-экспрессию многочисленных гладкомышечных генов в клетках миокардиальных предшественников (Рис. S1) (Samaha et al., 1996; Li et al., 1996; Jain et al., 1998). Хотя и было предположено, что миокардиальные клетки подвергаются переходу в клетки подобные гладкомышечным во время раннего развития (Li et al., 1996), мы продемонстрировали, что ко-экспрессия миокардиальных и сосудистых гладкомышечных клеточных маркеров представляет собой доказательство дивергенции этих двух клонов от общего миогенного предшественника. В этом отношении, недавние сообщения от бощих клетках предшественниках для параксиальных скелетно-мышечных клеток и аортальных гладкомышечных клеток (Esner et al., 2005), скелетных мышц головы и миокардиальных клеток тракта оттока (Tirosh-Finkel et al., 2006), миокардиальных и гематопоэтических клеток (Masino et al., 2004) и эндотелиальных и сосудистых гладкомышечных клеток (Ema et al., 2003)> всё это указывает на то, что онтогенетическая мультипотентность оказывается более преобладающей, чем это выявлялось в ранних исследованиях. Общий миогенный предшественник, который был нами выделен и охарактеризован подчеркивает новую парадигму кардиогенеза, где одиночная мультипотентная стволовая/предшественник клетка вносит вклад в клетки разных клонов внутри сердца. A Model for the Differentiation of Precardiac Mesoderm into Cells of Different Fates within the Heart Модель онтогенетического прогресса от прекардиальной мезодермы к детерминированным кардиоваскулярным клеткам предшественникам перед камер-специфической дифференцировкой представлена на Рис. 7. В этой модели экспрессия с-kit предшествует экспрессии Nkx2.5 на ст. прекардиальной мезодермы. Инициация экспрессии Nkx2.5 означает детерминацию в предшественников миокардиальных и гладкомышечных клонов клеток. Экспрессия с-kit в клетках Nkx2.5+ теряется, когда эти клетки переходят или в гладкомышечные или миокардиальные предшественники. С дальнейшей дифференцировкой эти клетки предшественники становятся специфическими lzk предсердий или желудочков миоцитами или клетками проводящей системы. Хотя специально не исследовано в данной работе, но установлено, что волокна Пуркинье происходят из предшественников кардиомиоцитов (Gourdie et al., 1995). Учитывая, что мутация Nkx2.5 ответственна за болезни проводящей системы у мышей и людей (Schott et al., 1998; Pashmforoush et al., 2004) наша способность отслеживать дифференцировку Nkx2.5+ предшественников в клетки проводящей системы in vitro может предоставить уникальную информацию о патогенезе кардиальных аритмий.
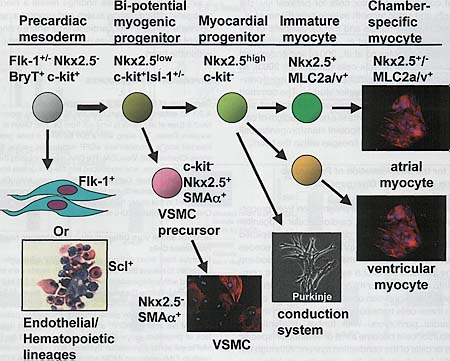 Figure 7. Differentiation of Cardiovascular Lineages from a Common Precursor in the Precardiac Mesoderm The expression of lineage markers shown is based on our current data as well as other published studies. The divergence of endothelial and hematopoietic lineages from myocardial lineage precedes the expression of Nkx2.5 in the precardiac mesoderm. BryT, brachyury T; VSMC, vascular smooth muscle cell. |