Посещений:  Развитие Почек
Развитие Почек
Клеточные Основы
|
|
The Cellular Basis of Kidney DevelopmentGregory R. Dressler  Annu. Rev. Cell Dev. Biol. 2006. 22:509–29
|
Mammalian kidney development has helped elucidate the general
concepts of mesenchymal-epithelial interactions, inductive signaling,
epithelial cell polarization, and branching morphogenesis.
Through the use of genetically engineered mouse models, the manipulation
of Xenopus and chick embryos, and the identification of
human renal disease genes, the molecular bases for many of the
early events in the developing kidney are becoming increasingly
clear. Early patterning of the kidney region depends on interactions
between Pax/Eya/Six genes, with essential roles for lim1 and
Odd1. Ureteric bud outgrowth and branching morphogenesis are
controlled by the Ret/Gdnf pathway, which is subject to positive
and negative regulation by a variety of factors. A clear role for Wnt
proteins in induction of the kidney mesenchyme is now well established
and complements the classic literature nicely. Patterning
along the proximal distal axis as the nephron develops is now being
investigated and must involve aspects of Notch signaling. The development
of a glomerulus requires interactions between epithelial
cells and infiltrating endothelial cells to generate a unique basement
membrane. The integrity of the glomerular filter depends in large
part on the proteins of the nephrin complex, localized to the slit
diaphragm. Despite the kidney’s architectural complexity, with the
advent of genomics and expression arrays, it is becoming one of the
best-characterized organ systems in developmental biology.
Branching
morphogenesis: the process of ureteric bud
expansion and repeated bifurcation that generates the
major collecting ducts
Ureteric bud: an outgrowth of the
nephric duct that invades and induces
the metanephric mesenchyme
Intermediate mesoderm: a narrow strip of
mesoderm, located between the somite and the lateral plate
mesoderm, that generates much of the urogenital system
Nephric duct: a bilateral epithelial
duct that extends caudally within the intermediate mesoderm
Mesenchyme-to-epithelial transition: a process
that occurs when aggregates of metanephric
mesenchyme assume apical and basolateral polarity
Interstitial stroma: cells derived from the metanephric
mesenchyme that do not become epithelial but migrate toward the
medullary zone
Renal vesicle: the first polarized epithelial derivatives
of the metanephric mesenchyme
S-shaped body: an intermediate structure formed
from the renal vesicle that is patterned along the
proximal-distal axis
Pax proteins: DNA-binding proteins expressed in
development of which Pax2 and Pax8 are particularly
important in the early kidney
Eya/Six genes: haploinsufficient genes associated with
human Branchio-Oto-Renal syndrome and essential for early
metanephric mesenchyme development
Podocyte: a highly specialized epithelial
cell of the glomerular tuft
Wnt proteins: secreted cell signaling proteins
that promote induction and differentiation of the
metanephric mesenchyme
Foot processes: dynamic, actin-based cellular extensions of
the podocytes that interdigitate and cover the glomerular
basement membrane
Slit diaphragm: a specialized cell-cell junction formed
between two adjacent podocyte foot processes that
creates the pore of the glomerular filtration barrier
Nephrin complex: a complex of proteins containing
nephrin, podocin, CD2AP, and neph1 that is required to
maintain the slit diaphragm and the foot processes
|
L.A.Bruggeman, S.Martinka, J.S.Simske (jsimske@metrohealth.org
Expression of TM4SF10, a Claudin/EMP/PMP22 Family Cell Junction Protein, During Mouse Kydney Development and Podocyte Differentiation
Dev. Dyn. - 2007. - V.236, No 2.- P. 596-605
TM4SF10 (Trans-Membrane tetra(4)-Span Family 10) является ортологом VAB-9 C.elegans, белком tetraspan слипчивых соединений. Было установлено, что TM4SF10 локализуется в наиболее базальной части предшественников подоцитов, в некоторых предшественниках канальцев и в соединениях уретрических зачатков с S-образными тельцами. Экспрессия TM4SF10 досигает пика на 4-й день постнатального развития и практически отсутствует во взрослых почках. Очень ограниченная экспрессия белка TM4SF10, которая сохраняется у взрослых, ограничена небольшими сегментами канальцев, оставаясь локализованной в базальной области латеральных мембран. В недифференцированных культивируемых подоцитах TM4SF10 локализуется в околоядерной области и транслоцируется на клеточные мембраны после появления Cadherin в межклеточных контактах. TM4SF10 колокализуется с ZO1 и p120ctn в недифференцированных сливающихся подоцитах и колокализуется также с кончиками актиновых филамент в клеточных контактах. После дифференцировки культивируемых подоцитов TM4SF10 белок исчезает из клеточных контактов и экспрессия затухает. Следовательно, TM4SF10 действует во время дифференцировки подоцитов и может участвовать в созревании клеточных соединений от простых слипчивых соединений до сложных щелевых диафрагм. | |
Функционирование почек млекопитающих нуждается в скоординированном развитии специфических типов клеток внутри точного архитектурного каркаса, так, чтобы жидкости тела могли бы отслеживаться и регулироваться. Эволюция почек отражает необходимость приспособившихся к суше позвоночных консервировать воду, экскретировать отходы и поддерживать гомеостаз электролитов внутри разнообразных неблагоприятных условий. Как специфицируются уникальные типы клеток в почках и как паттерн почечного развития генерируется, исследуется уже в течение многих десятилетий. Однако, только в последние годы стали более ясными механизмы, лежащие в основе генетических и клеточных основ развития почек. Почки стали модельным органом, для выяснения парадигмы эпителиально-мезенхимных взаимодействий, поляризации эпителиальных клеток и морфогенеза ветвления.
Исследования клеточных основ развития почек начались с пионерских работ Grobstein (1956), который впервые отделил почечную мезенхиму от эпителия уретрических почек и продемонстрировал необходимость индуктивных взаимодействий между этими тканями. Реципрокные индуктивные взаимодействия предоставляют существенные для жизнеспособности и дифференцировки как мезенхимные, так и эпителиальные компоненты в ранних почках. Природа индуктивных сигналов иих эффекты на пролиферацию, дифференцировку и морфогенез изучались интенсивно. Большинство ранних работ суммировано в классической монографии Lauri Saxen (1987), которые учтены Godfather в современном развитии почек. Сравнительно недавно генетический анализ людей, мышей и рыб выявил многие важные гены и пути, о которых классические работы только предполагали. Консервация генетический иерархий среди различающихся видов подчеркивает общее происхождение эмбриональных почек у всех позвоночных, если даже взрослые почки уникально приспособлены к видо-специфическим нуждам. Как и при любом онтогенетическом событии, важно начать с определения уже известных ступеней. Определение ранних механизмов, которые формируют паттерн почечных зачатков из окружающей мезодермы, оказалось успешным частично благодаря изучению раннего развития у позвоночных не млекопитающих, таких как эмбрионы рыб, лягушек и кур.
COMMON ELEMENTS OF RENAL DEVELOPMENT IN FISH, FROGS, AND MICE
Почки млекопитающих происходят из области мезодермы, расположенной между аксиальной или соматической, мезодермой и латеральной пластинкой мезодермы. Первым морфологическим указанием на уникальные производные возникают из промежуточной мезодермы, образуются пронефрические протоки или первичные нефрические протоки. Это билатеральные, толщиной в одну клетку эпителиальные трубки, распространяющиеся каудально от приблизительно от двенадцатого сомита у птиц и млекопитающих до тех пор, пока они не достигнут клоаки (Figure 1). По мере их роста формируются эпителиальные трубочки и распространяются медио-вентрально в направлении дорсальной аорты. Эти трубочки происходят из мезенхимных клеток, соседствующих с первичным нефрическим протоком и вместе составляют область, известную как нефрический тяж. Наиболее передние трубочки очень рудиментарны и обозначаются как пронефрические, в то время как более каудальные мезонефрические трубочки лучше развиты с гломерулами и завитыми проксимальными канальце-подобными структурами. У млекопитающих мезонефрические канальцы являются временными единицами фильтрации, которые дегенерируют у взрослых, а метанефрические придают почкам форму. На каудальном конце нефрического тяжа расположена метанефрическая мезенхима, область клеток, морфологически отличающихся от окружающей мезодермы.
Взрослые почки или метанефросы начинают формироваться, когда выросты из первичного нефрического протока, называемые уретрическими зачатками (bud) или метанефрическими дивертикулами, врастают в окружающую метанефрическую мезенхиму. Эпителий уретрического зачатка проникает в мезенхиму и начинает испытывать морфогенез ветвления. Т.к. генерируется стереотипический паттерн ранних точек ветвления, то некоторые мезенхимные клетки агрегируют вблизи кончиков вновь образующихся веточек и начинается процесс мезенхимно-эпителиальной конверсии, в то время как др. мезенхимные клетки генерируют интерстициальную строму (Figure 2). Агрегаты сначала образуют поляризованные почечные пузырьки, один конец которых всё ещё контактирует с эпителием уретрического зачатка. Формируется одиночная расщелина в пузырьке, чтобы создать структуру, известную как тело в виде запятой, что сопровождается образованием второй расщелины, что дает s-образное тело уже со сформированным паттерном
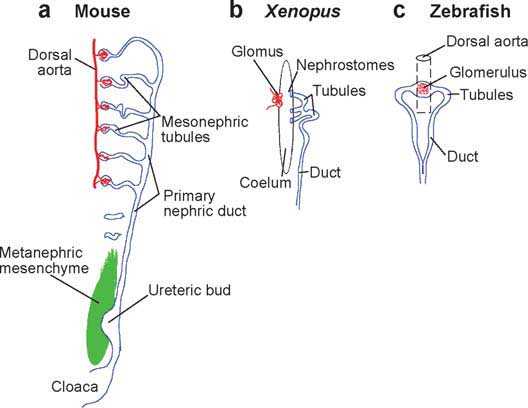
Figure 1
Early patterning of the mouse, Xenopus, and zebrafish kidneys. (a) One side of the developing mouse intermediate mesoderm is shown at approximately E10.5. More anterior, the primary nephric duct connects to a series of well-developed mesonephric tubules, and more posterior it exhibits a single ureteric bud. The metanephric mesenchyme will generate most of the adult metanephric kidney. (b) In the Xenopus embryo, by stage 38, the pronephros is fully functional and consists of a glomus that filters into the coelum. Filtrate is reabsorbed by the ciliated nephrostomes and passed down the duct. (c) The zebrafish larva has a single midline glomerulus filtering from the dorsal aorta. Two bilateral pronephric tubules direct the filtrate lateral and caudally down the ducts.
вдоль проксимо-дистальной оси. Дистальный конец, который остается в контакте с эпителием уретрического зачатка, теперь сливается, чтобы сформировать одиночную. непрерывную эпителиальную трубочку. Проксимальный конец формирует гломерулярный пучек (tuft), т.к. эндотелиальные клетки проникают в более проксимальную расщелину. Взаимодействия между эндотелиальными клетками и происходящими из мезенхимы гломерулярными эпителиальными клетками ведут к образованию гломерулярной базальной мембраны, высоко специализированного матрикса, который формирует основу для фильтрационного барьера. Переход от пронефросов к мезонефросам и затем метанефросам происходит быстро у эмбрионов мышей. Однако, у низших позвоночных пронефросы функционируют как фильтрационные единицы, чтоб делает их пригодными для экспериментального анализа. Учитывая консервацию генетических механизмов, которые специфицируют раннее развитие почек
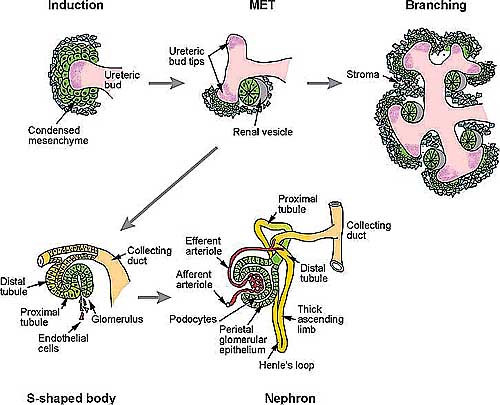
Figure 2
Sequential steps of nephrogenesis. Induction of the metanephric mesenchyme by the ureteric bud promotes aggregation of the condensed mesenchyme around the bud tips. These aggregates become
polarized as they undergo mesenchyme-to-epithelial (MET) conversion to generate the renal vesicle. Meanwhile, the ureteric bud continues to branch and induce new aggregates at the bud tips. Unpolarized
stromal mesenchyme is also now evident and can be seen migrating into the interior of the developing organ. Individual renal vesicles remain attached and fuse to the collecting ducts. By the s-shaped-body
stage, the nephron is already patterned along the proximal-distal axis. Invasion of the proximal cleft by endothelial cells starts the process of glomerulogenesis.
головастики Xenopus и личинки рыбок данио рерио являются прекрасными моделями для генетического скрининга и экспериментов по тканевым трансплантациям. У эмбрионов Xenopus ( Jones
2005), пронефросы происходят также из билатеральной промежуточной мезодермы и состоят из клубочков (glomus), канальцев и протока (Figure 1b). Клубочек фильтрует в целомическое пространство, откуда фильтрат направляется с помощью нефростомов, окруженных ресничками, в пронефрические канальцы для резорбции. Клубочек экспрессирует многие из тех же самых генов, которые обнаруживаются в развивающихся клубочках млекопитающих, хотя развитие клубочков. по-видимому, происходит независимо от пронефрических канальцев. У личинок рыбок данио (Figure 1c), Одиночный по срединной линии клубочек фильтрует жидкость из дорсальной аорты и дренирует её в два медио-латеральных пронефрических канальца, которые опорожняются в конвергирующие протоки (Drummond 2005).
Прозрачность личинок рыбок данио позволяет производить генетический скрининг по мутациям, затрагивающим развитие клубочка и канальцев (Drummond et al. 1998). Результаты таких скринингов не только подтвердили и расширили роль известных генов позвоночных в формировании раннего паттерна, но и также привели к открытию новых онтогенетических и вызывающих болезни факторов.
PATTERNING OF THE MESODERM
Перед началом гаструляции ткани, которые будут генерировать эмбрион млекопитающих, состоят из одиночного слоя клеток, называемого эпибластом. Во время гаструляции клетки эпибласта мигрируют через первичную борозду, чтобы создать эктодерму, мезодерму и эмбриональную энтодерму. Увеличение первичной полоски происходит посредством пролиферации и миграции более латеральных клеток эпибласта в борозду, что сопровождается инвагинацией по всей борозде и миграцией назад и в бок под слоем эпибласта. На наиболее переднем конце первичной полоски находится узелок или организатор, обозначаемый также узелком Гензена у кур. Узелок является функциональным эквивалентом губы бластопора амфибий, известным также как Шпемановский организатор. Узелок является сигнальным центром, который экспрессирует мощную комбинацию секретируемых факторов для установления оси тела и лево-правосторонней асимметрии (rev. Robb & Tam 2004). Узелок располагается на переднем полюсе первичной полоски приблизительно в средней точке эпибласта. Наиболее передняя часть эпибласта генерирует большую часть головы и ЦНС и не подвергается гаструляции подобного типа. Как только полоска достигает узелка, она начинает регрессировать обратно к заднему полюсу. Во время этого процесса регрессии первичной полоски формируется хорда вдоль срединной линии эмбриона и непосредственно вентральнее нервной пластинки. Хорда является вторичным сигнальным центром для формирования дорсо-вентрального паттерна нервной пластики и мезодермы. В это время формируется нервная трубка, а мезодерма оказывается паттерн-сформированной вдоль дорсо-вентральной и медио-латеральной осей. Осевая мезодерма оказывается соседней с нервной трубкой и становится сегментированной на сомиты, блоки клеток, окруженные простым эпителием. Постепенно всё более латеральная мезодерма становится компартментализованной на промежуточную и латеральную пластинки мезодермы. Т.к. промежуточная мезодерма генерирует большую часть урогенитального, то важно установить сигнальные процессы, которые специфицируют позицию этого производного мезодермы.
У эмбрионов кур и мышей ряд маркерных генов экспрессируется в латеральной пластинке мезодермы и оказывается ограниченным промежуточной мезодермой ещё до появления каких-либо морфологических указаний на урогенитальное развитие. Активация таких маркеров является первым указанием на то. что латеральная пластинка, а затем и промежуточная мезодерма дифференцируются из окружающих клеток. Спецификация промежуточной мезодермы происходит по мере миграции клеток через первичную полоску или вскоре после этого (Barak et al. 2005, James
& Schultheiss 2003). В это время ген Lim1 экспрессируется в висцеральной энтодерме, передней части мезодермы, латеральной и промежуточной мезодерме (Tsang et al. 2000). Постепенно экспрессия
Lim1 ограничивается нефрическими протоками, мезонефрическими канальцами и частями развивающихся метанефросов. Сходным образом,
Odd1 (odd-skipped related 1) также экспрессируется в широкой полосе латеральной и промежуточной мезодермы ( James & Schultheiss
2005). Paired-доменовые гены Pax2 и Pax8 экспрессируются после активации Odd1 и Lim1 в виде паттерна, более согласующегося со спецификацией промежуточной мезодермы. Экспрессия Pax2 начинается на уровне сомита 4 и распространяется каудально в виде тонкой полоски, толщиной в несколько слоёв клеток, но непосредственно рядом с сомитами (Bouchard et al. 2002, Patel & Dressler 2004). В отличие от экспрессии Lim1 и Odd1, ни Pax2, ни Pax8 экспрессия не распространяется на латеральную пластинку мезодермы.
Эксперименты по генетическому устранению у мышей продемонстрировали сложные взаимоотношения между Lim1, Pax2/8 и Odd1.Все три необходимы для правильного формирования паттерна почек. Lim1 необходим для корректного формирования паттерна всех эпителиальных структур, происходящих из промежуточной мезодермы, включая первичный нефрический проток, мезонефрические канальцы и метанефросы (Kobayashi et al. 2005, Pedersen et al. 2005, Shawlot & Behringer 1995). Экспрессия Pax2 выявляется у Lim1 мутантов, но немногие клетки, экспрессирующие Pax2, не способны соединяться в область презумптивной промежуточной мезодермы. Pax2 мутанты могут генерировать первичный нефрический проток, хотя это наиболее вероятно обусловлено перекрывающейся функцией Pax8 на ранних стадиях (Torres et al. 1995). У мышей, Pax2/Pax8 двойные гомозиготные нулевые эмбрионы не способны генерировать какие-либо эпителиальные структуры в области промежуточной мезодермы и не обнаруживают экспрессии Lim1 на E9.5 (Bouchard et al. 2002). Odd1 мутанты способны генерировать нефрический проток, который экспрессирует Pax2, но не имеют мезонефрических канальцев или доказательств метанефросов (Wang et al. 2005). Из упомянутых выше генов, только Pax2, по-видимому, достаточен, чтобы специфицировать почечные ткани, по крайней мере, в контексте ранней мезодермы. т.к. эктопическая экспрессия может расширять область, предназначенную. чтобы стать почечным эпителием (Bouchard et al. 2002).
Сигналы, которые специфицируют промежуточную мезодерму привлекли большое внимание в последнее время. Mauch et al. (2000) показали, что у эмбрионов кур контакт с аксиальной мезодермой необходим для спецификации Pax2-позитивной промежуточной мезодермы, хотя природа сигналов, продуцируемых мезодермой, неясна. Недавно James & Schultheiss (2005), использовали bone morphogenetic protein (Bmp) 2 для индукции экспрессии маркеров промежуточной мезодермы зависимым от концентрации способом. In vitro, высокие концентрации Bmp2 индуцировали судьбу латеральной пластинки мезодермы, тогда как низкие концентрации генерировали более промежуточные мезодермальные ткани. Экспрессия
Bmp высокая в дорсо-латеральной лежащей поверх эктодерме. В независимом эксперименте, образование нефрического протока оказалось возможным ингибировать, если удалялась покрывающая эктодерма, при этом образование протока восстанавливалось при добавлении экзогенных Bmps (Obara-Ishihara et al. 1999). Модель, предложенная James & Schultheiss
(2005) предполагает, что факторы внутри аксиальной мезодермы супрессируют экспрессию маркеров промежуточной мезодермы и что эта супрессия теряется при низких концентрациях Bmp. У эмбрионов Xenopus ретиноевая кислота и activins способны расширять пронефрическую область в animal cap подходах, это указывает на позитивную роль этих потенциальных морфогенов (Osafune et al. 2002).Сходным образом мышиные эмбриональные стволовые клетки отвечают на activin-A и ретиноевую кислоту экспрессией многих маркеров промежуточной мезодермы и её производных (Kim & Dressler 2005). Т.о., формирование медио-латерального паттерна, по-видимому, управляется оппозитными сигналами, чтобы специфицировать промежуточную мезодерму на разделе между латеральной пластинкой и аксиальной мезодермой. Данные подтверждают, что латеральными сигналами являются Bmps, хотя аксиальные сигналы еще предстоит выяснить.
FORMATION AND EXTENSION OF THE PRIMARY NEPHRIC
DUCT
Первичный нефрический проток является первым эпителиальным компонентом угогенитальной системы. Многие из генов, затрагивают паттерн промежуточной мезодермы, влияют на некоторые аспекты развития или удлинения нефрического протока. Существуют две гипотезы относительно формирования нефрического протока. Проток может развиваться путем рекрутирования мезодермальных клеток в эпителиальную трубку в передне-заднем направлении. Или проток может расти каудально путем пролиферации и удлинения. Клеточные клоны, отслеживаемые у эмбрионов кур говорят в пользу второй модели, т.к. клетки, составляющие нефрический проток, все, по-видимому, происходят из области внутри и вокруг сомита 12 (Obara-Ishihara et al. 1999).
На заднем конце нефрического протока вырост из уретрического зачатка является критическим событием, которое тонко регулируется вдоль передне-задней оси. Неспособность к правильному расположению уретрического зачатка (почки) вдоль нефрического протока может иметь ужасные последствия, включая врожденные аномалии мочевого тракта, ведущие к reflux, обструкции и hydroureter. Открытие, что тирозин киназные рецепторы RET, их лиганд [glial-derived neurotrophic factor (Gdnf)] и
glycophosphatidylinositol-сцепленный ко-рецептор GFRα1 являются существенными для обеспечения выроста уретрического зачатка, существенный прогресс был достигунт по выяснению биохимии и клеточной биологии выроста (Costantini & Shakya 2006). Ret экспрессируется вдоль всего нефрического протока, в то время как Gdnf локализуется в метанефрической мезенхиме. GFRα обнаруживается как в протоке, так и мезенхиме и может функционировать частично как лиганд. предназначенный для предупреждения дально-действующей диффузии Gdnf. Gdnf и GFRα1 активируют внутриклеточный тирозин киназный домен в Ret, чтобы обеспечить локальную клеточную миграцию, инвазию и пролиферацию зачатка. In vitro,
Gdnf может действовать как хемотактический наводящий сигнал для эпителиальных клеток, экспрессирующих Ret и это обеспечивается , по крайней мере, частично с помощью phosphatidyl inositol 3-kinase (Tang et al. 1998, 2002). Активация extracellular signal-related kinase (ERK) также участвует в последующих ветвлениях и пролиферации (Fisher et al. 2001,Watanabe & Costantini 2004). Передача сигналов Ret осложняется присутствием двух изоформ и множественных фосфорилированных тирозинов. В почках только изоформа Ret-9, по-видимому, существенна (de Graaff et al. 2001),
из-за её способности фосфорилировать tyrosine 1062 ( Jijiwa et al. 2004,Wong et al. 2005).
Регуляция передачи сигналов Ret/Gdnf является мультифакториальной и заключает в себе элементы на уровне генной экспрессии и более нижестоящих событий. Генетический анализ показал, что существуют множественные гены, которые супрессируют вырост зачатка эктопического мочеточника. Транскрипционные факторы FoxC1 и FoxC2 помогают предопределять переднюю границу экспрессии Gdnf, т.к. делеция любого из генов, ведет к экспансии вперед Gdnf и образованию дополнительных зачатков мочеточника более кпереди по отношению к месту обычного выроста (Kume et al. 2000). Сходным образом. делеция трансмембранного белка Slit2 или его рецептора Robo2 также приводит к множественным эктопическим зачаткам мочеточников к переди по отношению к нормальной позиции (Grieshammer et al. 2004). Передача сигналов Slit2/Robo2 также ограничивает передачу сигналов Gdnf спереди, хотя точный источник Slit2 и механизм передачи сигналов Robo2 не ясны. Дополнительными негативными регуляторами передачи сигналов RET/Gdnf включают Bmp4 белок, который супрессирует эффекты эктопического Gdnf in vitro (Brophy et al. 2001). В согласии с этим наблюдением являтся и то, что, гетерозиготные Bmp4-нулевые эмбрионы также обладают передними эктопическими зачатками мочеточников с варьирующей пенетрантностью (Miyazaki et al. 2000). Внутриклеточный ингибитор пути ERK MAP киназы, Sprouty, также вызывает образование дополнительных зачатков мочеточника у эмбрионов с потерей функции этого гена (Basson et al. 2005). Однако, ни Sprouty, ни Bmp4 не затрагивают паттерна экспрессии Gdnf. Неясно, действует ли Sprouty непосредственно на Ret рецепторную тирозин киназу, чтобы предотвратить передачу сигналов. Однако, мутантный Sprouty фенотип может быть супрессирован путем редукции дозы гена Gdnf, указывая тем самым, что Sprouty функционирует, чтобы подавлять реакцию сигнального пути Ret/Gdnf.
Спецификация метанефрической мезенхимы как уникальной области внутри промежуточной мезодермы, или нефрического тяжа, д. контролироваться, по крайней мере частично, генами, которые специфицируют позицию вдоль передне-задней оси. Прогрессируя спереди кзади на ст. E11.5 у эмбрионов мышей (Figure 1), нефрический тяж имеет хорошо развитые мезонефрические канальцы в торакальной области, рудиментарные канальцы более кзади, которые не соединены с нефрическим протоком, областью мезодермы лишенной канальцев и, наконец, метанефрическая мезенхима и зачаток мочеточника. Транскрипционные факторы путей FoxC1/C2 и Robo2/Slit2 репрессируют более переднюю экспрессию GDNF и тем самым предопределяют переднюю границу метанефрической мезенхимы. Однако, имеются также многие позитивные регуляторы Gdnf и позиции метанефрической мезенхимы. Неудивительно, что HOX семейство генов, как известно. существенное для формирования передне-заднего паттерна, осуществляет довольно существенное влияние. Когда все 6 аллелей Hox11 группы паралогов делетированы, то метанефрическая мезенхима не экспрессирует Gdnf, a вырост зачатка мочеточника нарушен (Wellik et al. 2002). Однако, у таких Hox мутантов экспрессия Pax2 и Eya1 не меняется. Eya1 (eyes absent homolog 1) является важным паттерн-формирующим геном, который необходим для спецификации метанефрической мезенхимы, но не для образования мезонефрических канальцев (Sajithlal et al. 2005, Xu et al. 1999). Семейство белков Eya , как полагают, взаимодействует с Six (Sina occulis) семейством, чтобы кооперативно регулировать нижестоящие мишени в большинстве развивающихся систем. В почках мутанты Six1 очень сходны с мутантами Eya1 тем, что они неспособны индуцировать метанефрическую мезенхиму (Xu et al. 2003). У людей мутации или в Six1 (Ruf et al. 2004) или в Eya1 (Abdelhak et al. 1997) ассоциированы с branchio-oto-renal синдромом, что ещё больше подчеркивает подобные генетические и биохимические взаимодействия. Др. гены, которые затрагивают вырост зачатка мочеточника, экспрессируются исключительно в метанефрической мезенхиме, включая Wt1 и Sal1. Wilms опухолей супрессорный ген Wt1 существенен в метанефрической мезенхиме для регуляции экспрессии Gdnf и для обеспечения выживаемости не индуцированных клеток (Kreidberg et al. 1993, Moore et al. 1999). На последних стадиях Wt1 экспрессируется на высоких уровнях в клетках podocyte из клубочков, где он выполняет существенную функцию. Sal1, гомолог Drosophila гомеозисного гена spalt, необходим для завершения инвазии уретрического зачатка и индукции метанефрической мезенхимы (Nishinakamura et al. 2001).
Транскрипционный фактор Gata-3 также необходим для собственно экспрессии Ret в нефрическом протоке (Grote et al. 2006). Мутации Gata-3 вызывают повышенную пролиферацию клеток протока и дают неправильно направленные уретрические зачатки (Grote et al. 2006, Lim et al. 2000). Ранняя экспрессия Gata-3 в промежуточной мезодерме нуждается в Pax2/8, хотя непосредственная регуляция не была продемонстрирована. У людей гаплонедостаточность по Gata-3 ассоциирует с гипотироидизмом, глухотой и почечными аномалиями - т. наз. HDR синдром (Van Esch et al. 2000). Базируясь на фенотипах потери функции и паттернах экспрессии у разных мутантов, ранние паттерн-формирующие гены, распределяются на две группы: гены. которые специфицируют промежуточную мезодерму вдоль медиолатеральной оси, такие как Pax2/8, lim1, Odd1 и гены, которые специфицируют промежуточную мезодерму вдоль передне-задней оси, такие как Hox11 группа, Eya1, Six1, и Wt1.
INDUCTIVE INTERACTIONS THAT INITIATE METANEPHRIC
DEVELOPMENT
В течение многих лет после экспериментов по трансфильтрации Grobstein (1956), в которых было доказано, что уретрический зачаток продуцирует сигналы для индукции метанефрической мезенхимы, молекулярные основы этих индуктивных сигналов по-прежнему остались неуловимы. Путем отделения на E11 метанефрической мезенхимы и культивирования её in vitro при различных условиях и с разными индуцирующими субстанциями, Saxen с коллегами охарактеризовали сигналы на множественных уровнях (Saxen 1987). Мезенхима должна быть индуцирована, чтобы сформировать канальцы, с помощью гетерологических тканей, наиболее мощной из которых явилась дорсальная часть спинного мозга эмбриона. Индуктивные сигналы не диффундировали свободно; скорее они нуждались в межклеточных и клетка-матрикс контактах в течение нескольких часов. Индукция была скорее пермиссивна, чем инструктивна: судьбы мезенхимы была уже предопределена, чтобы генерировать только почечные эпителиальные канальцы независимо от источника индуктивных сигналов. Окружающая метанефрическая мезенхима состояла из презумптивных ангиобластов, которые экспрессировали Flk1, рецептор для vascular endothelial growth factor (Vegf ). На стадии s-формы тела эти клетки мигрировали в наиболее проксимальную расщелину, чтобы сформировать капиллярные петли гломерулярного пучка (tuft). Однако, перед индукцией, Vegf стимуляция этих ангиобластов, как полагают, поддерживает экспрессию Pax2 в мезенхиме посредством ещё не идентифицированного механизма (Gao
et al. 2005). Pax2 безусловно необходим, чтобы интерпретировать индуктивные сигналы, исходящие из зачатка мочеточника (Brophy et al. 2001), только в недавнее время биохимическая природа индуктивных сигналов прояснилась.
Прорывом в установлении индуктивных сигналов, которые способствуют мезенхимно-эпителиальному превращению, стало наблюдение, что клетки, экспрессирующие Wnt белки, могут воспроизводить мощные индуктивные эффекты спинного мозга (Herzlinger et al. 1994, Kispert et al. 1998). Эти данные согласуются с наблюдением, что LiCl, специфический ингибитор glycogen
synthase kinase 3 (GSK3) в каноническом Wnt сигнальном пути, может воспроизводить ранние реакции на индукцию (Davies & Garrod 1995). Wnt белки секретируются, но не диффундируют свободно. Они скорее всего ассоциированы с heparin sulfate proteoglycans, чей синтез также необходим для раннего развития почек (Bullock et al. 1998). Некоторые Wnt белки экспрессируются в развивающихся почках, включая Wnt4 в мезенхимных агрегатах и Wnt11 на кончике зачатка мочеточника. К сожалению, потеря функции Wnt11 не устраняет индукции мезенхимы; Wnt11 , по-видимому, играет минорную или вообще перекрывающуюся роль в последующем морфогенезе ветвления зачатка мочеточника (Majumdar et al. 2003). Открытие, что Wnt9b также экспрессируется в окружении зачатка мочеточника и что wnt9b мутантные мыши неспособны индуцировать мезенхиму, в то время всё ещё осуществляют ранний морфогенез ветвления, делает этот белок наиболее многообещающим индуцирующим фактором (Carroll et al. 2005). Производились независимые попытки идентифицировать индуктивные сигналы с использованием стратегий, базирующихся на очистке факторов из линий клеток зачатка мочеточника крыс. Коктейль факторов, включая leukemia inhibitory factor (LIF), fibroblast growth factor 2 (FGF2)и или TGF-β2 или TGF-α был использован для обеспечения эпителиальной дифференцировки изолированной мезенхимы крыс (Barasch et al. 1999, Karavanova et al. 1996, Plisov et al. 2001). хотя эти факторы и обнаруживали активность in vitro получено мало генетических доказательств, что они важны для индукции и последующего развития почек. Др. возражением к этим экспериментам на крысах стало использование изолированной мезенхимы, вычленялась отдельно от зачатка мочеточника. Эта мезенхима может уже получить первичные индуктивные сигналы к тому же она подвергается апоптозу, когда культивируется одна. Культивирование в присутствии митогенов или факторов жизнеспособности может помочь формированию канальцев, в то время как в отсутствие таких факторов индуктивные сигналы не поддерживаются и не распространяются. Существенно, что наблюдаемые эффекты с LIF/FGF/TGFs зависят от активности Wnt лиганда, т.к. растворимые Wnt рецепторы ингибируют дифференцировку канальцев (Plisov et al. 2001). Эти данные подтверждают идею, что индукция действительно многоступенчатый процесс, который зависит от инициального сигнала, факторов, которые супрессирует клеточную гибель, и факторов, которые способствуют пролиферации индуцированной мезенхимы.
EXPANSION AND SURVIVAL OF RENAL STEM CELLS Индуцированная метанефрическая мезенхима, которая аггрегирует на кончиках зачатка мочеточника, может генерировать разнообразные типы эпителиальных клеток нефрона. Это впервые было показано методами отслеживания клонов клеток в органной культуре (Herzlinger et al. 1992) и недавно было подтверждено с помощью клонального анализа изолированных метанефрических мезенхимных клеток, ко-культивируемых с Wnt4-экспрессирующими питающими клетками (Osafune et al. 2006). Однако, не все клетки метанефрической мезенхимы агрегируют и становятся эпителиальными. Некоторые клетки сохраняют свой мезенхимный характер и остаются в качестве интерстициальных стромальных клеток между развивающимися канальцами. Передача клеточных сигналов между индуцированной мезенхимой, детерминированной стать эпителием и стромой, существенна для пролиферации обоих типов клеток по мере роста почек. Неспособность клеток эпителиальных предшественников увеличиваться в числе и обновляться ведет к аресту развития и рудиментарным почкам, без ингибирования дифференцировки уже индуцированных клеток. Такой фенотип наблюдается после делеции гена Bmp7 (Dudley et al. 1995, Luo et al. 1995). In vitro, Bmp7 ингибирует апоптоз ещё не индуцированной метанефрической мезенхимы и вместе с FGF2, поддерживает компетентность мезенхимы отвечать на индуктивные сигналы и увеличивать популяцию стромальных клеток (Dudley et al.1999). Bmp7 и FGF2 работают конкурентно, чтобы ингибировать образование канальцев, указывая тем самым, что экспансия доступного пула стволовых клеток необходима для тонкого баланса между дифференцировкой, жизнеспособностью и обновлением. Если клетки дифференцируются слишком быстро, то они могут опережать свою способность к самообновлению, приводя к образованию маленьких, рудиментарных почек.
Недавнее развитие технологии условных мутаций у мышей действительно прояснило потенциальную роль FGFs в развитии почек. In vitro и in vivo FGF2, FGF10 (Qiao et al. 2001) и FGF7 (Qiao et al. 1999) оказывают определенные эффекты на на паттерн морфогенеза ветвления, т.к. эпителий зачатка мочеточника ветвится, чтобы сформировать древо собирающих канальцев. Однако, неясно, являются ли эти эффекты клеточно автономными или обусловлены соседней мезенхимой. Используя специфичную для зачатка мочеточника Cre recombinase, Zhao et al. (2004) устраняли FGF рецепторы
(Fgfrs) 1 или 2 в эпителии зачатка и его производных. Лишь Fgfr2, по-видимому, существенен для обеспечения роста и формирования паттерна зачатка, т.к. эти мутанты имели меньше точек разветвления, пониженную пролиферацию и повышенную клеточную гибель внутри эпителия. Используя разные линии, экспрессирующие Cre recombinase в мезенхимном компоненте, Poladia et al. (2006) показали, что любой Fgfr1 или 2 существенен для нормального развития, тогда как делеция обоих Fgfr1 и Fgfr2 полностью ингибирует способность метанефрической мезенхимы отвечать на индукцию поддерживать развитие после E11.5. Т.о., существует перекрывание рецепторов в мезенхиме, но не в ветвящемся эпителии. Отражает ли это специфичность рецепторов для разных действующих с мезенхиме или эпителии FGFs предстоит определить. Эффекты на ткани, происходящие из мезенхимы, также наблюдались у Fgf8-нулевых эмбрионов (Grieshammer et al. 2005), с распространенной клеточной гибелью в периферической зоне и в более дифференцированных структурах, таких как s-образные тела. Однако, Fgf8 мутантный фенотип был существенно менее тяжел, чем у специфичных для мезенхимы Fgfr1/2 двойных мутантов, подтвержая, что др. FGFs также активны на более ранних стадиях.
Важность стромальных клеток в обеспечении сигналов жизнеспособности и пролиферации лучше всего проиллюстрирована анализом мутантов по рецепторам ретиноевой кислоты RARα и RARβ2. Эти ядерные рецепторы экспрессируются преимущественно в стромальной мезенхиме. У двойных мутантов Rarα/β2, клетки стромальных предшественников остаются распределенными по периферии с небольшим количеством клеток между собирающими канальцами в развивающейся медуллярной зоне (Mendelsohn et al. 1999). Наиболее сильным является подавление гена Ret на кончиках зачатка мочеточника, которое скорее всего вызывает гипопластический фенотип почек. Однако, мутантный Rarα/β2 фенотип может быть полностью восстановлен путем избыточной экспрессии гена Ret в ветвящемся эпителии (Batourina et al. 2001). Это довольно неожиданное открытие указывает на паракринный путь передачи сигналов, причем стромальные клетки нуждаются в ретиноидах, чтобы секретировать сигнал, стимулирующий экспрессию Ret и морфогенез ветвления. Источником ретиноидов, как показывает экспрессия Raldh2, могут быть сами периферические стромальные клетки, это открывает возможность, что передача сигналов ретиноидов в зачаток мочеточника осуществляется с помощью более прямого паракринного механизма. Во всяком случае, эти данные согласуются со стимулирующими эффектами ретиноидов в органной культуре почек these data are consistent (Vilar et al. 1996) и с эффектом почечной гипоплазии при vitamin A недостатке in vivo (Lelievre-Pegorier et al. 1998).
THE DEVELOPMENT OF THE NEPHRON
Мезенхимные агрегаты, индуцируемы с помощью зачатка мочеточника, д. сформировать большую часть эпителия нефрона. Это фенотипическое превращение мезенхимы в эпителий описано детально в др. месте и может быть суммировано кратко (Figure 2). Индуцированная мезенхима д. испытывать изменения в отношении свойств клеточной адгезии, т. к. она формирует агрегаты вокруг кончиков зачатка мочеточника. Эти агрегаты пролиферируют и начинают обнаруживать признаки полярности эпителиальных клеток. Клетки начинают экспрессировать белки, ассоциированные со слипчивыми и плотными соединениями. Клетки начинают принимать более цилиндрическую форму, а небольшой просвет выглядит по форме как почечный пузырёк. Затем откладывается эпителиальная базальная мембрана вокруг растущего пузырька. Пузырек остается ассоциированным с эпителием зачатка мочеточника. На стадии тела в виде запятой дистальный конец растущего нефрона сливается с эпителием протока, чтобы сформировать непрерывный просвет. Несмотря на хорошо охарактеризованные морфологические изменения, происходящие в ответ на индукцию, гены и белки, которые управляют этими событиями, всё ещё плохо охарактеризованы. Среди первых маркеров для индукции явилась позитивная регуляция гена Wnt4 в агрегатах. В отсутствие Wnt4 формируется мало агрегатов и не обнаруживается поляризованных почечных пузырьков (Stark et al. 1994). Т.о., передача сигналов Wnt4 по-видимому, действует аутокринным способом, чтобы поддержать и распространить индуктивный ответ. Как передача сигналов Wnt влияет на полярность клеток? Реакции на передачу сигналов Wnt в почках изучены плохо. Обусловленный Wnt путь планарной полярности клеток может активировать нижестоящую c-Jun N-terminal kinases ( JNKs) в др. системах (Saburi & McNeill 2005). Активированная JNK обнаруживается в ответ на экспрессию различных Wnt белков в культуре клеток и коррелирует с фосфорилированием серина белка Pax2 protein (Cai et al. 2002, 2003). Активированный JNK путь участвует также в переходе от мезенхимы к эпителию, когда изолированные метанефрические стволовые клетки культивируются на питающих клетках, экспрессирующих Wnt (Osafune et al. 2006). У мышей, несущих компаундные мутантные аллели из Jnk1, Jnk2 и Jnk3, наблюдается фенотип с существенным сходством с Pax2 гипоморфами, включая почечную гипоплазию и колобому зрительного нерва (Weston et al. 2003). Т.о., можно предположить, что активация JNK с помощью Wnt индуктивного пути д. модифицировать активность Pax2 и др. ядерных транскрипционных факторов с потенциальными местами фосфорилирования серина, чтобы инициировать переход к эпителию. После индукции изменения в экспрессии молекул межклеточной адгезии скорее всего участвуют в агрегации и поляризации. Среди наиболее важных ранних изменений являются позитивная регуляция R-cadherin и cadherin-6 и потеря cadherin-11 (Cho et al. 1998, Dahl et al. 2002, Goto et al. 1998). Однако, генетические эксперименты указывают на довольно значительное перекрывание внутри семейства cadherin генов, т.к. только едва заметная задержка в мезенхимно-эпителиальном переходе отмечена в развивающихся почках от cadherin-6-нулевых эмбрионов (Mah et al. 2000).
В то время как многое было сделано в мезенхимно-эпителиальном переходе, формирование паттерна нефрона вдоль проксимо-дистальной оси привлекло мало внимания. Как эпителиальные клетки становятся гломерулярным эпителием или воспринимают судьбу проксимальных или дистальных канальцев остается неясным. Недавние исследования с передачей сигналов Notch в ранних агрегатах и s-образных телах выяви ли критическую роль трансмембранного рецептора Notch и его лигандов в формировании проксимо-дистального паттерна. Notch белки и их лиганды - delta, serrate и jagged - используются повторно во многих развивающихся системах, чтобы дифференцировать группы клеток внутри региона на критической детерминирующей судьбу стадии (Louvi & Artavanis-Tsakonas 2006, Maillard et al. 2005). В пронефросах Xenopus Notch-1, по-видимому, регулирует решение выбора между судьбами пронефрического протока и клетками канальцев (McLaughlin et al. 2000). Активированный Notch расщепляется с помощью gamma-secretase, чтобы высвободить С-терминальный домен, который служит в качестве ядерного транскрипционного ко-активатора. Используя специфические ингибиторы gamma-secretase и in vitro органную культуру почек, Cheng et al. (2003) наблюдали снижение эпителиальных клеток гломерулярных и проксимальных канальцев, что указывает на необходимость передачи сигналов Notch в спецификации более проксимальных судеб. Сходные наблюдения были сделаны независимо у мутантных мышей, лишенных presenilin 1 и 2 в почках (Wang et al. 2003). Presenilins являются существенной частью gamma-secretase
энзиматического комплекса; поэтому их инактивация воспроизводит эффектц мутаций полной потери функции Notch. Более специфическая инактивация Notch2 в метанефрической мезенхиме вызывает четки фенотип потери проксимального эпителия в нефроне, не затрагивая морфогенез ветвления зачатка мочеточника (Cheng et al.2006).
THE DEVELOPMENT OF THE GLOMERULUS
4 самостоятельных типа клеток составляют зрелые клубочки (Figure 3). Эндотелиальные клетки капилляров формируют фенестрированные капиллярные пучки, которые позволяют жидкости и белкам проходить через эндотелиальную стенку. Мезангиальные клетки обеспечивают структуру и эластичность капиллярных сетей, секретируют внеклеточный матрикс и действуют как специализированные перициты, чтобы усилить или ограничить ток плазмы. Glomerular basement membrane (GBM) отделяет эндотелиальные и мезангиальные клетки от мочевого пространства. GBM покрывается эпителиальными
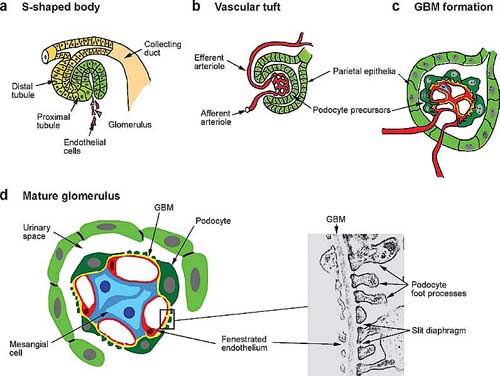
Figure 3
Development of the glomerulus. The sequential stages of glomerular development are outlined schematically. (a) The s-shaped body is infiltrated by endothelial cells to generate a primitive vascular tuft
within the cup-shaped glomerular precursor region. (b) The visceral epithelial cells, or podocyte precursors, contact the endothelial cells and begin to differentiate. (c) The glomerular basement
membrane (GBM) is formed at the boundary between podocyte and endothelial cells. Podocytes begin to extend primary and secondary foot processes. (d ) A schematic cross section through a mature glomerulus
shows the relationships among the capillary endothelial cells, mesangial cells, GBM, and podocytes that are evident at later stages and in mature glomeruli. A high-magnification electron micrograph (d, inset)
shows a typical cross section through the GBM. Note the fenestrated endothelium on the capillary side and the interdigitated podocyte foot processes on the urinary space side. Note also the precise distance
between interdigitations at the slit diaphragm. The ureteric bud continues to branch and induce new nephrons along the radial axis of the kidney such that the oldest nephrons are located closer to the
medulla, and the youngest more peripherally in the nephrogenic zone (Figure 2). Initial branching is dichotomous, with each new tip inducing a new mesenchymal aggregate. Dichotomous branching slows
beginning at approximately E15.5 in the mouse (Cebrian et al. 2004). Yet many new nephrons continue to be induced at the tips of the growing buds, within the nephrogenic zone, as late as five days post birth.
These younger nephrons form arcades that drain into a single collecting tubule.
клетками, подоцитами, чьи расширенные foot отростки переплетаются, чтобы создать уникальный тип плотных соединений, щелевую диафрагму. В то время как GBM и переплетающиеся подоциты отделяют капиллярное ложе от мочевого пространства, щелевая диафрагма поддерживает специфические размеры пор, так, что только молекулы меньше чем в 5000 daltons могут проходить через барьер фильтрации и проникать в мочевое пространство. Мочевое пространство окружено пристеночным гломерулярным эпителием и выходит в проксимальные канальцы. Развитие клубочков впервые обнаруживается на стадии s-образных тел, когда клетки предшественники на наиболее проксимальном конце начинают экспрессировать белки, специфичные для клеток подоцитов. Эти белки включают транскрипционные факторы WT1 и Pod1; трансмембранные белки podocin, Glepp1 и Nephrin; и секретируемый фактор роста VEGF (vascular
endothelial growth factor). Секреция VEGF клетками предшественниками подоцитов скорее всего помогает привлечь эндотелиальные клетки в проксимальную расщелину (Eremina et al. 2003). Эти проникшие эндотелиальные клетки могут также генерировать мезангиальные клетки в ответ на стимуляцию platelet-derived growth factor (PDGF) (Lindahl et al. 1998). Когда эндотелиальные клетки мигрируют и пролиферируют, они взаимодействуют с дифференцирующимися подоцитами, чтобы отложить GBM. Примитивный GBM состоит из collagen IV цепочек α1 и α2, но они замещаются цепочками коллагена IV α3, α4 и α5 (Miner 2005). Этот уникальный сдвиг в экспрессии генов коллагена является важным для подержания GBM и барьера фильтрации, т.к. мутации в любой из цепочек зрелых коллагенов IV приводят к наследственным формам гломерулярного нефрита, известного также как синдром Alport's (Hudson et al. 2003). Среди генов, известных как регулирующие сдвиг коллагена IV, экспрессия гена Lmx1b, чей гомеодоменовый белковый продукт может соединяться с и активировать интронный энхансер гена Col4A4 (Morello et al. 2001). Lmx1b активирует др. специфичные для подоцитов гены, обнаруженные в щелевой диафрагме, такие как гены, кодирующие CD2AP и podocin (Miner et al. 2002), и поэтому он может быть детерминирующим фактором для спецификации подоцитов. Благодаря открытию, что nephrin является белком мутантным при врожденном nephrotic синдроме Финского типа (Kestila et al. 1998) и локализации специфически в щелевой диафрагме (Holzman et al. 1999), к развитию и поддержанию специфических структур, уникальных для щелевых диафрагм, было привлечено много внимания. Комплекс белков. состоящий из nephrin, podocin (Boute et al. 2000, Roselli et al. 2002), CD2AP (Shih et al. 1999) и Neph1 (Barletta et al. 2003, Sellin et al. 2003) является существенным для поддержания интеграции барьера фильтрации. Устранение foot отростков подоцитов, является патологией, общей для хронических и острых гломерулярных болезней, ассоциированных с мутациями во многих компонентах nephrin комплекса. Недавно фосфорилирование nephrin с помощью Fyn семейства Src-like kinases обнаружено в развивающихся подоцитах и в моделях болезни, это указывает на то, что процесс вытягивания и ветвления foot отростка подоцитов ассоциирует с фосфорилированием тирозина цитоплазматического хвоста nephrin
ис его потенциальным взаимодействием с SH2-SH3 доменом белка Nck (Verma
et al. 2003, 2006; Jones et al. 2006). Понимание регуляции и сборки nephrin комплекса и его связь с динамикой актина может быть предварительным условием для выяснения механизмов вытягивания, устранения и регенерации foot отростка подоцитов.
KIDNEY DEVELOPMENT IN THE AGE OF GENOMICS
Разработка новых технологий начинает влиять на область развития почек, позволяя более всесторонне рассмотреть биологию поляризации эпителиальных клеток и морфогенеза ветвления. Выявление профилей экспрессии с использованием микромассивов стало возможно в многочисленных системах in vitro и in vivo. Ранние эксперименты исследовали профили генов как функцию стадии развития (Stuart et al. 2001), хотя это может быть неточным в тканях, которые обладают полным спектром от недифференцированных клеток предшественников до полностью развитых нефронов в средине беременности. Микровычленение метанефрической мезенхимы и эпителия зачатка мочеточника может представить более специфическую картину паттернов экспрессии генов в этих субпопуляциях (Schwab et al. 2003, Steer et al. 2004). Даже кончики зачатков мочеточников были изолированы специфически, чтобы проверить уникальные свойства этой области в отношении роста и ветвления (Schmidt-Ott et al. 2005). Комбинируя анализ микромассивов и генетически определенные клеточные популяции, Takasato et al. (2004) использовали Sal1-GFP knock in линии мышей, чтобы отсортировать клетки метанефрической мезенхимы и описать из уникальный паттерн экспрессии.
Совместные усилия по описанию паттернов экспрессии генов на всех стадиях развития почек и корреляции этих паттернов с морфологическими и физиологическими свойствами сегодня проводятся National Institute of Diabetes and Digestive and Kidney Disease с участием ведущих лабораторий в этой области. Публичный доступ к данным по мере их появления возможен по адресу http://www.gudmap.org.
CONCLUSION
There are many reasons to study kidney development—the beautiful architecture of the branching epithelia, the unique conversion
of mesenchyme to polarized epithelia, the long list of interesting genes and proteins required—but most importantly developmental studies in the kidney have provided significant insight into the realm of clinical
disease. Acute and chronic renal diseases present a societal health and financial burden that is only expected to worsen with the increased frequencies of obesity and diabetes. The tools and discoveries of developmental biology can be utilized for new cellbased therapies through the identification of renal stem cells, growth factors, and antifibrotic regulators. Although it may be within the realm of science fiction to construct a replacement kidney entirely in vitro, the use of
stem cells in renal replacement therapy after injury is already being tested in animal models. It will only be a matter of time before conditions
are optimized and stem cells can be directed to replace injured epithelia. In between the progress made and the limitless possibilities
remaining, a lot of work still remains to be done. The next five years will witness an explosion of information that will require more systemic analysis such that complex developmental systems can be modeled more quantitatively. Thus, if you are a young cell biologist, biochemist, or geneticist looking to study an interesting developmental system that has
profound implications for the health and well being of many, I would urge you to consider the mammalian kidney as an object well worth
your attention.
SUMMARY POINTS
1. The intermediate mesoderm, from which the kidney arises, is marked by expression of Pax2/8 and depends on signals from the lateral plate and somitic mesoderm.
2. Induction of ureteric bud outgrowth is driven by Gdnf, secreted from the metanephric mesenchyme, and its receptor, c-ret, expressed in the ureteric bud epithelium.
3. Anterior-posterior-patterning genes affect the position of the metanephric mesenchyme, the expression of Gdnf, and the precise point of ureteric bud outgrowth.
4. Conversion of the metanephric mesenchyme to polarized epithelia requires the sequential action of the Wnt genes, wnt9b and wnt4.
5. Growth and continued patterning of the kidney requires cell-cell interactions among induced mesenchyme, stromal cells, angioblasts, and ureteric bud epithelia.
6. The more proximal components of the nephron require Notch signaling to differentiate from the more distal tubules.
7. Glomerular development requires podocyte differentiation, slit diaphragm formation, and collagen IV chain switching to generate a viable filtration barrier.
FUTURE ISSUES
1. What are the somite-derived signals that maintain Pax2 expression levels in the intermediate mesoderm?
2. How do the suppressors of ureteric bud outgrowth Slit/Robo1 and sprouty affect the biochemistry of Gdnf/Ret signaling?
3. What are the positive and negative factors that shape the ureteric buds and control the stereotypic pattern of branching morphogenesis?
4. How are Wnt signals interpreted in the induced mesenchyme? Do these Wnts signal through the planar-cell-polarity or the canonical TCF/Lef pathways?
5. How do the metanephric mesenchyme specific transcription factors drive the process of mesenchyme-to-epithelial conversion?
6. Is mesenchyme-to-epithelial conversion reversible in renal disease processes? How do developmental factors contribute to disease initiation and progression?
7. What factors specify individual epithelial cell types along the proximal-distal axis of the developing nephron?
8. Is the developmental program reinitiated during the regeneration of proximal tubules after injury?
|
Сайт создан в системе
uCoz

