Microtubule organizing centers (MTOCs) существуют различных форм и размеров и включают центромеры клеток позвоночных и spindle pole bodies (SPB) дрожжей. Несмотря на свое разнообразие форм все MTOCs выполняют общую функцию по продукции (nucleation) и организации микротрубочек. MTOC-организованные цитоплазматические микротрубочки выполняют разнообразные функции, тогда как в митотических клетках они играют центральную роль в организации митотического веретена. Информацию о структуре, функции MTOC и связанных с этим болезнях м. найти у Doxsey 2001, Khodjakov & Rieder 2001, Nigg 2002, Sobel 1997. Недавно было установлено, что MTOCs выполняют и новые, неожиданные роли, что и явилось предметом данного обзора.
CENTROSOMES AND CELL CYCLE CONTROL
Центросомы (и др. MTOCs) состоят из многочисленных белков, чьи аминокислотные последовательности указывают на на суперскрученную четвертичную структуру. Растут доказательства, указывающие, что их молекулярная структура м.б. предназначена для организации мультибелковых каркасов (scaffolds), которые м. закреплять разнообразные активности, от белковых комплексов, участвующих вnucleation микротрубочек (Diviani et al. 2000, Diviani
& Scott 2001) до мульткомпонентных путей для клеточной регуляции (Elliott et al. 1999). С помощью физически сцепленных компонентов общего пути молекулярные каркасы (scaffolds) м. увеличивать локальную концентрацию компонентов, ограничивая неспецифические взаимодействия и осуществляя пространственный контроль регуляторных путей путем позиционирования их в специфических местах вблизи нижестоящих мишеней или вышестоящих модуляторов. На базе увеличения количества регуляторных молекул, закрепленных на centrosome/MTOC (более 100), вполне возможно, что эти органеллы служат в качестве централизованных контролирующих центров для регуляции разнообразных клеточных активностей. недавние исследования выяви ли первые функциональные связи между центромерами и регуляторными сетями.
Centrosomes and the G2 to M Transition
Активация Cdk1 центросом во время G2/M перехода.
Ранние работы по G2/M переходу показали, что центросомы м. индуцировать прохождение митозов после инъекции в G2-арестованных ооцитах у морских звезд (Picard et al. 1987). Центросомы были также способны активировать созревание maturation promoting factor
[MPF, известного также как cyclin-dependent kinase1-cyclinB complexes (Cdk1-cycB)] и индуцировать преждевременное вступление в митоз яйцеклеток Xenopus (Perez-Mongiovi et al. 2000). Др. исследования показали, что митотические киназы и циклины присутствуют в центросомах. Недавно было показано, что хромосомы вовлекаются в переход от G2 к M в клетках млекопитающих. Митозы инициируются частично с помощью активации Cdk1-cycB. CycB1 присутствует по всей цитоплазме до профазы. Однако, активные Cdk1-cycB1 впервые выявляются в центросомах во время профазы и до Cdk1-cycB1-зависимого фосфорилирования гистона H3 ядре ( Jackman et al. 2003). Это указывает на то, что центросомы м. функционировать в качестве мест интеграции и активации белков, которые запускают митозы.
Недавно была использована четкая центросомная targeting стратегия для получения доказательств, что вступление в митоз нуждается в локализации на центросомах Cdk1 и её модуляторов (Kramer et al.2004). Авт. продемонстрировали, что checkpoint kinase 1 (Chk1) ассоциирует с центросомами не митотических клеток и ингибирует активность Cdk1. Ингибирование Chk1 вызывает преждевременную активацию Cdk1 на центросомах и преждевременное вступление в митоз. Если centrosome localization sequence (CLS) центросомного белка AKAP450 слиты с Chk1, то kinase иммобилизируется на центросоме, где она неспособна фосфорилировать ядерные субстраты. Chk1, лишенная CLS, не локализуется на центросомах и фосфорилирует субстраты нормально. Иммобилизация на центросомах kinase-неактивной формы ведет к преждевременному вступлению в митоз, в то время как иммобилизация на центросомах дикого типа Chk1 предупреждает активацию Cdk1 на центросомах и индуцирует неспособность к митозам, полиплоидию и множественные центросомы.
Chk1-обусловленное ингибирование активности Cdk1 оказалось не прямым, а было связано с ингибированием Cdk1 activating phosphatase, Cdc25B (Kramer et al. 2004). Cdc25-обусловленная активация Cdk1, по-видимому, происходит посредством локализованной в центросомах Chk1 (Forrest et al. 1999, Kramer et al. 2004). Кроме того, aurora-A kinase необходима для рекрутирования Cdk1-cycB на центросомы, а значит для активации kinase (Hirota et al. 2003). Ассоциированная с центросомами Polo kinase (Polo) также участвует во вступлении в митоз, хотя она, по-видимому, не прямо связана с активацией Cdk1. Локализация Polo на центросомах во время G2/M зависит от polo box (Jang et al. 2002, Lee et al. 1998, Reynolds & Ohkura 2003), который предупреждает вступление в митоз и арестовывает клетки с 4N содержанием ДНК в случае избыточной экспрессии. Напротив, мутанты по polo box не локализуются в центросомах и не ингибируют ход митоза (Jang et al. 2002).
Всё это подтверждает, что существуют регулирующие клеточный цикл модули на центросомах, которые интегрируют позитивные и негативные пути контроля вступления в митоз. Однако, удаление centrosomes/centrioles не предупреждает вступления в митоз (Hinchcliffe et al. 2001, Khodjakov & Rieder 2001), указывая тем самым, что центросомная регуляция активации Cdk1 с помощью Chk1 м.б. необязательна для вступления в митоз. С др. стороны, pericentriolar material (PCM) и др. материал, остающийся в acentriolar MTOC после экстракции центриолей, м. выполнять эту функцию (Hinchcliffe et al. 2001, Khodjakov & Rieder 2001). Т.о., очевидно, что ассоциированные с центросомами регуляторные пути м.б. доминантными над независимыми от центросом путями вступления в митоз (Kramer et al. 2004).
Centrosomal γ tubulin and the G2/M transition.
Зарождение (nucleation) центросомных микротрубочек обеспечивается частично γ tubulin ring complexes (γTuRCs). Pericentrin является суперскрученным каркасным белком, который закрепляет γTuRCs на центросомах (Zimmerman et al. 2004). Разъединение взаимодействия pericentrin-γTuRC с помощью пептидов, кодирующих pericentrin's γTuRC связывающий домен, или с помощью siRNA (small interfering RNA)-обусловленным истощением pericentrin, вызывает арест G2/M , сопровождаемый апоптозом.
Некоторые клеточные линии, по-видимому, не чувствительные к аресту
G2/M, продолжают цикл и обнаруживают снижение центросомного γ tubulin и астральных микротрубочек в митозах. Было бы интересно установить, действительно ли ассоциированные с центросомами регуляторные молекулы, вовлекаемые в ход клеточного цикла, неправильно локализуются из центросом в этих условиях.
The Centrosome/Spindle Pole in the
Metaphase to Anaphase Transition
Хотя кинетохоры лучше известны как отслеживающие и регулирующие переход от метафазы к анафазе (Maiato et al. 2004), центросомы и полюса веретена также , по-видимому, играют роль в этом процессе. Впервые это было подтверждено данными, показавшими, что деструкция GFP-нагруженного и эндогенного cycB во время M-A перехода у
Drosophila инициируется на полюсах веретена, которая затем распространяется на веретено (Huang & Raff 1999). Когда центросомы теряются из веретена у мутантов Drosophila cfo, то cycB теряется из центросом, но не из веретена и клетки арестовываются в анафазе (Wakefield et al. 2000). Недавно на эмбрионах Drosophila было показано, что Fzy/Cdc20 отвечает за ассоциированную с веретеном волну деструкции cycB, в то время как
Fzr/Cdh1 необходим для деструкции цитоплазматического cycB (Raff et al. 2002).
Более недавние исследования выявили участие центросомных белков γ tubulin и pericentrin B homologue, Pcp1p, в регуляции перехода M-A. У Aspergillus nidulans, чувствительный к холоду аллель γ tubulin не ингибирует образование веретена при рестриктивной температуре, но задерживает переход M-A transition и вызывает неспособность к цитокинезу (Prigozhina et al. 2004). Сходным образом мутация Schizosaccharomyces pombe, Pcp1p, ингибирует переход M-A без нарушения сборки биполярного веретена (Rajagopalan et al. 2004). Очевидно, что гомолог центросомного pericentrin и γ tubulin комплексы м. вовлекаться в регуляцию множественных переходов клеточного цикла (G2/M and M-A).
The Centrosome in the G1 to S-phase Transition
Удаление центриолей и др. основных центросомных компонентов вызывает G1 арест. Недавние данные показали, что центросомы м. затрагивать прогресс клеточного цикла (Figure 1). Исследования, осуществляемые с помощью удаления центросом/центриолей из клеток микрохирургически (Hinchcliffe et al. 2001) или лазером (Khodjakov & Rieder 2001) предоставили прямые доказательства участия центросом в прогрессе клеточного цикла. В обоих случаях пара центриолей и ассоциированные белки удалялись и что важно отметить, эти клетки формировали acentriolar MTOCs, содержащие белки из PCM и вообще др. структуры центросом (Khodjakov & Rieder 2001, Khodjakov et al. 2002). Сходные лишенные центриолей MTOCs были функциональными у высших растений и в некоторых животных мейотических системах (Shimamura et al. 2004, Theurkauf & Hawley 1992). В клетках млекопитающих с лишенными центриолей MTOCs, ранние митотические события происходили нормально, но многие клетки обнаруживали дефекты или неспособность цитокинеза. Все клетки с acentriolar MTOCs, полученные с помощью микрохирургии, были неспособны инициировать репликацию ДНК (BrdU-негативны) независимо от того, заканчивали ли они цитокинез.
Более того, устранение одной из двух центросом в прометафазных клетках вызывало образование дочерней клетки, содержащей центросомы, которая продолжала цикл. и дочерней клетки с acentriolar
MTOC, которая останавливалась на ст. G1 (BrdU негативна). Обе стратегии использовали удаление стержневых структур центросом и компонентов и показали, что лишенные центриолей MTOCs испытывают проблемы во время цитокинеза и затем подвергаются аресту на ст. G1. Однако, добавочные центросомы, создаваемые за счет слияния клеток или ингибирования цитокинеза,
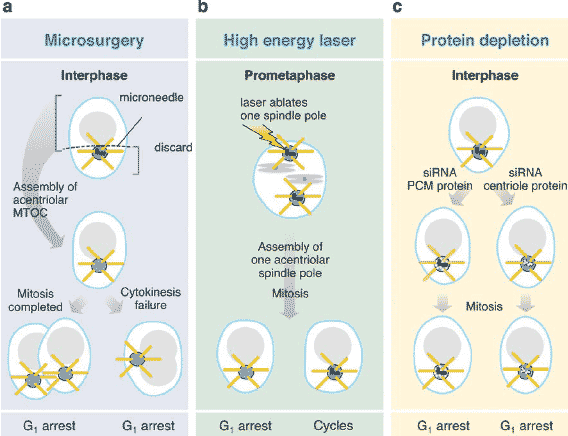 Figure 1
Centrosomes are required for G1 to S-phase progression. Removal of centrosome (blue/red) by (a) microsurgery or (b) laser ablation produces cells with loosely focused microtubule arrays (bottom row,
yellow) organized by an MTOC-containing PCM proteins (blue) but lacking centrioles (red). Acentriolar MTOC-containing cells undergo G1 arrest. (b) Cells with intact centrosomes cycle (right). (c) Depletion
of centrosome proteins of the centrioles (red turned white), PCM (blue turned white), or other structures by small interfering RNAs (siRNA) results in G1 arrest (bottom row). Nucleus, gray (adapted from Trends
in Cell Biology, in press).
Figure 1
Centrosomes are required for G1 to S-phase progression. Removal of centrosome (blue/red) by (a) microsurgery or (b) laser ablation produces cells with loosely focused microtubule arrays (bottom row,
yellow) organized by an MTOC-containing PCM proteins (blue) but lacking centrioles (red). Acentriolar MTOC-containing cells undergo G1 arrest. (b) Cells with intact centrosomes cycle (right). (c) Depletion
of centrosome proteins of the centrioles (red turned white), PCM (blue turned white), or other structures by small interfering RNAs (siRNA) results in G1 arrest (bottom row). Nucleus, gray (adapted from Trends
in Cell Biology, in press).
не ингибировали хода клеточного цикла (Uetake & Sluder 2004,Wong & Stearns 2003). Сходным образом ассоциированные с центросомами микротрубочки, по-видимому, не играют существенной роли в ходе клеточного цикла. Добавление лекарства, деполимеризующего микротрубочки, nocodazole
к нормально делящимся диплоидным (2N) клеткам, не вызывает ареста в G1 клеток с диплоидным геномом (2N), даже после того, как они были сначала синхронизированы по G1/G0 путем сывороточного голодания. Вместо этого,
обработанные nocodazole клетки продолжают клеточный цикл, задерживаются в митозе, переживают неспособность к митозу и затем арестовываются как тетраплоидные (4N) клетки в G1-подобном состоянии (Lanni & Jacks 1998,
Trielli et al. 1996). Т.к. G1 арест наблюдается после неспособности к митозу тетраплоидных клеток с множественными центросомами, то было бы необходимо подтвердить этот результат при физиологических условиях, используя нормально делящиеся диплоидные клетки.
Changes in centrosome protein levels or
localization induce G1 arrest.
Недавние исследования идентифицировали центросомные белки, которые функционируют в цитокинезе и в ходе клеточного цикла (Figure 1). Centriolin является белком центросом, который обладает гомологией с дрожжевыми белками, участвующими в цитокинезе и выходе из митоза (Nud1p and Cdc11p) (Gromley et al. 2003, Guertin et al. 2002). Избыточная экспрессия Nud1p/Cdc11p гомологичного домена или деплеция centriolin
индуцируют дефекты цитокинеза, сопровождаемые арестом клеточного цикла в G1, как было показано с помощью жидкостной цитометрии и BrdU окрашивания. Сходный арест клеточного цикла в G1 наблюдается, когда центросомные белки AKAP450 и PKA были перемещены из центросом (Gillingham & Munro 2000, Keryer et al. 2003). Эти данные показали, что удаление центриолей целиком или изменения в индивидуальных центросомных белках вызывают дефекты цитокинеза, которые, по-видимому, ведут к G1 аресту.
SiRNA-mediated depletion of several centrosome
proteins induces G1 arrest.
Как обсуждалось выше, центросомы играют ключевые роли в функционировании веретена и цитокинезе. Это указывает на то, что G1 арест, наблюдаемый после пертурбаций белков центросом или центриолей, может быть результатом митотической дисфункции. Недавние данные предоставили доказательства независимого от митоза ареста клеточного цикла. Антитела к центросомному белку PCM-1 предупреждают вступление в S-фазу, если микроинъецируются в зиготы мышей в ранней интерфазе (Balczon et al.
2002). В др. исследовании использовалась RNA interference, чтобы индивидуально истощить более 20 центросомных белков, которые локализуются в нескольких независимых сайтах центросом (напр., PCM, centriole) (Figure 1). Деплеция почти всех этих белков вызывает G1 арест, как показывает накопление в 2N пике при жидкостной цитометрии, отсутствие инкорпорации BrdU и снижение активности cyclin-dependent kinase2-cyclinA/E комплексов (Cdk2-cycA/E) (Mikule et al. 2003). G1 арест может быть снят путем возвращения удаленных центросомных белков к нормальному уровню. Необычное функциональное изменение наблюдается для белков, которые индуцируют арест клеточного цикла. Эти результаты подтверждает, что арест клеточного цикла может быть индуцирован благодаря дискретным альтерациям в композиции центросом.
G1 arrest is induced in postmitotic cells.
Роль митотической дисфункции в G1 аресте исследовалась более детально с использованием постмитотических клеток (ранних G1). Клеткам, которые недавно закончили цитокинез, микроинъецировали плазмиды, кодирующие centrosome-targeting область pericentrin/AKAP450, которые смещали оба белка из центросом (Gillingham & Munro 2000). Это снижение связанной с центросомами эндогенной фракции pericentrin и предохраняло клетки от вступления в S-фазу и от включения BrdU (K. Mikule & S. Doxsey, unpublished observations). Др. недавнее исследование покзало, что устранение центросом из постмитотических клеток ингибирует дальнейший прогресс клеточного цикла (14/16 cells; A. Khodjakov, personal communication). Всё это показывает, что G1 арест может быть индуцирован в течение G1.
Possible mechanisms of centrosome associated
G1 arrest.
Как потеря или альтерации центросом ведут к G1 к аресту сегодня неясно. Регуляция удвоения центросом и вступления в S-фазу сходны для обоих, нуждаются в Cdk2-cycE/A комплексах (Lacey et al. 1999). Как было описано выше, эктопическая экспрессия cycE ускоряет вступление в S-фазу. тогда как экспрессия cycE centrosome localization domain (CLD), нарушающего связывание центросом с эндогенным cycE (и cycA) не позволяет вступать в S-фазу (Matsumoto & Maller 2004). Сегодня мы не знаем, происходит ли потеря направляемого в центросомы cycE во время удаления центросом или деплеции центросомных белков и вносит ли это вклад в индуцируемый центросомами G1 арест. В этой связи центросомы д. контролировать и вступление в S-фазу и, следовательно, цикл ядерной репликации посредством механизмов, таких как связывание cycE, которые не зависят от клеточного цикла, поскольку арест клеточного цикла с помощью cycE CLD не нуждается в связывании Cdk2.
A centrosome-induced checkpoint?
Исследования деплеции центросомных белков подтвердили, что G1 арест связан с активацией КПП (checkpoint) клеточного цикла. Напр., G1 арест супрессируется в опухолевых клетках человека с отсутствием функции p53 и в клетках, действительно истощенных по p53 вследствие деплеции центросмного белка (K. Mikule & S. Doxsey, unpublished observation). Кроме того, путь передачи p38 stress-activated сигнала, как было установлено, используется в G1 аресте. Эти наблюдения указывают на то, что неспособность некоторых клеток к аресту в отсутствие центриолей может быть связана с потерей или удалением p53 или p38 или родственных регуляторных молекул (Bobinnec et al. 1998, Piel et al. 2001). Возможно также, что передача сигналов checkpoint может происходить на центросоме с учетом локализации и p53 и p38 в этом сайте (Ciciarello et al. 2001, Liu et al. 2004; K. Mikule & S. Doxsey, unpublished observations). Опухолевые клетки с устранением функции p53 или p38 могут быть неспособны к активации checkpoint, и продолжают цикл и распространяют дефекты центросом, митотическую дисфункцию и генетическую нестабильность
ROLE OF CENTROSOMES AND SPINDLE POLE BODIES
IN CYTOKINESIS AND MITOTIC EXIT
Недавние исследования выявили участие SPBs и центросом в многочисленных аспектах течения клеточного цикла, включая выход из митоза и цитокинез. Исследования на делящихся дрожжах S. pombe и почкующихся дрожжах Saccharomyces cerevisiae выявили два законсервированных сигнальных пути, названных septation initiation network (SIN) и mitotic exit network (MEN), соотв., которые локализуются в SPBs и регулируют цитокинез и выход из митоза. Оба эти пути рассмотрены детально в недавних обзорах reviews (Seshan & Amon 2004, Simanis 2003) и не быдут подробно рассматриваться здесь. Мы же обратимся к недавним исследованиям новых функций этих путей и потенциально законсервированным функциям в клетках млекопитающих.
The SIN Pathway in S. pombe
Как упоминалось выше, путь SIN существенен для цитокинеза у делящихся дрожжей (Figure 2). SIN это локализованный в SPB GTPase-регулируемый протеин киназный каскад (список SIN гомологов у S. pombe, S. cerevisiae и в клетках млекопитающих см. Table 1). SIN мутанты проходят нормально через клеточный цикл и митозы и могут формировать цитокинетические актомиозиновые контрактильные кольца, ключевые структуры, необходимые для цитокинетических аналогов борозды дробления клеток животных. Однако, мутанты SIN не способны инициировать контракции кольца и кольца распадаются, обусловливая неспособность клеток к цитокинезу и становятся многоядерными (Balasubramanian et al. 1998, Fankhauser
et al. 1995). Несоответствующая активация SIN может также управлять выходом из митоза, подтверждая тем самым, что SIN может играть несущественную роль в выходе из митоза (Fankhauser et al. 1993, Guertin et al. 2002).
Asymmetry of SIN signaling.
Одним из курьезных свойств SIN является асимметричный паттерн локализации некоторых компонентов в SPBs (Figure 2). Неясно, как генерируется асимметрия пути SIN, также как и почему передача сигналов SIN асимметрична. Хотя всё ещё мало известно о функциональном значении асимметрии передачи сигналов SIN, но недавнее исследование выявило основу асимметрии пути SIN (Grallert et al. 2004). В этой работе было установлено, что асимметрия SIN отражает лежащую в её основе асимметрию полюсов веретена. Полсе дупликации SPB, каждая клетка имеет старый SPB, который унаследован от предыдущего клеточного цикла и новый SPB, который формируется при удвоении SPB. Было установлено, что в анафазе, где возникает асимметрия SIN, ингибиторы SIN Cdc16p-Byr4p локализуются на старом SPB, тогда как активатор SIN Cdc7p и возможно Sid1p-Cdc14p локализуется на новом SPB. Пока неизвестно, почему передача сигналов SIN асимметрична, но она может иметь дело с регуляцией SIN т.к. большинство известных мутаций, которые активируют передачу сигналов SIN
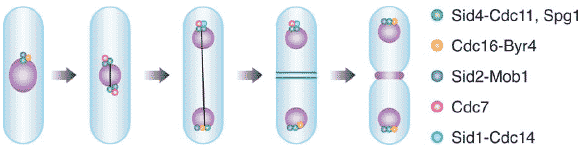 Figure 2
Cell cycle-dependent localization of SIN components. All SIN components localize to the spindle pole body (SPB). Sid4p and Cdc11p form a complex at the SPB that functions as a scaffold required for
localization all known SIN components to the SPB (Chang & Gould 2000; Guertin et al. 2000; Hou et al. 2000; Krapp et al. 2001, 2004; C. Li et al. 2000; Morrell et al. 2004; Sparks et al. 1999).
Sid4p-Cdc11p and Spg1 (green), and to some extent Sid2p-Mob1p (blue) localize to the SPB throughout the cell cycle. SIN signaling is negatively regulated by Cdc16p and Byr4p (orange), which function as part of a two-component GTPase activating protein (GAP) for Spg1p (Furge et al. 1998). A guanine-nucleotide exchange factor (GEF) for Spg1p has not been identified. Both the activity and
localization of SIN proteins is regulated through the cell cycle. In interphase the Cdc16p-Byr4p GAP complex localizes to the SPB (Cerutti & Simanis 1999, C. Li et al. 2000) and, consistent with this, Spg1p
is at the pole but in the inactive GDP-bound state (Sohrmann et al. 1998). As the mitotic spindle forms during metaphase, Spg1p becomes activated at both SPBs (GTP-bound form), and Cdc16p-Byr4p leave
both SPBs (Cerutti & Simanis 1999, C. Li et al. 2000). Cdc7p (red) is recruited to the SPB by the GTP-bound form of Spg1p to which it binds directly (Sohrmann et al. 1998). However, the SIN does not
become activated at this time. SIN activation in metaphase is restrained by Cdk activity. During anaphase B, after Cdk inactivation, Cdc16p-Byr4p returns to one SPB (Cerutti & Simanis 1999, C. Li et al. 2000). Spg1p is inactivated, and Cdc7p becomes delocalized at that SPB. Also at this time Sid1p-Cdc14p (aqua) localizes to the single Cdc7p containing SPB in anaphase (Guertin et al. 2000). Once Sid1p-Cdc14p
localizes to the SPB, it and possibly Cdc7p are then presumed to activate Sid2p-Mob1p and cause them to translocate to the actomyosin ring to trigger ring constriction and septation (Guertin et al. 2000,
Sparks et al. 1999). Once septum formation is complete, the SIN becomes inactive and returns to its interphase configuration.
Figure 2
Cell cycle-dependent localization of SIN components. All SIN components localize to the spindle pole body (SPB). Sid4p and Cdc11p form a complex at the SPB that functions as a scaffold required for
localization all known SIN components to the SPB (Chang & Gould 2000; Guertin et al. 2000; Hou et al. 2000; Krapp et al. 2001, 2004; C. Li et al. 2000; Morrell et al. 2004; Sparks et al. 1999).
Sid4p-Cdc11p and Spg1 (green), and to some extent Sid2p-Mob1p (blue) localize to the SPB throughout the cell cycle. SIN signaling is negatively regulated by Cdc16p and Byr4p (orange), which function as part of a two-component GTPase activating protein (GAP) for Spg1p (Furge et al. 1998). A guanine-nucleotide exchange factor (GEF) for Spg1p has not been identified. Both the activity and
localization of SIN proteins is regulated through the cell cycle. In interphase the Cdc16p-Byr4p GAP complex localizes to the SPB (Cerutti & Simanis 1999, C. Li et al. 2000) and, consistent with this, Spg1p
is at the pole but in the inactive GDP-bound state (Sohrmann et al. 1998). As the mitotic spindle forms during metaphase, Spg1p becomes activated at both SPBs (GTP-bound form), and Cdc16p-Byr4p leave
both SPBs (Cerutti & Simanis 1999, C. Li et al. 2000). Cdc7p (red) is recruited to the SPB by the GTP-bound form of Spg1p to which it binds directly (Sohrmann et al. 1998). However, the SIN does not
become activated at this time. SIN activation in metaphase is restrained by Cdk activity. During anaphase B, after Cdk inactivation, Cdc16p-Byr4p returns to one SPB (Cerutti & Simanis 1999, C. Li et al. 2000). Spg1p is inactivated, and Cdc7p becomes delocalized at that SPB. Also at this time Sid1p-Cdc14p (aqua) localizes to the single Cdc7p containing SPB in anaphase (Guertin et al. 2000). Once Sid1p-Cdc14p
localizes to the SPB, it and possibly Cdc7p are then presumed to activate Sid2p-Mob1p and cause them to translocate to the actomyosin ring to trigger ring constriction and septation (Guertin et al. 2000,
Sparks et al. 1999). Once septum formation is complete, the SIN becomes inactive and returns to its interphase configuration.
приводят к локализации активаторов SIN на обоих SPBs.
The SIN,CDK regulation, and the cytokinesis
checkpoint.
SIN держится неактивной в ранних фазах митозов с помощью активности Cdk (Chang et al. 2001, Guertin et al. 2000). Cdk ингибирование SIN может быть прямым результатом фосфорилирования компонентов SIN с помощью Cdk1, т.к. Cdk1p-Cdc13p соединяется непосредственно с SIN каркасным белком
Cdc11p, позиционируя его так, чтобы фосфорилировать SIN белки (Morrell et al. 2004). Мишени Cdk фосфорилирования в SIN неизвестны. Из-за того. что у S. pombe и большинства др. организмов, инактивация Cdk1p совпадает с сегрегацией хромосом, связанной с инициацией цитокинеза, чтобы инактивация Cdk1p гарантировала, что клеточное деление не начнется раньше, чем будут сегрегированы хромосомы. Однако, этот механизм делает цитокинез чувствительным к активности Cdk, которая начинается вскоре после завершения цитокинеза, т.к. инициируется следующий клеточный цикл. Если цитокинез задерживается, то возникающая активность Cdk1p может ингибировать SIN и цитокинез, несмотря на то, что клетки обладают способом ингибирования активности Cdk вплоть до завершения цитокинеза. Clp1p/Flp1p, гомолог S. pombe Cdc14 phosphatase, у почкующихся дрожжей гомолог
Clp1p/Flp1p (далее будет называться как Clp1p) играет критическую роль в поддержании активности SIN, если цитокинез задержан (Mishra et al. 2004, Trautmann et al. 2001). Т.к. Cdc14-семейство phosphatases дефосфорилирует сайты, фосфорилированные с помощью Cdks (Esteban et al. 2004, Kaiser et al. 2002, L. Li et al. 2000, Visintin et al. 1998, Wolfe & Gould 2004), то
Clp1p, по-видимому, поддерживает передачу сигналов SIN, если цитокинез задерживается за счет противодействующих ингибирующих эффектов Cdk фосфорилированию в SIN. Clp1p ингибирует также активность Cdk с помощью дефосфорилирования и дестабилизации Cdc25p (Esteban et al. 2004, Wolfe & Gould 2004). Посредством этого механизма Clp1p противодействует активности
Cdk1 способствуя ингибирующему фосфорилированию тирозина на Cdk1.
Clp1p располагается в ядрышке в интерфазе, где он, как полагают, секвестрирован и инактивирован (Cueille et al. 2001, Trautmann et al. 2001). Clp1p высвобождается из ядрышка во время митоза и SIN действует, чтобы удерживать Clp1p вне ядрышка вплоть до завершения цитокинеза. Т.о., Clp1p и SIN, по-видимому, функционируют совместно, каждый действуя, чтобы поддержать активность другого, пока не закончится цитокинез. Это указывает на то, что SIN ингибирует прогресс клеточного цикла посредством Clp1p. Однако недавние доказательства показали. что гиперактивация SIN может блокировать прогресс клеточного цикла независимо от Clp1p, указывая тем самым, что SIN может противодействовать активности Cdk посредством др. механизма (Mishra et al. 2004). Эта активность становится критической, когда цитокинез задерживается. Когда цитокинез задерживается в клетках дикого типа, то SIN остается активным, Clp1p находится вне ядрышка, цитокинетический аппарат сохраняется и клетки арестовывают дальнейшее деление ядра вплоть до окончания цитокинеза. Это гарантирует, что клетки не станут мультиядерными и полиплоидными, если цитокинез задерживается. Полное ингибирование цитокинеза ведет к продолжительной задержке ядерного деления (Cueille et al. 2001, Trautmann et al. 2001). Напротив, клетки с ослабленной передачей сигналов SIN или делецией clp1, неспособны поддерживать цитокинетический аппарат в ответ на задержку цитокинеза и цитоскелет возвращается к интерфазной конфигурации. Эти клетки затем подвергаются дальнейшим раундам ядерных делений, в результате возникают многоядерные, полиплоидные клетки. Это напоминает задержку или блокирование хода клеточного цикла, наблюдаемое в клетках млекопитающих после неспособности окоанчить митоз или цитокинез (rev. Stukenberg 2004).
Table 1 SIN and MEN proteins and potential mammalian
homologs
S. pombe S. cerevisiae Mammals Protein function
plo1 CDC5 Polo Kinase
sid4 Unknown ? SPB scaffold
cdc11 NUD1 centriolin SPB scaffold
spg1 TEM1 ? GTPase
cdc7 CDC15 Mst2? Kinase
sid1 Unknown Mst2? Kinase
cdc14 Unknown ? Sid1 binding
sid2 DBF2 Warts1/Lats1,Lats2 Kinase
mob1 MOB1 Mob1 Sid2/Dbf2 binding
clp1 CDC14 Cdc14A/B Phosphatase
cdc16 BUB2 ? Part of GAP
byr4 BFA1/BYR4 ? Part of GAP
The SIN consists of two scaffolding proteins (Sid4p, Cdc11p) (Krapp et al. 2004, Morrell et al. 2004), four protein kinases (Plo1p, Cdc7p, Sid1p, and Sid2p) (Fankhauser & Simanis 1994, Guertin et al. 2000, Ohkura et al. 1995, Sparks et al. 1999) and one small GTPase, Spg1p (Schmidt et al. 1997). Additionally, the Cdc14p (Fankhauser & Simanis 1993) and Mob1p (Hou et al. 2000, Salimova et al. 2000)
proteins function as subunits of the Sid1p and Sid2p kinases, respectively. The MEN consists of a scaffolding protein (Nud1p) (Gruneberg et al. 2000), four protein kinases (Cdc5p, Cdc15p, Dbf2p, and Dbf20p), a GTPase (Tem1p), an exchange factor (Lte1p), a protein phosphatase (Cdc14p), and a Dbf2p-binding protein
(Mob1p) (Johnston et al. 1990; Kitada et al. 1993; Luca &Winey 1998; Schweitzer & Philippsen 1991; Shirayama et al. 1994a,b; Toyn et al. 1991;Wan et al. 1992). Potential homologs of several SIN/MEN components have been identified,including centriolin (Gromley et al. 2003), Polo kinase (Golsteyn et al. 1994),Cdc14A/B (Li et al. 1997), Mst2 kinase (Hay & Guo 2003), Mob1 (Luca &Winey 1998),Warts/Lats1 (Nishiyama et al. 1999, Tao et al. 1999), and Lats2 (Hori et al. 2000, Yabuta et al. 2000) kinases.
The MEN Pathway in S. cerevisiae
У S. cerevisiae путь, аналогичный SIN, назван MEN. Подобно SIN, MEN является каскадом GTPase-регулируемых protein kinase, чьи компоненты локализуются как в SPB, так и в щейке почки (Seshan & Amon 2004, Simanis 2003). Мутанты пути MEN арестовывают конец анафазы с удлиненным веретеном и высокой активностью Cdk. MEN необходим для противодействия активности Cdk и является причиной выхода из митоза. Как и в случае SIN, MEN также играет роль. хотя и несущественную, в цитокинезе. MEN функционирует в анафазе, чтобы ингибировать активность Cdk и вызывает выход из митоза, способствуя высвобождению Cdc14p phosphatase из ядрышка с помощью неизвестного механизма (Shou et al. 1999, Visintin et al. 1999). Cdc14p затем дефосфорилирует ряд Cdk субстратов, включая Cdh1p/Hct1p и Cdk ингибитор Sic1p (Visintin et al. 1998). Дефосфорилирование с помощью Cdc14p стабилизирует Sic1p и вызывает также активацию Cdh1p/Hct1p, что способствует cyclin B протеолизу. Вместе эти события приводят к инактивации Cdk и выходу из митоза.
Regulation of MEN activity.
Элегантная модель была предложена для активации MEN в анафазе, когда элонгация веретена в почку д. приводить локализованную на SPB Tem1p GTPase в контакт с локализованным в почке активатором Tem1p (Bardin et al. 2000,Pereira et al. 2000) (Figure 3). Эта модель делает возможным временное и пространственное купирование выхода из митоза с сегрегацией хромосом, так что выход из митоза происходит только после того как хромосомы разойдутся по дочерним клеткам. Некоторые недавние доказательства указывают, что эта модель не совсем столь прямолинейна.
Не было показано, что Lte1p непосредственно активирует Tem1p
in vitro, a дальнейшие эксперименты подтвердили, что это изменение активности может быть не обязательным для его роли в
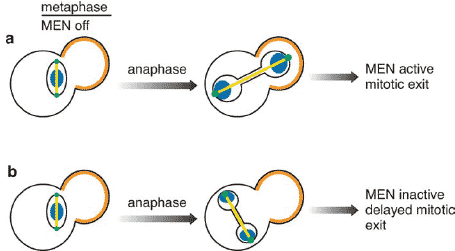 Figure 3
Regulation of MEN activity. (a) Several mechanisms function to keep the MEN inactive in metaphase. Premature activation of the MEN in metaphase is prevented by the Bub2p-Bfa1p, which serves as a
GAP for the Tem1p GTPase (Alexandru et al. 1999, Fesquet et al. 1999, Fraschini et al. 1999, Li 1999). Additionally, Tem1p is spatially separated from its proposed GTP exchange factor Lte1p, which localizes
to the bud cortex (orange). Cdk phosphorylation of Cdc15p is also thought to antagonize MEN signaling in metaphase (Jaspersen & Morgan 2000, Menssen et al. 2001). Similarly, activation of the MEN in
anaphase is brought about by multiple mechanisms. Activation of the MEN depends on the passage of one of the spindle poles through the bud neck during anaphase spindle elongation (Molk et al. 2004, Yeh
et al. 1995). Once this has occurred, it brings that pole in proximity to the putative exchange factor Lte1p, which localizes specifically to the bud cortex (Bardin et al. 2000, Pereira et al. 2000), presumably
allowing activation of the Tem1p GTPase. Although some recent results raise questions about certain aspects of this model (see text), it provides a nice explanation for how spindle orientation in anaphase is
coupled to mitotic exit. (b) Cells with defects in spindle orientation often undergo anaphase chromosome separation in the mother cell. These cells delay MEN activation and exit from mitosis until correct
spindle orientation is achieved. Correct spindle orientation results in exit from mitosis, presumably in part by bringing SPB localized Tem1p into contact with bud localized Tem1p (orange).
Figure 3
Regulation of MEN activity. (a) Several mechanisms function to keep the MEN inactive in metaphase. Premature activation of the MEN in metaphase is prevented by the Bub2p-Bfa1p, which serves as a
GAP for the Tem1p GTPase (Alexandru et al. 1999, Fesquet et al. 1999, Fraschini et al. 1999, Li 1999). Additionally, Tem1p is spatially separated from its proposed GTP exchange factor Lte1p, which localizes
to the bud cortex (orange). Cdk phosphorylation of Cdc15p is also thought to antagonize MEN signaling in metaphase (Jaspersen & Morgan 2000, Menssen et al. 2001). Similarly, activation of the MEN in
anaphase is brought about by multiple mechanisms. Activation of the MEN depends on the passage of one of the spindle poles through the bud neck during anaphase spindle elongation (Molk et al. 2004, Yeh
et al. 1995). Once this has occurred, it brings that pole in proximity to the putative exchange factor Lte1p, which localizes specifically to the bud cortex (Bardin et al. 2000, Pereira et al. 2000), presumably
allowing activation of the Tem1p GTPase. Although some recent results raise questions about certain aspects of this model (see text), it provides a nice explanation for how spindle orientation in anaphase is
coupled to mitotic exit. (b) Cells with defects in spindle orientation often undergo anaphase chromosome separation in the mother cell. These cells delay MEN activation and exit from mitosis until correct
spindle orientation is achieved. Correct spindle orientation results in exit from mitosis, presumably in part by bringing SPB localized Tem1p into contact with bud localized Tem1p (orange).
выходе из митоза (Yoshida et al. 2003), в результате возникает вопрос, является ли Lte1p GEF для Tem1p. Также, Lte1p является существенным только для выхода из митоза при низких температурах, указывая, что Tem1p может активироваться в отсутствии Lte1p. Т.о., др. механизмы могут вносить вклад в активацию MEN, включая редуцированное Cdk ингибирование MEN, которое происходит, когда Cdk активность снижается в анафазе посредством частичного протеолиза B-типа циклинов, а высвобождение в ранней анафазе Cdc14p phosphatase запускается с помощью FEAR сети (D'Amours & Amon 2004 rev.). Было предположено, что потеря астральных микротрубочек из шейки почки, которое происходит, когда веретено удлиняется через шейку почки, действует независимо от Lte1p, способствуя выходу из митоза (Castillon et al. 2003). Кроме того, Cdc5p,
S. cerevisiae polo гомолог, действует выше, чтобы противодействовать Bub2p/Byr4p путем фосфорилирования Byr4p, непосредственно облегчающего активацию MEN(Hu et al. 2001). Всё это указывает на то, что регуляция MEN сложна и контролируется с помощью многочисленных сигналов.
Asymmetry at SPBs and MEN regulation.
Хотя не все сообщения в согласии, но MEN компоненты Bub2p и Tem1p, по-видимому, преимущественно локализуются на SPB, который вступает в почку (Bardin et al. 2000, Pereira et al. 2000). Недавний анализ (Molk et al. 2004) локализации GFP слияний в живых клетках показывает, что Bub2p, Tem1p и Cdc15p обнаруживают асимметричную локализацию на SPB в почке. Когда старый SPB вступает в почку, локализация Tem1p в этом месте возрастает. Это совпадает с локализацией
Cdc15 в том же самом SPB, который , по-видимому, рекрутируется с помощью Tem1p. Неожиданно, локализация Tem1p ингибитора Bub2p также увеличивается на старом SPB, когда оно проникает в почку. Причина асимметрии неясна. Предполагается. что асимметрия важна для передачи сигналов MEN. У dynein мутантов, у которых анафаза происходит в почке, Tem1p локализуется симметричным образом на обоих SPBs, а MEN остаётся неактивным. Курьезно, что и MEN и SIN белки локализуются асимметрично на
SPBs, а активные SIN компоненты на новом SPB, тогда как MEN компоненты на старом SPB. Однако, как и в случае SIN, доказательства важности асимметрии при передаче сигналов MEN отсутствуют.
MEN and cytokinesis.
Недавние доказательства показали, что MEN, подобно SIN,
также играет более непосредственную роль в цитокинезе, хотя эта функция и не кажется существенной. Клетки, в которых выявляется потребность в MEN для выхода из митоза, жизнеспособны, но они всё ещё обнаруживают дефекты цитокинеза (Lippincott et al. 2001, Luca et al. 2001, Menssen et al. 2001). Более того, идентифицированы определенные аллели cdc15 и mob1. которые специфически дефектны для цитокинеза (Jimenez et al. 1998, Luca et al. 2001, Menssen
et al. 2001). Внутриклеточная локализация некоторых MEN компонентов согласуется также с ролью в цитокинезе, так Cdc15p (Xu et al.
2000), Cdc5p (Cheng et al. 1998, Song et al. 2000)и Dbf2p-Mob1p (Frenz et al. 2000, Luca et al. 2001, Yoshida & Toh-e 2001) обнаруживаются в шейке почки. MEN необходим для обеспечения расщепления septin кольца и сжатия актомиозинового кольца в телофазе (Cid et al. 2001, Lippincott et al. 2001);однако, как и в случае SIN, неясно на молекулярном уровне, как MEN запускает цитокинез. Имеются также доказательства, что MEN функция в цитокинезе ингибируется с помощью активности Cdk, также как и для SIN у S. pombe. Напр., MEN способствует высвобождению Cdc14p из ядрышка. Cdc14p также, по-видимому, способствует функции MEN в цитокинезе. В раннем митозе Cdc15p фосфорилируется с помощью Cdk1, а в позднем митозе, т.к. активность Cdk снижается, Cdc15p дефосфорилируется с помощью Cdc14p (Menssen et al. 2001,Xuet al. 2000). Дефосфорилирование с помощью Cdc15p, по-видимому, важно дляего способности обеспечивать цитокинез, но не выход из митоза (Menssen et al.2001). Cdc14p может быть также важным для регуляции локализации Dbf2p-Mob1p, т.к. Dbf2p активируется у cdc14 мутантов (Lee et al. 2001, Mah et al. 2001), но не локализуется в шейке почки (Frenz et al. 2000, Yoshida&Toh-e 2001). Это напоминает наблюдения у S. pombe, показывающие, что SIN ингибируется с помощью активности Cdk, чтобы гарантировать, что цитокинез не начнется вплоть до завершения выходя из митоза.
Centrosomes and Cytokinesis in Animal Cells
Хотя центросомы не участвуют в выходе из митоза в клетках животных, как это происходит у дрожжей, но некоторые исследования указывают на роль центросом в цитокинезе. Наиболее прямым указанием на роль центросом в цитокинезе являются наблюдения клеточных делений у млекопитающих в клетках культуры ткани, из которых центросомы были удалены хирургически или в линиях клеток Drosophila без центриолей, которые показали, что с высокой частотой этих клетки специфически не способны заканчивать цитокинез (Piel et al. 2001). Эти клетки были способны завершать ингрессию борозды и часто остаются соединенными узким цитоплазматическим мостиком в течение длительного времени. В отличие от нормальных клеток эти клетки были неспособны подвергаться разрезанию и разделению этих мостиков и заканчивать цитокинез. Как обсуждалось ранее эти клетки неспособны также вступать в след. клеточный цикл. Эти наблюдения согласуются с мнением, что центросомы играют важную роль в цитокинезе. Используя time-lapse видео микроскопию клеток, стабильно экспрессирующих центросомный белок centrin, слитый с GFP в качестве марера центриолей, Piel et al.
наблюдали, что непосредственно перед разделением материнская центриоля временно и быстро мигрирует в межклеточный мостик почти на midbody. Каждая центросома представлена двумя различимыми центриолями, материнской и дочерней. Лишь когда материнская центриоля возвращается назад из мостика в центр клетки, цитокинез (abscission) завершается.
Это напоминает предыдущие наблюдения, при которых центросомы в ассоциации с комплексом Golgi, обнаруживали сдвиг локализации от полюсов в межклеточный мостик и возвращались назад в конце митоза (Mack & Rattner 1993, Moskalewski & Thyberg 1992). Сходным образом, белок, ассоциированный с recycling эндосомами, FIP3 локализуется сначала на центросомах во время анафазы и затем локализуется в midbody в телофазе, где он необходим для cytokinesis/abscission (Wilson et al. 2004). Эти наблюдения подтверждают, что центросомы и ассоциированные органеллы д. временно и пространственно приходить в тесный контакт с midbody для завершения цитокинеза.
Какую функцию выполняет такое ре-позиционирование центросом? Т.к. комплекс Golgi ассоциирует с мигрирующими центросомами, то это временное перемещение может поставлять мембранные и секреторные пузырьки, необходимые для полного клеточного разделения. Однако, существует и др. возможность, что центросомы обладают регуляторными компонентами, необходимыми для выхода из митоза и цитокинеза, как у почкующихся. так и делящихся дрожжей. Недавние исследования позволили предположить, что обе идеи могут быть корректны. Идентифицированы потенциальные гомологи некоторых компонентов SIN/MEN (see Table 1). Некоторые были охарактеризованы (centriolin, Polo kinase,
Cdc14A, Lats1,2 kinases) и была продемонстрирована их локализация в центросомах и их роль в цитокинезе (Carmena et al. 1998, Gromley
et al. 2003, Kaiser et al. 2002, Mailand et al. 2002, McPherson et al. 2004, Yang et al. 2004). Centriolin, который близок к S. pombe
Cdc11p и S. cerevisiae Nud1p, локализуется в материнских центриолях и в midbody (Gromley et al. 2003). Интересно, что эти авт. показали, что centriolin может связывать Bub2p дрожжей. Потеря функции Centriolin вызывает в клетках дефекты разделения (abscission) и они остаются соединенными в течение длительного периода, имея фенотип. сходный с тем. что наблюдается в клетках при отсутствии центросом (Gromley et al. 2003). Истощение Centriolin с использованием RNAi вызывает также арест в G1, как было описано выше. Недавние исследования показали, что Centriolin может функционировать, рекрутируя факторы, необходимые для целенаправленной секреции в midbody, которая необходима для abscission (Gromley et al. 2004). Интересно, что истощение центросомного белка Pericentrin/Kendrin (Gromley et al. 2003) или делеция Sid2p/Dbf2p гомолога Lats2 (McPherson et al. 2004) также вызывают сходные дефекты цитокинеза. Эти исследования указывают на то, что может существовать SIN/MEN путь в клетках млекопитающих, который регулирует цитокинез; однако, еще не было установлено, что эти белки функционируют вместе, как часть сигнальной сети у дрожжей.
SIN/MEN HOMOLOGS AND CELL CYCLE CHECKPOINTS
В некоторых лаб. было показано, что недостаточность цитокинеза индуцируется рядом различных воздействий, заставляющих клетки останавливаться в G1 фазе след. клеточного цикла в виде тетраплоидных клеток (Stukenberg 2004 rev.). Арест зависит от p53 (Andreassen et al. 2001b). Этот арест первоначально обозначался как tetraploidy checkpoint
(Andreassen et al.2001b), хотя недавние результаты показали, что он может быть и ни тетраплоидным и не результатом нарушения разделения, которые запускают checkpoint (Uetake & Sluder 2004). Что в действительности отслеживается, остается загадкой. Независимо от того, что запускает арест, выявлены некоторые интересные сходства с checkpoint цитокинеза у делящихся дрожжей, который арестовывает клетки, когда они двуядерные, на длительный период из-за неспособности разделения. Интересно бы установить, существуют ли какие-либо гомологи компонентов у млекопитающих для функции checkpoint
делящихся дрожжей при аресте клеток млекопитающих. Недавние результаты показали, что это возможно. Обычно клетки, обработанные лекарствами, деполимеризующими микротрубочки, останавливают митозы благодаря checkpoint веретена. Эти клетки в конечном итоге постепенно преодолевают этот checkpoint, выходят из митоза не вступая в цитокинез и арестовываются в G1 фазе следующего клеточного цикла p53-зависимым образом. В одном сообщении было показано, что после такой обработки арестованные клетки экспрессируют высокие уровни p53, это согласуется с его необходимостью для ареста (Iida et al. 2004). Однако, если то же самое воздействие направлено на клетки, избыточно экспрессирующие доминантно негативную форму Sid2
[(SIN pathway)/Dbf2 (MEN pathway)] гомолога Lats1 (Warts), то эти клетки неспособны подвергаться аресту в G1 и индуцировать p53. Отмечено также, что Cdc14 гомологи млекопитающих Cdc14A и Cdc14B связывают p53 и дефосфорилируют его по Ser315 (L. Li et al. 2000). Это скорее всего д. стабилизировать p53 т.к. фосфорилирование по этому сайту, как было показано, способствует деградации p53 (Katayama et al. 2004). Было бы интересно посмотреть, действует ли Lats1/Warts kinase посредством Cdc14, чтобы обеспечивать стабильность p53 и G1 арест из-за неспособности разделения.
Исследования на Drosophila melanogaster показали, что Warts действует вместе со второй kinase hippo, возможно гомологом Mst2 kinase млекопитающих, чтобы предупредить возникновение опухоли (Harvey et al. 2003, Hay & Guo 2003, Pantalacci et al. 2003). Mst2 родственна SIN kinases Sid1p и Cdc7p, а также Cdc15p почкующихся дрожжей. Warts/Lats1 kinase, как было установлено, действует как опухолевый супрессор и у мышей (St. John et al. 1999). Было бы интересно определить, могут ли Warts kinase и Mst2 (hippo) kinase действовать как опухолевые супрессоры путем ингибирования хода клеточного цикла при неспособности к разделению. Пока предполагается, что SIN/MEN гомологи могут быть необходимы для обеспечения p53-зависимого ареста вследствие неспособности к разделению, напоминая checkpoint цитокинеза у S. pombe. Этот арест обнаруживает также сходство с p53-зависимым G1 арестом вследситвие истощения ряда центросомных белков и вообще G1 ареста. вызванного хирургическим удалением центросом (Hinchcliffe et al. 2001). Учтастуют ли SIN/MEN гомологи в этом аресте, неизвестно.
The Centrosome and Genotoxic Stress
Поддержание геномной интеграции является критическим для нормального развития и предупреждения болезней, для законсервированных повреждений ДНК и checkpoints задержки репликации клеточного цикла, чтобы позволить репарироваться генетическим повреждениям или закончить репликацию ДНК. Checkpoint failures, который позволяет повреждениям и неполной репликации ДНК персистировать в митозах, запускает "mitotic catastrophe," плохо изученный процесс, характеризующийся задержкой в метафазе, сопровождаемой неспособностью к сегрегации хромосом и цитокинезу. Возникающие в результате клетки затем арестовываются в G0 или погибают в результате апоптического или не-апоптического механизмов (Andreassen et al. 2001a, Canman 2001, Roninson et al. 2001, Sibon et al. 2000).
(Процесс митотических катастроф, по-видимому, является важной причиной индуцируемой химиотерапией гибели клеток в опухолях и может служить для поддержания геномной функции (rev. Roninson et al. 2001). Исследования на эмбрионах Drosophila и культивируемых клетках млекопитающих показали, что митотическая катастрофа связана с разрушением центросом, которое может вносить вклад в последующую неспособность к сегрегации хромосом и цитокинезу (Roninson et al. 2001). На клетках мух и человека установлено, что Chk2 kinase необходима для разрушения центросом при checkpoint failure, указывая тем самым, что митотическая катастрофа является генетически запрограммированной реакцией на генотоксические повреждения (Takada et al. 2003). Chk2 является опухолевым супрессором у людей, это открывает возможность, что дефекты при зависимых от повреждений разрушениях центросом вносят вклад в геномную нестабильность и прогрессирование раковых опухолей.
Centrosome Inactivation in Early Embryos
Эмбриогенез дрозофилы инициируется 13 очень быстрыми митотическими делениями, которые происходят бехз цитокинеза. Эти синцитиальные деления сходны с делениями стадии дробления у др. эмбрионов и характеризуются чередованием S и M фаз без перерыва (Foe & Alberts 1983). Первые 9 делений происходят внутри эмбриона, но большинство ядер мигрирует в кортекс и формирует монослой во время интерфазы деления 10. Финальные 4 ядерных делений синцитиальной бластодермы (митозы 10-13) происходят в кортикальном монослое и во время этих делений длина S фазы прогрессивно увеличивается, тогда как М фаза остается относительно постоянной. Checkpoint репликации ДНК необходим для задержки митозов, т.к. S фаза замедляется во время этих финальных синцитиальных делений (Sibon et al. 1997, 1999). Как результат эмбрионы. мутантные по checkpoint репликации спонтанно инициируют митозы до окончания S фазы, запуская тем самым митотическую катастрофу. Timelapse
конфокальный микроскопический анализ показал, что checkpoint failure запускает специфичную для митозов инактивацию центросом, anastral сборку веретена и задержку митозов, а инактивация центросом коррелирует с потерей множественных компонентов γTuRC из стержневой структуры центросом (Sibon et al. 2000). У эмбрионов дикого типа идентичные митотические дефекты запускаются с помощью ингибиторов репликации ДНК, широкго круга агентов, повреждающих ДНК, и прямых инъекций рестрикционного энзима, переваривающего ДНК. Разрушение центросом и неспособность к митотическому делению т.о., по-видимому, являются нормальной реакцией на генотоксические повреждения в начале митозов (Sibon et al. 2000, Takada et al. 2003). Из-за неспособности делений возникающие ядра опускаются во внутрь эмбриона и деградируют. В синтициальных эмбрионах митотическая катастрофа устраняет ядра, несущие повреждения ДНК и тем самым служит поддержанию генома. функции, аналогичной апоптозу.
Мутации в гомологе Drosophila Checkpoint kinase 2 (Chk2), кодируемой геном mnk, блокируют все аспекты митотической катастрофы у ранних эмбрионов (Takada et al. 2003). Реакция восстанавливается при введении дикого типа Chk2 трансгена или инъекции GST-Chk2 слитого белка, демонстрируя, что митотические катастрофы, по крайней мере у эмбрионов мух, являются генетически запрограммированными реакциями на генотоксические стрессы.
Centrosome Inactivation in
Mammalian Cells
Митотические катастрофы в клетках млекопитающих запускаются также с помощью G2/M checkpoint failures и характеризуются задержками в метафазе, неспособностью к сегрегации хромосом и цитокинезу и клеточной гибелью. В некоторых клетках неспособность к митотическим делениям сопровождается апоптозом. Однако, чаще всего клетки арестовываются в G1 или погибают в результате не-апоптических механизмов (Roninson et al.
2001). Цитологически сходные реакции в виде митотических катастроф описаны в разных системах, включая первичные фибробласты эмбрионов мышей, эмбрионы дрозофилы и рад культивируемых клеток (Brown & Baltimore 2000, Bunz et al. 1998, Chan et al. 1999, Liu et al. 2000, Sibon et al. 2000) Очевидно, что митотические катастрофы могут быть первичным механизмом клеточной гибели в в ряде опухолевых линий клеток после воздействия химиотерапевтическими агентами (Roninson et al. 2001).
Признаком вызванных повреждениями митотических катастроф является накопление клеток с крупными полиплоидными ядрами или множественными ядрами. In vivo исследования клеток colorectal опухолей людей продемонстрировали, что эти клетки могут быть сформированы в результате неспособности к митотическим делениям (Bunz et al. 1998). После ионизирующей радиации HCT116 клетки вступают в митозы, а хромосомы выстраиваются в метафазную пластинку. Однако, расхождение хромосом в анафазе и цитокинез не происходят, возникают полиплоидные клетки, которые содержат двухдолевые ядра (Bunz et al. 1998). Из-за неспособности делений ядра фрагментируются в компактные массы, которые напоминают гроздья винограда. Сходная морфология ядер наблюдается во время апоптоза, а обычный апоптоз иногда наблюдается после индуцированной повреждениями неспособности делиться. Однако. такие клетки часто TUNEL негативны, а ДНК, выделенная из этих клеток не обнаруживает признаков апоптоза (Lock &
Stribinskiene 1996, Nabha et al. 2002). Кроме того, в некоторых случаях такая гибель клеток не блокируется ингибиторами апоптоза, клетки не сжимаются или раздуваются и апоптические тела не образуются (rev. Roninson
et al. 2001). Клеточная гибель с помощью митотических катастроф, т.о. возможно отличается от апоптоза как в фазах клеточного цикла, так и по механизму исполнения.
Некоторые недавние исследования связали митотические катастрофы с Chk2-зависимыми разрушениями центросом, указывая тем самым, что законсервированные сигнальные механизмы запускают эти реакции. Hut
et al. анализировали центросомы, когда клетки хомячка вступали в митозы до завершения репликации ДНК (Hut et al. 2003), тогда как Castedo et al. (Castedo et al. 2004b) анализировали распределение γ tubulin, когда интерфазные и митотические клетки сливались, заставляя интерфазные ядра вступать в митозы и обходить G2/M checkpoint. Используя GFP-γ tubulin в качестве центромерного маркера, Hut et al. показали, что центромеры часто фрагментируются, когда checkpoint контроль нарушен и митозы инициируются до завершения S фазы. Эти клетки часто собирают мультиполярные веретена и вступают в абортированные митотические деления, чтобы дать одиночные полиплоидные клетки. Эти авт. также нашли, что клетки, несущие мутации, которые спонтанно нарушают репарацию повреждений ДНК, обнаруживают сходные митотические дефекты, указывающие. что фрагментация центросом не обусловлена воздействием caffeine, используемого в исследованиях репликации. Лрокализация γ tubulin также нарушается, когда обходится G2/M фазы checkpoint
контроль слитыми клетками (Castedo et al. 2004a,b). Важно, что эта реакция нуждается в Chk2 kinase (Castedo et al. 2004a,b), это подтверждает, что активное нарушение функции центросом в ответ на checkpoint failure запускается с помощью законсервированного киназного пути.
Время повреждений ДНК может быть критическим для митотической реакции на повреждение ДНК. Mikhailov et al. (2002), используя лазерный свет, чтобы индуцировать повреждения ДНК во время прометафазы, обнаружили, что эти клетки не имеют дефектов центросом. Однако, митозы задерживались, а гистон H2Ax фосфорилировался, указывая тем самым, что повреждения присутствуют и выявляются с помощью клеточной кухни (machinery). Мы установили, что индукция повреждений ДНК во время митозов не оказывает четкого эффекта на структуру центросом у ранних эмбрионов Drosophila (S. Takada & W. Theurkauf, unpublished data), это указывает на то. что разрушение центросом может быть необходимо временно во время G2/M перехода в случае повреждений ДНК. Передача сигналов для митотической катастрофы, следовательно, может нуждаться в ассоциации белков с повреждениями ДНК до конденсации митотических хромосом.
Как уже отмечалось, растут доказательства связи функции центросом с выходом из митоза и цитокинезом. Наблюдения за checkpoint-дефектными клетками и эмбрионами, описанные выше, подтверждают, что повреждения ДНК ведут к инактивации центросом, что ведет к неспособности сегрегации хромосом и цитокинеза, а значит и к выходу из митоза. Эта реакция митотической катастрофы элиминирует поврежденные клетки из популяции. Ингибирование функции центросом с помощью Chk2 опухолевого репрессора ведет к дефектам выхода из митоза, следовательно, может выполнять функцию, аналогичную апоптозу для поддержания интеграции генома. Этот может иметь важное значение для супрессии опухолей и химиотерапевтического лечения рака.
CONCLUSIONS
A growing body of evidence demonstrates
that centrosomes and SPBs are involved in
an increasing number of regulatory processes
in cells. Centrosomes and SPBs provide
a scaffold for binding numerous regulatory
molecules. Among these are proteins
involved in cell cycle progression and checkpoint
control. Recent work shows that centrosomes
are crucial for several cell cycle
transitions, including entry into mitosis and
progression from S phase to G1. In budding
and fission yeast, SPBs control exit from
mitosis and progression through cytokinesis.
Proteins involved in mitotic exit are sometimes
positioned asymmetrically on the two
SPBs. Centrosomes can also respond to cellular
changes. For example, centrosomes lose
their microtubule organizing activity and prevent
mitosis when cells are exposed to genotoxic
and other stresses. The ensuing failure
in mitosis or cytokinesis results in polyploid
cells that usually result in cell death, thus eliminating
damaged cells from the population.
The multitude of regulatory proteins that associate
with centrosomes suggests that the
number of regulatory processes in which centrosomes
participate is only beginning to be
revealed
Сайт создан в системе
uCoz 

 Figure 3
Regulation of MEN activity. (a) Several mechanisms function to keep the MEN inactive in metaphase. Premature activation of the MEN in metaphase is prevented by the Bub2p-Bfa1p, which serves as a
GAP for the Tem1p GTPase (Alexandru et al. 1999, Fesquet et al. 1999, Fraschini et al. 1999, Li 1999). Additionally, Tem1p is spatially separated from its proposed GTP exchange factor Lte1p, which localizes
to the bud cortex (orange). Cdk phosphorylation of Cdc15p is also thought to antagonize MEN signaling in metaphase (Jaspersen & Morgan 2000, Menssen et al. 2001). Similarly, activation of the MEN in
anaphase is brought about by multiple mechanisms. Activation of the MEN depends on the passage of one of the spindle poles through the bud neck during anaphase spindle elongation (Molk et al. 2004, Yeh
et al. 1995). Once this has occurred, it brings that pole in proximity to the putative exchange factor Lte1p, which localizes specifically to the bud cortex (Bardin et al. 2000, Pereira et al. 2000), presumably
allowing activation of the Tem1p GTPase. Although some recent results raise questions about certain aspects of this model (see text), it provides a nice explanation for how spindle orientation in anaphase is
coupled to mitotic exit. (b) Cells with defects in spindle orientation often undergo anaphase chromosome separation in the mother cell. These cells delay MEN activation and exit from mitosis until correct
spindle orientation is achieved. Correct spindle orientation results in exit from mitosis, presumably in part by bringing SPB localized Tem1p into contact with bud localized Tem1p (orange).
Figure 3
Regulation of MEN activity. (a) Several mechanisms function to keep the MEN inactive in metaphase. Premature activation of the MEN in metaphase is prevented by the Bub2p-Bfa1p, which serves as a
GAP for the Tem1p GTPase (Alexandru et al. 1999, Fesquet et al. 1999, Fraschini et al. 1999, Li 1999). Additionally, Tem1p is spatially separated from its proposed GTP exchange factor Lte1p, which localizes
to the bud cortex (orange). Cdk phosphorylation of Cdc15p is also thought to antagonize MEN signaling in metaphase (Jaspersen & Morgan 2000, Menssen et al. 2001). Similarly, activation of the MEN in
anaphase is brought about by multiple mechanisms. Activation of the MEN depends on the passage of one of the spindle poles through the bud neck during anaphase spindle elongation (Molk et al. 2004, Yeh
et al. 1995). Once this has occurred, it brings that pole in proximity to the putative exchange factor Lte1p, which localizes specifically to the bud cortex (Bardin et al. 2000, Pereira et al. 2000), presumably
allowing activation of the Tem1p GTPase. Although some recent results raise questions about certain aspects of this model (see text), it provides a nice explanation for how spindle orientation in anaphase is
coupled to mitotic exit. (b) Cells with defects in spindle orientation often undergo anaphase chromosome separation in the mother cell. These cells delay MEN activation and exit from mitosis until correct
spindle orientation is achieved. Correct spindle orientation results in exit from mitosis, presumably in part by bringing SPB localized Tem1p into contact with bud localized Tem1p (orange).