Во время клеточных делений каждая хромосома удваивается и возникающие в результате копии сегрегируют в разные дочерние клетки. Два продукта репликации хромосом называются сестринскими хроматидами. Прикрепление сестринских хроматид а микротрубочкам веретена в правильной ориентации нуждается в тонком балансе сил, растаскивающие хромосомы и удерживающей их вместе. Последняя называется Sister chromatid cohesion (SCC).
В мейозе последний премейотический раунд репликации ДНК сопровождается двумя последовательными делениями, которые ведут к продукции гаплоидных гамет. В первом мейотическом делении (MI) гомологичные хромосомы сегрегируют. Связь между гомологами, необходимая для соотв. их ориентации на веретене, создается с помощью рекомбинации между несестринскими хроматидами и путем pre-serving SCC (Рис. 1). Для осуществления первого деления слипчивость хромосомных плеч нарушается, но слипчивость центромер продолжает удерживать сестринские хроматиды связанными до тех пор, пока они прикреплены к веретену и не станут готовы разойтись в мейоза II (MII).
Слипчивость между сестринскими хроматидами устанавливается во время S-фазы и обеспечивается с помощью cohesin protein complex, чьи субъединицы часто обозначаются как cohesins (Jassberger 2002, 2003; Hagstrom & Meyer, 2003; Uhlman, 2004).
Первоначально cohesins были обнаружены в митотически делящихся клетках, а позднее и мейозе (Firooznia et al., 2005). Митотический cohesin комплекс содержит 4 стержневые субъединицы: 2 - члены семейства белков structural maintenance of chromosomes (SMC), SMC1 и SMC3; Rad21/Scc1, член семейства белков kleisin; и Scc3 (Uhlman, 2004). У позвоночных Scc3 существует в двух изоформах SA1 и SA2 (Losada et al., 2000; Sumara et al., 2000). Считается, что 4 белка формируют кольцевую структуру, которая охватывает две сестринские хроматиды и тем самым удерживает их вместе (Gruber et al., 2003; Haering et al., 2004). Протеолитическое расщепление kleisin субъединицы с помощью специфической протеазы, наз. separase, высвобождает SCC в анафазе (Nasmyth, 2005). У позвоночных фосфорилирование Rad21, расположенных на хромосомных плечах предшествует этому протеолитическому процессу и делает его более эффективным (Hauf et al., 2005).
В клетках, участвующих в мейозе, митотические cohesin субъединицы сосуществуют, по крайней мере, первоначально, с мейоз-специфическими изоформами, которые кодируются самостоятельными генами. Мейотические паралоги у млекопитающих описаны для SMC1, RAD21 и SA1/SA2 и называются SMC1β (Rеvenkova et al., 2001), REC8 (Parisi et al., 1999) и STAG3 (Prieto et al., 2001) соотв. По крайней мере, в контексте мейоза первоначально выявленный митотический SMC1 белок был назван SMC1α
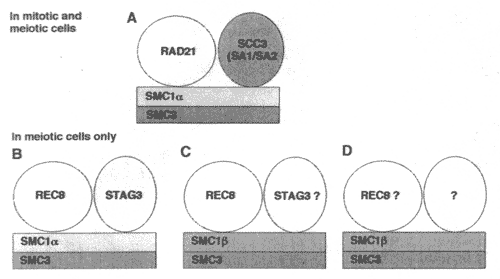 Figure 2 Cohesin complexes in meiocytes. Current evidence suggests the existence of at least four different cohesin complexes in mammalian meiocytes. None of the complexes shown here have been fully characterized for meiotic cells.
Figure 2 Cohesin complexes in meiocytes. Current evidence suggests the existence of at least four different cohesin complexes in mammalian meiocytes. None of the complexes shown here have been fully characterized for meiotic cells.
Существование митотических и мейотических SMS и не-SMC субъединиц cohesin комплекса в профазе I подтверждает параллельное присутствие более чем одного cohesin комплекса на этой стадии, Пока неизвестно, сколько разных cohesin комплексов с уникальной комбинацией этих субъединиц существует в мейозах, какова специфическя функция каждого из этих комплексов и как они связаны и возможно взаимодействуют др. сдр.
Существуют доказательства, указывающие на существование, по крайней мере, трех если не 4-х, самостоятельных комплексов (Рис. 2). В ядерных экстрактах из целых семеников с вкладом от митотических и мейотических клеток, ожидается, по крайней мере, присутствие "стандартных" митотических и мейотических cohesins. Иммунофлюоресценция показала, что SMC1α и SMC1β сосуществуют в профазе I в сперматоцитах (Ravenkova et al., 2001, 2004; Eijpe et al., 2003), это указывает на наличие двух cohesin комплексов, каждый формирующийся на базе одной специфической изоформы SMC1. SMC1α и REC8, а также SMC1α и STAG3 также копреципитируют (Ravenkova et al., 2004). Эти cohesins могут формировать мейоз-специфические базирующиеся на SMC1α комплексы, представленные SMC1α/SMC3/REC8/STAG3 (Рис. 2В), или два отдельных комплекса, в которых одна мейоз-специфическая и non-SMC субъединицы ассоциируют с non-meiosis-specific non-SMC субъединицами. В экспериментах по иммунопреципитации REC8 ассоциирует по крайней мере с SMC1α, SMC3, SMC1β и STAG3, указывая тем самым, что имеется, по крайней мере, 2 или более REC8-содержащих комплексов - один содержит SMC1α и один SMCAβ - в мейоцитах млекопитающих (Рис. 2В-D).
Данные иммунофлюоресценции показывают отсутствие SMC1α и STAG3 в хромосомах мейоза II и в некоторых случаях уменьшение между профазой I и анафазой I (Pezzi et al., 2000; Prieto et al., 2001; Eijpe et al., 2003), возникает вопрос, действительно ли SMC1a; необходим для профазы I или это скорее остаток от премейотических времен. Т.к. SMC1α существенен, то на этот вопрос может ответить только благодаря созданию условных нокаутных мышей. Однако, т.к. SMC1α ассоциирует с STAG3 и REC8 и т.о. формирует мейоз-специфичный комплекс, который очень возможно и составляет подлинный мейотический комплекс.
Однако, REC8 не исчезает бесследно на этой стадии. Скорее большая часть его остается ассоциированной с хромосомами метафазы I и исчезает из хромосомных плеч в конце перехода метафаза II/анафаза (Ejipe et al., 2003). Т.о., REC8 является возможно одним из cohesins, ответственных за центромерный SCC. SMC1β и SMC3 также остаются ассоциированными с центромерами вплоть до начала анафазы II, подтверждая, что комплекс SMC1β, SMC3,REC8 и еще не идентифицированная SCC3-подобная субъединица действуют как центромерный cohesisn (Raenkova et al., 2001). Идентичен ли этот центромерный cohesin с комплексом, обеспечивающим слипчивость плеч, и являющийся только специфически пост-трасляционно модифицированным и/или защищенным на центромерах, или центромерный cohesin комплекс имеет другой состав, или имеется более одного типа cohesin комплексов на центромере, пока неизвестно.
Анализ мышей, дефицитных по SMC1β, продемонстрировал роль этого cohesin в слипчивости обоих плеч и центромер (Ravenkova et al., 2004). В Smc1b;-/- сперматоцитах, cohesins SMC1α, SMC3, REC8 и STAG3 локализуются на хромосомных осях в ранней профазе, как у клеток дикого типа, демонстрируя роль в установлении SCC. Однако в отсутствии SMC1β остальные cohesins недостаточны для обеспечения хода мейоза после пахитены и мутантные сперматоциты в конечном итоге погибают из-за апоптоза. Обработка Smc1b;-/- сперматоцитов окадиковой кислотой, которая индуцирует преждевременную конденсацию хромосом до матафаза-подобного состояния, выявляет потерю SCC центромерами. Smc1b;-/- ооциты развиваются дальше, чем сперматоциты и могут достигнуть метафазы Ii, когда становится очевидной полная потеря SCC с плеч и центромер. И самцы и самки Smc1b;-/- полностью стерильны.
Сходным образом REC8-дефицитные мыши (Bannister et al., 2004; Xu et al., 2005) не дают жизнеспособных гамет. Преждевременное разделение плеч сестринских хроматид в пахитене предшествует исчезновению мутантных сперматоцитов. У Rec8-/- мышей дефекты хромосомных синапсов более тяжелые. Происходит арест и сперматогенеза и оогенеза на более ранних стадиях, чем у Smc1b;-/- мышей (Bannister et al., 2004; Revenkova et al., 2004; Xu et al., 2005). Фенотипы обоих мышиных мутантов указывают на то, что SMC1β и REC8 формируют комплекс и действуют совместно, но имеют также самостоятельные роли, которые, по-видимому, используются др. комплексами. Участие REC89 в отдельных комплексах с SMC1α и SMC1β может объяснить более тяжелый фенотип мутантов Rec8-/-.
Функция RAD21 белка на специфических стадиях мейотических клеток пока непонятна. В литературе спорят, остается ли RAD21 ассоциированным с хромосомами после профазы Ш. В одной работе подтверждается, что комплекс млекопитающих образуется из RAD21, SMC3, SMC1β и неустановленной 4-й субъединицы и персистирует в центромерах до перехода от метафазы к анафазе II и тем самым может вовлекаться в биполярное прикрепление кинетохор к микротрубочкам для расхождения сестринских хроматид (Xu et al., 2004). В др. публикации заявляется, что RAD21 удаляется из центромер в телофазе I и не присутствует в центромерах мейоза II (Parra et al., 2004). Время и положение RAD21 относительно др. белков, накапливающихся в центромерах в конце профазы I подтверждает гипотезу, что RAD21 у мышей играет роль в ориентации сестринских кинетохор (Parra et al., 2004). Кинетеохоры являются белковыми структурами, обеспечивающими соединение центромер с микротрубочками веретена. Чтобы сестринские хроматиды двигались вместе к одному полюсу во время первого мейотического деления, их кинетохоры д.б. ориентированы в том же самом направлении, тогда как при мейозе II сестринские кинетохоры д.б. расположены спина-к-спине. У делящихся дрожжей моно-ориентация сестринских кинетохор в мейозе I нуждается среди прочих факторов в cohesin Rec8 (Hauf & Watanabe, 2004; Marston & Amon, 2004). Вопрос об участии Rec8 в ориентации кинетохор у млекопитающих пока без ответа.
SA1 и SA2 белки обычно обнаруживаются рядом со своим мейоз-специфическим вариантом STAG3 (Pezzi et al., 2000; Prieto et al., 2001;2002), но их специфическая ассоциация с определенными типами комплексов и функция этих комплексов неизвестны.
Т.о., имеется существенная изменчивость мейотических cohesin комплексов, поэтому можно ожидать специфических функций для большинства из них. Может быть некоторая перекрываемость и мыши, дефицитные по определенному cohesin м.б. способны частично восполнить потерю. Однако, учитывая уникальные различия в мейозе между слипчивостью плеч и центромер, а также фенотипы cohesin мутантов у дрожжей и cohesin-дефицитных мышей, очевидно, что существуют уникальные, не перекрывающиеся комплексы.
The patterns of cohesin assotiation with chromosomes
Картирование с низким разрешением cohesin-связывающих сайтов на митотических хромосомах S.cerevesiae выявляет преимущественную ассоциацию cohesin с областями, окружающими центромеры и определенные сайты на плечах. Перицентрические cohesin-связывающие домены у дрожжей оккупируют области примерно в 50 kb, тогда как cohesin-связывающие сайты в плечах занимают приблизительно 1 kb в длину и разделены интервалами примерно в 10 kb (Blat & Kleckner 1999, Megee ef aд. 1999, Tanaka et al 1999, Weber eе aд. 2004).
Cohesin связывание в перицентрических регионах зависит от присутствия специфических центромерных последовательностей (Megee et al 1999, Tanaka et al. 1999, Weber et al 2004). Напротив картирование cohesin-связывающих сайтов в плечах не выявило какого-либо консенсуса а последовательностях их ДНК (Glynn et al 2004, Lengronne et al 2004). Позиции большинства из этих сайтов а плечах, по-видимому, предопределяются активной транскрипцией и огромное большинство сайтов располагается между генами с конвергентным направлением транскрипции. Это подтверждает, что транскрипционная кухня заставляет скользить cohesion комплексы в направлении концов транскрибируемых генов. Некоторые эксперименты демонстрируют, что изменения в транскрипционной активности в самом деле влияют на связывание cohesin как следствие:
1. Выключение транскрипции стирает ассоциацию cohesin с сайтом, расположенным ниже гена (Lengronne et al 2004).
2. Изменение статуса транскрипции по нескольким генам путем вариации условий роста вызывает перемещение cohesin-связывающих сайтов вниз от активно транскрибируемых последовательностей.
3. Изменение транскрипции нескольких генов, обусловленное переключением на мейоз, вызывает соотв. перемещение cohesin (Glynn et al 2004, Lengronne et al 2004).
Различия между соматическими и мейотическими cohesin-связывающими сайтами также могут вызываться с помощью различных композиций cohesin комплексов, но у C. cerevisae, сайты связывания для Rec8 (meiotic) и Scc1 (mitotic; присутсвует в мейотических клетках) занимают те же самые позиции в мейотических клетках (Lengronne ef ai 2004). Важно, что Glynn et al (2004) нашли, что сайты разрывов двойных нитей, где инициируется мейотическая рекомбинация оказываются свободными от cohesin.
Дальнейший анализ (Lengronne et al 2004) показал, что первоначально cohesin загружается на Scc2/Scc4 (adherin)-связывающие сайты и затем перемещается в места наиболее соответствующие регионам между генами с конвергирующими направлениями транскрипции (для adherin rev. Dorsett 2004). Недавно мутации в NIPBL, который является человеческим гомологом Scc2, были открыты как причина синдрома Cornelia de Lange (Krantz et al 2004, Tonkin et al 2004).
Синдром Roberts, который также характеризуется аномалиями развития и задержкой роста, вызывается мутациями в ESC02 человеческом гомологе дрожжевого Eco1 (Vega et al 2005). S. cerevisiae Eco1 необходим для установления SCC во время репликации, но он безразличен для поддержания слипчивости (Toth et al 1999) или загрузки cohesin (Skibbens et al 1999).
Мейоз-специфичные факторы для загрузки cohesin или создания слипчивости пока ещё не описаны. Неясно, могут ли исследования, проведенные на дрожжах, удовлетворительно объяснить загрузку и позиционирование cohesin в мейоцитах млекопитающих. Напр., кинетика хромосомных ассоциаций индивидуальных cohesin белков или комплексов выглядит более сложной в клетках млекопитающих, так REC8, по-видимому, ассоциирует раньше, чем SMC1β с мейотическими хромосомами (Eijpe et al 2003).
У дрожжей, Rec8-содержащий cohesin загружается на хромосомы до премейотической S-фазы для установления слипчивости (Watanabe & Nurse 1999, Watanabe et al 2001). Тем не менее, т.к. большинство cohesin комплексов может быть загружено во время премейотической S-фазы, др. могут загружаться позднее и могут добавляться к или (частично) замещать ранее загруженные комплексы. Аргументом против массивного замещения cohesin по крайней мере, в митозах, может служить исследование, в котором не расщепляемый вариант Scc1p экспрессируется после S-фазы, т.е. после установления слипчивости. Если мутантные Scc1p экспрессируются после репликации ДНК, то не обнаруживается эффекта на разделение сестринских хроматид (Haering et al 2004). Конечно, мейоз отличен и клетки млекопитающих поддерживают уровень cohesin сложности, не характерный для дрожжей.
В клетках человека cohesin рекрутируется на сайты разрывов двойной нити ДНК в S/G2 фазе (Kim et al 2002a), a tuj SMC1 субъединица фосфорилируется в ответ на повреждение ДНК с помощью ATM kinase (Kim et al 20026, Yazdi et al 2002). После повреждения ДНК, новые обогащенные cohesin домены возникают вокруг разрывов ДНК у дрожжей (Strom et al 2004, Unal et al. 2004), иллюстрируя один из способов загрузки новых и/или отличных комплексов cohesin по длине хромосом после S-фазы. Strom et al (2004) также продемонстрировали, что cohesin соединяется с сайтами повреждений ДНК в G2 и способен обеспечивать SCC. Индуцированное повреждениями ДНК рекрутирование cohesin необходимо для эффективной пострепликативной репарации ДНК (Strom et al 2004, Unal et al 2004). Более того, генетические доказательства на С. cerevisiae демонстрируют функционирование cohesin в координации с рекомбинационной репарацией посредством пути Rad52 epistasis group, как противоположность пути негомологичного end-joining (Schar et al., 2004).
Генерация и репарация разрывов двойной нити является признаком мейоза, подчеркивающим, что специфическая функция cohesin в процессинге разрывов двойной нити ДНК может быть одной из причин существования разнообразных мейотических комплексов.
Role of cohesin in chromosome axes formation and synapsis
Загрузка cohesin имеет далеко идущие последствия для структуры мейотических хромосом, чем только удержание сестринских хроматид вместе. У дрожжей загрузка Rec8p необходима для формирования synaptonemal complex (SС (Klein et al 1999). SC это мейоз-специфическая, zipper-подобная белковая структура, которая обеспечивает спаривание гомологов и поддерживает рекомбинацию с помощью механизма, который еще не понят (rev. Zickler & Kleckner 1999, Hunter 2003, Rage & Hawley 2004). SCs состоят из двух axial elements (AEs), которые соединены многочисленными поперечными филаментами вдоль всей их длины. Каждый AE поддерживается двумя сестринскими хроматидами одного гомолога. S. cerevisiae Smc3p колокализуется с AE компонентом во время мейотической профазы и является существенным для мейотической рекомбинации и SCC (Klein et al. 1999). У млекопитающих идентифицированы два AE компонента, которые специфически экспрессируются в мейотической профазе, SYCP2 (Offenberg et al. 1998) и SYCP3 (Lammers et al. 1994). Поперечные филаменты состоят из SYCP1 (Meuwissen et al. 1992). Ранние исследования SMC белков в сперматоцитах подтвердили взаимодействия между SC белками и cohesins (Eijpe et al. 2000). Дальнейшие доказательства таких взаимодействий и новый свет на роль cohesins в формировании структуры хромосом в мейозе млекопитающих были получены в результате анализа мутантов мышей, дефицитных по cohesins SMC1β или REC8, а также мышей, дефицитных по компоненту SC, SYCP3.
Отсутствие SMC1β или REC8 в сперматоцитах мутантных мышей вызывает драматические изменения в формировании SC. последняя стадия мутантных сперматоцитов, которая может быть достигнута перед арестом мейоза, может быть охарактеризована как аберрантная пахитена, у мутантных сперматоцитов наблюдается высокий показатель не синапсированных или неполностью синапсированных хромосомных стержней (Bannister ef al. 2004, Revenkova et al. 2004, Xu et al. 2005).
Вообще-то наиболее характерным признаком Smclβ-/- сперматоцитов является 50% уменьшение длины AEs (Revenkova et al. 2004). Сходная редукция наблюдалась у Rec8-/- мышей (Bannister et al. 2004, Xu et al. 2005). Этот фенотип указывает на то, что cohesin предетерминирует общую организацию хроматина во время сборки AE. Если количество загруженного на хромосому cohesin или количество cohesin-связывающих сайтов предетерминирует количество или размеры доменов хроматина, расположенного в основании хроматиновой петли, то дефицит cohesin может вызывать снижение количества хроматина упакованного в AE и соотв. увеличение размеров петель (Fig. 3). В самом деле размер петель, оценивающийся путем измерения расстояния между AE и наиболее дистальной точкой окружающих хромосому специфического хроматинового облака, а также объем хроматина, повышены в Smciβ-/- сперматоцитах по сравнению с диким типом (Revenkova et al, 2004).
Элиминация SYCP3 вызывает арест мейоза и стерильность у самцов. Мейоз у самок продолжается до завершения; однако, SYCP3-дефицитные самки обнаруживают достоверное уменьшение размеров выводков (Yuan et al. 2000, 2002). В дикого типа и SYCP3-дефицитныъ сперматоцитах spermatocytes, SMС1α, SMC3 b STAG3 формируют волокно-подобный набор фокусов, по-видимому, соответствующих хромосомному каркасу (scaffold) который удерживает сестринские хроматиды вместе (Pielttari et al. 2001). Cohesin основа формируется в этих SC-лишенных сперматоцитах, в то же время нет того же самого регулярного проявления, которое видно при полном SC, эта основа всё ещё способна рекрутировать рекомбинационные белки и способствовать некоторому спариванию между гомологичными хромосомами. Всё это говорит о, по крайней мере, независимом формировании cohesin основы в присутствии SC (Kouznetsova et al. 2005). Сходным образом, локализация cohesin в ранней профазе I в Sycp1-/- сперматоцитах подобна той, что имеется в клетках дикого типа (de Vries et al. 2005).
Др. интересный признак
Sycp3-/- мейоцитов заключается в увеличении длины AE в 2-4 раза (Yuan et al. 2002). Т.о., функциональные взаимоотношения между SYCP3, который обнаруживается в компактных хромосомных осях, и SMC1β, который появляется или чтобы ограничить или активно противодействовать компакции и предопределяют места прикрепления хроматиновых петель, являются критическими для установления собственно длины AE (Fig. 3). Мутантные мыши, дефицитные по обоим белкам, могут помочь выяснить природу этих взаимоотношений.
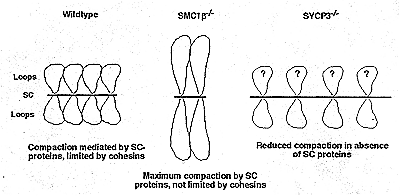 Figure 3 Hypothetical interplay between SCP3/SCP2 and SMC1β cohesin in determining the lateral compaction of the SC. Chromosome loops and SC are shown for wild-type and two mutant mice. A speculative interpretation of the interplay between SMC1β and SYCP3 is indicated for each genotype. SYCP3 and SYCP2 act in concert. The loop size m the Sycp3-/- meiocytes is not known; therefore, two alternative explanations are offered.
Figure 3 Hypothetical interplay between SCP3/SCP2 and SMC1β cohesin in determining the lateral compaction of the SC. Chromosome loops and SC are shown for wild-type and two mutant mice. A speculative interpretation of the interplay between SMC1β and SYCP3 is indicated for each genotype. SYCP3 and SYCP2 act in concert. The loop size m the Sycp3-/- meiocytes is not known; therefore, two alternative explanations are offered. Хромосомы у Smс1β-/- мейоцитов не только коротки, но и не способны в некоторых др. отношениях. Их теломеры неправильно прикрепляются к периферии ядра по сравнению со сперматоцитами дикого типа. Образование кластеров теломер в одной точке периферии ядра является характерным для ранней профазы I и соответствует расположению хромосом, называемому мейотическим букетом (rev. Scherthan 2003, Harper et al. 2004). Более того, как упоминалось раньше, синапсы гомологов неполные у Smc1β-/- мутантов. Оба фенотипа могут быть следствием укорочения структуры хромосом. Напр., короткие хромосомы может не достигать периферии ядра из-за стерических проблем и могут иметь сходные стерические проблемы по нахождению гомологичных партнеров для синапса, особенно если образование букета будет участвовать в спаривании. Альтернативно, SMC1β может обладать теломер-специфической функцией и/или функцией в спаривании.
Прохождение ооцитов через мейоз I и вступление в анафазу II позволяет задать вопрос, может ли дефицит SMC1β влиять на количество и локализацию кроссоверов и могут ли какие-либо возникающие в результате альтерации в паттернах кроссоверов транслироваться в анеуплоидию. Такие вопросы важны для понимания анэуплоидии, которая является главной проблемой репродуктивного здоровья (Hunt & Hassold 2002).
Regulation of metotic SCC
Ряд noncohesin белков вносит вклад в сам SCC, может взаимодействовать с cohesins или регулировать процессы, которые важны для установления, поддержания или устранения SCC. Т.к. анализ cohesin-дефицитных мышей иллюстрирует, что существует также интимная связь между мейотической рекомбинацией и SCC и поэтому взаимодействия др. белков также необходимо учитывать. Все эти факторы и процессы находятся за рамками данного обзора, который концентрируется на немногих избранных областях. Одна из них связана с механизмами, которые гарантируют ступенчато образное устранение cohesion в мейозе I и II. У млекопитающих, цель удаления cohesin распределена между двумя путями (rev. Uhlmann 2003). Один имеет отношение к расщеплению kleisin субъединицы с помощью специфической протеазы, наз. separase. Активация separase запускается как результат активности anaphase promoting complex APC/C. Второй путь не нужен, чтобы kleisin был расщеплен, а вовлечен в модификацию Scc1/Rad21 и Scc3-подобной субъединицы с помощью фосфорилирования и зависит от активности протеин киназы Aurora B и POLO-подобрной киназы Plkl. В митотических клетках этот путь оперирует в профазе и удаляет большинство cohesin из хромосомных плеч. Путь профазы зависит от фосфорилирования cohesin субъединицы SA2 (Hauf et al. 2005)? а высвобождение cohesin в профазе необходимо для расцепления сестринских хроматид (Losada et al. 2002). Центромерный cohesin т остаточный cohesin плеч удаляются во время перехода метафаза/анафаза с помощью separase пути.
В мейозе наблюдается и снижение количества различных cohesins, связанных с хромосомными плечами во время профазы (Prieto et al. 2001, 2002, Revenkova et al. 2001), но детальные механизмы этого истощения неизвестны. Разделение гомологов в анафазе I коррелирует с распусканием кроссоверов и полной деструкцией слипчивости плеч. В ооцитах мышей активность separase необходима для первого перехода от метафазы к анафазе (Tenet etal. 2003).
В противоположность митотическому делению, в мейозе I, слипчивость центромер сохраняется, чтобы гарантировать успешную сегрегацию сестринских хроматид в анафазе II. Механизм защиты слипчивости центромер, когда она исчезает из плеч в начале анафазы I хорошо изучен у дрожжей. Найден белок существенный для защиты центромерной слипчивости, 'shu-goshin' {Japanese for 'guardian spirit') или Sgolp (Kitajima et al. 2004). У дрожжей он локализуется в кинетохорах и локально защищает Rec8p от расщепления с помощью separase. Млекопитающие имеют два члена семейства shugoshin, SGO1 и SG02. Функция SG02 не известна, а SGOI служит в качестве защитника слипчивости центромер, но в противоположность дрожжам, он выполняет свой долг во время митотической профазы и он противодействует не separase пути, а Plkl-зависимому пути (McGuiness et al. 2004 Kitajima et al. 2005). В клетках HeLa механизм SCO1-обусловленной защиты слипчивости центромер, по-видимому, имеет отношение к предупреждению митоз-специфического гиперфосфорилирования SA2 (McCuiness et al. 2004). Функция shugoshins в качестве защиты слипчиваости во время мейоза I и II у позвоночных еще не была продемонстрирована. Однако, у Drosophila, shugoshin MEI-S332 давно известен в качестве протектора центромерной слипчивости (Kerrebrock et al. 1992). Недавно было показано, что диссоциация MEI-S332 из центромер обеспечивается с помощью POLO kinase (Clarke et al. 2005). Т.о., возможно, что SCC зависит от баланса противодействующих сил с shugoshin на одной стороне и APO/C b POLO-like kinase на др. Определенно, shugoshin не единственный защитник слипчивости в мейозе. Др. факторы. такие как Mnd2, мейоз-специфический антагонист APC/C (Oelschaegel et al. 2005, Penkner et al. 2005) или Spo13, который участвует в поддержании центромерной слипчивости ы мейозе I (Katis et al. 2004, Lee et al. 2004), были недавно охарактеризованы у дрожжей и они также вносят вклад в поддержание центромерной слипчивости. Сходные у млекопитающих мейоз-специфичные регуляторы слипчивости еще предстоит выявить.
Если митотический SCC и сегрегация кажутся сложными, то мейоз добавляет еще пласты сложности. Т.о., не удивительно видеть мейоз-специфичные белки и комплексы и специфические хромосомные структуры и поведение. Cohesins не являются привилегией и д. создавать множество более пленяющих наблюдений. Более того, с их центральной ролью в выполнении расхождения хромосом, они м. прекрасно служить ключом к пониманию частых анеуплоидий у людей.
Сайт создан в системе
uCoz  Figure 2 Cohesin complexes in meiocytes. Current evidence suggests the existence of at least four different cohesin complexes in mammalian meiocytes. None of the complexes shown here have been fully characterized for meiotic cells.
Figure 2 Cohesin complexes in meiocytes. Current evidence suggests the existence of at least four different cohesin complexes in mammalian meiocytes. None of the complexes shown here have been fully characterized for meiotic cells.  Figure 3 Hypothetical interplay between SCP3/SCP2 and SMC1β cohesin in determining the lateral compaction of the SC. Chromosome loops and SC are shown for wild-type and two mutant mice. A speculative interpretation of the interplay between SMC1β and SYCP3 is indicated for each genotype. SYCP3 and SYCP2 act in concert. The loop size m the Sycp3-/- meiocytes is not known; therefore, two alternative explanations are offered.
Figure 3 Hypothetical interplay between SCP3/SCP2 and SMC1β cohesin in determining the lateral compaction of the SC. Chromosome loops and SC are shown for wild-type and two mutant mice. A speculative interpretation of the interplay between SMC1β and SYCP3 is indicated for each genotype. SYCP3 and SYCP2 act in concert. The loop size m the Sycp3-/- meiocytes is not known; therefore, two alternative explanations are offered.