A Common Progenitor at the Heart of Development | |
|
|
Врожденные и приобретенные болезни сердца ведут к аномалиям в кардиальном росте, сократимости и кровоснабжении. Неспособность постнатальных кардиальных мышечных клеток пролиферировать ставит основной барьер для функционального восстановления больного сердца. Регенеративная терапия стволовыми клетками болезней сердца неизбежно влечет за собой необходимость понимания молекулярных механизмов, управляющих предопределением судеб, дифференцировкой и морфогенезом мириадов клеточных типов, которые составляют сердце и способности манипулировать этими механизмами. получены доказательства для клеток кардиальных предшественников, которые обладают потенциалом дифференцироваться во все три основных клеточных типа: кардиальные миоциты, гладкомышечные клетки и эндотелиальные клетки (Kattman et al., 2006; Moretti et al., 2006; Wu et al., 2006). В них демонстрируется пластичность и онтогенетический потенциал клеток кардиальных предшественников. В то же время они ставят вопросы об эмбриональном источнике клона кардиальных клеток и о критериях, используемых для определения стволовых клеток и их производных.
The Embryonic Origins of Cardiac Cell Lineages Образование зрелого многокамерного сердца нуждается во вкладе различных типов клеток со специализированными функциями. Кардиальные мышечные клетки становятся специализированными, чтобы сформировать миоциты желудочков и предсердий. Гладкомышечные клетки формируют венозную и артериальную сосудистую сеть, эндотелиальные клетки дают эндокард и клапаны, а эпикард служит источником предшественников коронарных сосудов.
Недавние исследования продемонстрировали, что сердце формируется из двух отдельных популяций клеток предшественников или "полей сердца". которые сегрегируют от общего предшественника на ст. гаструляции (Kelly et al.,2001; Cai et al., 2003; Abulssa et al., 2004). Самая ранняя популяция кардиальных предшественников, обозначаемая как первичное поле сердца, возникает в передней части спланхнической мезодермы и дает кардиальный полумесяц, который в конечном итоге вносит вклад в левый желудочек и предсердия (Рис. 1). Клетки от кардиального полумесяца мигрируют медиально и образуют линейную сердечную трубку, которая состоит из внутреннего эндокардиального слоя и наружного миокардиального слоя. Образование петли в правую сторону и различия в росте вдоль наружной кривизны сердечной трубки в конце концов генерируют многокамерное сердце (rev. Buckingham et al., 2005). Дополнительный источник кардиальных предшественников, обозначается как вторичное или переднее поле сердца, оно возникает из фарингеальной мезодермы, расположенной медиальнее кардиального полумесяца (Рис. 1). Эксперименты по клональному отслеживанию показали. что вторичное поле сердца вносит вклад преимущественно в правый желеудочек и тракт оттока (Kelly et al., 2001; Cai et al., 2003; Laugwitz et al., 2005).
Первичное и вторичное поля сердца могут быть отличены по экспрессии специфических транскрипционных факторов и сигнальных молекул. Т-боксный транскрипционный фактор Tbx5 и bHLH транскрипционный фактор Hand1, напр., маркируют первичное поле сердца, тогда как Hand2, LiM-гомеодоменовый транскрипционный фактор Isl1 и Fgf10, среди прочих, маркируют вторичное поле сердца (Kelly et al., 2001; Cai et al., 2003). Мышиные эмбрионы с мутациями в этих и др. генах приводят к аномалиям в соотв. регионах сердца (Buckingham et al., 2005). Др. кардиальные регуляторные гены, такие как гомеобоксный ген Nkx2-5, экспрессируются в обоих полях сердца и полагаются на разные цис-регуляторные элементы для экспрессии в этих популяциях предшественников, демонстрируя тем самым, что транскрипционные сети, которые управляют кардиогенезом в разных регионах развивающегося сердца являются самостоятельными (rev. Schwartz, Olson, 1999). 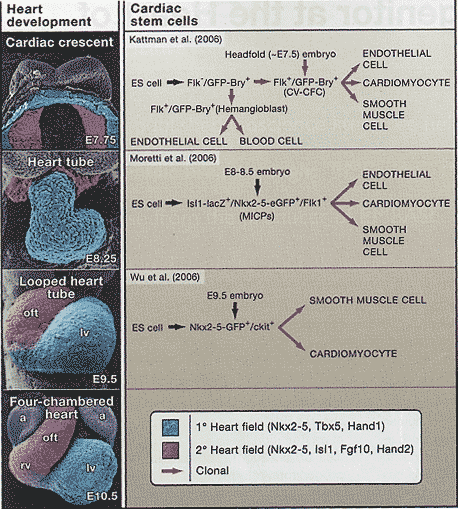 Cardiac Stem Cells. The heart forms from two heart fields. Scanning electrom micrographs of representative stages of mouse development are shown with derivatives of the primary and secondary heart fields shown in color (left column; adapted from Kaufman, 1992). The individual panels show the characteristics and lineage relationships of cardiac progenitor cells as described in Kattman et al (2006) (top), and Monetti et al. (2006) (middle), Wu et al., (2006) (bottom). a, atrium; lv, left ventricle; oft, outflow tract; rv, right ventricle; CV-САСб cardiovascular colony forming cells; MiCPs, multipotent isl+ cardiac progenitors. Cardiac Stem Cells. The heart forms from two heart fields. Scanning electrom micrographs of representative stages of mouse development are shown with derivatives of the primary and secondary heart fields shown in color (left column; adapted from Kaufman, 1992). The individual panels show the characteristics and lineage relationships of cardiac progenitor cells as described in Kattman et al (2006) (top), and Monetti et al. (2006) (middle), Wu et al., (2006) (bottom). a, atrium; lv, left ventricle; oft, outflow tract; rv, right ventricle; CV-САСб cardiovascular colony forming cells; MiCPs, multipotent isl+ cardiac progenitors. Clonality, Self Renewal, and Multipotentiallity Некоторые последние исследования (Kattman et al., 2006; Moretti et al., 2006; Wu et al., 2006) описывают мультипотентные мезодермальные предшественники дающие разнообразные типы клеток внутри сердца. Но прежде рассмотрим свойства стволовых клеток: клональность, самообновление и мультипотентность. Embryonic stem (ES) клетки, происходящие из бластоцистов, представляют собой прототипическую популяцию стволовых клеток, способную давать более чем 200 типов соматических клеток. По ходу развития потомство стволовых клеток становится прогрессивно всё более специализированным и ограничивает свой онтогенетический потенциал.
Отслеживание клонов с репортерными генами обычно используется для демонстрации того, что популяция предшественников может давать разные типы клеток в эмбрионе. Однако, только клональный анализ может недвусмысленно показать мультипотентность клонов. Существуют многочисленные утверждения о существовании кардиальных стволовых клеток с заметно отличающимися характеристиками. Часть несоответствий проистекает из того факта, что во многих классах популяций "стволовых клеток" почти с определенностью содержатся гетерогенные популяции. Смешанные и часто противоречивые свойства разных кардиальных стволовых клеток ставят вопрос о критериях, используемых для их определения. Эти противоречия иллюстрируют необходимость в тщательной документации клональности, самообновляемости и степени мультипотентности в исследованиях кардиальных стволовых клеток. Vultipoptent Cardiac Progenitors Получены доказательства мультипотентных клеток предшественников, которые дают разные типы клеток сердца (Ema et al., 2006). Такая мультипотентность популяций мышечных предшественников выявляется как общая тема, как это продемонстрировано с помощью генеза скелетных мышц и аортальных гладкомышечных клеток из общего предшественника (Esner et al., 2006).
Вообще то наилучшим примером мутьтипотентного предшественника является гемангиобласт - мезодермальный предшественник гематопоэтических и сосудистых клонов, маркированных экспрессией brachyury (Bry) и VEGF репрессора Flk1. Доказательства существования способности гемангиобластов быть родоначальником эндотелиальных и гематопоэтических клеток получены с использованием мышиных ES/embryoid body (Huber et al., 2004) и с помощью стратегии картирования судеб у рыбок данио рерио (Vogeli et al., 2006). Анализ Flk1-lacZ нокаутных эмбрионов показал, что Flk1 экспрессируется у предшественников с потенциалом участия в широком кругу мезодермальных производных, включая клетки, мигрирующие из первичной полоски и производные, локализующиеся в кардиальном полумесяце, сомитах и внеэмбриональной мезодерме (Ema et al., 2006). Flk1 обязателен для формирования эндотелиальных и гематопоэтических клонов, но он не абсолютно необходим для развития др. мезодермальных клонов, таких клон кардиальных мышц.
Особенно интересно то, что мультипотентные кардиоваскулярные стволовые клетки могут быть изолированы из взрослого сердца? Beltrami et al., (2003) описали Lin-/ckit+ клетки, изолированные из взрослого сердца крыс, которые обладают свойствами стволовых клеток и способны давать кардиальные миоциты, гладкомышечные клетки и эндотелиальные клетки при культивировании in vitro. Более того, инъекции этих клеток в инфарктное, ишемическое сердце улучшали функцию миокарда. Представляют ли собой эти клетки остатки эмбриональных кардиогенных предшественников или отдельную популяцию клеток предстоит ещё выяснить. Наблюдения, что кардиосферы (сферические, клеточные агрегаты, формируемые из популяции клональных клеток, неизвестного происхождения) могут быть изолированы и экспоненциально умножены из сердец взрослых людей и мышей, иллюстрируют пролиферативный и онтогенетический потенциал взрослых кардиальных предшественников (Messina etal., 2004).
Используя ES клетки, несущие репортерный green fluorescent protein (GFP), нацепленный на Bry ген, Kattman et al. (2006) показали, что Flk1-/GFP-Bry+ предшественник может давать последовательно в культуре две самостоятельные популяции Flk1+/GFP-Bry+ предшественников. Первая соответствует гемангиобластам, из которой происходят эндотелиальные и гематопоэтические клоны, а вторая способна генерировать кардиальные миоциты, сосудистые гладкомышечные клетки и эндотелиальные клетки (Figure 1). Последние клетки, которые являются кардиоваскулярным эквивалентом гемангиобластов (обозначенные Id как кардиоваскулярные колонии формирующие клетки), экспрессируют Flk1 прежде кардиальных маркеров, таких как Nkx2-5, GATA4 и MEF2C. Сердечно-сосудистые колонии формирующие клетки, по-видимому, способны генерировать как первичное, так и вторичное поля сердца, как это демонстрируется взаимоисключающей эксклюзивной экспрессией Tbx5 и Isl1, соотв., в клональных колониях. Эти находки согласуются с заключением, что два поля сердца развиваются из общего предшественника с эндотелиальным потенциалом и сегрегируют в раннем развитии (Meilhac et al., 2004).
Сердечно-сосудистые колонии формирующие клетки могут быть также изолированы на ст. головной складки у эмбрионов мышей и клонально увеличиваться в культуре, чтобы генерировать колонии, которые экспрессируют эндотелиальные, сосудистые гладкомышечные и кардиальные маркеры. Это исследование вместе с предыдущими (Huber et al., 2004; Ema et al., 2006), подтверждают гипотезу, что экспрессия Flk1 идентифицирует мультиклональных мезодермальных предшественников, которые могут приобретать судьбу кардиальных мышц. Далее необходимо будет определить действительно ли такие Flk1+ предшественники полностью предопределены к продукции кардиоваскулярных клонов во время эмбриогенеза или они наделяются более широкой онтогенетической способностью после повреждения или когда помещаются в пермиссивные условия.
Используя трансгенных мышей, несущих репортерный enhanced yellow fluorescent protein (eYFP), контролируемый с помощью Nkx2-5 энхансера, как раннего кардиального маркера, мы изолировали кардиальных предшественников из кардиального полумесяца, сердечной трубки и петлеобразного сердца мышиных эмбрионов с помощью проточной цитометрии (Masino et al., 2004). Анализ транскриптома выявил стадио-специфические молекулярные характеристики (signatures)) кардиальных предшественников в каждом из этих онтогенетических периодов (Masino et al., 2004). Особенно кардиальные предшественники, изолированные из кардиального полумесяца, были богаты транскриптами, обычно экспрессируемыми в кардиальных, эндотелиальных и гематопоэтических клонах (Masino et al., 2004).
Wu et al. (2006), используя сходный подход, чтобы изолировать кардиальные предшественники из эмбрионов мышей и дифференцированные ES клетки, экспрессирующие Nkx2-5-GFP. Nkx2-5-GFP+ клетки, полученные из ES культур, обладают высокой пролиферативной способностью и способны генерировать клональные колонии с кардиальным и гладкомышечным фенотипами in vitro. Эти клетки экспрессируют скромные уровни маркеров стволовых клеток ckit и Sсal, но не экспрессируют эндотелиальных маркеров, указывая тем самым, что эндотелиальный и миогенный клоны уже были сегрегированы ко времени активации трансгена Nkx2-5-GFP. Nkx2-5-GFP+ клетки, изолированные из сердец E9.5 эмбрионов мышей, также были способны генерировать кардиальные и гладкомышечные клоны, если им позволяли дифференцироваться en mass in vitro. В этих условиях экспрессия Nkx2-5-GFP сегрегирует с кардиальными маркерами, в то время как гладкомышечные маркеры были ограничены GFP-клетками, указывая тем самым, что поддержание экспрессиии Nkx2-5 характеризует кардиальный фенотип. Попытки изолировать и расширить популяцию клональных Nkx2-5-GFP+/ckit+ клеток из эмбрионов оказались безуспешными, как и попытки направить Nkx2-5-GFP+/ckit+ клетки приобрести др. судьбы (т.e., нейральных, скелетно-мышечных, гематопоэтических клонов), в результате вопрос остался открытым, является ли мультипотентность уникальной для предшественников, производных ES клеток. Т.о., Nkx2-5-GFP+/ckit+ бипотенциальные сердечно-сосудистые предшественники, по-видимому, более ограничены по своему онтогенетическому потенциалу, чем предшественники сердечно-сосудистых колонии формирующих клеток, описанных Kattman et al. (2006). Согласуется с этим мнением то, что предшественники cardiovascular-colony forming клеток не экспрессируют Nkx2-5 или др. кардиальные маркеры, указывая, что они существуют на более ранних путях развития, чем Nkx2-5-GFP+/ckit+ предшественники (Kattman et al., 2006).
Дополнительные доказательства мультипотентных эмбриональных кардиальных предшественников получены в исследованиях Laugwitz et al. (2005) и Moretti et al. (2006), которые показали с помощью отслеживания клонов, что Isl1+ клетки, обозначаемые как мультипотентные isl+ cardiac progenitors (MICPs), вносят вклад в эндотелиальные, эндокардиальные, гладкомышечные клетки, проводящую систему, миогенные клоны правого желудочка и предсердий (Figure 1). Используя проточную цитометрию, Isl1 экспрессирующие клетки были изолированы из развивающейся сердечной трубки E8.0-8.5 мышиных эмбрионов и после экспансии с системе мезенхимного питающего слоя, они обнаруживали спонтанную экспрессию эндотелиальных, кардиальных и гладкомышечных маркеров. Происходящие из ES клеток Isl1+ кардиальные предшественники, маркированные с помощью экспрессии GFP из локуса Nkx2-5, также оказались способными давать более ограниченные популяции клеток предшественников, которые ко-экспрессировали Isl1 и Nkx2-5 (обнаруживая тем самым кардиальный и гладкомышечный потенциал) или Isl1 и Flk1 (обнаруживая эндотелиальный потенциал).
Moretti et al. (2006) обнаружили сходство мультипотентных isl1+ кардиальных предшественников с гематопоэтическими стволовыми клетками, которые способны восстанавливать все клоны кровяных клеток in vivo. Хотя это является интересной аналогией, но неспособность, таким образом, клонально генерировать полный спектр кардиальных клеток из одиночных Isl1+ предшественников in vivo, ограничение экспрессии Isl1 вторичным полем сердца и существование многочисленных др популяций предшественников, которые вносят вклад в сердце, указывают, что развитие сердца не толь просто. Outstanding Questions Осуществление того, что разные типы клеток сердца могут возникать из общих предшественников ставит многочисленные вопросы. Напр., что диктует выбор кардиоваскулярным предшественникам принимать одну судьбу, а не другую? Bone morphogenetic proteins (BMPs) и Wnts играют позитивную и негативную роли в спецификации судеб кардиальных клеток. Как эти и др. сигналы сталкиваются с транскрипционной кухней (machinery), которая управляет судьбами кардиальных мышц, гладкомышечных клеток и эндотелиальных клеток, предстоит ещё определить. Относительные вклады разных популяций предшественников (напр., для первичного и вторичного полей сердца, эпикарда и т.д. ) в разные типы клеток сердца также предстоит ещё решить.
Почему кардиальные предшественники. описанные разными группами, обладают разными характеристиками и каковы взаимоотношения между разными мультипотентыми кардиальными предшественниками? Учитывая, что путь от предшественника к полностью дифференцированному типу клеток, кардиальным миоцитам, гладким мышцам или эндотелию, скорее всего таков, что многочисленные переменные, такие как онтогенетическое время изоляции, анатомические источники клеток, а также культуральные условия влияют на фенотипы клеток по ходу этих путей. Кроме того, разные маркеры, используемые для выделения и идентификации клеток предшественников, безусловно выбираются для специфических субнаборов клеток. Кардиальные предшественники, изолированные из взрослого сердца также обладают самостоятельными и перекрывающимися свойствами, базирующимися на их мультиклональной диверсификации, маркерах клеточной поверхности, пролиферативной способности и локализации внутри сердца (Beltrami et al., 2003; Oh et al., 2003; Martin et al., 2004). Наши знания ограничены в отношении взаимоотношений этих предшественников один к др. или молекулярных сетей, которые регулируют их пролиферацию, самообновление или клональное состояние дифференцировки. Исследования изолированных стволовых клеток, которые используют ex vivo данные по экспрессии маркеров, чтобы определить пластичность и потенциал судеб предполагаемых клеток предшественников, говорят нам, что возможно в чашках с тканевой культурой, не обязательно действительно происходит in vivo во время развития и болезней. Этот вопрос особенно важен для исследований, в которых предполагаемые стволовые клетки используются у людей для лечения миокардиальных заболеваний.
Склонность производных ES клеток генерировать тератомы in vivo ограничивает из использование для регенеративной терапии у людей. Мультипотентные кардиальные предшественники, следовательно, представляются потенциально очень привлекательными для репарации сердца. Клинические испытания уже проводятся с использованием гематопоэтических и мезенхимных стволовых клеток для восстановления функции инфарктного сердца и сердечной недостаточности и первые успехи вовсю рекламируются. Тем не менее, остаются многочисленные препятствия и предосторожности необходимы. Время высвобождения клеток после повреждения, качественные особенности и количества высвобождаемых клеток, способ высвобождения и долговременные успехи всё ещё остаются нерешенными вопросами. Более того неясно, может ли клеточная терапия ограничивать прогрессирование сердечной недостаточности и могут ли популяции аутологичных стволовых клеток быть способными к трансдифференцировке в кардиальную судьбу и занимать поврежденные места в сердце.
Дальнейший анализ эмбриональных и взрослых кардиальных предшественников в отношении их происхождения, молекулярной регуляции и взаимоотношений др. и др. обещают улучшить наше понимание кардиального развития и болезней и могут послужить платформой для разработки терапии врожденных и приобретенных заболеваний сердца. REFERENCES Abu-lssa, R, Waldo, K., and Wrby, M.L (2004). Dev. Biol. 272,281-285.
Beltrami, A.R, Baricchi, L, Torefla, D., Baker, M., Limana, F, Chimertti,
S., Kasahara, H., Rota, M., Musso, E., Urbanek, K., et al. (2003). Cell 7 74,763-776.
Buckingham, M., Meilhac, S., and Zafrran, S. (2005). Nat. Rev. Genet. 6, 826-835.
Cai, C.-L, Liang, X., Shi, Y, Chu, P.-H., Pfaff, S.L, Chen, J., and Evans, S. (2003). Dev. Cell 5, 877-889.
Ema, M„ Takahashi, S., and Rossant, J. (2006). Blood 707,111-117.
Esner, M., Meilhac, S.M., Relaix, E, Nicolas, J.-F, Cossu, G., and Buckingham, M.E. (2006). Development 733, 737-749.
Huber, T.L., Kouskoff, V, Fehiing, H.J., Palis, J., and Keller, G. (2004). Nature 432, 625-630.
Kattman, S.J., Huber, T.L, and Keller, G.M. (2006). Dev. Cell 11, 723-732.
Kaufman, M.H. (1992). The atlas of mouse development, pp. 442. Academic Press, London.
Kelly, R.G., Brown, NA, and Buckingham, M.E. (2001). Dev. GeU 1, 435-440.
Laugwitz, K.-L, Moretti, A., Lam, J., Gruber, P., Chen, Y, Woodard, S., Lin, L-Z., Cai, Q.-L, Lu, MJvl., RettvM., et al. (2005). Nature 433,647-653.
Martin, CM., Meeson, A., Robertson, S.M., Hawke, T.J., Richardson, J.A., Bates, S., Goetsch, S.C., Gallardo, T.D., and Garry, D.J. (2004). Dev. Bid. 265,262-275.
Masino, A.M., Gallardo, T.D., WHcox, CA, Olson, E.N., WHMams, R.S., and Garry, D.J. (2004). Circ. Res. 95,38&-S97.
Meilhac, S.M., Esner, M., Kelly, R.G., Nicolas, J.F., and Buckingham, rvf.E. (2004). Dev. Cell 6,685-698.
Messina, E., De Angelis, L, Frati, G., Morrone, S., Chimenti, S., Fiordal-iso, F, Salio, M., Battagtia, M., Latronico, M.V.G., Cotetta, M., et al. (2004). Circ. Res. 95,911-921.
Moretti, A, Canon, L, Nakano, A, Lam, J.T., Bernshausen, A, Chen, Y, Qyang, Y, Bu, L, Sasaki, M., Yurrfu, S., et al. (2006). Cell, this issue.
Oh, H., Bradfute, S.B., Gallardo, T.D., Nakamura, T., Gaussin, V, Mishina, Y, Pocius, J., Michael, L.H., Behringer, R.R., Garry, D.J., et al. (Ј003), Proc. Natl. Acad. Sci. USA 700,12313-12318.
Schwartz, R.J., and Olson, E.N. (1999). Development 726, 4187^192.
Vogeli, K.M., Jin, S.-W., Martin, G.R., and Stainfer; D.YR. (2006). Nature 443,337-339.
Wu, S.M., Fujiwara, Y, Cibulsky, S.M., Clapham, D.E., Uen, C.-L, Schul-theiss, T.M., and Orkin, S.H. (2006). Cell, this issue.
|