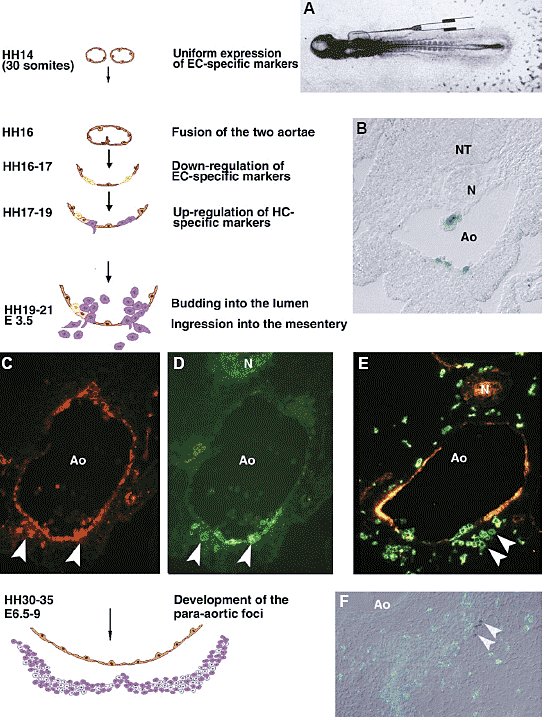
Затем мы использовали два витальных трассера, acetylated Low
Density Lipoprotein (AcLDL), купированный с флюоресцентным липофильным маркером (DiI), и не-репликативные ретровирусные вектора, несущие репортерные гены. Первый осуществлял кратковременную трассировку, тогда как второй позволял таргетинг клеток в течение более длительного времени. Оба вводили с помощью внутри-кардиальной инокуляции (Fig. 1A). Инокуляции осуществляли в начале второго дня инкубации, т.e., за день до
появления первых, ассоциированных с аортой HC. Идентификация клеток достигалась использованием anti-VEGF-R2 (Eichmann et al.,
1997) и anti-CD45 антител (Jeurissen and Janse, 1998) в качестве соотв. EC- и HC-специфических зондов. AcLDL-DiI имеет два основных преимущества: 1° он подвергается эндоцитозу с помощью EC и макрофагов (которые отсутствуют у эмбрионов на этой стадии) посредством специфических рецепторов. 2° Он обладает коротким периодом полу-жизни и быстро исчезает из кровообращения, даже если эндоцитоз не происходит. Спустя два ч. после инокуляции всё сосудистое древо оказывается меченным. Аорта всё ещё парная в это время целиком выстилается LDL
отсутствуют и на уровне аорты и в кровообращении. Спустя 24 ч после инокуляции парная аорта сливается. LDL окраска обнаруживается в EC , но также в аортальных кластерах, которые обнаруживают строгий сигнал LDL (Fig. 1C). Более того, LDL
клетки обнаруживаются в мезенхиме вентральной части аорты (Fig.1 C, D) указывая тем самым, что субнабор HC проникает в эту область (Jaffredo et al., 1998). Т.о., внутри-аортальные кластеры происходят из клеток, локализованных в дне аорты и обладают типичным эндотелиальным фенотипом во время инокуляции, подвергаясь 'transdifferentiation'. Важно, что недавно было продемонстрировано на эмбрионах мышей и людей, что аортальные EC также могут давать HC (de Bruijn et al., 2002, Oberlin et al., 2002).
В противоположность внутри-аортальным кластерам, para-aortic фокусы, развивающиеся в мезенхиме вентральнее аорты и не обнаруживают видимых взаимоотношений с аортальным эндотелием. Экспериментальный анализ показал, что среди этих клеток присутствуют HSC. Имеются ли онтогенетические взаимоотношения между двумя аспектами аортального гематопоэза или они относятся к двум независимым генерациям HSC? Этот вопрос важен, т.к. взрослые, по-видимому, больше не способны к продукции HSC из EC. Др. вопрос, генерируются ли HSC из эндотелия в качестве промежуточных образований во время раннего развития или онит генерируются
из мезенхимы? Чтобы ответить на этот вопрос мы использовали нерепликативные lacZ-несущие ретровирусные вектора, вводимые в кровообращение. Преимущества этой системы двояки: 1° клоны могут быть идентифицированы благодаря интеграции, происходящей только в немногих EC. 2°
репортерный ген стабильно экспрессируется в потомстве инфицированных клеток и помеченные клетки могут отслеживаться в течение длительного периода. Выводы: как и в случае с AcLDL-DiI, ретровирусные вектора метят исключительно EC (Fig. 1B). На ст. E3 меченные клоны, представлены или EC или HC, но никогда не смешаны. Меченные клетки наблюдались проникающими в мезентерий вентральнее дна аорты. На ст. E7, пара-аортальные фокусы содержат многочисленные lacZ
клетки (Fig. 1F) (Jaffredo et al., 2000). Т.о., пара-аортальные фокусы засеваются предшественниками, происходящими из дна аорты на E3, посредством уникального события возникновения HSC из эндотелия аорты.
У эмбрионов мышей AGM регион также является местом, где происходит дефинитивный гематопоэз (Godin and Cumano, 2002, Ling and Dzierzak, 2002). В то же самое время, когда мы продемонстрировали эндотелиальное происхождение внутри-аортальных кластеров у эмбрионов птиц,
Nishikawa and colleagues (1998) показали, что EC, выделенные из эмбрионов мышей на ст. E9.5 на базе экспрессии VE-cadherin, были способны давать кровяные клетки
in vitro. Анализируя AGM, было установлено, что HSC возникают из дорсальной части аорты и окружающих тканей (de Bruijn et al.,
2000). Наконец, используя трансгенных мышей, несущих ген GFP под контролем промотора Ly6-A, было показано, что первые дефинитивные HSC появляются в эндотелиальном слое (de Bruijn et al., 2002). Результаты, полученные на эмбрионах птиц, убедили нас использовать сходный подход отслеживания к эмбрионам мышей. В сотрудничестве с Daisuke
Sugiyama, мы проанализировали продукцию HC эндотелием, ассоциированным с сосудами, во время эмбрионального развития мышей. Как и в эмбрионах птиц, AcLDL-DiI инъецировали внутрь сердца культивируемых эмбрионов. Спустя част после инокуляции DiI окрашивание обнаруживалось по всему эндотелиальному древу. После диссоциации FACS анализ показал, что DiI
+ клетки были CD31
+, CD34
+, но не CD45, антиген характерный для эндотелиального клона. После культивирования клонов эти клетки давали взрослого типа эритроидные колонии, которые обладали цепочками взрослого глобина. Некоторым эмбрионам давали воозможность развиваться дополнительно 12 или 24 ч.Спустя 12 ч после инокуляции 43% DiI
+ циркулирующих клеток принадлежало к дефинитивному эритроидному клону. После ст. 29-сомитов, пропорция DiI
+ эритроидных клеток постепенно снижалась. Эти результаты демонстрируют впервые на эмбрионах мышей генерацию гематопоэтических клеток из эндотелиальных промежуточных образований. Т.о., получены доказательства высвобождения этих клеток в кровообращение и в пользу гипотезы, что они способны колонизировать печень плода и генерировать дефинитивные эритроциты
in vivo (Sugiyama et al., 2003).
Molecular characterisation of the hemangioblast and
the hemogenic endothelium
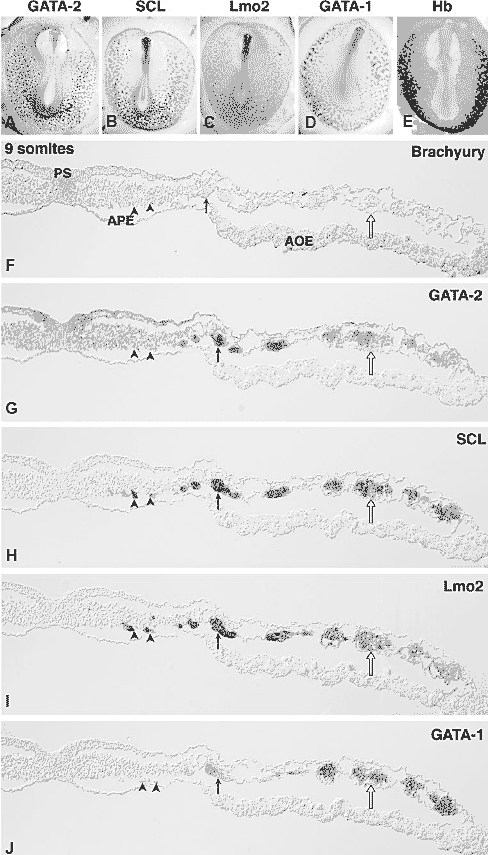
Экспериментальная демонстрация гемогенеза аортальным эндотелием подвигла нас на поиск молекул, специфически экспрессируемых гемангиобластами или гемогенным эндотелием. Используя молекулярные маркеры, некоторые из которых были клонированы нами, мы оказались способны идентифицировать ступени от закладки мезодермы для EC и HC в YS и на уровне аорты при переходе от EC к HC. Кровь-формирующая система, а именно EC и HC, дифференцируются из мезодермы во время процесса гаструляции, т.е. во время проникновения клеток из поверхностного эпибласта. Вне-эмбриональная мезодерма закладывается первой и вносит вклад в Area Opaca (AO), называемая так из-за клеток представляющих энтодермальный слой, гипобласт, которые из-за yolky выглядит непрозрачным (opaque).
Мезодерма, дающая начало BI , как было показано, откладывается на ранних стадиях из клеток, расположенных в задней части первичной полоски
(Schoenwolf et al., 1992). Картирование первичной полоски у эмбрионов мышей привело к сходным заключениям (Kinder et al., 1999). Клетки, отложенные первыми, подвергаются экстенсивной направленной латерально и к голове (cephalwards) миграции и достигают краёв бластодиска, тогда как клетки, проходящие через полоску, непосредственно после этого, оккупируют более медиальные и более каудальные позиции. После этого клетки постепенно заполняют более центральные и более задние позиции, т.к. первичная полоска регрессирует от цефалического к каудальному уровню. Т.о., рано заложенные клетки имеют более длинную историю жизни, чем их непосредственные соседи и подвергаются дифференцировке раньше. Кровяные островки (BI), из которых возникают первые HC дифференцируются из AO мезодермы. BI обычно состоят из наружного слоя EC и сердцевины из HC. BI прогрессивно распространяются на весь YS. Мезодерма, дающая эмбриональную область обозначается как Area Pellucida (AP), т.к. она располагается выше сегментационной полости и выглядит прозрачной. AP генерируется клетками, занимающими наиболее переднюю позицию вдоль первичной полоски
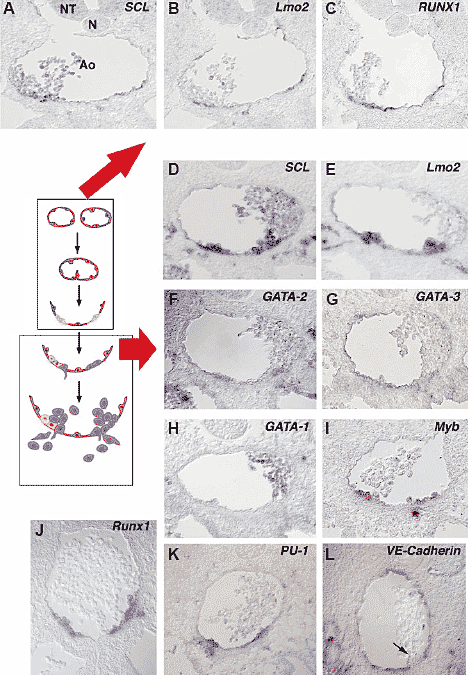 Fig. 3. Gene activity during formation of the intraaortic clusters. The drawing in the left side schematises the different steps in the formation of the clusters. The frames point out the two major aspects of cluster formation: hemogenic endothelium without any morphological sign of hematopoiesis and full cluster formation. (A-C) Beginning of the third day of development when intraaortic clusters have not appeared yet. Adjacent sections. (D-L) Middle of the third day when intraaortic clusters are fully
developed. (A) SCL/Tal-1 is expressed by all aortic EC but appears strengthened in the aortic floor. Note the presence of SCL/Tal-1+ circulating cells. (B) Lmo2 stains all aortic EC. A few circulating cells are Lmo2+. (C) Runx1 expression is restricted to EC of the aortic floor. (D) SCL/Tal-1 is now vividly expressed by the clusters and expressed at low levels by aortic EC. (E) Lmo2 displays a similar signal. In addition
non-aortic EC display a conspicuous Lmo2 expression. Reprinted with permission from Hematopoietic stem cells, Dr. I. Godin and A. Cumano editors; Extra and intraembryonic HSC commitment in the avian
model. Jaffredo T., Bollerot K., Minko K., Gautier R., Romero S and Drevon C. Copyright 2003 with permission from Landes Biosciences.
Fig. 3. Gene activity during formation of the intraaortic clusters. The drawing in the left side schematises the different steps in the formation of the clusters. The frames point out the two major aspects of cluster formation: hemogenic endothelium without any morphological sign of hematopoiesis and full cluster formation. (A-C) Beginning of the third day of development when intraaortic clusters have not appeared yet. Adjacent sections. (D-L) Middle of the third day when intraaortic clusters are fully
developed. (A) SCL/Tal-1 is expressed by all aortic EC but appears strengthened in the aortic floor. Note the presence of SCL/Tal-1+ circulating cells. (B) Lmo2 stains all aortic EC. A few circulating cells are Lmo2+. (C) Runx1 expression is restricted to EC of the aortic floor. (D) SCL/Tal-1 is now vividly expressed by the clusters and expressed at low levels by aortic EC. (E) Lmo2 displays a similar signal. In addition
non-aortic EC display a conspicuous Lmo2 expression. Reprinted with permission from Hematopoietic stem cells, Dr. I. Godin and A. Cumano editors; Extra and intraembryonic HSC commitment in the avian
model. Jaffredo T., Bollerot K., Minko K., Gautier R., Romero S and Drevon C. Copyright 2003 with permission from Landes Biosciences.
(Schoenwolf et al., 1992). В то время, когда BI дифференцируются, AP, из которой развивается собственно эмбрион, не участвует в этой ранней кровь-формирующей фазе, однако она содержит структуры, очень сходные с YS BI (называемыми vascular islands), которые никогда не дают гематопоэз. Кровь-формирующий потенциал этой последней области выявляется два дня позднее, когда область аорты подвергается гематопоэзу. Мы исследовали эти ранние события путем изучения паттернов некоторых молекул, скорее всего участвующих в появлении HC и EC, т.e., Notch и его лиганды и транскрипционные факторы, которые участвуют в мультимерных комплексах:
GATA-1, -2, -3, SCL/Tal-1 и Lmo2, (чьи птичьи ортологи мы клонировали) и
VEGF-R2, регулятор гематопоэтического и эндотелиального предопределения. Передача сигналов Notch является важным эволюционно законсервированным механизмом, как известно, контролирующим выбор судьбы клетками с помощью локальных взаимодействий. Анализировали паттерны экспрессии
Notch-1 и
-2 генов и их лигандов,
Delta-1, Serrate-1 и -2, в раннем бластодиске эмбрионов кур со стадии пред-полоски (pre-streak) до ст. первого сомита.
Delta-1 выявлялся на ст. pre-streak в задней части эмбриона сразу же после Notch-1 в той же самой области стадии инициальной полоски. После чего оба строго экспрессируются в задней части первичной полоски вплоть до HH4.
Notch-2 также обнаруживается на уровне полоски, хотя и на более низких уровнях.
Notch-1 гомогенно экспрессируется клетками эпибласта и мезодермы, проникающими на уровень полоски, тогда как экспрессия
Delta-1 проявляется в виде паттерна "salt and pepper". Активность Notch и Delta не выявляется в кровяных островках YS, указывая тем самым, что клональные ограничения м.
происходить очень рано во время развития (Caprioli et al., 2002). По ходу гаструляции на ст. HH3 and HH4 (соотв. 12-13 ч и 18 ч инкубации)
GATA-2 и VEGF-R2 обнаруживаются как самые ранние во всей ingressing мезодерме. Выявляются два отдельных паттерна; один низкий, ассоциированый с ingressing мезодермой, и др. высокий, специфический, ограниченный мезодермальными клетками, находящимися в непосредственном контакте с энтодермой, хотя морфологическое разделение не видно в мезодермальном компартменте. Мы интерпретировали такой паттерн как раннее событие предетерминации, возникающее в результате взаимодействий энтодерма/мезодерма. С этого момента появляется экспрессия S
CL/Tal-1 и Lmo2 в группах клеток или в одиночных клетках, сходных с гемангиобластами, которые обладают общей экспрессией
GATA-2 и VEGF-R2 с остальной мезодермой. Это сопровождается усилением транскрипции
GATA-2 в гемангиобластных агрегатах (Fig. 2A to J). Экспрессия этих генов преимущественно обнаруживается в клетках, локализованных в вентральном аспекте мезодермы, где сопровождается появлением морфологически самостоятельных структур. На более поздних стадиях эти структуры становятся более заметными, что сопровождается экспрессией
SCL/Tal1, Lmo2 и появлением
GATA-1 (Minko et al., 2003).
Активности генов были также охарактеризованы на уровне аорты. Когда аорты всё ещё парные и не обнаруживается признаков гематопоэза, то аортальные EC экспрессируют молекулы, характерные для эндотелия (поверхностные молекулы VEGFR2, VE-Cadherin и низкие уровни экспрессии транскрипционных факторов Lmo2, SCL/Tal-1). Когда аорты ещё парные или начинают сливаться, то появляется экспрессия Runx1 и GATA-2, тогда как SCL/Tal-1 и Lmo2, усиливают свою активность в вентральных аспектах аорты, сохраняя в то же самое время экспрессию EC-специфических генов (Fig. 3A, B, C). Ступени после слияния были охарактеризованы в отношении утолщений вентральных EC, что сопровождается повышенной экспрессией HC-специфических генов и снижением
EC's (подавляются VEGF-R2, VE-Cadherin усиливаются
Runx1, SCL/Tal-1, Lmo2, GATA-2, GATA-3 ). C этого момента гематопоэтические кластеры становятся видимыми и экспрессии
EC- и HC-специфических генов расходятся (Fig. 3D to L). Runx1,
птичий ортолог которого был клонирован, является единственным геном, чья экспрессия кстати, как известно, ограничена вентральной областью аорты. Этот транскрипционный фактор содержит эволюционно законсервированный ДНК-связывающий домен, названный runt, который также необходим для гетеродимеризации с ко-факторам, наз. CBF. Инактивация этого гена у эмбрионов мышей предваряет появление дефинитивного гематопоэза (Wang et al., 1996). Используя knock in подход, было показано, что Runx1 специфически экспрессируется вентро-латеральными аортальными EC, внутри-аортальными кластерами (North et al., 1999) и тесно ассоциированы с фракцией HSC (North et al., 2002). У эмбрионов птиц Runx1 is экспрессируется уже на ст. E2.5 в EC вентрального дна аорты. Экспрессия начинается, когда аорта ещё парная и сохраняется после слияния сосудов. Во время продукции гематопоэтических кластеров Runx1 оказывается ограниченным HC, отпочковывающимися в просвет и проникающими в мезентерий.
Интересно, что
PU-1, предполагаемый ген-мишень для
Runx1, экспрессируется в предшественниках миэлоидного и лимфоидного ростка и выявляется во внутри-аортальных кластерах (Fig. 3)
.
The allantois: another source for hemangioblasts?
У птиц время появления внутри-аортальных кластеров и пара-аортальный фокусов соответствует засеванию тимуса и сумки Fabricius.
Клетки para-aortic фокусов, как было установлено, обладают B и T
лимфоидным потенциалом. Однако колонизация костного мозга начинается на ст. E10.5 у эмбрионов кур и продолжается вплоть до вылупления. В это время активность para-aortic фокусов затихает. Возможность того, что клетки para-aortic фокусов остаются в недифференцированном состоянии где-то в эмбрионе, маловероятна. Поэтому мы обратили внимание на др. сайт, продуцирующий предшественников, идентифицированный в аллантоисе. Этот орган обладает соответствующим тканевым потенциалом продуцировать гематопоэз, т.е. энтодерму, ассоциированную с мезодермой. Этот придаток, как было показано, участвует в газовом обмене, экскреции продуктов накопления, очистке резорбированного Ca++ и конструкции костей.
Используя India ink или AcLDL-Di микроангиографию мы впервые установили, что аллантоис васкуляризуется между 75-80 ч инкубации. Он обладает настоящими эритроцитами в этом месте, даже еще до периода появления гематопоэза, независимо от остальных частей эмбриона (Caprioli et al., 1998, Caprioli et al., 2001). В аллантоисе действует программа, характеризующаяся выраженной экспрессией некоторых "hemangioblastic" генов в мезодерме, сопровождаемой др. паттерн-формирующими генами, ассоциированными с энтодермой. VEGF-R2, по крайней мере, со ст. HH17 и далее экспрессируется непосредственно вслед за транскрипцией факторов GATA-2, SCL/Tal-1 и GATA-1. Дифференцируются структуры, похожие на кровяные островки, которые содержат как CD45+ клетки, так и клетки, накапливающие гемоглобин; эти структуры выглядят в точности как кровяные островки в желточном мешке. Этот гемопоэтический процесс происходит до установления сосудистой сети, соединяющей аллантоис с эмбрионом. Как только энтодерма вовлекается в процесс, то в этой области обнаруживается мРНК GATA-3, там, где должен дифференцироваться аллантоис ещё до того как posterior instestinal portal станет анатомически различимым. Незадолго до выроста зачатка GATA-2 экспрессируется в энтодерме и в то же время инициируется гемангиобластическая программа в мезодерме. GATA-3 выявляется, по крайней мере, вплоть до E8, а GATA-2 вплоть до E3, самой поздней из исследованных для этого фактора стадии. Используя культуры in vitro, мы показали, что зачаток аллантоиса, выделяемый до установления циркуляции между зачатком и остальной частью эмбриона, продуцирует эритроциты дефинитивного ростка. Более того, используя межвидовые трансплантации между эмбрионами перепела и кур, мы продемонстрировали, что сосудистая сеть аллантоиса развивается из внутренне присущих ему предшественников (Caprioli et al., 2001). Всё это вместе с более ранними находками, указывает на предетерминацию мезодермы в эндотелиальный и гемопоэтический клоны в аллантоисе. Выявление выраженной экспрессии GATA-3, ограниченной энтодермой области пре-аллантоиса и зачатком аллантоиса, сопровождаемое экспрессией GATA-2, является интересной и новой информацией в контексте формирования органа и спецификации энтодермы в возникновении гематопоэтических клеток. Исследования на эмбрионах мышей показали. что плодная часть плаценты, которая происходит из аллантоиса является источником гематопоэтических предшественников
(Dieterlen-Lievre et al., 2005 in this issue).
Сайт создан в системе
uCoz