Понимание молекулярных путей, которые управляют развитием на транскрипционном уровне у высших эукариот, - давно ожидаемая цель, особенно понимание, как это знание может быть применено для хорошо разработанных подходов борьбы с болезнями. С современным выяснением жизненно важной роли гистоновых модификаций в программировании ДНК для транскрипционной регуляции, давно ожидаемая задача стала казаться достижимой.
Эукариотическая геномная ДНК в ядре диаметром свыше 10 microns, упаковано более чем в 10 000 раз с помощью очень basic белков, известных как гистоны. В результате возникает высоко структуированная организация, называемая хроматином. Фундаментальная единица хроматина, нуклеосомная стержневая частица, состоит из 147 п.н. супер-спирализованной ДНК, обернутой в виде 1.75 витков вокруг гистонового стержневого октамера. Центрально расположенный гистоновый (H3/H4)2 тетрамер соединяется с двумя гистоновыми димерами H2A/H2B [1]. Возникающая в результате нуклеосомная нить дает волокно диаметром 11 nm, названное beads-on-a-string, которое может компактизоваться еще больше в 30 nm волокно, по крайней мере, частично за счет инкорпорации линкерного гистона H1 [2,3]. Процесс, ответственный за эту высокого порядка архитектуру всё ещё понят не полностью. В последние два десятилетия было доказано, что хроматин является высоко податливым (flexible) состоянием, там пространственно и во времени скоординированные изменения между транскрипционно репрессированными/структурно конденсированным состоянием и транскрипционно активным/структурно доступным состоянием регулируют экспрессию генов.
Первоначально гистоны рассматривались как в основном структурные компоненты, то теперь выяснена их важная роль в поддержании динамического равновесия хроматина, благодаря которому регуляция генной экспрессии осуществляется на всех стадиях развития многоклеточных организмов. N-концы гистонов (гистоновые хвосты) являются доступными, не структуировнными доменами, которые торчат из нуклеосом. Гистоны, особенно остатки N-концов гистонов H3 и H4 и N- C-концы гистонов H2A, H2B и H1, чувствительны к разнообразным пост-трансляционным модификациям (Figure 1): фосфорилированию (S и T остатков) [4]; ацетилированию (K) [5,6]; метилированию (K and R)[7]; ubiquitination (K) [8]; sumoylation (K) [9]; ADP ribosylation [10]; glycosylation [11]; biotinylation [12], и carbonylation [13]. Хотя первые три типа модификаций были изучены наиболее тщательно [14], довольно мало известно о др. Метилирование гистонов катализируется гистоновыми methyltransferases (HMTs) и существенно отличается от др. типов модификаций. Во-первых, метилирование лизинов гистона, по-видимому, необратимо, по крайней мере, пока гистоновая demethylases ещё не открыта (см. Update). Благодаря этой стабильности, methyl метки представляют собой великолепный эпигенетический механизм стабильного переноса профилей генной экспрессии клеткам потомкам. Во-вторых, HMTs могут быть сгруппированы в два разошедшихся семейства: histone lysine methyltransferases (HKMTs), катализирующих метилирование лизиновых остатков (rev. [15-17]) и protein arginine methyltransferases (PRMTs)[7], катализирующих метилирование аргининовых остатков. (Рис. 1 представляет обновленный список HMTs млекопитающих с их остатками мишенями). В-третьих, метки метилирования гистонов обусловливают несравнимые последствия в отношении экспрессии генов, т.е. активации репрессии. Это контрастирует с acetylation/deacetylation гистоновых хвостов
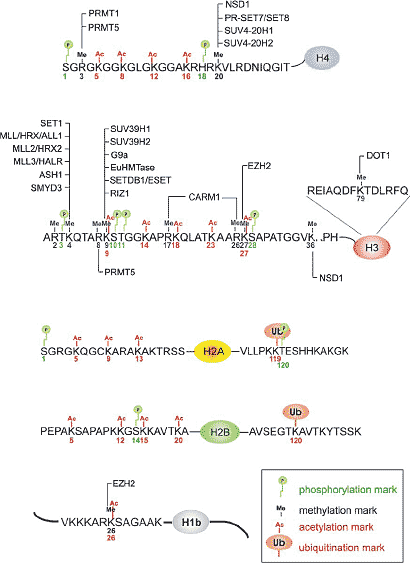 Histones are subjected to a variety of post-translational modifications. The modifications on human histones include acetylation (Ac, red),
methylation (Me, blue), phosphorylation (P, green) and ubiquitination (Ub, brown). The enzymes responsible for methylation of mammalian
histones are listed above or below their target sites. Note that there are several redundant enzymes specific for methylation of histone H3-K4
and H3-K9.
Histones are subjected to a variety of post-translational modifications. The modifications on human histones include acetylation (Ac, red),
methylation (Me, blue), phosphorylation (P, green) and ubiquitination (Ub, brown). The enzymes responsible for methylation of mammalian
histones are listed above or below their target sites. Note that there are several redundant enzymes specific for methylation of histone H3-K4
and H3-K9.
В целом ацетилирование снижает взаимодействия ДНК--нуклеосомы, облегчая транскрипцию, а деацетилирование дает обратный эффект. Недавно это мнение было пересмотрено в свет накопления данных, что гистоновые deacetylases функционируют также в качестве активаторов транскрипции у дрожжей (rev. [18]). Наконец, др. уровень сложности дает ряд метильных групп, которые могут быть инкорпорированы в специфические остатки. Это, в свою очередь, по-видимому, является детерминантом транскрипции. Т.о., ε-amino группа лизинов может быть mono-, di-, или trimethylated, a guanidino-ε-amino группы аргининов могут принимать две метильные группы симметричным или асимметричным образом. Заметим, что аргинины также существуют в ε-N-mono-метилированном состоянии
in vivo [19], но ответственные энзим(ы) и их функции всё ещё не неизвестны. Недавно было сообщено [20,21] о ферментативном deimination аргининовых остатков гистоновых хвостов у H3 и H4 в citrulline с помощью PADI4 - члена семейства peptidyl arginine deiminase protein. Метаболическое превращение свободного аргинина в citrulline было известно уже дано. Эти эксперименты показывают, что эта реакция также происходит с аргининовыми остатками гистонов нуклеосом и что подобное превращение также ассоциирует с биологическими функциями, а именно, с предотвращением метилирования аргинина с помощью PRMTs ис транскрипционной репрессией. Но всё ещё неясно, представляет ли реакция deimination механизм деметилирования аргинина в гистонах, т.к. dimethylated аргининовые остатки не превращаются в citrulline с помощью PADI4
in vitro [21]. Более того, очевидно, что неметилированные и метилированные аргинины гистоновых хвостов deiminated в одинаковой степени
in vivo [20].
Coordinated histone modifications
Специфические гистоновые модификации и их транскрипционные последствия уже рассматривались в обзорах литературы [6,22]. Сегодня очевидно, что определенные комбинации этих модификаций или 'меток' оказывают выраженное влияние на регуляцию транскрипции. Распознавание динамического взаимодействия между модификациями гистонов достигло кульминации в гипотезе 'histone code' [23,24]. Эта гипотеза предполагает, что данная модификация специфического гистонового остатка является детерминантом последующих модификаций того же самого гистона. Более того, индивидуальные типы гистоновых модификаций или их сумма 'считываются' белками, которые модулируют структуру хроматина, а тем самым транскрипцию.
Существование 'гистонового кода' сегодня дискуссионно; однако, недавние находки может быть интерпретированы как подтверждение такого кода. Напр., гипотеза бинарного переключения methyl/phos, как предполагается, оперирует
на гистоновых концах [25]. Эта гипотеза обрисовывает способ, с помощью которого комбинации из разных модификаций могут обходить (circumvent) стабильную methyl-lysine метку, чтобы динамически изменить транскрипционное состояние. В этом случае фосфорилирование S/T остатков по соседству с метильной меткой будет менять последующее рекрутирование связывающих белков. Последующее состояние хроматина, а , следовательно, транскрипция этих 'switch' сайтов, как предполагается, будет зависеть от положения phospho-акцептора относительно метилированного остатка - создавая активационную кассету, если phospho-метка предшествует methyl-метке или кассету замалчивания (silencing), если phospho-метка следует за метилированным остатком.
Рис. 2 иллюстрирует разные предполагаемые 'правила гистонового кода', которые были описаны в др. месте (ссылки на Figure 2). Большинство эти х данных получены в экспериментах in vitro с использованием пептидов гистоновых хвостов или октамеров в качестве субстратов. Необходимо предостеречь, однако, что в некоторых случаях предполагаемое взаимодействие описываемых модификаций возможны благодаря структурным альтерациям в гистоновых хвостах, которые сопровождают инициальную модификацию, тем самым врожденно мешают или облегчают последующие модификации in vitro. Возможные взаимодействия, затрагивающие метилирование H3-K9 и др. модификации, распознаются как важные для рекрутирования heterochromatin protein 1 (HP1), который обеспечивает долговременную репрессию транскрипции. Т.о., др. модификации, которые могут модулировать это следствие, представляют огромный интерес. Одним из первых опубликованных примеров, подтверждающих идею гистонового кода, является предупреждение метилирования H3-K9 с помощью фосфорилирования H3-S10 (Figure 2c) благодаря стерическим помехам. Др. показали, что H3-S10 фосфорилирование облегчает ацетилирование H3-K9 и H3-K14; ингибируя тем самым метилирование H3-K9. Mateescu et al. [26] предоставили in vivo данные, демонстрирующие, что метилирование H3-K9 и фосфорилирование H3-S10 сосуществуют во время ранней фазы G2/M перехода.
По-видимому, не одно фосфорилирование H3-S10, а скорее H3-K14 ацетилирование вместе с фосфорилированием H3-S10, обусловливает диссоциацию HP1 от метилированного H3-K9 [26]. Это создает др. аспект гипотезы бинарного переключения за счет привлечения третьей модификации, чтобы изменить структуру хроматина. Однако, остается продемонстрировать, действительно ли метилирование H3-K9, фосфорилирование H3-S10 и ацетилирование H3-K14 сосуществуют в одном и том же хвосте гистона in vivo. Сложная картина гистонового кода выявляется в исследованиях [27,28] на дрожжах, демонстрирующая, что H2B-K123 ubiquitination предшествует метилированию H3-K4 и H3-K79, модификациям открытого хроматина, а значит активной транскрипции.
Эти эксперименты были подкреплены в исследованиях мутантных линий дрожжей, у которых дикого типа H2B был замещен копией с мутацией в K123. Впечатляюще, потеря H2B-K123 mono-ubiquitination ведет к полной потере метилирования H3-K4 и H3-K79 [28,29], это указывает на то, что K123 mono-ubiquitination является вышестоящей модификацией, необходимой для последующего метилирования на транс хвостах (Figure 2d). Более того, транскрипция специфических генов нуждается в динамических изменениях в уровнях H2B ubiquitination. Инициальное убиквитилирование сопровождается de-ubiquitination посредством активности Ubp8, компонента комплекса SAGA [30]. De-ubiquitination H2BK123 является предварительным условием для метилирования H3-K36 и активации экспрессии гена GAL1 у почкующихся дрожжей и одновременно снижает уровень триметилирования H3-K4. Недавно Ezhkova and Tansey [31] расширили эту находку и продемонстрировали, что метилирование H3-K4 и H3-K79 зависит также от присутствия протеосомной ATPases Rpt4 и Rpt6 у дрожжей. Они предложили модель, согласно которой Rad6 зависимое ubiquitination H2B-K123 сопровождается рекрутированием протеосомных ATPases (не зависящим от протеолитических компонентов протеосом), которое, в свою очередь, изменяет структуру хроматина, чтобы дать возможность HKMTs метилировать H3-K4 и H3-K79. Растет количество доказательств, связывающих компоненты 19S протеосом (APIS complex) с инициацией транскрипции и процессами элонгации [32]. Неожиданно 20S протеолитический субкомплекс был найден в 3'-регионах активных генов в физическом контакте с RNA polII [33], это оказывает выраженное влияние на регуляцию всех ступеней транскрипции.
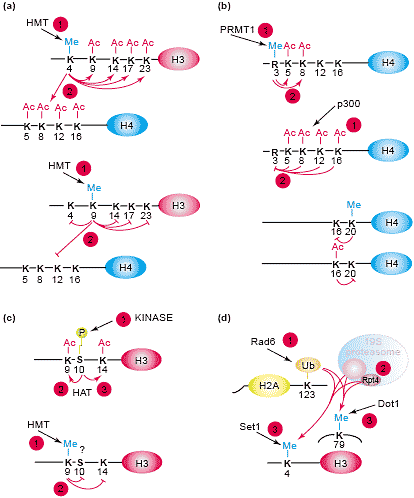 Fig/2 Interplay of different histone modifications. The depiction illustrates examples of 'histone code rules'. (a) H3-K4 methylation by an HKMT
(see Figure 1) facilitates subsequent H3 and H4 acetylation by p300. H3-K9 methylation, however, inhibits acetylation events [96]. (b) H4-R3 methylation by PRMT1 (see Figure 1) is severely impaired by acetylation of H4, whereas H4-K8 and H4-K12 acetylation is elevated after
methylation of R3 [97]. Moreover, H4-K20 methylation and H4-K16 acetylation were found to preclude each other [63]. (c) Phosphorylation of S10 facilitates the sequential acetylation of H3-K9 and acetylation of K14, whereas H3-K9 methylation impairs subsequent S10 phosphorylation [98]. Recently, this view has been challenged by data that show the coexistence of H3-K9 methylation and S10 phosphorylation [26]. (d) In yeast, Rad6-mediated H2B-K123 ubiquitination is required for subsequent H3-K4 and H3-K79 methylation [27]. However, recent experiments [31]
demonstrated that downstream methylation events were also dependent on the presence of Rpt4 and Rpt6 - two subunits of the 19S
proteasome subcomplex.
Fig/2 Interplay of different histone modifications. The depiction illustrates examples of 'histone code rules'. (a) H3-K4 methylation by an HKMT
(see Figure 1) facilitates subsequent H3 and H4 acetylation by p300. H3-K9 methylation, however, inhibits acetylation events [96]. (b) H4-R3 methylation by PRMT1 (see Figure 1) is severely impaired by acetylation of H4, whereas H4-K8 and H4-K12 acetylation is elevated after
methylation of R3 [97]. Moreover, H4-K20 methylation and H4-K16 acetylation were found to preclude each other [63]. (c) Phosphorylation of S10 facilitates the sequential acetylation of H3-K9 and acetylation of K14, whereas H3-K9 methylation impairs subsequent S10 phosphorylation [98]. Recently, this view has been challenged by data that show the coexistence of H3-K9 methylation and S10 phosphorylation [26]. (d) In yeast, Rad6-mediated H2B-K123 ubiquitination is required for subsequent H3-K4 and H3-K79 methylation [27]. However, recent experiments [31]
demonstrated that downstream methylation events were also dependent on the presence of Rpt4 and Rpt6 - two subunits of the 19S
proteasome subcomplex. В заключение, доказано, что разные гистоновые модификации кооперируются, чтобы регулировать биологические процессы. Более того, по-видимому, предписанным образом специфический тип модификации на специфическом остатке гистона м. создавать сигнал для отпечатывания или стирания др. метки или в том же самом хвосте или на соседних хвостах внутри той же самой или соседних нуклеосом. Однако, принимая во внимание ряд неожиданных модификаций гистонов, уже идентифицированных с помощью недавнего mass spectrometric анализа эндогенных стержневых гистонов [34], и наши всё ещё ограниченные знания о сосуществовании различных гистоновых меток в одном хвосте гистона и их модификациях мы далеки еще от полной расшифровки.
Decrypting the histone code
Пригодность и специфичность гистонового кода будут прояснены, когда будет понята координация гистоновых модификаций особенно в контексте их транскрипционных последствий. Два неоценимых инструмента исследования, chromatin immunoprecipitation (ChIP) и immuno-fluorescence (IF), используются для выявления паттернов гистоновых модификаций in vivo. Кроме того, стали возможны исследования по всему геному с использованием микромассивов ДНК. Это уже привело к открытиям, что ацетилирование гистонов и метилирование H3-K4 коррелируют с активацией транскрипции и что деацетилирование гистонов коррелирует во многих случаях с репрессией у дрожжей [35,36]. Более того, H3-K4 trimethylation, как было установлено, ассоциирует с промотором и 5'-кодирующими регионами активных генов у дрожжей и высших эукариот, тогда как H3-K4 dimethylation появляется на активных и неактивных генах дрожжей [37]. Недавно важная информация о статусе гистоновых модификаций получена у высших эукариот в исследованиях у кур и млекопитающих β-globin локуса. Совместно
H3-K4 di/tri-methylation и повышенные уровни H3/H4 acetylation появляются одновременно в онтогенетически активных β-globin генах, но они обнаруживаются также на низких уровня. в неактивных глобиновых генах [38,39]; однако, метилирование H3-K9, H3-K27 и H4-K20 служат признаками состояния конденсированного хроматина (rev. [15]). Специфические HKMTs, перекрывающиеся по своей специфичности, для H3-K9 (see Figure 1), как было показано, управляют переносом разных количеств метильных групп, чтобы маркировать гетерохроматиновые и молчащие эухроматиновые регионы [40]. Пластичность гистоновых меток была подчеркнута в исследованиях с использованием эмбриональных стволовых клеток, происходящих от двойных нулевых мутантных мышей в Suv39h - HKMT, нацеленной на H3-K9.
Дикого типа эмбриональные стволовые клетки обнаруживали сильное увеличение H3-K9 trimethylation и H3-K27 monomethylation в перицентромерном гетерохроматине, тогда как Suv39h двойные нулевые клетки обнаруживали полную потерю перицентрического H3-K9 trimethylation и, неожиданно увеличение уровней H3-K27 trimethylation [41]. Недавно открыты две новые
HKMTs, специфичные для перицентрического H4-K20 trimethylation и было установлено, что способ их действия зависит от активности Suv39h и, следовательно, от триметилирования H3-K9 [42].
Среди подтверждающих доказательств гистонового кода, исследования группы Thanos [43], которые картировали временной паттерн ацетилирования гистонов в промоторе Ifn-β как функцию индукции. Только небольшой субнабор лизинов гистонов H3 и H4 ацетилируется. Так, паттерн последовательных модификаций, связанный с ацетилированием гистонов и фосфорилированием H3-S10, наблюдался вследствие сборки enhanceosome. Это согласуется с последовательным рекрутированием HAT, TFIID (компоненты базовой транскрипционной кухни (machinery)) и SWI/SNF (ATФ-зависимого хроматин ремоделирующего белкового комплекса). Более того, модификации в специфических остатках были обязательным условием для рекрутирования данного фактора. Это исследование. однако, не смогло объяснить эффекты др. модификаций, подобных метилированию гистонов; тем не менее оно показало, что модификация считывается с помощью фактора и что жто предопределяет последовательнрость модификации(й), каждая из которых влияет на экспрессию генов.
Хотя некоторые специфические метки могут влиять на глобальную организацию хроматина, но некоторые индивидуальные ген-специфические модификации не всегда согласуются с моделью универсального гистонового кода. Сообщение о регуляции HSP70 трансгена у Drosophila показывает, что экспрессия гена регулируется исключительно с помощью фосфорилирования H3 и полностью не зависит от H3/H4 acetylation [44]. Кроме того, недавно сообщалось о расхождениях между дрожжами и высшими эукариотами в отношении общего распределения H3-K4 di/trimethylation в активно транскрибируемых генах [36]. Хотя в обоих случаях H3-K4 trimethylation было наиболее выраженным в активных в противоположность неактивным генам, H3-K4 dimethylation локализуется в 5'-nhfycrhbg,bhetvs[ регионах у metazoan, но не во всех транскрибируемых генах, как это у дрожжей. Т.о., роль этой модификации для транскрибирования polymerase может быть не универсальной. Также в этом исследовании неактивные β-globin гены кур, как было установлено, содержат обнаружимые уровни
H3-K4 di/trimethylation.
Влияние гистоновых модификаций на транскрипцию, особенно у высших эукариот, уже начало признаваться. Имеются, однако, некоторые гистоновые модификации, которые, по-видимому, обладают противоречивыми ролями в транскрипции. Примеры включают метилирование H3-K4 и H3-K79 , а также ubiquitination и deubiquitination гистонов, каждое из которых играет роль и в активации и репрессии транскрипции(rev. [45,46]). Более того, роль др. модификаций, таких как sumoylation гистонов, еще не определена. Проверка уровней H2B ubiquitination и H3-K4 methylation по всему геному дрожжей показала, что только 5% нуклеосом ubiquitinated, это д. указывать, что оно несущественно для непосредственного метилирования H3-K4 приблизительно 35%
от всех гистонов, если H2B-K123 ubiquitination д. ему предшествовать [28]. Это расхождение может быть объяснено тем фактом, что de-ubiquitination д. наступать после метилирования H3-K4, чтобы облегчить метилирование H3-K36 и транскрипцию [30]. Кроме того, учитывая количество перекрывающихся HKMTs для метилирования H3-K9 и H3-K4 (Figure 1), необходимы дальнейшие исследования для выяснения их удаленных функций как части кухни модификации гистонов на хромосомном или генном уровне [15]. Важная ступень в направлении выяснения механизмов рекрутирования для этих перекрывающихся HKMTs - это открытие новой HKMT, SMYD3, которая метилирует H3-K4, но также содержит ДНК-связывающий домен. Более того, её HKMT активность увеличивается с помощью HSP90, её экспрессия ткане-специфична и она обнаруживает избыточную экспрессию в опухолевых тканях [47]. Супрессия экспрессии SMYD3 с помощью siRNA оказывает рост ингибирующие эффекты и ведет к повышению апоптоза раковых клеток. Этот энзим комбинирует свойства хроматин модифицирующего фермента и классического транскрипционного фактора. Его участие в канцерогенезе у людей подтверждает, что разные субнаборы генов регулируются разными HKMTs с той же самой специфичностью и что потеря SMYD3 не может быть компенсирована за счёт др. H3-K4 специфичных HKMTs.
Reading the tails
Предложены две модели, чтобы объяснить, как модификации гистонов могут управлять изменениями в хроматине. Накапливаются доказательства, подтверждающие, что обе модели могут одновременно оперировать, чтобы регулировать изменения в структуре хроматина. Одна модель подчеркивает структурную роль модификаций, так, что результирующая плотность зарядов гистоновых хвостов д. влиять на их взаимодействия с ДНК. Т.о., ацетилированные гистоновые хвосты д., как ожидается, способствовать распространению более открытого состояния хроматина. Вторая модель предполагает, что гистоновые модификации могут влиять на транскрипцию, служа в качестве мест распознавания для рекрутирования эффекторных молекул. В соответствии с последней моделью, bromo- и chromodomains, как было продемонстрировано, связывают ацетилированные и метилированные лизиновые остатки, соотв. Модули связывания, однако, имеют высокую специфичность для определенных модифицированных гистоновых остатков; напр., chromodomain в HP1 соединяется исключительно с di/trimethylated H3-K9, а chromodomain polycomb protein (PC) соединяется специфически с trimethylated H3-K27. Модификационные метки были обнаружены в качестве облегчающих или предупреждающих модулей связывания (Figure 3 и [48]) и связывающие модули, как было показано, диссоциируют от гистоновых хвостов после появления в гистонах специфических наборов модификаций [26]. Напр., сродство ко-репрессорного комплекса, INHAT, к хвосту гистона H3 теряется после H3-T3 phosphorylation и H3-K9/K14 acetylation [48], a NuRD комплекс удаляется с хвоста гистона H3 после метилирования H3-K4. Более того, H3-K4 methylation, по-видимому, рекрутирует комплекс, содержащий SNF2H (Figure 3).
Экстраординарным свойством 'readers' такого гистонового кода является их способность распространять биологические сообщения кода. Напр., HP1, связанный с trimethylated H3-K9 , может рекрутировать SUV39H1, который, по-видимому, метилирует хвост H3 соседней нуклеосомы, чтобы обеспечить дальнейшее связывание HP1 в результате чего происходит распространение гетерохроматина. Др. механизм молчания инициируется с помощью EHZ2 (Figure 1), который, как часть комплекса, который модулирует его активность, может trimethylate H3-K27, который, в свою очередь, рекрутирует PC. PC является компонентом polycomb repressive complex 1
(PRC1), который, будучи загруженным на гистоновые концы, блокирует доступ SWI/SNF хроматин ре-моделирующего комплекса к хроматину [49]. Известно, что PC содержит chromodomain и формирует димеры, которые могут соединяться с trimethylated H3-K27 двух соседних нуклеосом, вызывая тем самым более высокую степень компакции, мешая связыванию SWI/SNF. Недавно предложен альтернативный способ действия PRC1 Pirrotta и др. [50]. На промоторе
Drosophila hsp26, PRC1 не предупреждает доступа к базовым
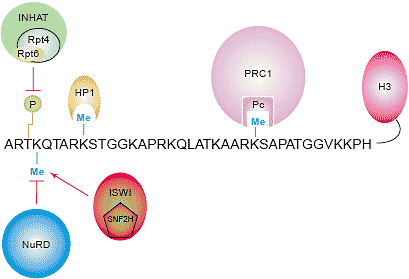 Modified histone residues serve as recognition marks that facilitate or prevent binding of proteins and protein complexes. The depiction shows the amino terminus of histone H3 and its potential binding modules. The chromodomain-containing protein HP1 binds di- and tri-methylated H3-K9 [99] and PC binds di- and tri-methylated H3-K27 [100,101]. In addition, NuRD binding [102] and INHAT binding [48] to H3 are severely impaired by the presence of H3-K4 trimethylation and H3-T3 phosphorylation, respectively. Recently, it was demonstrated that mammalian SNF2H, an ATPase of the ISWI family of chromatin-remodelling enzymes, and its yeast homolog, Isw1p, bind specifically to trimethylated H3-K4 [103].
Modified histone residues serve as recognition marks that facilitate or prevent binding of proteins and protein complexes. The depiction shows the amino terminus of histone H3 and its potential binding modules. The chromodomain-containing protein HP1 binds di- and tri-methylated H3-K9 [99] and PC binds di- and tri-methylated H3-K27 [100,101]. In addition, NuRD binding [102] and INHAT binding [48] to H3 are severely impaired by the presence of H3-K4 trimethylation and H3-T3 phosphorylation, respectively. Recently, it was demonstrated that mammalian SNF2H, an ATPase of the ISWI family of chromatin-remodelling enzymes, and its yeast homolog, Isw1p, bind specifically to trimethylated H3-K4 [103].
транскрипционным факторам, а вместо этого вмешивается в последующие события, которые ведут к инициации транскрипции. Однако, заключение из изучения
hsp26 необходимо интерпретировать с осторожностью, т.к. хитшоковые промоторы у
Drosophila, как известно, обладают устойчивым транскрипционным комплесом в нижестоящем промоторе. Неспособность инициировать транскрипцию в этих исследованиях может быть вызвана неспособностью рекрутирования факторов, необходимых для избегания устойчивой (stalled) РНК полимеразы. Ацетилированные гистоновые остатки, однако, рекрутируют позитивные эффекторы транскрипции, напр., компоненты базовой транскрипционной кухни. Среди bromodomain содержащих белков имеется несколько HATs, таких как p300 и CBP, и хроматин ре-моделирующие факторы, такие как BRG1, которые могут связываться с ацетилированными нуклеосомами [51]или ацетилированными гистоновыми хвостами с высоким сродством [43]. Кроме того, TAF1 (первоначально TAFII250), интегральный компонент metazoan TFIID, как было обнаружено, соединяется с ацетилированными H4 хвостами посредством своего двойного bromodomain модуля [52]. Интересно, что TAF1 комбинирует в себе прирожденную HAT [53], histone H1 ubiquitin-activating/conjugating [54] и
histone phosphorylation [55] активности. Эти уникальные свойства указывают на критическую роль TAF1 в качестве предполагаемого считывателя и писателя в одно и то же время гистоновой модификации. В заключение, все эти данные указывают на то, что инициальное событие ацетилирования ведет к рекрутированию факторов. котрые могут открывать хроматиновую структуру и ограничивать распространение меток ацетилирования ограниченными в пространстве регионами. Однако, учитывая количество мест модификаций и их комбинаторные состояния, большинство хроматин-считывающих модулей ещё не открыто.
Суммируя сегодняшнее понимание модификаций хвостов гистонов, мы теперь сконцентрируемся на роли модификаций хвостов гистонов во время развития.
Coding development: imprinting and X inactivation
Геномный импринтинг является эпигенетическим механизмом ограничения экспрессии генов одним из родительских аллелей, так что возникает разный вклад материнских и отцовских геномов во время развития (см Nusinow and
Panning, this issue).
В случае X chromosome inactivation (XCI) у млекопитающих существует мехзанизм, приводящий к дозовой компенсации, который гарантирует равную экспрессию X-сцепенных генов у XX самок и XY самцов. У эмбрионов XX мышей,
импринтированная инактивация отцовской X хромосомы происходит в клетках вне-эмбрионального клона, тогда как случайная инактивация Х происходит в клетках внутренней клеточной массы, которая и образует собственно эмбрион [56]. Недавние исследования пролили свет на роль гистоноых модификаций на инактивацию отцовской Х хромосомы (XP) у мышей [57,58] и предоставили новую информацию о взаимодействии между разными модуляторами этого феномена (untranslated RNA, histone modification and deposition, DNA methylation), которые приводят к молчанию целой хромсомы с разными уровнями стабильности.
Вплоть до недавнего времени превалировала модель XCI, согласно которой XP инактивируется на стадии бластоциста преимплантационного развития. Однако недавние исследования показали, что инактивация XP происходит раньше [57-59]. Инактивация XP инициируется на 4-8-клеточной стадии [57,58], хотя др. сообщают, что XP наследуется в молчащем или частично молчащем состоянии из зародышевой линии самцов [59]. Независимо от этого расхождения основная роль приписывается не транслируемой РНК (Xist), которая экспрессируется первоначально только с отцовской X хромосомы. Экспрессия отцовской Xist начинается с двух-клеточной стадии и продолжается вплоть до зиготической активации гена и до покрытия XP с помощью Xist РНК, которое может быть выявлено в большинстве бластомеров, начиная с 4-клеточной стадии [59]. Вскоре после этого выявляется hypoacetylation H3-K9 и hypomethylation H3-K4 (Figure 4) [58]. EED (embryonic ectoderment) и EZH2 (enhancer of zeste homolog 2) компоненты PRC комплексов рекрутируются на XP, давая в результате trimethylation H3-K27 Xist-зависимым способом. На ст. бластоциста большинство клеток обладает этой меткой на XP. Одновременно с этими событиями, XP нуклеосомы обнаруживаются обогащенными вариантом гистона macroH2A.1.2 благодаря механизму замещения гистона, начиная со стадии морулы [60]. Dimethylation
H3-K9 на XP, как сообщается, происходит позднее по сравнению с H3-K27. В терминах метилирования ДНК, импринтированная Х инактивация, по-видимому, не нуждается в эжтой метке как для инициации, так и распространения инактивации, т.к. мужской пронуклеус подвергается деметилированию ДНК после оплодотворения, а метилирование de novo стартует примерно во время имплантации [61]. Конечно, сообщалось, что избыточная экспрессия Xist в недифференцированных эмбриональных стволовых клетках ассоциирует не только с H3-K27 trimethylation, но и также с H4-K20 monomethylation [62]. Главным кандидатом, который может быть ответственным за эту последнюю модификацию, является PRSET7 - энзим, который, как мы показали, является H4-K20 специфической histone methyltransferase [63]. Однако, взаимосвязь H4-K20 monomethylation с инактивацией XP и соотв. ролями метилирования H3-K27 и H4-K20 нуждается в дальнейших исследованиях.
Во время импртинтируемой XCI, помимо инактивации X
P, maternal X (X
m) хромосома приобретает резистентность к такой инактивации. Точная природа этой материнской резистентности imprint остается неизвестной, но очевидно, что происходит репрессия материснкой Xist. Интересно, что H3-K9 метилируется в женском пронуклеусе, но не в мужском пронуклеусе у мышей; более того, это различие сохраняется вплоть до поздней 2-клеточной стадии [64]. Материнский импринт на X
m и материнская репрессия
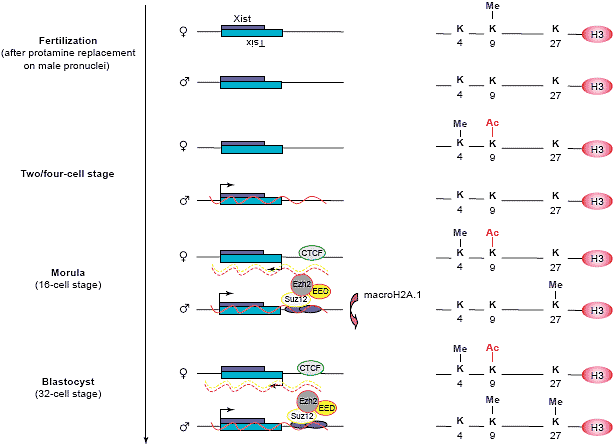 Fig.4. Model showing the establishment of X inactivation in pre-implantation embryos. Initially, only the maternal pronucleus is methylated on H3-K9.
This modification is replaced by active marks (acetylation of H3-K9 and methylation of H3-K4) on Xm whereas, at the same time, XP starts to express Xist RNA (red line). This RNA might be a signal for the recruitment of the PRC complex, which in turn methylates H3-K27. Also, XP has been reported to be enriched in macroH2A.1.2 histone variant through histone replacement mechanisms. Subsequently, H3-K9 is methylated. The recruitment of CTCF at the choice/imprinting center might lead to the expression of Tsix (yellow lane), which inhibits the accumulation of Xist (broken yellow and red lanes) on Xm.
Fig.4. Model showing the establishment of X inactivation in pre-implantation embryos. Initially, only the maternal pronucleus is methylated on H3-K9.
This modification is replaced by active marks (acetylation of H3-K9 and methylation of H3-K4) on Xm whereas, at the same time, XP starts to express Xist RNA (red line). This RNA might be a signal for the recruitment of the PRC complex, which in turn methylates H3-K27. Also, XP has been reported to be enriched in macroH2A.1.2 histone variant through histone replacement mechanisms. Subsequently, H3-K9 is methylated. The recruitment of CTCF at the choice/imprinting center might lead to the expression of Tsix (yellow lane), which inhibits the accumulation of Xist (broken yellow and red lanes) on Xm.
Xist могут, следовательно, осуществляться на уровне метилирования H3-K9. Более того, асимметричное метилирование H3-K9 м. делать различными материнский и отцовский геномы вплоть до действия др. механизмов, таких как отцовская экспрессия Xist (Figure 4). Репрессия Xist может также быть обусловлена и с помощью др. не транслируемой РНК (Tsix), которая транскрибируется как антисмысловая по отношению к Xist на X
m и которая, по-видимому, ингибирует накопление Xist [65]. Интересно, что 5' конец гена Tsix располагается в choice/imprinting центре, который содержит предполагаемые сайты связывания для insulator и транскрипционного фактора CTCF (CCCTC-binding factor), которые могут быть вовлечены в контроль импринтинга [66]. Является или нет эта область ответственной за репрессию экспрессии материнской Xist во время раннего преимплантационного эмбриогенеза (до ст. бластоциста) является вопросом, который ждет разрешения.
Cell identity and differentiation Hox genes
У metazoans качественные особенности закладываются во время развития с помощью экспрессии специфического субнабора генов, включая высоко законсервированные Hox гены. Эти гены организованы в кластеры, в которых физический порядок генов соответствует их временной и пространственной программе экспрессии. Экспрессия Нох генов разрешается в три фазы: инициация, установление и поддержание [67]. Хотя очевидно, что структура хроматина участвует в инициальной активации Hox, контролирующие механизмы изучены плохо [68]. Недавно Chambeyron and Bickmore [69] оценили структурные свойства хроматина, которые приводят к активации транскрипции с двух генов локуса HoxB. Экспрессия гена Hoxb1 коррелирует с активной хроматиновой меткой, такой как ацетилирование H3-K9 или dimethylation H3-K4. Тем не менее, хотя Hoxb9 обладает теми же самыми метками, его экспрессия задерживается [69]. Это очевидное расхождение оказалось возможно примирить, когда авт. исследовали др. феномен - состояние хроматина высокого порядка. Последовательный (successive) паттерн экспрессии генов достигается благодаря образованию петли из последовательностей деконденсированного хроматина из хромосомной территории. Следовательно, в данном случае, хотя гистоновые модификации и могут приводить к транскрипционно уравновешанному состоянию, но временной паттерн экспрессии возникает как следствие прогрессивного выталкивания гена и ре-локализации его в ядре [69]. Конечно же эта гипотеза несколько отличается от той, что предложна для β-globin локуса [70]. В этом случае петлеобразный локус уже готов, но еще не активен в отношении транскрипции. Чёткая транскрипция происходит после активации гена β-globin во время эритроидной дифференцировки клеток, во время которой петлеобразование локуса, как было установлено, редуцировано. Это исследование также показало, что выталкиваемый β-globin локус может быть локализован в компартменте, который является репрессивным для транскрипции, центромерном гетерохроматине, если контролирующий элемент данного локуса замещен таковым для IgH. К сожалению, данное исследование не рассматривало статус гистоновых модификаций и т.о., петлеобразование локусов м. не всегда коррелировать с активной транскрипцией.
Во время позднего развития и взрослого периода экспрессия Hox генов поддерживается с помощью polycomb и trithorax групп белков. Эти белки регулируют активацию или репрессию посредством гистоновых модификаций, блокирования RNA polymerase II и синтеза не кодирующих РНК [71,72].
Lymphocyte maturation
Развитие лимфоцитов нуждается в серии перестроек ДНК из V, D и J сегментов, чтобы собрать T-клеточный рецептор и зрелый иммуноглобулин. Эти перестройки ограничены клеточными клонами и происходят в специфической последовательности. Готовность клеточных линий лимфоцитов подвергаться 'on demand' созреванию и/или блокировать специфические стадии созревания делает эту систему очень привлекательной для изучения роли гистоновых модификаций во время клеточной дифференцировки. V(D)J рекомбинация инициируется с помощью recombinase комплекса, включающего гены, активирующие рекомбинацию, RAG-1 и RAG-2, которые находят рекомбинационные сигнальные последовательности, которые фланкируют генные сегменты. Становится ясным, что структура хроматина является ключевым регулятором рекомбинации благодаря ее способности модулировать доступность RAG к последовательностям рекомбинационного сигнала. Следовательно, области V(D)J локуса, которые доступны для DNA recombinase, содержат di- и tri-methylated H3-K4 [73] и горячие точки H3-K4 dimethylation могут демаркировать активные области [74]. Активные области коррелируют также с гипометилированными и гиперметилировнными H3-K9 [74]. Важность метилирования гистона по H3-K9 для созревания лимфоцитов выявлена с помощью искусственного таргетинга G9a, который dimethylates H3-K9, в мини-локусе T-cell receptor (tcrb). Это ингибирование транскрипции в зародышевой линии и рекомбинации V(D)J [75]. В соответствии с этим недавно установлено, что метилирование H3-K9 предваряет перестройку V-to-DJ тяжелой цепи immunoglobulin [76]. Авт. подтвердили, что эта модификация удаляется во время созревания В клеток посредством механизма замены гистонов и как следствие экспрессия транскрипционного фактора Pax5 [76].
Кстати, G9a, как было установлено, рекрутируется с помощью PRDIBF1
- транскрипционного фактора, необходимого для терминальной дифференцировки зрелых B-лимфоцитов в плазматические клетки [77]. Это указывает на то, что транскрипция и рекомбинация могут регулироваться с помощью общего механизма во время созревания лимфоцитов. Др. сообщения, однако, указывают на то, что эти процессы могут иметь самостоятельные гистоновые метки. Т.о., метилирование H3-K79 присутствует в рекомбинационно активных локусах [78], а фосфорилирование H4-S1, метка активации транскрипции, обнаруживается в V(D)J локусе клеток NIH3T3, в которых не происходят перестройки [74] (Figure 5). Некоторые данные описывают статус H3-K27 в V(D)J локусе, хотя Ezh2, как известно, является критическим для развития В клеток [79]. Т.к. инактивация Ezh2 в В клетках специфически блокирует перестройку VhJ558, то мы можем ожидать, что метилирование H3-K27 не будет распространяться на весь V(D)J локус.
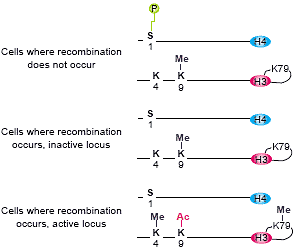 Pattern of modifications associated with the active and inactive
V(D)J locus during lymphocyte maturation. Phosphorylation of H4-S1
has been found in cell lines in which recombination does not occur.
In lymphocyte cells, H3-K9 methylation is replaced by H3-K9
acetylation and methylation of H3-K4 and H3-K79.
Pattern of modifications associated with the active and inactive
V(D)J locus during lymphocyte maturation. Phosphorylation of H4-S1
has been found in cell lines in which recombination does not occur.
In lymphocyte cells, H3-K9 methylation is replaced by H3-K9
acetylation and methylation of H3-K4 and H3-K79.
Поддержание транскрипционного и рекомбинационного молчания в развитии В клеток, по-видимому, связано как с метилированием ДНК, так и гистоновыми модификациями. Метилирование H3-K9 ведет к
de novo метилированию ДНК и к снижению метилирования H3-K4 и ацетилирования H3-K9 [75]. Метилирование ДНК ингибирует рекомбинацию [80] и заметно, даже после потери метилирования ДНК, эта репрессия поддерживается [81]. Интересно, что необратимость транскрипционного молчания во время созревания лимфоцитов совпадает с распространением гистоновых модификаций [82]. Su et al. [82], используя две модели дифференцировки лимфоцитов, сообщили, что необратимость молчания промотора Dntt коррелирует с распространением в обоих направлениях метилирования H3-K9 на всю область промотора в 22 kb [83].
Cancer and epigenetics
Нарушения паттернов экспрессии онтогенетически регулируемых генов являются признаком канцерогенеза. Сюда входит глобальное гипометилирование ДНК. Это сопровождается также гиперметилированием областей, ассоциированных с промоторами (CpG островки) генов супрессоров опухолей. Потеря ацетилирования гистонов и увеличение метилирования гистона H3-K9 наблюдались в сильно метилированных промоторных регионах генов супрессоров опухолей [83]. Кроме того, белки со специфическим methyl-CpG-связывающим доменом, как было установлено, рекрутируют хроматин модифицирующие комплексы с ассоциированной histone deacetylase активностью к сайтам метилирования ДНК de novo [84]. Далее, изменения профилей модификации гистонов генов супрессоров опухолей может также управлять последующим метилированием ДНК [85]. В согласии с этим растут доказательства, подтверждающие, что дисрегуляция паттерна гистоновых модификаций выше или ниже метилирования ДНК может быть критическим событием в развитии рака.
Озлокачествелние гематопоэтической системы часто ассоциирует с хромосомными перестройками, инверсиями и делециями генов, которые вызывают несоответствующую экспрессию белка или синтез новых слитых белков. Напр., смешанные клоны гена leukaemia MLL, члена trxG и позитивного регулятора собранных в кластеры Hox генов, транслоцируются в более чем 50 генов партнеров. Интересно, что MLL обладает H3-K4 HKMT активностью благодаря своему С-терминальному SET домену, который теряется при транслокациях MLL. ChIP данные подтверждают, что уровни метилирования H3-K4 и ацетилирования H3/H4 в промоторе Hox гена и экспрессия Hox гена, были связаны в присутствии MLL и его функционального SET домена [86]. Очевидно, что белки, которые содержат SET домен вовлекаются в канцерогенез, это указывает на то, что чёткая регуляция по всему геному активности HKMT необходима для сохранения нетрансформированного состояния. Кстати, экспрессия EZH2, как было установлено, усиливается на продвинутых стадиях рака простаты и груди [87,88].
 Schematic representation of the factors that interact with modified histones to establish the epigenetic regulation of transcription
through the histone code.
Schematic representation of the factors that interact with modified histones to establish the epigenetic regulation of transcription
through the histone code.
EZH2 участвует, по крайней мере, в двцх комплексах: PRC2 и PRC3, имеющих сходный состав, но дивергентную специфичность к субстрату. Помимо H3-K27, PRC2 может также метилировать H1-K26 [89]. Можно предположить, что усиление активности EZH2 может менять равновесие отдельных PRCs и тем самым менять профили метилирования гистонов и вызывать дисрегуляцию транскрипции [90].
Conclusions
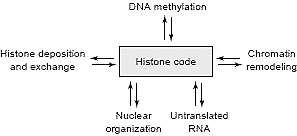
Histone modifications influence chromatin structure in a
combinatorial manner and within the context of other
chromatin modulations like DNA methylation, histone
exchange, histone remodeling and nuclear organization
(see Figure 6). Up until now, most studies have focused
on the modification of a limited number of residues. A
complete understanding of the histone code will, however,
require a comprehensive analysis of histone modifications
at a defined time and in a precise context. We
conclude this review with the vision that the histone code
might be part of a cellular protein code and that such an
epiproteome, together with epigenome and genome,
could be ultimately responsible for the complexity of
mammalian organisms.
Update
Недавно Shi и др. [91] идентифицировали и охарактеризовали первую histone lysine demethylase. Они продемонстрировали, что она является членом семейства polyamine oxidases (LSD1/NPAO/BHC110), которые используют FAD в качестве ко-фактора. Хотя ферментативное demethylation гистонов открыто 30 лет тому назад [92], это исследование показало специфичность деметилирования meH3-K4, метки. ассоциированной с активацией транскрипции. В согласии с этим LSD1/BHC110-катализируемое деметилирование ассоциирует с установлением репрессии. Это подтвердилось, когда авт. наблюдали, что RNAi-обуслоленный нокдаун LSD1/BHC110 увеличивал уровень экспрессии различных генов. Важно, что LSD1/BHC110 способен использовать в качестве субстрата только mono- и di-methylated H3-K4, тогда как три-метилированные лизины остаются неприкасаемыми. Возможно, что tri-methyl группы удаляются др. 'highly regulated' ещё не открытым энзимом. Альтернативно, H3-K4 tri-methylation может быть частью долговременной эпигенетической памяти, тогда как H3-K4 mono- и di-methylation регулируют ступени, необходимые для установления меток с эпигенетическими свойствами.
Недавно было показано, что mono-ubiquitination H2AK119 обеспечивается с помощью PRC1 компонента Ring1b [93].
Затем сообщалось [94,95], что Ring1b и H2A-K119 mono-ubiquitination встречаются с высокой частотой в неактивной Х хромосоме самок. Рекрутирование Ring1b происходит во время инициации как импринтируемой, так случайной инактивации Х хромосом в сочетании с рекрутированием компонентов PRC2 [94,95]. Кстати, в клетках, деплетированных по H2A mono-ubiquitination, не получено доказательств реактивации Х хромосомы [94]. Роль этой метки в инактивации Х остается неясной.
Сайт создан в системе
uCoz 
 Histones are subjected to a variety of post-translational modifications. The modifications on human histones include acetylation (Ac, red),
methylation (Me, blue), phosphorylation (P, green) and ubiquitination (Ub, brown). The enzymes responsible for methylation of mammalian
histones are listed above or below their target sites. Note that there are several redundant enzymes specific for methylation of histone H3-K4
and H3-K9.
Histones are subjected to a variety of post-translational modifications. The modifications on human histones include acetylation (Ac, red),
methylation (Me, blue), phosphorylation (P, green) and ubiquitination (Ub, brown). The enzymes responsible for methylation of mammalian
histones are listed above or below their target sites. Note that there are several redundant enzymes specific for methylation of histone H3-K4
and H3-K9.  Fig/2 Interplay of different histone modifications. The depiction illustrates examples of 'histone code rules'. (a) H3-K4 methylation by an HKMT
(see Figure 1) facilitates subsequent H3 and H4 acetylation by p300. H3-K9 methylation, however, inhibits acetylation events [96]. (b) H4-R3 methylation by PRMT1 (see Figure 1) is severely impaired by acetylation of H4, whereas H4-K8 and H4-K12 acetylation is elevated after
methylation of R3 [97]. Moreover, H4-K20 methylation and H4-K16 acetylation were found to preclude each other [63]. (c) Phosphorylation of S10 facilitates the sequential acetylation of H3-K9 and acetylation of K14, whereas H3-K9 methylation impairs subsequent S10 phosphorylation [98]. Recently, this view has been challenged by data that show the coexistence of H3-K9 methylation and S10 phosphorylation [26]. (d) In yeast, Rad6-mediated H2B-K123 ubiquitination is required for subsequent H3-K4 and H3-K79 methylation [27]. However, recent experiments [31]
demonstrated that downstream methylation events were also dependent on the presence of Rpt4 and Rpt6 - two subunits of the 19S
proteasome subcomplex.
Fig/2 Interplay of different histone modifications. The depiction illustrates examples of 'histone code rules'. (a) H3-K4 methylation by an HKMT
(see Figure 1) facilitates subsequent H3 and H4 acetylation by p300. H3-K9 methylation, however, inhibits acetylation events [96]. (b) H4-R3 methylation by PRMT1 (see Figure 1) is severely impaired by acetylation of H4, whereas H4-K8 and H4-K12 acetylation is elevated after
methylation of R3 [97]. Moreover, H4-K20 methylation and H4-K16 acetylation were found to preclude each other [63]. (c) Phosphorylation of S10 facilitates the sequential acetylation of H3-K9 and acetylation of K14, whereas H3-K9 methylation impairs subsequent S10 phosphorylation [98]. Recently, this view has been challenged by data that show the coexistence of H3-K9 methylation and S10 phosphorylation [26]. (d) In yeast, Rad6-mediated H2B-K123 ubiquitination is required for subsequent H3-K4 and H3-K79 methylation [27]. However, recent experiments [31]
demonstrated that downstream methylation events were also dependent on the presence of Rpt4 and Rpt6 - two subunits of the 19S
proteasome subcomplex. 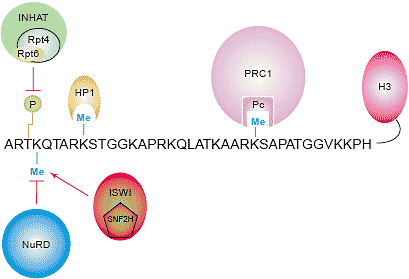 Modified histone residues serve as recognition marks that facilitate or prevent binding of proteins and protein complexes. The depiction shows the amino terminus of histone H3 and its potential binding modules. The chromodomain-containing protein HP1 binds di- and tri-methylated H3-K9 [99] and PC binds di- and tri-methylated H3-K27 [100,101]. In addition, NuRD binding [102] and INHAT binding [48] to H3 are severely impaired by the presence of H3-K4 trimethylation and H3-T3 phosphorylation, respectively. Recently, it was demonstrated that mammalian SNF2H, an ATPase of the ISWI family of chromatin-remodelling enzymes, and its yeast homolog, Isw1p, bind specifically to trimethylated H3-K4 [103].
Modified histone residues serve as recognition marks that facilitate or prevent binding of proteins and protein complexes. The depiction shows the amino terminus of histone H3 and its potential binding modules. The chromodomain-containing protein HP1 binds di- and tri-methylated H3-K9 [99] and PC binds di- and tri-methylated H3-K27 [100,101]. In addition, NuRD binding [102] and INHAT binding [48] to H3 are severely impaired by the presence of H3-K4 trimethylation and H3-T3 phosphorylation, respectively. Recently, it was demonstrated that mammalian SNF2H, an ATPase of the ISWI family of chromatin-remodelling enzymes, and its yeast homolog, Isw1p, bind specifically to trimethylated H3-K4 [103]. 
 Pattern of modifications associated with the active and inactive
V(D)J locus during lymphocyte maturation. Phosphorylation of H4-S1
has been found in cell lines in which recombination does not occur.
In lymphocyte cells, H3-K9 methylation is replaced by H3-K9
acetylation and methylation of H3-K4 and H3-K79.
Pattern of modifications associated with the active and inactive
V(D)J locus during lymphocyte maturation. Phosphorylation of H4-S1
has been found in cell lines in which recombination does not occur.
In lymphocyte cells, H3-K9 methylation is replaced by H3-K9
acetylation and methylation of H3-K4 and H3-K79.  Schematic representation of the factors that interact with modified histones to establish the epigenetic regulation of transcription
through the histone code.
Schematic representation of the factors that interact with modified histones to establish the epigenetic regulation of transcription
through the histone code.