Microtubule Capture: A Concerted Effort | |
|
Литература |
Правильное расхождение хромосом является критическим для предупреждения анеуплоидии. Расхождение хромосом зависит от взаимодействия между хромосомами и микротрубочками веретена, динамическими полимерами из повторяющихся α/β tubulin димеров. Микротрубочки обладают прирожденной полярностью: их минус концы всегда проксимальные по отношению к полюсам веретена, а их динамические плюс концы являются дистальными по отношению к полюсам веретена и взаимодействуют с хромосомами. Соединения между микротрубочками и хромосомами обеспечиваются кинетохорами, мультипротеиновыми комплексами, которые собираются на центромерной ДНК (rev. Cleveland et al., 2003). Предварительным условием для начала анафазы является то, что каждая пара реплицированных сестринских кинетохор оказываться ориентированной в разных направлениях, т.е. прикрепляются к микроторубочкам, исходящим из противоположных полюсов веретена. Однако, этот процесс биориентации склонен к ошибкам и часто приводит к несоотв. взаимодействиям кинетохор-микротрубочки, это д.б. выявлено и удалено.
Несмотря на идентификацию более чем 60 кинетохорных белков, специфические компоненты кинетохор, которые непосредственно обеспечивают прикрепление микротрубочек и молекулярный механизм, с помощью которого клетки определяют и корректируют неправильные взаимодействия кинетохор с микротрубочками, остаются неизвестными. Три недавних исследования (Cheesemen et al., 2006; DeLuca et al., 2006; Sandall et al., 2006) пролили свет на эти вопросы. The Regulation of Chromosome Attachment to Microtubules Dj время каждого клеточного цикла могут возникать разнообразные не корректные конфигурации кинетохора-микротрубочка. Monotelic прикрепления возникают, когда только одна сестринская кинетохора соединяется с микротрубочками, syntelic прикрепления возникают, когда обе сестринские кинетохоры присоединяются к микротрубочкам от одного и того же полюса и merotelic прикрепления возникают, когда одна или обе сестринские кинетохоры соединяются с микротрубочками от обоих полюсов. Хотя monotelic прикрепления могут быть обнаружены благодаря отсутствию микротрубочек, связывающих одну из кинетохор, syntelic и merotelic прикрепления являются интригующей проблемой, т.к. они не могут быть определены на базе простого присутствия или отсутствия связывающих микротрубочек. Ранее было установлено наличие механического натяжения как ключевого сигнала, используемого клеткой для отслеживания соединений микротрубочек с кинетохорами (rev. Pinsky и Biggins, 2005). Сестринские кинетохоры испытывают натяжение, когда они биорентированы, т.к. растаскивающие силы, обеспечиваемые микротрубочками от противоположных полюсов, направлены в противоположные стороны и от соединения между сестринскими хроматидами. Соединения кинетохор с микротрубочками, которые генерируют нормальное натяжение, избирательно стабилизируются, в то время как те, что нескособны генерировать соотв. уровень натяжения, становятся нестабильными.
Кстати, идентифицирован единственный белок, который, по-видимому, выявляет неправильные соединения на базе натяжения на кинетохоры, это Ipl1/Aurora B протеин киназа. Aurora B формирует комплекс, наз. комплексом хромосомных пассажиров, который содержит inner centromere protein (INCENP), Survivin, Dasra B/Borealin/Csc1 и Dasra A (rev. Vagnarelli, Earnshaw, 2004). Более того, INCENP является белком активатором киназной активности Aurora В. Исследования на почкующихся дрожжах и культурах клеток показали, что Aurora В специфически дестабилизирует кинетохорные микротрубочки, которые прикреплены syntelically или merotically (Pinsky, Biggins, 2005). What is the Core Microtubule Attachment Site at the Kinetochre? Хотя потеря функции многих кинетохорных белков ведет к дефектам связывания микротрубочек, трудно непосредственно указать на какой-либо из этих факторов, как обеспечивающий стержень прикрепления к кинетохоре. Было ясно показано, что хотя большинство мутантных кинетохор содержат хромосомы, которые не прикреплены к микротрубочкам, но это кажется вторичным следствием механизма коррекции с помощью Ipl1/Aurora киназы, который дестабилизирует дефектные прикрепления микротрубочек (Dewar et al., 2004; Lampson, Kapoor, 2005; Pinsky et al., 2006). Неправильное прикрепление микротрубочек, следовательно, происходит у большинства кинетохорных мутантов, у которых отсутствует активность Aurira В. Это указывает на то, что ни один из протестированных белков не является необходимым для связывания микротрубочек или что имеются множественные компоненты, связывающие микротрубочки, на кинетохорах.
Законсервированный Твс80 комплекс является прекрасным кандидатом на роль стержневого в присоединении микротрубочек, т.к. он локализован на наружной пластинке кинетохор позвоночных, области кинетохор, где заканчиваются плюс концы микротрубочек (DeLuca et al., 2005). De Luca et al., (2006) анализировали роль комплекса Ndc80/Hec1 в прикреплении микротрубочек. В противоположность к истощению Ndc80 с помощью siRNA, которое делает нестабильными взаимодействия кинетохор с микротрубочками, было установлено, что микроинъекции антител, которые специфически блокируют N-терминальный глобулярный домен Ndc80 в митотических PtK1 клетках, ведут к крепким соединениям кинетохор с микротрубочками. Однако, обнаруживается достоверное увеличение merotelic прикреплений, фенотипически напоминающих подавление Aurora В. Кроме того, пары кинетохор в клетках, которым инъецировали антитела, неспособны обнаруживать нормальные осциллирующие движения, указывающие на то, что динамика плюс концов микротрубочек нарушена. Т.к. Aurora В, скорее всего, высвобождает микротрубочки благодаря фосфорилированию одного или нескольких стержневых микротрубочки связывающих компонентов кинетохор, то неспособность фосфорилироваться с помощью Aurora В д. приводить к стабильным. но неправильным взаимодействиям микротрубочек с кинетохорами. Фенотипы. продуцируемые антителами привели авт. к предположению, что N концы Ndc80 содержат ключевой сайт для фосфорилирования с помощью Aurora В, что вызывает отсоединение микротрубочек, если они фосфорилированы. Путем блокирования доступа к этим сайтам фосфорилирования, антитела д. приводить к аберрантным присоединениям. В соответствии с этим они установили, что Aurora В фосфорилирует N конец Ndc80 in vitro , а элиминация этого сайта приводит к дефектам выравнивания хромосом и к увеличению merotelic прикреплений. Авт. предположили, что Ndc80 связывает кинетохоры с микротрубочками непосредственно или посредством др. фактора. В ответ на неправильное прикрепление Aurora В фосфорилирует или Ndc80 или др. фактор и это д. редуцировать их сродство к связыванию микротрубочек и тем самым вызывать отсоединение микротрубочек от кинетохоры.
Можно предположить, что Ndc80 комплекс может быть стержневым компонентом кинетохор связывания микротрубочек. В этом случае клетки, лишенные Ndc80 д. иметь неприкрепленные кинетохоры даже в отсутствие активности Aurora В. Однако, когда Aurora В нарушена в мутантных ndc80 клетках почкующихся дрожжей, то дефектные кинетохоры способны соединяться с микротрубочками слабо (Pinsky et al., 2006). Следовательно, дополнительные факторы действуют параллельно с Ndc80, чтобы обеспечивает присоединение микротрубочек.
Др. группа исследователей идентифицировала дополнительную связывающую микротрубочки активность. Chessman et al. (2004: 2006) анализировали биохимические свойства у С. elegans KMN сеть, которая содержит KNL-1, Mis12 комплекс и Ndc80 комплекс и которая необходима для нормальной функции кинетохор. Используя элегантный подход, ранее использованный для восстановления комплекса DAM1/DASH у почкующихся дрожжей, и продемонстрировали, что он формирует кольца вокруг микротрубочек (Miranda et al., 2005; Westerman et al., 2005), авт. успешно реконструировали каждый субкомплекс у бактерий путем ко-экспрессии открытой рамки считывания каждого из комплексов из индивидуальных плазмид (Tan, 2001). Используя гель фильтрацию авт. показали, что комплекс Ndc80 взаимодействует не независимо с KNL-1 или Mis12 комплексом и что KMN сеть может быть полностью восстановлена, когда присутствуют все три составляющие. Затем были проанализированы связывающие микротрубочки активности внутри KMN сети. Хотя Mis12 комплекс не взаимодействует с микротрубочками, KNL-1 и Ndc80 субкомплексы связывают микротрубочки независимо. Однако, тщательные измерения связывающей способности показали, что эти взаимодействия были очень слабыми. Следовательно, восстановленный комплекс KMN вызывает синергичное увеличение способности сети связывать микротрубочки. Chessmam et al. (2006) предположили, что интерфейс между кинетохорами и микротрубочками скорее всего состоит из набора сайтов с низким сродством связывания, которые и представляют KMN и др. факторов, которые кооперируются, чтобы создать динамический интерфейс кинетохора-веретено (Рис. 1). В соответствии с этим, авт. осуществили ультраструктурный анализ очищенного Ndc80 комплекса и установили, что он присоединяется вдоль длины пространственной решетки микротрубочки под специфическим углом. Соединение Ndc80 с решеткой может облегчать залавливание микротрубочки благодаря обеспечению большей площади поверхности по сравнению с плюс концом микротрубочки, а также благодаря обеспечению аккомодации динамического роста и сжатию плюс концов. Кроме того, если Ncd80 соединяется с микротрубочками сходным образом и in vivo , то др. факторы смогут легко соединяться с плюс концами микротрубочек и приводить к синергичному усилению способности кинетохор связывать микротрубочки (Рис. 1).
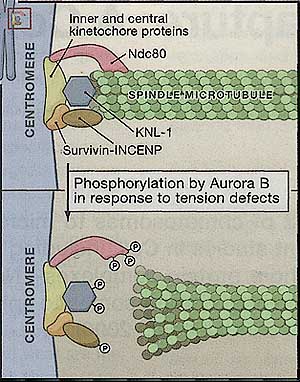 Figure 1. Kinetochore Attachment to Microtubules and Its Regulation by Aurora B
The kinetochore—a proteinaceous structure that forms on centromeric DNA—is composed of multiple low-affinity microtubule-binding components. Although the Ndc80 complex binds to the microtubule lattice, other components may bind to the microtubule plus end. In response to tension defects, Aurora B phos-phorylates the microtubule-binding proteins to decrease the affinity of these factors for microtubules. In turn, this leads to detachment of microtubules from kinetochores. Factors such as INCENP-Survivin may perform multiple functions at the kinetochore. In addition to serving as tension sensors that are regulated by Aurora B, these molecules may also promote core microtubule-binding activity. Figure 1. Kinetochore Attachment to Microtubules and Its Regulation by Aurora B
The kinetochore—a proteinaceous structure that forms on centromeric DNA—is composed of multiple low-affinity microtubule-binding components. Although the Ndc80 complex binds to the microtubule lattice, other components may bind to the microtubule plus end. In response to tension defects, Aurora B phos-phorylates the microtubule-binding proteins to decrease the affinity of these factors for microtubules. In turn, this leads to detachment of microtubules from kinetochores. Factors such as INCENP-Survivin may perform multiple functions at the kinetochore. In addition to serving as tension sensors that are regulated by Aurora B, these molecules may also promote core microtubule-binding activity. Чтобы определить, может ли связывающая микротрубочки активность KMN быть объектом для регуляции с помощью Aurora В, исследователи анализировали фосфорилирование Ndc80 с помощью гомолога Aurora В почкующихся дрожжей, Ipl1. В соответствии с находкой LeLuca et al., (2006) N конец Ndc80 фосфорилировали in vitro с помощью Ipl1. Добавление Ipl1 и АТФ ингибировало микротрубочки-связывающую активность Ndc80 комплекса, это предоставило первое механистическое указание на то. как Ipl1-зависимое фосфорилирование может приводить к высвобождению микротрубочек из соединения. Хотя Ndc80 комплекс, по-видимому, является ключевой мишенью для Aurora В, но неизвестно, законсервировано ли фосфорилирование Ndc80 с помощью Aurora В. Ни одна из групп не продемонстрировала, что в Ndc80 действительно сайты связывания Aurora В фосфорилируются in vivo How Do Cells Detect Inappropriate Attachments? Хотя Aurora В может определять прикрепления микротрубочек, которые не находятся под натяжением, каков молекулярный механизм, с помощью которого несоотв. прикрепления выявляются? В 125 п.н. сиквенс-специфическая точечная центромера (CEN DNA) почкующихся дрожжей стала инструментом анализа функции кинетохор на молекулярном уровне. Sorger et al (1994) попытались реконструировать кинетохоры in vitro ? используя флюоресцентные кусочки, соединенные с CEN DNA, и нашли, что кусочки связываются с иммобилизированными микротрубочками, когда инкубируются в экстракте дрожжевых клеток. Эта связывающая микротрубочки активность нуждается в CBF3 комплексе, который непосредственно связывается с CEN дрожжей. Однако, CBF3 недостаточен для обеспечения связывания микротрубочек, значит необходимы дополнительные факторы для взаимодействий CEN DNA с микротрубочками. Связывающая микротрубочки активность в этом случая была также объектом для регуляции с помощью Ipl1 и противостоящей ей фосфатазы, Glc7 (Biggins et al., 1999; Sassoon et al., 1999). Когда добавляли АТФ к экстрактам дикого типа, то микротрубочки оказывались неспособными соединяться с CEN DNA. Однако, добавление АТФ не влияло на связывание микротрубочек, если CEN DNA инкубировалась в ipl1 мутантных экстрактах, указывая тем самым, что активность Ipl1 киназы предупреждает соединение микротрубочек с CEN DNA.
Sandall et al., (2006) описывают идентификацию дополнительных факторов, которые делают возможным связывание CBF3-связанной CEN ДНК с микротрубочками in vitro . Авт. подвергли дрожжевые экстракты трех-ступенчатой очистке для идентификации фракций, которые могут обеспечивать связывание микротрубочек с CBF3-связанной CEN ДНК . Когда они проанализировали комплементирующие активности с помощью масс-спектрометрии, то только один белок присутствовал, который как известно функционирует в кинетохорах, Bir1, дрожжевой гомолог Survivin. Bir1 взаимодействует с Sli15, гомологом INCEP почкующихся дрожжей, и CBF3 компонентом Ndc10 in vivo (Cheeseman et al., 2002; Yoon, Carbon, 1999). Экстракты, лишенные или Bir1 или Sli15 не способны обеспечивать связывание микротрубочек, указывая тем самым, что Bir1/Sli15 комплекс формирует связь между CBF3 и микротрубочками, чтобы обеспечить стержневую связывающую микротрубочки активность у почкующихся дрожжей.
Когда Sandall et al. (2006) исследовали фенотипы sli15 мутаций, которые дефектны по связыванию микротрубочек с CBF3-связанной CEN ДНК in vitro, то они не наблюдали не прикрепленных кинетохор in vivo . Вместо этого клетки, содержащие syntelic прикрепления, имели фенотип сходный с таковым мутантов Ipl1. Это устраняет возможность того, что Sli15 и Bir1 являются единственными стержневыми компонентами кинетохор для связывания микротрубочек и указывает на то, что связывающая микротрубочки активность в подходе с кусочками отражает роль комплекса хромосомных пассажиров, и комплексов CBF3 в восприятии натяжения, что согласуется с предыдущими исследованиями, показавшими, что компонент комплекса CBF3 необходим для мониторинга натяжения (Kitagawa et al., 2003). Sendall et al. (2006) предположили поэтому. что Bir1/Sli15 формирует сцепление между центромерами и микротрубочками посредством CBF3, что делает возможным активирование Ipl1 посредством Sli15 в отсутствие натяжения. Когда кинетохоры не находятся под натяжением, то активированный Ipl1 l/ фосфорилировать компоненты обоих machinery как стержневого прикрепления, так и регистрации натяжения, чтобы высвободить микротрубочки из кинетохор. Как только будет достигнута биоринтация, то изменения в CBF3-Bir1-Sli15 тройном комплексе не будут больше активировать Ipl1 и в результате будет стабилизировано биполярное прикрепление. Нужно помнить, что Ndc80 не нужен для связывания микротрубочек в CBF3-bead подходе, Более того, CBF3-bead подход не содержит центромерного хроматина, критического детерминанта функции кинетохор in vivo . В дальнейшем важно понять, как натяжение транслируется в сигналы, которые могут передаваться регуляторными молекулами, подобными Ipl1, к их нижестоящим мишеням. Future Directions Although it is critical that Aurora B be activated in response
to tension defects, it is equally important that Aurora B activity be turned off when biorientation is established. However, because all chromosomes in the cell do not achieve bioriented attachments simultaneously, the regulation of Aurora B activity likely occurs at the level of individual kinetochores. The model proposed by Sandall et al. (2006) provides an elegant explanation for how Aurora B activity could be spatially regulated on individual kinetochores. A further mechanistic understanding of the regulation of Aurora B by tension will require the analysis of CBF3, Bir1, SI/15, and Ipl1 interactions at single molecule resolution as well as the identification of the Ipl1 -responsive phosphorylation sites in this purified system.
It will also be important to determine the number of different microtubule-binding activities that exist at the kinetochore. A number of motor- and microtubule-asso-ciated proteins localize to the kinetochore and may also contribute to the core binding activity. For example, the Bir1/Sli15 complex may actually have two roles: one in tension sensing via regulation of Ipl1, and one in core microtubule binding that does not require Ipl1 (Figure 1). The CEN DNA bead assay may have distinguished between these activities in vitro because a lack of Bir1 or Sli15 would not be able to mediate microtubule binding in the absence of the other low-affinity microtubule-binding sites. However, because Bir1/Sli15 is essential for Ipl1 activity, mutations in Bir1 or Sli15 would result in low Ipl1 activity in vivo leading to microtubule binding via the other low-affinity binding sites at the kinetochore. This could be easily addressed by testing whether core binding activity is abolished in a sli15 ndc80 double mutant in the absence of Ipl1 activity in vivo, as well as determining whether the addition of Bir1/Sli15 further enhances the microtubule-binding activity of the KMN network in vitro. In addition, it will be important to test whether there are additional regulatory mechanisms like Aurora B that destabilize inappropriate attachments, or whether Aurora B alone regulates all of the microtubule-binding proteins at the kinetochore. The gold standard will be to determine whether the loss-of-function phenotypes of the potential microtubule-binding activities individually and in combination, particularly in the absence of regulatory factors like Aurora B, result in unattached kinetochores. Finally, the tension-sensing and core microtubule-binding activities will need to be fuWy reconstituted in vitro to elucidate the microtubule-binding interface and its regulation by Aurora B and other proteins. |