Cellular and molecular control of neurogenesis in the mammalian telencephalonПеревод И.Г. Лильп (lilp@mail.ru) | |
| Конечный мозг млекопитающих обнаруживает удивительное разнообразие типов нейронов. Появление этого разнообразия базируется на множественных стратегиях развития, включающих региональное паттернирование предшественников, их временн’ую спецификацию и образовании промежуточных популяций клеток-предшественников. В настоящее время достигнут определенный прогресс в понимании некоторых механизмов такого разнообразия. В частности было показано, что промежуточные предшественники играют важную роль в генерировании нейронов в коре мозга, а с помощью элегантных методов timelapse микроскопии исследованы свойства и взаимосвязи между клетками радиальной глии и их промежуточными предшественниками. Множество путей контролирует преобразование нейральных предшественников из мультипотентных стволовых клеток в промежуточные предшественники, постмитотические предшественники и конечные зрелые нейроны. Достигнут значительный прогресс и в понимании регуляции двух важных этапов – commitment («фиксации») нейронов и детерминация идентичности их подтипов. Эти два этапа четко различимы, но согласованно регулируются общими транскрипционными факторами, такими как нейрогенины (neurogenin) и Pax6. По мере улучшения наших знаний о механизмах спецификации нейронов конечного мозга, появится возможность внедрять стволовые клетки в генерирующие особые популяции нейронов конечного мозга, что открывает путь для эффективной заместительной клеточной терапии.
|
Конечный мозг млекопитающих в течение долгого времени является моделью для исследования механизмов, лежащих в основе образования новых нейронов и клеток глии у эмбрионов позвоночных. Многое из того, что сейчас известно о природе и свойствах нейрональных предшественников является результатом ранних исследований, проводимых на коре мозга эмбрионов грызунов. Были охарактеризованы родоначальники нервных клеток in vivo и in vitro (1). Совсем недавно были идентифицированы молекулы, регулирующие важные этапы нейрального развития, включая молекулы определяющие принадлежность стволовых клеток к нейрональным и глиальным предшественникам (2), спецификацию нейрональных подтипов и миграцию нейронов (4,5) и снова благодаря исследованиям с использованием конечного мозга в качестве модели. Цель данного обзора – это иллюстрация того, что конечный мозг остается лучшей моделью для исследования клеточных и молекулярных механизмов, лежащих в основе нейрогенеза позвоночных. 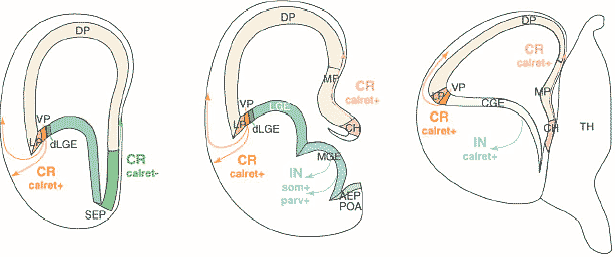 Fig.1. Progenitors in the embryonic telencephalon are organized in distinct domains that generate defined neuronal subtypes. This figure represents frontal sections through the mouse embryonic telencephalon at three rostral–caudal levels (rostral to caudal sections are shown from left to right). The dorsal telencephalon includes the choroids plexus (cpe), the cortical heme (ch), medial pallium (mp), dorsal pallium (dp), lateral pallium (lp) and ventral pallium (vp), while the ventral telencephalon includes the dorsal lateral ganglionic eminence (dlge), ventral lateral ganglionic eminence (vlge), medial ganglionic eminence (mge), septum (sep), and caudally, the caudal ganglionic eminence (cge). Distinct populations of Cajal–Retzius cells (CR; calret+ denotes the presence of caretinin) [20,21] and of cortical interneurons (IN; som+, parv+ and calret+ denote the presence of somatostatin, parvalbumin and calretinin, respectively) [18] have been shown to originate from some of these domains. Their migration directions are indicated by arrows. Конечный мозг, включающий кору и базальные ганглии, обеспечивает координацию движений, эмоции, когнитивные способности и сознание у человека. Это наиболее сложно устроенная область мозга у взрослых млекопитающих, хотя она относительно проста у эмбриона, у которого она состоит из крупных и просто идентифицируемых участков, каждый из которых содержит легко различимые клеточные популяции (РИС.1). Два основных подотдела конечного мозга – это дорсальный конечный мозг (pallium) и вентральный конечный мозг (subpallium) – производят совершенно разные типы нейронов. Герминальная зона дорсального конечного мозга дает начало возбуждающим глутаматергическим проекционным нейронам, последовательно достигающим различных слоев коры через радиальную миграцию. Родоначальники вентрального конечного мозга генерируют GABA-ергические ингибиторные нейроны, включая нейроны базальных ганглиев, а также интернейроны, мигрирующие тангенциально и способствующие формированию коры. Кроме описанных региональных различий, каждый из этих участков конечного мозга дает начало огромному разнообразию нейрональных подтипов. Например, как кортикальные проекционные нейроны, так и интернейроны значительно отличаются по своим молекулярным профилям, морфологии, способности к взаимодействию и физиологическим свойствам (6,7). Появление такого разнообразия клеток в нервной системе обусловлено множеством механизмов развития, включая переднее-заднее и дорсо-антральное паттернирование, временну’ю спецификацию и появление вторичных или промежуточных популяций клеток-предшественников. Все эти механизмы изучаются особенно активно на модели конечного мозга. Некоторые из этих исследований обсуждаются в данном обзоре. Обзор состоит из двух частей. В первой части обсуждаются клеточные аспекты нейрогенеза, разные типы предшественников нейронов, их свойства и взаимосвязи. Во второй части обсуждаются некоторые молекулы, регулирующие ключевые этапы нейрогенеза конечного мозга. Авторы не обсуждают нейрогенез во взрослом мозге, т.к. об этом можно прочесть в недавно вышедшем обзоре Tramontin с соавт (8). Клетки предшественники в конечном мозгеТри отличающихся друг от друга популяции клеток генерируют нейроны и клетки глии в эмбриональном конечном мозге (РИС.2). Нейроэпителиальные клетки, формирующие стенку нервной трубки в начале нейрогенеза, дают начало самым ранним нейронам коры и двум другим популяциям предшественников – клеткам радиальной глии и базальным предшественникам (basal progenitors). Клетки радиальной глии подобно нейроэпителиальным клеткам, достигают внутренней (вентрикулярной) и наружной (относящейся к мягкой мозговой оболочке – pial) поверхности нервной трубки и делятся у вентрикулярной поверхности, однако они отличаются по экспрессии глиоспецифических маркеров (9). В дорсальном конечном мозге клетки радиальной глии появляются вскоре после начала нейрогенеза (Е12-Е13 у мышей). Исследования по картированию судьбы клеток показало, что клетки радиальной глии дают начало прямо или через образование базальных предшественников проекционным нейронам коры мозга, тогда как их вклад в образование нейронов базальных ганглиев и кортикальных интернейронов остается пока под вопросом (9-11). Третий тип предшественников, которые достаточно изменчивы – это базально-, интермедиально-, абвентрикулярно- (abventricular) или внеповерхностно- делящиеся предшественники, отличаются от остальных групп тем, что утрачивают вентрикулярную локализацию (присязку) и делятся вне вентрикулярной поверхности. Такие «внеповерхностно-делящиеся» клетки были известны давно, однако степень их вклада в кортикальный нейрогенез была оценена лишь недавно – показано, что именно эти клетки могут давать начало большинству кортикальных проекционных нейронов (12, 13). Базальные предшественники, которые могут быть визуализированы у GFP репортерных мышей, обнаруживаются в конечном мозге сразу как только начинается нейрогенез и задолго до того как они формируют гистологически отличимую субвентрикулярную зону (SVZ). Это подтверждает то, что они генерируют рано- и поздно-рожденные нейроны (12). 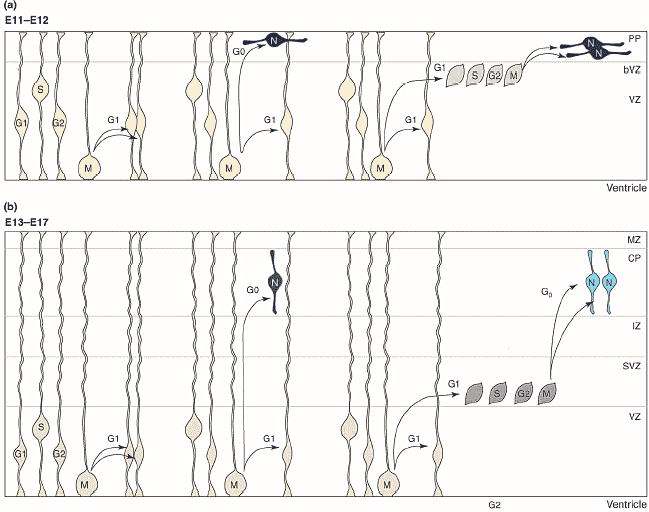 Fig.2. Several types of progenitors contribute to neurogenesis in the mammalian cortex [12–14]. (a) At the beginning of neurogenesis (around E11–E12 in the mouse), neuroepithelial cells located in the ventricular zone (VZ) and undergoing interkinetic nuclear migration either divide symmetrically to generate two new neuroepithelial cells or divide asymmetrically to generate either a neuroepithelial cell and a neuron, which migrates to the preplate (PP), or a neuroepithelial cell and a basal progenitor, which divides symmetrically on the basal side of the VZ (bVZ) to generate two neurons. (b) As neurogenesis progresses (around E13–E17 in the mouse), several signalling pathways induce the expression of glial markers by neuroepithelial cells, which thus become radial glial cells. These cells also divide either symmetrically, to generate two radial glial cells, or asymmetrically, to generate a radial glial cell and either a neuron, which migrates through the intermediate zone (IZ) into the cortical plate (CP), or a basal progenitor, which moves to the subventricular zone (SVZ) and divides symmetrically to generate two neurons. MZ, marginal zone. С помощью метода time-lapse микроскопии было показано, что клетки радиальной глии и базальные предшественники продуцируют нейроны при помощи разных механизмов (РИС.2). Клетки радиальной глии делятся, как правило, асимметрично. В результате одних делений появляются другие клетки радиальной глии и постмитотические нейроны, в результате других делений - также клетки радиальной глии и базальные предшественники (12-14). В отличие от этого, базальные предшественники всегда делятся симметрично и продуцируют, главным образом, два нейрона (12-14). Оба способа нейрогенеза протекают одновременно во время кортикального развития, хотя на поздних стадиях нейроны образуются чаще из базальных предшественников. Кроме разных способов деления, радиально-глиальные/ вентрикулярные и базальные/ субвентриулярные предшественники также различаются по продолжительности клеточного цикла – у них более продолжительный G2 период для SVZ предшественников (15). Об экспрессии их молекулярных маркеров можно прочесть в обзорах (6, 16). Только базальные предшественники экспрессируют нейрональные маркеры, указывая на то, что они являются родоначальниками нейронов. Имеется четкая корреляция между положением делящихся предшественников (базальное или апикальное), способом их деления (асимметричное или симметричное) и их потенциалом развития (мультипотентное или нейрональное), а это предполагает, что локальное окружение предшественников может влиять на способ их деления и их судьбу. Остается однако неясным, продуцируют ли асимметрично делящиеся клетки радиальной глии и симметрично делящиеся базальные предшественники разные типы нейронов, а, следовательно, играет ли экспансия SVZ в конечном мозге млекопитающих важную роль в появлении разнообразия нейронов (6). Региональная спецификация предшественников – хорошо изученный механизмом, с помощью которого образуется многообразие нейронов. В конечном мозге как дорсальные, так и вентральные последовательные подотделы содержат домены множественных предшественников, продуцирующие разные типы нейронов (РИС. 1, обзор 17). Еще не установлено, все ли клеточные популяции конечного мозга имеют отношение к особым доменам предшественников, но недавние эксперименты частично заполнили этот пробел для подтипа кортикальных интернейронов, которые, как оказалось, происходят из особых вентральных доменов конечного мозга (18) (РИС.1). Как оказалось, клетки Кахаля-Ретциуса (Cajal–Retzius - CR ) – популяция рано возникающих клеток (происхождение которых долго оставалось загадкой), играющих важную роль в миграции нейронов коры (19), также генерируются из дискретных доменов предшественников. Три области, локализованные на границах дорсального конечного мозга, продуцируют CR клетки (это было показано методом «картирования судьбы клеток») (20, 21) (РИС.1). CR клетки, генерированные в этих разных ограниченных участках, имеют необычно высокую степень гетерогенности по своим путям миграции и молекулярным фенотипам. Молекулярный контроль выбора пути родоначальниками нейронов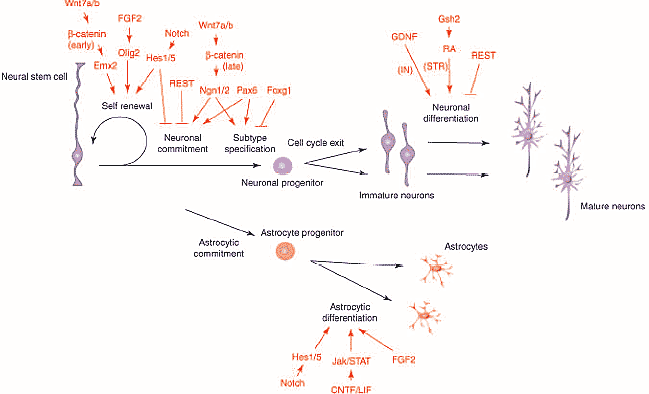 Fig.3. Some of the pathways that regulate the generation of telencephalic neurons or astrocytes by neural stem cells. Several signalling pathways have been shown to promote the self-renewal of telencephalic stem cells and to interact (the FGF and Notch pathways [25], and the FGF and Wnt/b-catenin pathways [39]). Cross-talk between signalling pathways is also important for astrocyte differentiation, and some of the mechanisms underpinning the synergy between signalling pathways in the activation of the astrocyte differentiation marker GFAP have been identified [38,66]. These pathways have been studied in the cerebral cortex, except for GDNF, which is involved in cortical interneuron differentiation (IN) [61] and the Gsh2/RA pathway, which is involved in striatal neuron differentiation (STR) [60]. В настоящее время пути, регулирующие нейрогенез в конечном мозге, в целом идентифицированы (РИС.3). Их механизмы не всегда хорошо поняты, но, по крайней мере, в некоторых случаях было установлено, что они связаны с регуляцией перехода от одной стадии предшественников к другой – т.е. из нейроэпителиальной клетки к клетке радиальной глии или от клетки радиальной глии к базальному предшественнику. Большинство путей, регулирующих нейрогенез в конечном мозге, контролирует множественные этапы процесса нейрогенеза. Например, самовосстановление и нейрональное commitment (направление, выбор) или нейрональное commitment и спецификацию подтипов предшественников. Имеется некоторое пересечение, взаимное влияние между сигнальными путями. Некоторые из этих комбинаций сигналов уже изучены. К сожалению, немного известно о механизмах, модулирующих активность транскрипционных факторов и определяющих, каким образом они выбирают именно ту роль, которая требуется для нейрогенеза. Выбор стволовыми клетками их нейрональной судьбы Множество сигнальных путей и ядерных факторов участвуют в самообновлении стволовых нервных клеток, включаясь в их пролиферацию и/или поддержание их недифференцированного состояния. В обзоре обсуждаются лишь исследования, касающиеся регуляции появления стволовых нервных клеток и клеток предшественников. О пролиферации предшественников можно прочесть в обзоре (22). Хорошо известно, что Notch сигнальный путь и его основные эффекторы – Hes белки - участвуют в удержании предшественников в недифференцированном состоянии и их изоляции от сигналов спецификации (детерминации), поэтому предшественники, которые избегают Notch ингибирования в разные периоды времени, имеют иную судьбу (23, 24). Однако оказалось, что Notch сигналы оказывают влияние на клетки предшественники не прямым путем. Недавно было показано, что Notch1 активация влияет на особую популяцию клеток предшественников – радиальную глию (25,26). Активность Notch1 действительно ограничивается клетками радиальной глии (27), а Notch сигналы прямым способом активирует маркер радиальной глии – brain lipid binding protein (BLBP) (28). В стриатуме Notch активность требуется только во время периода нейрогенеза, когда предшественники делятся асимметрично, а различные комбинации Notch рецепторов необходимы для появления рано- и поздно-рожденных нейронов стриатума (29). Эндотелиальные клетки, являющиеся «убежищем» и источником стволовых нервных клеток как в эмбриональном, так и во взрослом мозге, секретируют растворимые факторы, стимулирующие Notch сигнализирование и, следовательно, самообновление стволовых нервных клеток, возможно путем тесных межклеточных контактов, которые необходимы для Notch активирования (30). FGF сигнальный путь запускает сходные с Notch реакции в предшественниках конечного мозга – также способствует самообновлению клеток, возможно, через активирование Olig2 (31) и индуцирует радиально-глиальный фенотип, что подтверждает возможное взаимодействие между этими двумя сигнальными путями в поддержании популяции предшественников (25) Numb относится к внутриклеточным ингибиторам сигналов Notch, который у беспозвоночных играет важную роль в определении судьбы дочерних клеток асимметрично делящихся предшественников. У мышей утрата Numb и отчасти избыток гена Numb-like ведет к тяжелым дефектам кортикогенеза (32, 33). Однако эти дефекты могут быть разной степени выраженности - от гиперпролиферации мутантных кортикальных предшественников до преждевременной нейрональной дифференцировки в зависимости от того, когда в коре исчезает Numb активность (32,33, обсуждение в 34). Это свидетельствует о том, что Numb и Numb-like играют сложную роль в нейрогенезе, в который вовлекаются взаимодействия с другими путями, а не только с Notch. Разрушение гена клеточной полярности Lgl1 ведет к утрате асимметричной локализации Numb и к гиперпролиферации кортикальных предшественников, подтверждая тем самым то, что Lgl1-опосредованная локализация Numb на апикальной мембране необходима для поддержания асимметричных делений и нейрогенеза (35). Wnt сигнальная система также играет важную и сложную роль в регуляции активности стволовых нервных клеток. В коре стабилизированная форма β- catenin способствует либо самообновлению (36), либо нейрональной дифференцировке предшественников (37) в зависимости от того, когда он экспрессируется во время кортикального развития. Это подтверждает то, что временн’ой механизм корректирует ответ кортикальных предшественников на Wnt сигналы (38). Было также установлено, что FGF сигналы модифицируют реакцию кортикальных предшественников на β- catenin, опосредуя переключение от пролиферации (в присутствии FGF2) на нейрональную дифференцировку (в его отсутствии) (39). Вклад FGF в этот временной механизм, как уже предполагалось для временн’ого контроля дифференцировки астроцитов, неизвестен и является предметом будущих исследований (40). Пролиферативная активность, зависимая от Wnt сигнализирования в коре, опосредуется Emx2 (41), тогда как его роль в нейрональной дифференцировке может заключаться в непосредственной транскрипционной активации проневрального bHLH gene Neurogenin1 посредством TCF/ β-catenin комплекса (37, 39). Сверхэкспрессия Neurogenin2 приводит к тому, что предшественники в вентрикулярной зоне делятся вдали от желудочка (13), подтверждая, что Wnt сигнальная система может стимулировать образование нейронов, превращая клетки радиальной глии в базальные предшественники. Такая активность предполагалась для Wnt7a/b также в синергизме с другими сигнальными молекулами – FGF2 и Shh (42). В любом случае путь Wnt/Neurogeni действует инструктивно и способствует выбору пути мультипотентных стволовых нервных клеток по нейрональной линии (38, 43, 44). Прогрессивное начало экспрессии невральных генов, которые маркируют определенные предшественники для развития их по нейрональному пути и их последующую дифференцировку, включает не только транскрипционные активаторы, такие как проневральные bHLH белки (3), но и транскрипционный репрессоры. Известно, что REST/NRSF – фактор, репрессирующий гены в не-нейральных клетках, является важным регулятором, от которого зависит развитие клеток по нейральному пути (45). Переход от плюрипотентных стволовых клеток к стволовым нервным клеткам и затем к нейронам включает прогрессивное уменьшение REST связывания с нейрональными промоторами. Более того, время экспрессии нейральных генов может регулироваться разной аффинностью REST связывающих участков – так, ранняя экспрессия проневрального гена Mash1 коррелирует с более низким связыванием REST с Mash1 геном, чем невральные гены, экспрессирующиеся в более поздние сроки (45). Астроциты имеют множество общих маркеров с клетками радиальной глии (9). Однако дифференцировка астроцитов происходит не по «умолчанию», для этого необходимы инструктивные сигналы, действующие через множественные интерактивные пути, включающие BMP/Smad, JAK/STAT и Notch пути (38,46,47). Как и во всей нервной системе, астроциты в коре образуются после нейронов. В отсроченной экспрессии маркера дифференцировки астроцитов GFAP участвует множество механизмов, включающих ингибиторную роль проневральных белков во время нейрогенетической фазы (44), саморегулирующую активность JAK/STAT пути (46) и эпигенетические модификации как GFAP , так и генов JAK/STAT пути, которые блокируют активность этого пути на ранних этапах кортикального развития и способствуют активности на более поздних стадиях развития (38,40,48,49). Детерминация и дифференцировка отдельных подтипов нейронов Принадлежность мультипонентных стволовых клеток к «клану» нейронов и спецификация нейрональных предшественников представляют два концептуально отличных этапа нейрогенеза. Пока еще они связаны механистически, т.к. гены определяющие направление нейронального развития, контролируют нейрональную идентичность. Известна история с проневральными генами Neurogenin1 и в особенности с Neurogenin2, которые не только способствуют нейрогенезу (43, 44) и дорсальным признакам нейронов конечного мозга через репрессию вентрального проневрального гена Mash1 (50), но и определяют многие аспекты фенотипа кортикальных проекционных нейронов, включая фенотип их глутаматергической нейротрансмиссии и морфологию дендритов (51, 52). Удивительно, что только Neurogenin гены нужны для спецификации рано-рожденных кортикальных нейронов, заселяющих самые глубокие слои коры (51). Важно и то, что роль Neurogenin2 в детерминации морфологии дендритов и содействии радиальной миграции может быть иной, чем его роль, определяющая направление нейронального развития, поскольку только в первом случае необходимо фосфорилирование особого тирозинового остатка внешнего bHLH домена (52). Другие факторы имеют дополнительное значение в отношении Neurogenin1/2 и контролируют появление поздно-рожденных поверхностно-локализованных кортикальных нейронов. Известен случай со спаренным доменом и гомеобоксным белком Pax6 и с ядерным рецептором Tlx: эти белки действуют синергически при дорсально-вентральном паттернировании конечного мозга и позже в генерировании поверхностных нейронов коры (6,51, 53). Несколько новых транскрипционных факторов с интересным паттерном кортикальной экспрессии, ограниченным базальными предшественниками и поверхностными нейронами, также играют заметную роль в детерминации этого подтипа кортикальных нейронов (6). Оказалось также, что Pax6 участвует в появлении интернейронов обонятельных луковиц (54) – популяции нейронов, которая в отличие от кортикальных нейронов, происходит из вентрального конечного мозга и продолжает генерироваться у взрослых организмов (55). Pax6 необходим для появления обонятельных нейронов, способствуя нейрогенезу вместе с проневральным белком Mash1 (56) и детерминируя особые подтипы обонятельных нейронов – дофаминергических перигломерулярных (periglomerular) нейронов (54). Как и в случае Neurogenin2 функции Pax6 могут быть экспериментально разобщены (54), указывая на то, что эти два действия являются действительно отдельными, хотя механистически они связаны общими транскрипционными регуляторами. Детерминация нейрональной идентичности определяется не только факторами, действующими инструктивно для обеспечения определенной судьбы клеток, но и факторами, подавляющими альтернативную судьбу клеток. Foxg1 - winged helix transcription factor, экспрессируемый большинством предшественников конечного мозга, регулирует пролиферацию и клеточную судьбу как в дорсальном, так и в вентральном конечном мозге (57-59). В коре Foxg1 подавляет предопределенную судьбу CR клеток. Является ли это частью временн’ого механизма, необходимого для того чтобы кортикальные предшественники адаптировались к более поздней клеточной судьбе (58), или это осуществляется посредством регуляции пространственного паттернирования и ограничениями CR судьбы по отношению к кортикальным границам, остается пока неизвестным (20, 21, 59). Как только судьба постмитотического предшественника становится детерминированной, он еще должен мигрировать в место своего окончательного расположения, приобрести морфологию зрелых дендритов и выжить до тех пор, пока его аксон достигнет соответствующей ему мишени. Недавно идентифицировано несколько генетических программ, контролирующих поздние этапы дифференцировки нейронов конечного мозга. В дифференцировке проекционных нейронов стриатума участвуют сигналы ретиноевой кислоты, индуцированные паттернирующим геном Gsh2 (60). Glial-derived neurotrophic factor (Gdnf) принимает участие в росте аксона и приобретении нейрональной морфологии кортикальными интернейронами (61), тогда как Dlx1, необходимый в избытке вместе с Dlx2 для тангенциальной миграции кортикальных интернейронов способствует выживаемости и приобретению зрелой морфологии подтипов кортикальных интернейронов (62). Сравнительно мало известно о факторах, регулирующих дифференцировку кортикальный нейронов, хотя Neurogenin2, который транзиторно экспрессируется в постимитотических и премиграционных предшественниках (52,63), играет важную роль в начале этого процесса (52). Очевидно, что предстоит исследовать регуляторные сети, лежащие в основе дифференцировки постмитотических предшественников в разные типы зрелых нейронов. ЗаключениеМногие случаи инсультов и наиболее распространенные нейродегенеративные заболевания человека ведут к утрате нейронов в определенных областях конечного мозга. Такая утрата почти невозместима, т.к. только часть эндогенных предшественников во взрослом мозге является нейрогенной и эти предшественники продуцируют лишь небольшую часть от всех типов нейронов в ограниченной зоне конечного мозга (8,64). Авторы надеются, что выявлению путей в эмбриональной конечном мозге, определяющих судьбу клеток, помогут новые методы, с помощью которых можно будет генерировать новые нейроны соответствующих типов в разных участках взрослого мозга, и т.о. появится перспектива клеточно-заместительной терапии для восстановления мозга. На самом деле некоторый прогресс уже достигнут в генерации регионально специфических нейронов конечного мозга из эмбрионвльных стволовых клеток (65). Тем не менее, предстоит исследовать пути контролирующие появление огромного массива нейронов конечного мозга, и их дальнейшую интеграцию в нейральные цепи и тогда наши надежды на клеточную терапию станут реальностью. Литература 1. Price J,Williams BP, GotzM: The generation of cellular diversity in the cerebral cortex. Ciba Found Symp 1995, 193:71-84 discussion 117-126.
2. Ross SE, Greenberg ME, Stiles CD: Basic helix–loop–helix factors in cortical development. Neuron 2003, 39:13-25.
3. Bertrand N, Castro DS, Guillemot F: Proneural genes and the specification of neural cell types. Nat Rev Neurosci 2002, 3:517-530.
4. Honda T, Tabata H, Nakajima K: Cellular and molecular mechanisms of neuronal migration in neocortical development. Semin Cell Dev Biol 2003, 14:169-174.
5. Marin O, Rubenstein JL: A long, remarkable journey: tangential migration in the telencephalon. Nat Rev Neurosci 2001, 2:780-790.
6. Campbell K: Cortical neuron specification: it has its time and place. Neuron 2005, 46:373-376.
7. Flames N, Marin O: Developmental mechanisms underlying the generation of cortical interneuron diversity. Neuron 2005, 46:377-381.
8. Tramontin AD, Garcia-Verdugo JM, Lim DA, Alvarez-Buylla A: Postnatal development of radial glia and the ventricular zone (VZ): a continuum of the neural stem cell compartment.
Cereb Cortex 2003, 13:580-587.
9. Gotz M, Barde YA: Radial glial cells defined and major intermediates between embryonic stem cells and CNS neurons. Neuron 2005, 46:369-372.
10. Anthony TE, Klein C, Fishell G, Heintz N: Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron 2004, 41:881-890.
11. Malatesta P, Hack MA, Hartfuss E, Kettenmann H, Klinkert W, Kirchhoff F, Gotz M: Neuronal or glial progeny: regional differences in radial glia fate. Neuron 2003, 37:751-764.
12.Haubensak W, Attardo A, Denk W, Huttner WB: Neurons arise in the basal neuroepithelium of the early mammalian telencephalon: a major site of neurogenesis. Proc Natl Acad Sci U S A 2004, 101:3196-3201.See annotation to [14].
13.Miyata T, Kawaguchi A, Saito K, Kawano M, Muto T, Ogawa M: Asymmetric production of surface-dividing and non-surfacedividing cortical progenitor cells. Development 2004, 131:3133-3145.See annotation to [14].
14.Noctor SC, Martinez-Cerdeno V, Ivic L, Kriegstein AR: Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat Neurosci 2004, 7:136-144. This study and those by Haubensack et al. [12] and Miyata et al. [13]
use time-lapse imaging to demonstrate that cortical neurons are produced either by asymmetric division of radial glial or symmetric division of basal progenitors. These studies also provide evidence that basal progenitors are already present at the onset of neurogenesis [12] and that
they contribute a large fraction of cortical neurons [12,13].
15. Calegari F, Haubensak W, Haffner C, Huttner WB: Selective lengthening of the cell cycle in the neurogenic subpopulation of neural progenitor cells during mouse brain development. J Neurosci 2005, 25:6533-6538.
16. Englund C, Fink A, Lau C, Pham D, Daza RA, Bulfone A, Kowalczyk T, Hevner RF: Pax6, Tbr2, and Tbr1 are expressed sequentially by radial glia, intermediate progenitor cells,
and postmitotic neurons in developing neocortex. J Neurosci 2005, 25:247-251.
17. Campbell K: Dorsal-ventral patterning in the mammalian telencephalon. Curr Opin Neurobiol 2003, 13:50-56.
18. Xu Q, Cobos I, De La Cruz E, Rubenstein JL, Anderson SA:
Origins of cortical interneuron subtypes. J Neurosci 2004, 24:2612-2622.
19. Soriano E, Del Rio JA: The cells of Cajal-Retzius: still a mystery one century after. Neuron 2005, 46:389-394.
20.Bielle F, Griveau A, Narboux-Neme N, Vigneau S, Sigrist M, Arber S, Wassef M, Pierani A: Multiple origins of Cajal-Retzius cells at the borders of the developing pallium.Nat Neurosci 2005. See annotation to [21]
21.Takiguchi-Hayashi K, Sekiguchi M, Ashigaki S, Takamatsu M, Hasegawa H, Suzuki-Migishima R, Yokoyama M, Nakanishi S, Tanabe Y: Generation of reelin-positive marginal zone cells from the caudomedial wall of telencephalic vesicles. J Neurosci 2004, 24:2286-2295.
In this study and that by Bielle et al. [20], the authors have traced the origin of Cajal-Retzius cells to several progenitor domains at the border of the dorsal telencephalon, including the ventral pallium [20], septum [20] and cortical heme [21]. Cajal-Retzius cells born in these different territories follow different routes of tangential migration and have different
molecular phenotype [20].
22. Molofsky AV, Pardal R, Morrison SJ: Diverse mechanisms regulate stem cell self-renewal. Curr Opin Cell Biol 2004, 16:700-707.
23. Hatakeyama J, Bessho Y, Katoh K, Ookawara S, Fujioka M, Guillemot F, Kageyama R: Hes genes regulate size, shape and histogenesis of the nervous system by control of the timing
of neural stem cell differentiation. Development 2004, 131:5539-5550.
24. Mizutani K, Saito T: Progenitors resume generating neurons after temporary inhibition of neurogenesis by Notch activation in the mammalian cerebral cortex. Development 2005,
132:1295-1304.
25. Yoon K, Nery S, Rutlin ML, Radtke F, Fishell G, Gaiano N: Fibroblast growth factor receptor signaling promotes radial glial identity and interacts with Notch1 signaling in
telencephalic progenitors. J Neurosci 2004, 24:9497-9506.
26. Ever L, Gaiano N: Radial ‘glial’ progenitors: neurogenesis and signaling. Curr Opin Neurobiol 2005, 15:29-33.
27. Tokunaga A, Kohyama J, Yoshida T, Nakao K, Sawamoto K, Okano H: Mapping spatio-temporal activation of Notch signaling during neurogenesis and gliogenesis in the
developing mouse brain. J Neurochem 2004, 90:142-154.
28. Anthony TE, Mason HA, Gridley T, Fishell G, Heintz N: Brain lipidbinding protein is a direct target of Notch signaling in radial glial cells. Genes Dev 2005, 19:1028-1033.
29. Mason HA, Rakowiecki SM, Raftopoulou M, Nery S, Huang Y, Gridley T, Fishell G: Notch signaling coordinates the patterning of striatal compartments. Development 2005. in press.
30. Shen Q, Goderie SK, Jin L, Karanth N, Sun Y, Abramova N, Vincent P, Pumiglia K, Temple S: Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells.
Science 2004, 304:1338-1340.
31. Hack MA, Sugimori M, Lundberg C, Nakafuku M, Gotz M: Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6. Mol Cell Neurosci 2004, 25:664-678.
32. Li HS, Wang D, Shen Q, Schonemann MD, Gorski JA, Jones KR, Temple S, Jan LY, Jan YN: Inactivation of Numb and Numblike in embryonic dorsal forebrain impairs neurogenesis and disrupts cortical morphogenesis. Neuron 2003, 40:1105-1118.
33. Petersen PH, Zou K, Krauss S, Zhong W: Continuing role for mouse Numb and Numbl in maintaining progenitor Cellular and molecular control of neurogenesis Guillemot 645
www.sciencedirect.com Current Opinion in Cell Biology 2005, 17:639–647 cells during cortical neurogenesis. Nat Neurosci 2004, 7:803-811.
34. Fishell G, Kriegstein AR: Neurons from radial glia: the consequences of asymmetric inheritance. Curr Opin Neurobiol 2003, 13:34-41.
35. Klezovitch O, Fernandez TE, Tapscott SJ, Vasioukhin V: Loss of cell polarity causes severe brain dysplasia in Lgl1 knockout mice. Genes Dev 2004, 18:559-571.
36. Chenn A, Walsh CA: Regulation of cerebral cortical size by control of cell cycle exit in neural precursors. Science 2002, 297:365-369.
37.Hirabayashi Y, Itoh Y, Tabata H, Nakajima K, Akiyama T, Masuyama N, Gotoh Y: The Wnt/b-catenin pathway directs neuronal differentiation of cortical neural precursor cells.
Development 2004, 131:2791-2801. See annotation to [39].
38. Hirabayashi Y, Gotoh Y: Stage-dependent fate determination of neural precursor cells in mouse forebrain. Neurosci Res 2005, 51:331-336.
39.Israsena N, Hu M, Fu W, Kan L, Kessler JA: The presence of FGF2 signaling determines whether b-catenin exerts effects on proliferation or neuronal differentiation of neural stem cells. Dev Biol 2004, 268:220-231. This study and that by Hirabayashi et al. [37] provide evidence for a dual role of the Wnt/b-catenin pathway in cortical development, promoting
proliferation early in corticogenesis or in the presence of FGF2, and promoting neuronal differentiation at a later stage or in the absence of FGF2. The differentiation function of b-catenin appears to involve direct transcriptional activation of Neurogenin1.
40. Song MR, Ghosh A: FGF2-induced chromatin remodeling regulates CNTF-mediated gene expression and astrocyte differentiation. Nat Neurosci 2004, 7:229-235.
41. Muzio L, Soria JM, Pannese M, Piccolo S, Mallamaci A: A mutually stimulating loop involving Emx2 and canonical Wnt signaling specifically promotes expansion of occipital cortex and hippocampus. Cereb Cortex 2005, in press.
42. Viti J, Gulacsi A, Lillien L: Wnt regulation of progenitor maturation in the cortex depends on Shh or fibroblast growth factor 2. J Neurosci 2003, 23:5919-5927.
43. NietoM, Schuurmans C, Britz O, Guillemot F: Neural bHLH genes control the neuronal versus glial fate decision in cortical progenitors. Neuron 2001, 29:401-413.
44. Sun Y, Nadal-Vicens M, Misono S, Lin MZ, Zubiaga A, Hua X, Fan G, Greenberg ME: Neurogenin promotes neurogenesis and inhibits glial differentiation by independent mechanisms. Cell 2001, 104:365-376.
45.Ballas N, Grunseich C, Lu DD, Speh JC, Mandel G: REST and its corepressors mediate plasticity of neuronal gene chromatin throughout neurogenesis. Cell 2005, 121:645-657.
The authors show that REST, a transcriptional repressor preventing neuronal gene expression in non-neuronal tissues, also regulates the progression of neuronal lineages. The transitions from pluripotent cells to neural stem cells, and from progenitors to neurons, involves a progressive
reduction in levels of REST binding to neuronal promoters. The temporal onset of neuronal gene expression may be regulated by the affinity of REST binding sites in promoters of neuronal genes.
46. He F, Ge W, Martinowich K, Becker-Catania S, Coskun V, Zhu W, Wu H, Castro D, Guillemot F, Fan G et al.: A positive autoregulatory loop of Jak-STAT signaling controls the onset of astrogliogenesis. Nat Neurosci 2005, 8:616-625.
47.Kamakura S, Oishi K, Yoshimatsu T, Nakafuku M, Masuyama N, Gotoh Y: Hes binding to STAT3 mediates crosstalk between Notch and JAK-STAT signalling. Nat Cell Biol 2004, 6:547-554.
The authors demonstrate that Hes proteins interact with JAK and STAT proteins and are required for proper JAK/STAT signalling, thus providing evidence for a direct interaction between the Notch and JAK/STAT pathways and identifying a mechanism for the induction of astrocyte
differentiation by Notch signalling.
48. Takizawa T, Nakashima K, Namihira M, Ochiai W, Uemura A, Yanagisawa M, Fujita N, Nakao M, Taga T: DNA methylation is a critical cell-intrinsic determinant of astrocyte differentiation in the fetal brain. Dev Cell 2001, 1:749-758.
49. Fan G, Martinowich K, Chin MH, He F, Fouse SD, Hutnick L, Hattori D, Ge W, Shen Y, Wu H et al.: DNA methylation controls the timing of astrogliogenesis through regulation of JAK-STAT signaling. Development 2005, 132:3345-3356.
50. Fode C, Ma Q, Casarosa S, Ang SL, Anderson DJ, Guillemot F: A role for neural determination genes in specifying the dorsoventral identity of telencephalic neurons. Genes Dev
2000, 14:67-80.
51.Schuurmans C, Armant O, Nieto M, Stenman JM, Britz O, Klenin N, Seibt J, Brown C, Tang H, Cunningham JM et al.: Sequential phases of neocortical fate specification involve Neurogenindependent and -independent pathways. EMBO J 2004, 23:2892-2902.See annotation to [52].
52.Hand R, Bortone D, Mattar P, Nguyen L, Heng I-TK, Guerrier S, Boutt E, Peters E, Barnes AP, Parras C et al.: Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron 2005, in press.
This study and that by Schuurmans et al. [51] demonstrate that the bHLH protein Neurogenin2 is required for the specification of multiple aspects of cortical projection neuron identity, including their corticalspecific molecular profile, neurotransmission phenotype and dendritic morphology. The proneural activity of Neurogenin2 and some aspects of its specification function can be distinguished by different dependence on phosphorylation of a particular tyrosine residue. Neurogenin2 specification function is unexpectedly restricted to early-born cortical
neurons.
53. Roy K, Kuznicki K, Wu Q, Sun Z, Bock D, Schutz G, Vranich N, Monaghan AP: The Tlx gene regulates the timing of neurogenesis in the cortex. J Neurosci 2004, 24:8333-8345.
54.Hack MA, Saghatelyan A, de Chevigny A, Pfeifer A, Ashery-Padan R, Lledo PM, Gotz M: Neuronal fate determinants of adult olfactory bulb neurogenesis. Nat Neurosci 2005, 8:865-872. The authors provide evidence that the adult telencephalon contains several progenitor populations for olfactory bulb interneurons, which have different locations and generate different interneuron subtypes. They also demonstrate that Pax6 has a dual role in olfactory bulb
neurogenesis, in promoting neuronal commitment and directing neuronal progenitors towards a particular subtype identity. 55. Merkle FT, Tramontin AD, Garcia-Verdugo JM, Alvarez-Buylla A: Radial glia give rise to adult neural stem cells in the subventricular zone. Proc Natl Acad Sci USA 2004, 101:17528-17532.
56. Parras CM, Galli R, Britz O, Soares S, Galichet C, Battiste J, Johnson JE, Nakafuku M, Vescovi AL, Guillemot F: Mash1 specifies neurons and oligodendrocytes in the postnatal
brain. EMBO J 2004, 23:4495-4505.
57. Martynoga B, Morrison H, Price DJ, Mason JO: Foxg1 is required for specification of ventral telencephalon and region-specific regulation of dorsal telencephalic precursor proliferation and apoptosis. Dev Biol 2005, 283:113-127.
58. Hanashima C, Li SC, Shen L, Lai E, Fishell G: Foxg1 suppresses early cortical cell fate. Science 2004, 303:56-59.
59. Muzio L, Mallamaci A: Foxg1 confines Cajal-Retzius neuronogenesis and hippocampal morphogenesis to the dorsomedial pallium. J Neurosci 2005, 25:4435-4441.
60. Waclaw RR, Wang B, Campbell K: The homeobox gene Gsh2 is required for retinoid production in the embryonic mouse telencephalon. Development 2004, 131:4013-4020.
61. Pozas E, Ibanez CF: GDNF and GFRa1 promote differentiation and tangential migration of cortical GABAergic neurons. Neuron 2005, 45:701-713.
62. Cobos I, Calcagnotto ME, Vilaythong AJ, Thwin MT, Noebels JL, Baraban SC, Rubenstein JL: Mice lacking Dlx1 show subtypespecific loss of interneurons, reduced inhibition and epilepsy. Nat Neurosci 2005.
63. Kawaguchi A, Ogawa M, Saito K, Matsuzaki F, Okano H, Miyata T: Differential expression of Pax6 and Ngn2 between pair-generated cortical neurons. J Neurosci Res 2004,
78:784-795. 646 Cell differentiation Current Opinion in Cell Biology 2005, 17:639–647 www.sciencedirect.com
64. Emsley JG, Mitchell BD, Kempermann G, Macklis JD: Adult neurogenesis and repair of the adult CNS with neural progenitors, precursors, and stem cells. Prog Neurobiol 2005,
75:321-341.
65. Watanabe K, Kamiya D, Nishiyama A, Katayama T, Nozaki S, Kawasaki H, Watanabe Y, Mizuseki K, Sasai Y: Directed differentiation of telencephalic precursors from embryonic
stem cells. Nat Neurosci 2005, 8:288-296.
66. Nakashima K, Yanagisawa M, Arakawa H, Kimura N, Hisatsune T, Kawabata M, Miyazono K, Taga T: Synergistic signaling in fetal brain by STAT3–Smad1 complex bridged by p300. Science 1999, 284:479-482.
|