Печень развивается из вентральной энтодермы передней кишки на ст. 14-20 сомитов (Le Douarin, 1975). Зачаток печени формируется первым; он увеличивается и пролиферирует в поперечную перегородку (septum transversum), чтобы сформировать эмбриональную печень (Zhao and Duncan, 2005). В Zaret Лаб. было установлено на мышах, что вентральная энтодерма д. экспрессировать GATA-4 и FoxA2 (ранее известный как HNF3β)? чтобы быть компетентной осуществить печеночную дифференцировку (Bossard and Zaret, 1998). Спецификация печени затем может зависеть от сочетанного действия членов семейства fibroblast growth factor (FGFs), передающих сигналы из соседней кардиальной мезодермы (Jung et al., 1999), и передачи сигналов bone morphogenetic protein (BMP) из соседней septum transversum (Rossi et al., 2001). Передача сигналов BMP2
необходиа также для развития печени у кур, где она индуцирует экспрессию гомеобоксного белка Hex (Zhang et al., 2004). Hex является самым ранним из идентифицированных маркеров для энтодермы, которая будет формировать печень (Bogue et al., 2000, Thomas et al., 1998). Однако, доказательства роли мезодермальных FGFs у кур отсутствуют (Zhang et al., 2004). В отсутствие FGF и BMP сигналов у мышей, передне-вентральная энтодерма приобретает панкреатическую судьбу (Rossi et al., 2001). Инициальная спецификация печени и поджелудочной железы может, следовательно, зависеть от реакции на эти сигналы от мезодермы, но идентифицировать гены, которые в этом участвуют, нелегко. В случае поджелудочной железы известно, что транскрипционный фактор Pdx1 играет ключевую роль в спецификации (Jonsson et al., 1994), в то время как в печени транскрипционные факторы Foxa1 (HNF3α) и Foxa2 необходимы для инициации развития (Lee te al., 2005).
В предыдущих работах нашей Лаб. было предположено, что члены семейства C/EBP важны для выбора между печенью и поджелудочной железой (Tosh and Slack, 2002; Tosh et al., 2002; Slack and Tosh, 2001; Shen et al., 2000). Используя линию панкреатических клеток крыс AR42J-B13, мы показали, что трансфекция C/EBPβ провоцирует печеночную дифференцировку, тогда как трансфекция доминантно негативного ингибитора для C/EBPβ (liver-enriched transcriptional inhibitory protein, LIP) ингибировала глюкокортикоидом индуцированное образование гепатоцитов и вызывала также потерю печеночного фенотипа клетками, поддерживаемых в течение длительного времени на dexamethasone (Shen et al., 2000, Kurash et al., 2004, Burke et al., 2006). C/EBPβ активируется также в органной культуре эмбриональной поджелудочной железы после обработки глюкокортикоидом и его экспрессия ассоциирует с печеночной дифференцировкой в этой системе (Shen et al., 2000; Shen et
al., 2003).
C/EBPβ является членом семейства CCAAT/enhancer binding protein
(C/EBPs), которые являются basic-leucine zipper транскрипционными факторами, которые взаимодействуют с CCAAT мотивами, присутствующими в промоторах многочисленных генов. 6 членов описано и названо named α, β, γ, δ, ε и ζ (Lekstrom-Himes and Xanthopoulos, 1998). Хотя существует 6 генов, но количество изоформ C/EBP белков выше из-за альтернативных промоторов, стартовых точек трансляции, дифференциального сплайсинга и регулируемого протеолиза
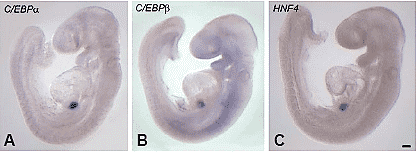 Fig. 1. Wholemount in situ hybridisation staining of C/EBPα, C/EBPβ and HNF4 in
E9.5 mouse embryos. (A) C/EBPα. (B) C/EBPβ. (C)HNF4. Scale bar, 200 мm
Fig. 1. Wholemount in situ hybridisation staining of C/EBPα, C/EBPβ and HNF4 in
E9.5 mouse embryos. (A) C/EBPα. (B) C/EBPβ. (C)HNF4. Scale bar, 200 мm
Члены семейства экспрессируются в печени, гематопоэтической ткани и адипоцитах взрослых (Lekstrom-Himes and Xanthopoulos, 1998). Экспрессия
C/EBPs была изучена во время развития мышей и рыбок данио рерио (Birkenmeier et al., 1989, Shiojiri et al., 2004., Lyons et al., 2001). Первоначально мыши экспрессирую C/EBPα в развивающейся кишечной ткани, начиная с E17.5d (Birkenmeier et al., 1989). Затем, используя окрашивание антителами, Shiojiri et al. продемонстрировали экспрессию C/EBPα на ст. E9.5d в энтодерме мышей в области развивающейся печени. Т.к. авт. не выявили параллельной экспрессии каких-либо др. печеночных или панкреатических маркеров, то было трудно понять в точности, какой энтодермальный орган экспрессирует C/EBP факторы. Более убедительное печеночное C/EBPα иммуно-окрашивание наблюдалось со ст. E10.5d , а начало экспрессии C/EBPβ приходилось на период E13.5 и E14.5d. Экспрессия C/EBPα позднее супрессировалась в предшественниках желчных клеток, указывая тем самым, что этот транскрипционный фактор может участвовать в выборе между дифференцировкой печеночных и желчных клеток (Shiojiri et al., 2004). У рыбок данио, C/EBPα and β экспрессируются в субнаборе гематопоэтических клеток, в печени и регионах ЖКТ (Lyons et al., 2001).
Results and Discussion
Хотя исследования трансдифференцировки подтвердили, что эти факторы могут выбирать между ранней спецификацией печени и поджелудочной железы, критическим условием для этой гипотезы является то, что, по крайней мере, один из C/EBP генов действительно экспрессируется в раннем зачатке печни и не экспрессируется в раннем зачатке поджелудочной железы. В данной работе мы установили с помощью гибридизации in situ паттерны экспрессии во время эмбрионального развития генов C/EBPα и C/EBPβ. Мы сравнили экспрессию C/EBPα и C/EBPβ с хорошо охарактеризованным печеночным транскрипционным фактором, HNF4 и с продуктом ранней дифференцировки печени, α-fetoprotein (AFP).
Было установлено, что C/EBPα и C/EBPβ отсутствуют у эмбрионов E8.5d, но экспрессия обоих факторов C/EBP и HNF4 впервые обнаруживается на ст. E9.5. Четко было показано, что единственным местом экспрессии на этой стадии является ранний зачаток печени (Fig. 1). Смысловые зонды были негативными (data not shown). На ст. E10.5 криосрезы показали участки экспрессии внутри раннего зачатка печени с некоторыми негативными и позитивными клетками (Fig. 2). Это ожидалось, т.к. на данной стадии печеночные клетки инвазируют мезенхиму septum transversum и печеночный рудимент содержит высокую пропорцию мезенхимных клеток. на ст. E11.5 экспрессия в печени становится более униформной, по мере врастания гепатоцитов в мезенхиму. Уровень C/EBP факторов. экспрессируемых гепатобластами остается достоверно выше, чем в окружающей ткани (Fig.3). На этой стадии HNF4 (но не C/EBPα или β) экспрессируется также на низком уровне в duodenum. Сравнение профилей иммуноокрашивания для AFP и Pdx1 показало, что Pdx1 экспрессируется в поджелудочной железе и duodenum, но не в печени. Мы продолжили отслеживать экспрессию в печени в течение следующих трех дней и ситуация оставалась сходной и в точном соответствии экспрессии C/EBPα и β с таковой для HNF4 и AFP. Рис. 4 показывает ситуацию на ст. E13.5. Этот паттерн экспрессии у мышей отличается от такового у рыбок данио, которые обнаруживают экспрессию C/EBPs как в дуоденум, так и печени (Lyons et al., 2001).
C/EBPs, как известно, регулируют несколько важных печеночных генов (Friedman et al., 1989, Umek et al., 1991). Сюда входят как регуляторные транскрипционные факторы, такие как HNF4, так и продукты дифференциации, такие как albumin (Bossard et al.,1997). Albumin и α-fetoprotein начинают транскрибироваться с E9.5 (Jochheim et al., 2004). Время сходное с экспрессией C/EBPα, указывающее на то, что транскрипционный фактор может регулировать экспрессию albumin и α-fetoprotein. Доказательства, полученные от нокаутных мышей показали, что потеря функции у мутантов или C/EBPα или C/EBPβ не вызывает гибели и дает незначительные дефекты печени (Wang et al., 1995; Screpanti et al., 1995; Liu et al., 1998), но C/EBPα нокаутные мыши вскоре умирают после рождения от гипогликемии (Wang et al., 1995). В двух работах были получены условные делеции C/EBPα , продемонстрировавшие роль C/EBPα у постнатальных мышей. Первый нокаут показал нарушенную толерантность к глюкозе и hyperammonemia из-за уменьшения экспрессии glucokinase
и carbamoylphosphate synthetase (Inoue et al., 2004).
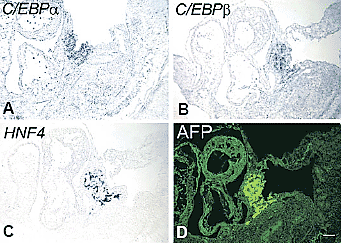 Fig. 2. Expression of C/EBPα, C/EBPβ and HNF4 in E10.5 mouse
embryos. Neighbouring cryosections were processed for in situ
hybridisation or immunostaining. (A) In situ of C/EBPα. (B) In situ of C/EBPβ. (C) In situ of HNF4. (D) Immunostain of α-fetoprotein (AFP)showing the region of the developing liver. Scale bar, 100 мm.
Fig. 2. Expression of C/EBPα, C/EBPβ and HNF4 in E10.5 mouse
embryos. Neighbouring cryosections were processed for in situ
hybridisation or immunostaining. (A) In situ of C/EBPα. (B) In situ of C/EBPβ. (C) In situ of HNF4. (D) Immunostain of α-fetoprotein (AFP)showing the region of the developing liver. Scale bar, 100 мm.
Вторая нокаутная модель продемонстрировала гликогликемическую и fatty, steatotic печень (Yang et al., 2005). Кроме того, C/EBPβ, как было показано, необходим для регенерации печени (Diehl, 1998). У
Drosophila, имеется одиночный C/EBP гомолог, который экспрессируется в выстилке кишечника. Потеря функции его является летальной для эмбрионов (Rorth and Montell, 1992), так что можно предполагать, что одновременная потеря всего C/EBP семейства у мышей будет иметь более драматические эффекты на развитие печени, чем потеря одного члена. Полученные результаты согласуются с ролью генов
C/EBP как ключевых регуляторов печеночного развития.
Сайт создан в системе
uCoz Fig. 1. Wholemount in situ hybridisation staining of C/EBPα, C/EBPβ and HNF4 in
E9.5 mouse embryos. (A) C/EBPα. (B) C/EBPβ. (C)HNF4. Scale bar, 200 мm
Fig. 1. Wholemount in situ hybridisation staining of C/EBPα, C/EBPβ and HNF4 in
E9.5 mouse embryos. (A) C/EBPα. (B) C/EBPβ. (C)HNF4. Scale bar, 200 мm
 Fig. 2. Expression of C/EBPα, C/EBPβ and HNF4 in E10.5 mouse
embryos. Neighbouring cryosections were processed for in situ
hybridisation or immunostaining. (A) In situ of C/EBPα. (B) In situ of C/EBPβ. (C) In situ of HNF4. (D) Immunostain of α-fetoprotein (AFP)showing the region of the developing liver. Scale bar, 100 мm.
Fig. 2. Expression of C/EBPα, C/EBPβ and HNF4 in E10.5 mouse
embryos. Neighbouring cryosections were processed for in situ
hybridisation or immunostaining. (A) In situ of C/EBPα. (B) In situ of C/EBPβ. (C) In situ of HNF4. (D) Immunostain of α-fetoprotein (AFP)showing the region of the developing liver. Scale bar, 100 мm.