Прошло 40 лет с момента первой публикации о локализации РНК в клетках эукариот (Bodian 1965, Koenig 1965a,b). Курьезно, но эти данные привлекли первоначально мало внимания. Даже после доказательств о локализации РНК и рибосомах, полученных в нескольких лаб. в 1980s
(Colman et al. 1982, Jeffery et al. 1983, Palacios-Pr Ёu et al. 1981, Steward & Levy 1982), локализация РНК всё ещё рассматривалась как некая темная странность в клеточной биологии. Идея встречалась со скептицизмом.
В конце 1980s и начале 1990s, однако, стало ясно, белок синтезирующая кухня (machinery) и индивидуальные РНК могут направляться в разные места, временами на значительные расстояния от perikaryal соматических областей. Т.к. доказательства, подтверждающие эту идею получены на разных типах клеток, включая и ооциты Xenopus, нейроны млекопитающих и глиальные клетки и на эмбрионах Drosophila среди прочего, то исследователи начали понимать, что здеь скорее всего работае общий принцип. Сегодня мы понимаем, что мРНК транспортируются, локализуются и фокально транслируются во многих типах клеток эукариот. Эти механизмы имеют фундаментальное значение в регуляции экспрессии генов, т.к. они позволяют клеткам предоставлять контроль автономно действующим локальным сайтам. В последние несколько лет мы наблюдаем быстрый прогресс в нашем понимании механизмов, которые управляют локализацией РНК и локальным трансляционным контролем, механизмами, которые лежат в основе пространственно-временной модуляции локальных белковых репертуаров. Рука об руку с этим приходит понимание, что малые не транслируемые РНК, многие до сих пор не оцененные (Couzin 2002), играют важные роли в качестве медиаторов трансляционного контроля.
Почему клетки локализуют РНК? Транспорт РНК и локальная трансляция теперь документированы у позвоночных, беспозвоночных и у одноклеточных организмов и, следовательно, очевидно, что локализация РНК является древним клеточным механизмом. Сегодня этот механизм используется различными типами клеток по разным причинам, но одним из основных преимуществ является то, что клетки - особенно сложные и высоко поляризованные клетки - способны контролировать экспрессию генов локально.
Это особенно касается нейронов, где пластическая модуляция синаптических соединений формирует клеточные субстраты для высшей деятельности головного мозга, таких как обучение и память. Долговременное, зависимое от опыта и сигнал-специфическое ремоделирование синапсов нуждается в изменениях генной экспрессии и синтезе белка de novo; учитывая тот факт, что типичный нейрон осуществляет несколько тысяч синаптических соединений с помощью своего дендритного древа, то преимущества локального контроля трансляции становятся очевидными.
Мы ограничимся обзором литературы последних 4-х лет. Отсылаем к более ранним обзорам (Chartrand et al. 2001, Goldstein&Yang 2000, Kapp&Lorsch 2004, Palacios & St. Johnston 2001, Piper & Holt 2004, Steward & Schuman 2001). Piper & Holt (2004) создали современное объяснение локальной трансляции в аксонах, вопрос, который не рассматривается здесь. Существует и ряд др. обзоров (Bassell & Kelic 2004, Carson et al.
2001, Darnell 2003, Giuditta et al. 2002, Job & Eberwine 2001, Kloc & Etkin 2005, Kloc et al. 2002, Martin 2004, Smith 2004, Steward
& Schuman 2003,Wang & Tiedge 2004).
RNA TRANSPORT AND LOCALIZATION
Локализация РНК является широко распространенным феноменом, который наблюдается во многих типах клеток эукариот, включая одноклеточные механизмы (напр., дрожжи), развивающиеся зародышевые клетки и эмбрионы
(гапр., у Drosophila и Xenopus), растительные и др. животные клетки (напр., нейроны млекопитающих). Активная поставка связана с распознаванием цис-действующих РНК элементов, т.е. сегментов РНК, которые содержат коды, специфицирующие целенаправленную поставку. с помощью транс-действующих связывающих РНК факторов. Это взаимодействие приводит к образованию ribonucleotide protein (RNP) комплексов, которые путешествуют вдоль цитоскелетных филамент с помощью моторных белков. На своих местах предназначения высвобождаемые транскрипты закрепляются и оказываются готовы к трансляции.
Cis-Acting Targeting Elements
Location-кодирующие, cis-действующие направляющие элементы были идентифицированы у разных локализуемых транскриптов высших эукариот (Table 1). В ооцитах Xenopus более чем 20 РНК транспортируются по трем разным путям или к вегетативному полюсу или к анимальному полушарию (King et al. 1999). Локализация на вегетативном полюсе осуществляется во время ранней и поздней фазы оогенеза. РНК из раннего METRO (messenger transport organizer) пути (Kloc&Etkin 2005), такие как Xcat-2, Xdaz1, Xpat, Xwnt-11, и Xlsirts, первоначально ассоциируют с митохондриальным облаком (stages I-II) и постепенно мигрируют в вегетативный кортекс между поздней стадией II и ранней стадией III. Транскрипты позднего пути, включая Vg1 (Melton 1987) и VegT (Zhang & King 1996), транспортируются во время поздней стадии III и ранней стадии IV и остаются прикрепленными к вегетативному кортексу вплоть до конца оогенеза. Этот путь локализует детерминанты зародышевого слоя в вегетативном полушарии. В Vg1 мРНК, мотив в 340-nucleotide (nt),
названный Vg1 localization element (VLE), обеспечивает vegetal поставку (Mowry & Melton 1992). VLE и цис-элементы всех др. действительно vegetally локализованных транскриптов содержат кластеры из коротких CAC-содержащих мотивов (Betley et al. 2002). Легкие вариации последовательностей этих мотивов, по-видимому, коррелируют с самостоятельными функциями во время процесса локализации (Zhou & King 2004). Однако, Xvelo1 транскрипты из позднего пути к вегетативному полюсу используют самостоятельный в 75-nt stem-loop локализационный элемент (Claussen & Pieler 2004). Т.о., поставка разных мРНК в идентичные клеточные сайты может использовать как перекрывающиеся, так и разные молекулярные механизмы.
Многочисленные РНК направляются в дендриты нейронов млекопитающих (Eberwine et al. 2002). Доставка в дендриты некоторых из этих мРНК зависит от активности нейрона. Синаптическая активация in vivo строго усиливает активность гена Arc/arg3.1 (Link et al. 1995, Lyford et al. 1995) и приводит к избирательному, N-methyl-d-aspartate (NMDA) receptor (NMDAR)-зависимому рекрутированию соотв. транскриптов в дендритные сегменты, в которых синапсы были стимулированы (Steward & Worley 2001). Сходным образом, стимулы, вызывающие эпилепсию in vivo продуцируют повышенные уровни мРНК brain derived neurotrophic factor (BDNF) в купе с NMDAR-зависимым накоплением транскриптов в проксимальных сегментах дендритов в гиппокампе (Tongiorgi et al. 2004). Общими требованиями в этих путях д.б. ретроградная передача от синапса к ядру и механизмы, лежащие в основе такой передачи сигналов, они теперь начинаю исследоваться (Thompson et al. 2004).
Dendritic targeting elements (DTEs) идентифицированы в ряде нейрональныхмРНК. Такие DTEs, по-видимому, совершенно самостоятельны п дине и последовательностям и они могут
Table 1 cis-acting elements and trans-acting factors in cell types of vertebrate organisms. cis-acting elements have
often been only broadly defined. Position range and length therefore represent maxima that in many cases are likely
to be further narrowed down in the future
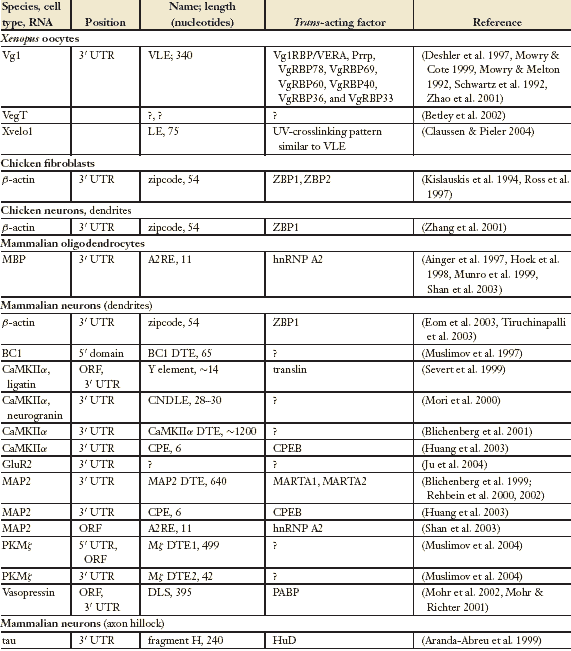
также кодировать разные места назначения внутри дендритного древа. Белковые репертуары в дендритных доменах обычно мозаичны и разнообразны. Синапсы, в частности, характеризуют высоко специализированные complements макромолекулярных компонентов. Сегодня очевидно, что часть этой сложности осуществляется и поддерживается с помощью местной (on-site) трансляции локально доступных мРНК. Сложность нейрональных DTEs может быть, следовательно, отражением разнообразия внутриклеточных сайтов-мишеней, что иллюстрируется слудующими примерами.
Calcium/calmodulin-dependent protein kinase II (CaMKII) обогащена в постсинаптических микродоменах. 3' untranslated region (UTR) мРНК CaMKIIα , как сообщалось, содержит два самостоятельных не перекрывающихся DTEs, один примерно в 30 nt (Mori
et al. 2000), другой же, локализованный внутри примерно в 1200 nt (Blichenberg et al. 2001). В головном мозге мышей in vivo, однако, маленький элемент сам по себе не достаточен для обеспечения поставки в дендриты (Miller et al. 2002). Помимо, the 3' UTR мРНК CaMKIIα
содержит две копии hexanucleotide мотива, наз. cytoplasmic polyadenylation
element (CPE), который облегчает транслокацию в дендриты (Huang et al. 2003).
В shank1 транскриптах DTE находится внутри 200 nt 3' UTR (Bockers et al. 2004), тогда как в транскриптах vasopressin, DTE располагается внутри сегмента в 395-nt, который занимает часть open reading frame (ORF) и 3' UTR (Prakash et al. 1997). В мРНК protein kinase Mζ (PKMζ) один DTE расположен внутри 499 nt в месте встречи 5' UTR и ORF (499 nt) обеспечивает экспорт в теле, тогда как второй со структурой stem-loop из 42 nt в 3' UTR, ответственен за доставку мРНК в дистальные части дендритов (Muslimov et al. 2004). Элемент, кодирующий дистальные targeting свойства GA kink-turn (K-turn) мотива. K-turns были идентифицированы в качестве сайтов для взаимодействий РНК-белок в различных РНК (Klein et al. 2001), возникает вопрос, действительно ли такие маленькие мотивы играют столь широко распространенную роль в локализации РНК. В небольшой не транслируемой BC1 РНК, сегмент в 65-nt в 5' stem-loop домене оказывается достаточным для доставки в дендриты (Muslimov et al. 1997). (Т.к. все локализованные РНК независимо от того, транслируются ли они, несут коды для спецификации своих мест предназначения, термин не кодирующая д.б. аннулирован; см. Brosius & Tiedge 2004.) В разных др. дендритных мРНК DTEs ещё не картированы или не идентифицированы. Взятые все вместе, однако, сигналы, направляющие в дендриты, в разных мРНК, по-видимому, совершенно самостоятельны, отличаются по длине, последовательности, относительной позиции и количеству на РНК и закодированы к разным местам предназначения. Следовательно, остается удивляться, действительно ли кажущаяся сложнсть DTEs в самом деле диктуется исключительно биологической целесообразностью или лежащие в основе принципы медленны, чтобы быть обнаружены.
Олигодендроциты млекопитающих сильно удлиненные глиальные клетки, которые расширяют экстенсивно разветвленные отростки, чтобы сформировать изолирующие (insulating) миэлиновые слои вокруг аксонов. Несколько мРНК, включая те, что кодируют myelin basic protein (MBP), транспортируются в эти отростки (Barbarese et al. 1999, Boccaccio 2000). Доставка MBP мРНК обеспечивается с помощью 11-nt цис-действующего элемента, обозначенного как heterogeneous ribonucleoprotein (hnRNP) A2response element (A2RE), который участвует также в формировании гранул RNP и в cap-зависимой трансляции (Carson et al. 2001). A2REs в трех разных транскриптах из человеческого immunodeficiency virus 1 (HIV-1) также обеспечивают extrasomatic доставку микроинъецированных мРНК в культивируемых олигодендроцитах, хотя и с разной эффективностью (Mouland et al. 2001). Фланкирующие последовательности, по-видимому, модулируют компетентность к доставке у A2RE. A2RE как было показано, поддерживает также поставку в дендриты в нейронах (Shan et al. 2003, Smith 2004). A2RE-подобный элемент был идентифицирован в ORF дендритных мРНК MAP2; в этом случае, однако, DTE
локализуется в 3' UTR, тогда как ORF, как было установлено, не компетента к доставке (Blichenberg et al. 1999).
Полимеризация актина на ведущем крае движущихся клеток регулирует выпячивание lamellipodia, filopodia или pseudopodia (Rafelski & Theriot 2004). В эмбриональных фибробластах и миобластах кур β-actin транскрипты концентрируются непосредственно проксимальнее ведущего края (Lawrence & Singer 1986). A 54-nt "zipcode" в 3' UTR обеспечивает сортировку мРНК в ведущий край (Kislauskis et al. 1994). Тот же самый zipcode обеспечивает также поставку β-actin мРНК в ростовые конусы незрелых нейронов кур (Zhang et al. 2001) и в дендриты зрелых нейронов гиппокампа крыс (Eom et al. 2003). Т.о., функциональная роль β-actin cis-действующего элемента, по-видимому, законсервирована у птиц и млекопитающих. С др. стороны, ограничение MAP2 мРНК птиц телами нейронов в сетчатке птиц (в противоположность сомато-дендритному распределению в сетчатке млекопитающих) и отсутствие DTE-подобных последовательностей в 3' UTR мРНК птиц указывают на то, что приобретение компетентности доставки в дендриты относительно недавнее событие в эволюции (Cristofanilli et al. 2004). Всё это указывает на то, что локализованные мРНК используют как общие, так и уникальные цис-действующие элементы, которые могли быть приобретены в разные промежутки времени в ходе эволюции. Длинные цис-действующие элементы часто, по-видимому, соответствуют множественным коротким мотивам, иногда кооперирующихся, иногда частично перекрывающихся. Физическое описание таких мотивов является важной задачей будущего.
Trans-Acting Factors
По определению trans-acting factors (TAFs) являются белками, которые поддерживают транспорт РНК и/или локализацию путем связывания цис-действующих элементов (Figure 1). В этом контексте TAFs являются декодирующими устройствами, белками, которые распознают location-специфицирующие коды в РНК. Vg1RBP/VERA и ZBP1, TAFs, которые взаимодействуют с Vg1-VLE и β-actin цис-действующим элементом, соотв., представлены двумя членами семейства РНК-связывающих белков, которые содержат два RNA recognition motifs (RRMs) и 4 hnRNP K homology
(KH) домена (Bassell & Kelic 2004, Yaniv & Yisraeli 2002). Zipcode мутации снижают ассоциацию ZBP1 с β-actin мРНК и локализацию транскриптов на ведущем крае фибробластов (Ross et al. 1997). В развивающихся нейронах нарушение взаимодействия между zipcode и ZBP1 ингибирует индуцируемую
neurotrophin локализацию мРНК β-actin в ростовом конусе и уменьшает подвижность ростового конуса (Zhang et al. 1999). В зрелых нейронах, ZBP1 и гранулы β-actin мРНК располагаются в остях и шипах (spines) дендритов (Tiruchinapalli et al. 2003). Пониженные уровни ZBP1 снижают концентрации дендритных β-actin мРНК и нарушают рост филоподий дендритов после стимуляции neurotrophin, тогда как избыточная экспрессия zipcode содержащих мРНК увеличивает плотность дендритных филоподий (Eom et al. 2003). Члены семейства Vg1RBP/ZBP1 РНК-связывающих белков являются т.о., медиаторами цитоплазматической доставки РНК у разных видов и клеточных систем.
Два TAFs, которые взаимодействуют с дендритными MAP2 мРНК, MARTA1 и MARTA2, принадлежат к подсемейству FUSE-binding protein (FBP) KH-доменовых белков (Duncan et al. 1994, Rehbein et al. 2002; K. Zivraj, M.
Rehbein, F. Buck, M. Schweizer, D. Richter,S. Kindler). РНК-связывающий белок MARTA2 регулирует поставку дендритной MAP2 мРНК. (In preparation). MARTA1 является крысиным ортологом человеческого KH-type splicing
regulatory protein (KSRP/FBP2), компонента мультибелкового комплекса, который участвует в нейрон-специфическом сплайсинге (Min et al. 1997). ZBP2, куриный ортолог MARTA1, взаимодействует с zipcode
β-actin мРНК (Gu et al. 2002). Локализованный преимущественно в ядре, ZBP2 снует между ядром и цитоплазмой, a избыточная экспрессия укороченного ZBP2 частично нарушает доставку β-actin мРНК как в ламеллоподии поляризованных фибробластов кур, так и ростовые конусы нейронов в культуре.
В противоположность MARTA1/ZBP2, MARTA2/FBP3 преимущественно располагается в сомато-дендритном компартменте нейронов, где он обнаруживается ассоциированным в полисомами. При экспрессии в культивируемых нейронах, экзогенный
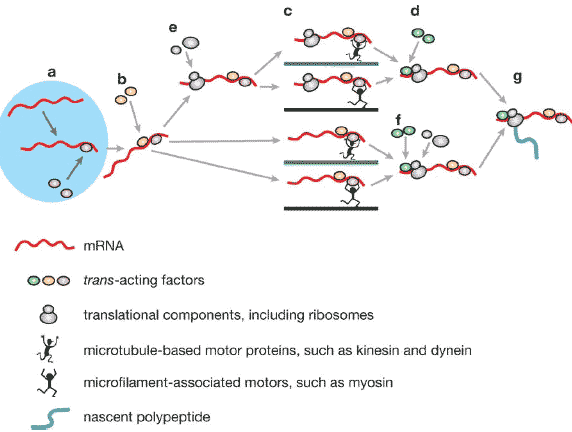 Figure 1
Active transport of mRNAs from the nucleus (left, light blue) to peripheral cytoplasmic destination sites in eukaryotic cells. Transport proceeds through a number of sequential phases as follows. (a) recognition of cis-acting elements by nuclear trans-acting factors (TAFs) (purple ellipses) and formation of ribonucleotide protein (RNP) complexes; (b) nuclear export of RNP particles and recruitment of cytoplasmic TAFs
( yellow ellipses); (c) motor-based active transport of cytoplasmic RNP particles along cytoskeletal filaments (green and blue lines); (d, f ) association with additional cytoplasmic TAFs, such as anchoring proteins, at destination sites (light green ellipses); (e, f ) recruitment of ribosomes and other translational components (not shown) either before (e) or after ( f ) cytoplasmic translocation; ( g) locally controlled translation.
Figure 1
Active transport of mRNAs from the nucleus (left, light blue) to peripheral cytoplasmic destination sites in eukaryotic cells. Transport proceeds through a number of sequential phases as follows. (a) recognition of cis-acting elements by nuclear trans-acting factors (TAFs) (purple ellipses) and formation of ribonucleotide protein (RNP) complexes; (b) nuclear export of RNP particles and recruitment of cytoplasmic TAFs
( yellow ellipses); (c) motor-based active transport of cytoplasmic RNP particles along cytoskeletal filaments (green and blue lines); (d, f ) association with additional cytoplasmic TAFs, such as anchoring proteins, at destination sites (light green ellipses); (e, f ) recruitment of ribosomes and other translational components (not shown) either before (e) or after ( f ) cytoplasmic translocation; ( g) locally controlled translation.
MARTA2 частично ко-локализуется с рекомбинантными DTE-содержащими мРНК в гранулах вдоль дендритов. Избыточная экспрессия укороченной версии MARTA2 полностью нарушает поставку в дендриты эндогенных MAP2 мРНК гранул. Т.о., два члена семейства FBP, по-видимому, участвуют в локализации РНК в разных типах клеток.
Testis/brain RNA-binding protein (TBRBP; известный как translin у приматов) соединяется с законсервированными Y и H элементами нескольких мРНК из тестисов и головного мозга и репрессирует их трансляцию (Han et al. 1995, Kwon & Hecht 1993). TB-RBP прикрепляет трансляционно репрессированные РНК к цитоскелету из микротрубочек (Han et al. 1995). Его присутствие в межклеточных цитоплазматических мостиках между сперматидами указывает на то, что TB-RBP может обеспечивать транспорт мРНК между зародышевыми клетками самцов (Morales et al. 1998). Эти данные указывают на взаимодействие между транспортом и трансляционной репрессией РНК.
Др. белки могут также играть двойную роль в контроле доставки и трансляции РНК. Одним из примеров является семейство белков Staufen, связывающих double-stranded (ds) РНК (Roegiers & Jan 2000). В ооцитах и ранних эмбрионах Drosophila Staufen необходим для локализации и трансляционного контроля различных материнских транскриптов и для установления передне-заднего паттерна тела. Два Staufen ортолога, Stau1 и Stau2, были описаны у млекопитающих (Duchaine et al. 2002, Monshausen et al. 2001, Tang et al. 2001). Stau1 обнаруживается в большинстве тканей, тогда как Stau2 преимущественно присутствует в головном мозге (Duchaine et al. 2002, Monshausen et al. 2001). В нейронах оба белка локализуются в дендритах, ассоциируя с дендритными микротрубочками и располагаясь в гранулах (Duchaine et al. 2002, Monshausen et al. 2001, Tang et al. 2001). В то же самое время обогащение фракциями полисом может указывать на дополнительную роль в трансляции (see below). Сходным образом cytoplasmic polyadenylation element (CPE), содержащийся в субнаборе дендритных мРНК, осуществляет двойную функцию как translational control element (TCE) и как DTE. Связывающий его белок, CPEB, обеспечивает как цитоплазматическую индуцированную полиаденилированием трансляцию (see below), так и транспорт CPE-содержащих мРНК в дендриты (Huang et al. 2003). Итак, очевидно, что локализованные мРНК могут рекрутировать связывающие белки с двойной целью, транспорта РНК и локального контроля за трансляцией, подчеркивая еще раз, что два механизма функционально независимы.
Цитоплазматический таргетинг мРНК может быть инициирован ещё в ядре, накапливаются доказательства в разных типах клеток. Некоторые TAFs являются ядерно-цитоплазматическими снующими белками, которые сначала, по-видимому, ассоциируют с транскриптами в ядре и затем управляют доставкой мРНК в цитоплазму (Farina & Singer 2002). В ооцитах Drosophila история ядерного процессинга транскриптов oskar является детерминантом его цитоплазматической судьбы (Hachet & Ephrussi 2004). Сходным образом, распознавание транскриптов и формирование специфических RNP комплексов в ядре является ранним событием локализации мРНК Vg1 в ооцитах Xenopus (Kress et al. 2004). RNP ре-моделируется после своего экспорта в цитоплазму, а дополнительные транспортные факторы рекрутируются в комплексы. Несколько др. TAFs также, по-видимому, снуют между ядром и цитоплазмой (Bassell & Kelic 2004). Складывается мнение, что таргетинг РНК в клетках эукариот часто является многоступенчатым процессом, в котором РНК с момента своей транскрипции в ядре до закрепления в месте финального предназначения, заручается поддержкой ряда TAFs последовательным, упорядоченным способом. Такого типа поставка с множественными TAFs, кооперирующими по доставке груза, может быть рациональной, особенно когда транспортные маршруты длинны и сложны для реализации, напр., в дендритах с тысячами потенциальных синаптических мест предназначения.
Cytoskeletal Elements and Molecular Motors
Разные цитоскелетные элементы, как было установлено, поддерживают транспорт РНК и локальное закрепление (Figure 1). В фибробластах микрофиламенты используются для локализации частиц, содержащих β-actin транскрипты и ZBP1. В нейронах, с др. стороны, ZBP1 и его β-actin мРНК находят мишени, перемещаясь преимущественно вдоль микротрубочек (Bassell & Kelic 2004). Т.о., ZBP1 может служить в качестве адаптора между мРНК и любым из молекулярных моторов, движущихся по микрофиламентам или микротрубочкам. Вполне правдоподобно, что в нейронах транспорт РНК на большие расстояния обеспечивается микротрубочками, тогда как локализация в микродоеменах предназначения поддерживается актиновыми филаментами (Muslimov et al. 2002). Нейрональные CPEB гранулы содержат как кинезиновые, так и динеиновые моторы, а их двунаправленное перемещение в дендритах зависит от микротрубочек (Huang et al. 2003). Кроме того, kinesin I комплексы из головного мозга млекопитающих содержат несколько уже упоминавшихся TAFs (Kanai et al. 2004). В аксоно-подобных отростках P19 клеток эмбриональной карциномы нокдаун др. члена семейства кинезинов, KIF3A, нарушает сортировку tau мРНК (Aronov et al. 2002). В олигодендроцитах ингибирование кинезина нарушает поставку MBP мРНК (Carson et al. 1997); в тестисах, kinesin KIF17b ассоциирует с TB-RBP, указывая тем самым, что зависимая от микротрубочек транспортная система РНК оперирует в зародышевых клетках самцов млекопитающих (Chennathukuzhi et al. 2003). Накапливаются доказательства, что транспорт на дальне расстояния РНК в разных типах клеток млекопитающих обеспечивается молекулярными моторами kinesin- и dynein-типа, перемещающихся с помощью микротрубочек.
LOCAL CONTROL OF TRANSLATION
Mechanisms of Local Translational
Control
Трансляция мРНК в соотв. белок осуществляется в три последовательные ступени инициации, элонгации и терминации (rev. Sonenberg et al. 2000). Регуляция может осуществляться на любой из этих ступеней, но инициация обычно является скорость-органичивающей и поэтому часто является мишенью для регуляции (Gingras et al. 1999, Kapp & Lorsch 2004). Во время инициации, 43S преиниационный комплекс формируется путем связывания eIF2oGTPoMet-tRNAi четвертичного комплекса с 40S рибосомальной субъединицей (Figure 2). 43S комплекс затем рекрутируется на инициирующий кодон РНК, чтобы сформировать стабильный 48S комплекс. Эта ступень нуждается в участии ряда факторов из семейства eIF4. Эти факторы последовательно диссоциируют, 60S рибосомальная субъединица соединяется с 40S субъединицей. чтобы сформировать 80S комплекс и начинается элонгация (Figure 2; Hershey & Merrick 2000). Во время элонгации eEF1A наводят aminoacyl-tRNAs на A сайт на рибосоме; затем следует образование пептидных мостиков, рибосома транслоцируется на одни кодон вдоль мРНК, ступень, которая катализируется с помощью eEF2. Наконец, терминация на стоп кодоне обеспечивается рядом релиз факторов.
Из-за своей связи с долговременной зависимой от опыта модуляцией синаптической силы (и тем самым нейрональной пластичности), трансляционный контроль генной экспрессии в синапто-дендритных доменах стал предметом повышенного интереса. Поэтому мы использовали эту систему, чтобы подчеркнуть некоторые характерные общие принципы контроля локальной трансляции (Figure 3).
Фактор инициации трансляции eIF4E, субъединица комплекса eIF4F, соединяется с 5' cap мРНК и способствует рекрутированию преиниационного 43S комплекса (Figure 2; Gingras et al. 1999, Kapp&Lorsch 2004). Некоторые сигнальные пути выявлены в нейронах, они модулируют трансляцию с помощью доставки eIF4E. Один связан с BDNF и mammalian target of rapamycin (mTOR), serine/threonine kinase. Активированный mTOR фосфорилирует eIF4E-связанные белки (eIF4EBPs), приводя в результате к их диссоциации от eIF4E и затем к активации инициации трансляции (Raught et al. 2000). Этот путь участвует в регуляции трансляции в нейронах млекопитающих (Takei et al. 2001, 2004; Tang et al. 2002). Ключевые компоненты пути mTOR, такие как mTOR, eIF4E, и eIF4E-BP, были идентифицированы в постсинаптических доменах (Tang et al.
2002). BDNF, член семейства neurotrophin, как было показано, участвует в долговременной синаптической potentiation (Korte et al. 1995). Воздействие rapamycin, ингибитором пути mTOR, на слои гиппокампа предупреждает BDNF-индуцируемую синаптическую potentiation (Tang et al. 2002). BDNF индуцирует фосфорилирование eIF4E-BP, eIF4E и mTOR в кортикальных нейронах, а также в изолированных дендритах (Takei et al. 2001, 2004), указывая тем самым, что путь mTOR является важным для BDNF, чтобы активировать трансляцию в дендритах. Идентифицирован субнабор мРНК в качестве мишеней
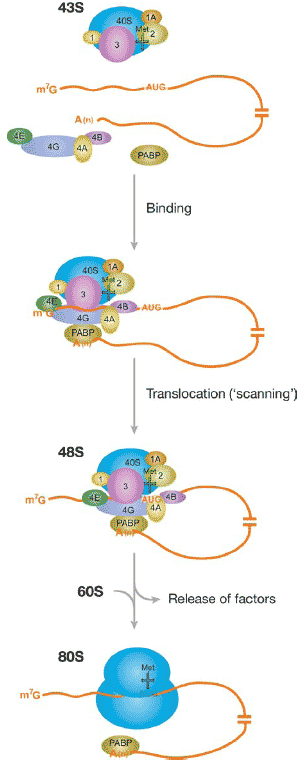 Figure 2
Cap-dependent translation initiation in
eukaryotes. Recruitment of the 43S preinitiation
complex to the mRNA, mediated by factors of the
eIF4 family and poly(A) binding protein (PABP),
results in the formation of a 48S complex at the
AUG initiator codon. Alternatively to the scenario
shown here, eIF4E may remain bound to the cap
during scanning (resulting in a looping-out of the
5 UTR; Jackson 2000); in general, it remains to
be established at which point after initial
cap-binding the eIF4 factors dissociate from the
mRNA and from PABP. Translation may also be
initiated in cap-independent fashion, for instance
by binding of the 43S complex to an internal
ribosome entry site (IRES), which is typically
located directly upstream of the AUG start codon
(not shown; see Hellen & Sarnow 2001). Some
factors (e.g., eIF5) have been omitted for clarity.
Figure 2
Cap-dependent translation initiation in
eukaryotes. Recruitment of the 43S preinitiation
complex to the mRNA, mediated by factors of the
eIF4 family and poly(A) binding protein (PABP),
results in the formation of a 48S complex at the
AUG initiator codon. Alternatively to the scenario
shown here, eIF4E may remain bound to the cap
during scanning (resulting in a looping-out of the
5 UTR; Jackson 2000); in general, it remains to
be established at which point after initial
cap-binding the eIF4 factors dissociate from the
mRNA and from PABP. Translation may also be
initiated in cap-independent fashion, for instance
by binding of the 43S complex to an internal
ribosome entry site (IRES), which is typically
located directly upstream of the AUG start codon
(not shown; see Hellen & Sarnow 2001). Some
factors (e.g., eIF5) have been omitted for clarity.
BDNF-активируемого mTOR пути (Schratt et al. 2004).
Сигнальный путь mitogen-activated protein kinase (MAPK) также активирует локальную трансляцию посредством своей нежестоящей мишени eIF4E (Kelleher et al. 2004). После фосфорилирования с помощью MAPK/ERK kinase (MEK), extracellular signal-regulated kinase (ERK), член семейства MAPK, активирует свой нижестоящий субстрат MAP kinase-interacting kinase 1 (Mnk1) (Fukunaga & Hunter 1997, Waskiewicz et al. 1997). Активированная Mnk затем фосфорилирует eIF4E, способствуя тем самым инициации трансляции (Pyronnet et al. 1999, Waskiewicz et al. 1999). Эти находки подтвердили ко-регуляцию локальной транлсляции с помощью доставки eIF4E посредством MEK и mTOR сигнальных путей (Gingras et al. 1999; Figure 3).
Работы с Drosophila недавно показали, что экспрессия eIF4E сама по себе является предметом регуляции. Pumilio (Pum), репрессор трансляции, играет важную роль в детерминации передне-заднего паттерна тела Drosophila во время раннего эмбриогенеза (Johnstone & Lasko 2001). Белок Pum, как было установлено, контролирует морфогенез дендритов (Ye et al. 2004) и участвует в формировании долго-временной памяти (Dubnau et al. 2003). В нейромышечных соединениях Drosophila постсинаптический Pum негативно регулирует экспрессию eIF4E (Menon et al. 2004). Pum избирательно взаимодействует с 3' UTR мРНК eIF4E, указывая тем самым, что Pum может модулировать синаптическую функцию путем непосредственного контроля экспрессии eIF4E (Menon et al. 2004).
eIF4F, гетеротримерный белок, который обеспечивает рекрутирование 43S комплекса на мРНК, он состоит из eIF4E, cap-связывающего белка, eIF4G, большого каркасного белка, и eIF4A, ATФ-зависимой РНК helicase, которая расплетает вторичные структурные элементы в 5' UTR перед рекрутированием комплекса 43S (Figure 2; Gingras et al. 1999, Kapp & Lorsch 2004). Активность eIF4F существенно усиливается с помощью её взаимодействия с PABP, белком, которые соединяется с poly(A) хвостами мРНК. Это взаимодействие, как было показано, поставляет дендритную BC1 РНК (Wang et al. 2002). BC1 РНК является маленькой, не транслируемой РНК, которая избирательно транспортируется в дендриты (Muslimov et al. 1997). Она репрессирует инициацию трансляции, ингибируя образование преиниационного комплекса 48S (Wang et al. 2002). BC1-обусловленная репрессия является эффективной при cap-зависимой инициации и при одном субтипе IRES-обусловленной инициации. Т.к. IRES-обусловленная инициация может быть предпочтительным способом в синапсах, особенно в ответ на стимуляцию (Dyer et al. 2003, Pinkstaff et al. 2001), то и BC1 РНК также считают необходимой для модулярной роли в синаптической трансляции.
Также участвующий в инициации трансляции путь CPE впервые был проанализирован ооцитах Xenopus. Некоторые мРНК остаются трансляционно дремлющими пока их короткие poly(A) хвосты не увеличатся в цитоплазме (Mendez & Richter 2001). Цитоплазматическое полиаденилирование зависит от присутствия CPE на 3' UTR мРНК. После фосфорилирования CPEB с помощью киназы aurora, CPEB соединяется с CPE и рекрутирует poly(A) polymerase, чтобы полиаденилировать мРНК. CPEB в свою очередь распознается с помощью двух CPEB-связывающих белков, Symplekin, каркасного белка, и xGLD-2, poly(A) polymerase (Barnard et al. 2004). Полиаденилирование способствует диссоциации maskin от eIF4E, 'demasking' тем самым eIF4E и позволяя ему участвовать в инициации трансляции (Richter 2000).
Дендритная CaMKIIα мРНК содержит две CPE-подобные последовательности на своем 3' UTR (Wu et al. 1998). Трансляция CaMKIIα vHYR зависит от того же самого механизма полиаденилирования, который был описан выше в ооцитах Xenopus, а факторы, такие как aurora,CPEB, poly(A) polymerase и maskin были идентифицированы в синаптических сайтах нейронов гиппокампа (Huang et al. 2002, Wells
et al. 2001,Wu et al. 1998). Активация NMDAR оказалась существенной для CPE-зависимого синтеза CaMKIIα (Wells et al. 2001). NMDAR стимуляция индуцирует фосфорилирование aurora, активируя тем самым локальную трансляцию CaMKIIα мРНК (Huang et al. 2002). Дендритная мРНК plasminogen activator (tPA) также взаимодействует с CPEB; она быстро полиаденилируется и транслируется в соотв. белок после активации metabotropic glutamate receptor (mGluR) (Shin et al. 2004). Цитоплазматическое полиаденилирование, т.о., представляет собой механизм контроля трансляции, который является избирательным для CPE-несущих мРНК.
Элонгация также может быть мишенью для локального трансляционного контроля, если не чаще, чем инициация. Одной из мишеней является eEF2 (Scheetz et al. 1997, 2000). В tectum амфибий фосфорилирование eEF2 зависит от активации NMDARs и может быть индуцировано с помощью визуальной стимуляции (Scheetz et al. 1997). Фосфорилирование eEF2 вызывает снижение общего синтеза белка у эукариот (Nairn et al. 2001), но может усиливать трансляцию некоторых мРНК в развивающихся нейронах (Scheetz et al. 2000). Этот механизм может т.о. являться альтернативным типичному контролю initiation-targeted локальной трансляции (Figure 3). FMRP используется для регуляции дендритной трансляции, но точный способ действия ещё не установлен (Antar & Bassell 2003, O'Donnell &Warren 2002). Белок ингибирует трансляцию, в то время как вызывающий болезнь мутантная форма FMRP нет
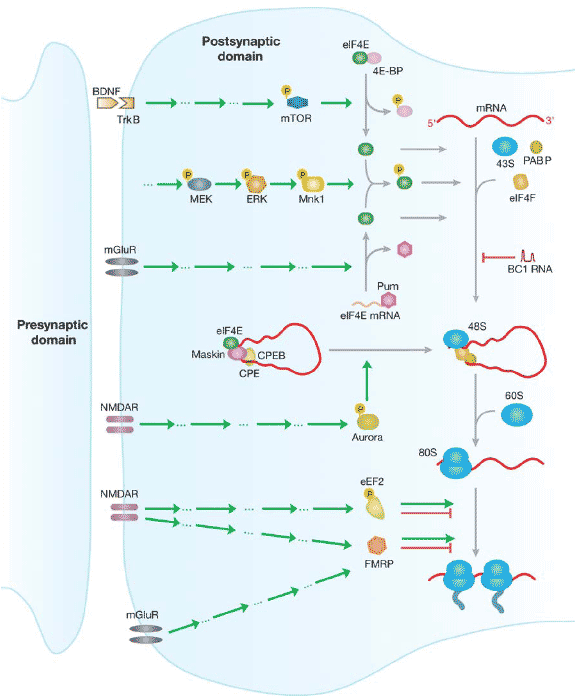 Figure 3. Many roads lead to Rome: possible pathways of translational control at the synapse. Translational control can be implemented by activation of various receptor systems (left) and can be mediated at the level of
initiation and elongation (right). Mechanisms in addition to those summarized here have been discussed; for example, FMRP has also been reported to repress translation at the level of initiation (Laggerbauer
et al. 2001). Green arrows, stimulation; red arrows, inhibition. Aspects of this diagram remain speculative; note that not all factors shown are currently known to be active at the synapse. Factors not drawn to scale.
Figure 3. Many roads lead to Rome: possible pathways of translational control at the synapse. Translational control can be implemented by activation of various receptor systems (left) and can be mediated at the level of
initiation and elongation (right). Mechanisms in addition to those summarized here have been discussed; for example, FMRP has also been reported to repress translation at the level of initiation (Laggerbauer
et al. 2001). Green arrows, stimulation; red arrows, inhibition. Aspects of this diagram remain speculative; note that not all factors shown are currently known to be active at the synapse. Factors not drawn to scale.
(Laggerbauer et al. 2001). FMRP, как предполагается ингибирует трансляцию путем взаимодействия с мРНК (Li et al. 2001). В синапсах активация NMDAR, а также mGluR участвуют в FMRP пути (Antar et al. 2004, Gabel et al.
2004, Weiler et al. 1997). FMRP, как полагают, взаимодействует с нетранслируемой BC1 РНК, чтобы репрессировать трансляцию таких мРНК, которые base-pair с 5' BC1 доменом (Zalfa et al. 2003). Однако, т.к. FMRP ассоциирует с полирибосомами (Corbin et al. 1997; Eberhart et al. 1996; Feng et al. 1997; Khandjian et al. 1996, 2004; Stefani et al. 2004; Weiler et al. 2004), в то время как BC1 РНК обогащена более легкими фракциями RNP (Krichevsky & Kosik 2001), кажется наиболее вероятным, что FMRP и BC1 РНК оперируют в контроле трансляции без непосредственного взаимодействия др. с др. Более того, функциональная роль FMRP в трансляции может быть более сложной в
in vivo - ингибирование или стимулирование в зависимости от мишени мРНК - т.к. загрузка полисом дифференциально меняется в отсутствие FMRP (Brown et al. 2001). Статус фосфорилирования FMRP может быть др. детерминантом регуляции трансляции: в то время как не фосфорилированный FMRP обнаруживается ассоциированным с активно транслирующими полирибосомами, фосфорилированный FMRP обнаруживает тенденцию к ассоциации с кажущимися застрявшими полирибосомами (Ceman
et al. 2003). В этом сценарии FMRP д. модулировать трансляцию на уровне элонгации (Figure 3). Др. поворот связан с тем фактом, что FMRP связывает eEF1A мРНК и репрессирует её трансляцию
in vivo (Sung et al 2003). Др. предполагаемый механизм связывает FMRP с микроРНК (miRNAs) (Jin et al.
2004). miRNAs небольшие РНК (21-24 nt), которые действуют как репрессоры трансляции благодаря частичному спариванию оснований со своей мРНК мишенью (Ambros 2003, Ruvkun 2001). miRNAs были идентифицированы в препаратах головного мозга млекопитающих, где они обогащены в фракциях полирибосом (Kim et al. 2004). dFXR,
Drosophila ортолог FMRP,
также, по-видимому, взаимодействует с RNAi путем (Caudy et al. 2002, Ishizuka et al. 2002), подтверждая тем самым гипотезу, что FMRP регулирует трансляцию мРНК мишеней посредством miRNAs и/или small interfering
RNAs (siRNAs).
Translational Repression During Transport
В целом предполагается, что мРНК д.б. трансляционно репрессированы во время своего перемещения, чтобы предотвратить эктопическую экспрессию (Kwon et al.1999). Этот принцип был подтвержден на нескольких типах клеток. Во время оогенеза и раннего эмбриогенеза у Drosophila oskar мРНК ведется благодаря своему 3' UTR из питающих клеток к переднему краю ооцита, чтобы затем закрепиться на заднем полюсе (Johnstone & Lasko 2001). Во время транспорта трансляция мРНК oskar репрессирована с помощью нескольких транс-действующих факторов, включая Bruno и Apontic белки (Lie & MacDonald 1999, Webster et al. 1997). мРНК oskar транслируется в соотв. белок только после того как она достигнет заднего полюса; фактически эктопическая экспрессия oskar мРНК во время транспорта дает в результате тяжелые дефекты развития (Kim-Ha et al. 1995). Подтверждение этой модели получено в недавней работе с Cup, вновь идентифицированным компонентом комплекса oskar RNP (Wilhelm et al. 2003). Cup, eIF4E-связывающий белок, необходим как для транспорта, так и для репрессии трансляции oskar мРНК, что снова подтверждает тесную координацию между двумя процессами (Wilhelm et al. 2003). Сходная координация выявляется и для CPEB в нейронах. Как обсуждалось выше, CPEB облегчает транспорт в дендриты CPE-содержащих мРНК (Huang et al. 2003). Во время транспорта, CPEB ко-локализуется с репрессором трансляции maskin в транспортных частицах. Взаимодействие между обоими белками может , следовательно, играть роль в транспорте трансляционно бездействующих мРНК в дендритах (Huang et al. 2003). Во многих типах клеток комплексы RNP были идентифицированы в качестве действительно подвижных транспортных единиц. Эти макромолекулярные комплексы, по-видимому, содержат множественные РНК, ассоциированные с
TAFs, и/или компоненты трансляционной кухни (machinery). Работа с MBP мРНК показала, что транспортные гранулы формируются в течение минут после микроинъекции РНК в олигодендроциты (Ainger et al. 1997). Трансляция MBP мРНК может быть активирована только, если она вовлечена в процесс миэлинизации (Boccaccio 2000). Транспортные гранулы РНК, как сообщалось, лишены существенных трансляционных компонентов и неспособны инкорпорировать радиоактивные аминокислоты, указывая тем самым, что они трансляционно не компетентны (Krichevsky & Kosik 2001). Репрессор трансляции FMRP недавно был найден взаимодействующим с человеческим ZBP1 ортоголом IMP1 в гранулах (Rackham & Brown 2004). Сходным образом, РНК-связывающий белок RNG105 является репрессором трансляции, он найден в ассоциации с нейрональными гранулами РНК (Shiina et al 2005). Эти данные подтверждают дальнейшую функциональную связь между транспортом РНК и репрессией трансляции.
Итак, репрессия трансляции, по-видимому, важна во время транспорта РНК для предупреждения эктопической экспрессии и - по крайней мере в нейронах - также после достижения места предназначения. Не соответствующим образом контролируемый синтез белка в синапсах может нарушить деликатный нейрональный баланс между возбуждением и ингибированием и, следовательно, он может быть существенным для доставки множественных систем до места, чтобы удерживать локальную трансляцию в "off" состоянии вплоть до поступления сигнала "go". Природа такого сигнала и механизм, с помощью которого такой сигнал передается в локальную кухню трансляции, пока задача для дальнейших исследований.
PERSPECTIVE
Impressive as it may be, recent progress in the
field of RNA transport and local translational
control can not distract from the fact that we
remain ignorant of some very fundamental aspects.
Various cis-acting RNA elements have
been described that encode subcellular destination
sites, but we do not understand how
such codes are expressed in the structural design
of RNA motifs. We are therefore not
yet able to read such codes, and we do not
know how they are decoded by TAFs. What is
urgently needed is a physical description—in
conjunction with a functional dissection—of
code-carrying RNA motifs that specify targeting.
The number of such motifs may in fact be
limited (Moore 1999). In evolutionary terms,
RNA has predated proteins, and at least some
functional RNA motifs may therefore have
evolved early. It will be interesting to see how
such motifs have been recruited and adapted
by RNAs to encode subcellular destination
sites, and how they have evolved to differ from
one another in the various aspects ofRNAtargeting.
A physical description of RNA targetencoding
motifs will also be essential for us
to understand how transport RNPs are assembled
around cis-acting elements, how such
RNP formation shapes the molecular architecture
of transport-competent particles that
have been described in various systems, and
how these particles are delivered to their final
destination sites.
Similarly, although much has been learned
about translational control mechanisms, our
understanding of how translation is repressed during transport and at the destination site remains rudimentary. It is poorly understood
how repression is implemented in transport
granules, and how mRNAs are released from
granules. When and how are released RNAs
activated (i.e., derepressed) for translation,
and what are the roles of untranslated RNAs
in these mechanisms? These questions are
particularly relevant at synaptic sites in neurons
where translational repression/activation
is assumed to be controlled by the local activity
status (Smith et al. 2005).
Activity-dependent local protein synthesis
is considered one of the key mechanisms in
the long-term modulation of synaptic connections,
and the pathway is thus seen underlying
higher brain functions, including learning
and memory. This area will certainly
attract more attention, in part because it appears
that neurological diseases such as the
Fragile X Syndrome are causally related to
RNA localization and/or translation at synaptic
sites. However,we are still far from arriving
at a clear picture of the underlying molecular
mechanism and the way it is disrupted in the
disease. To understand the disease, it appears,
it will be necessary that we first understand
the codes.
Сайт создан в системе
uCoz 

 Figure 2
Cap-dependent translation initiation in
eukaryotes. Recruitment of the 43S preinitiation
complex to the mRNA, mediated by factors of the
eIF4 family and poly(A) binding protein (PABP),
results in the formation of a 48S complex at the
AUG initiator codon. Alternatively to the scenario
shown here, eIF4E may remain bound to the cap
during scanning (resulting in a looping-out of the
5 UTR; Jackson 2000); in general, it remains to
be established at which point after initial
cap-binding the eIF4 factors dissociate from the
mRNA and from PABP. Translation may also be
initiated in cap-independent fashion, for instance
by binding of the 43S complex to an internal
ribosome entry site (IRES), which is typically
located directly upstream of the AUG start codon
(not shown; see Hellen & Sarnow 2001). Some
factors (e.g., eIF5) have been omitted for clarity.
Figure 2
Cap-dependent translation initiation in
eukaryotes. Recruitment of the 43S preinitiation
complex to the mRNA, mediated by factors of the
eIF4 family and poly(A) binding protein (PABP),
results in the formation of a 48S complex at the
AUG initiator codon. Alternatively to the scenario
shown here, eIF4E may remain bound to the cap
during scanning (resulting in a looping-out of the
5 UTR; Jackson 2000); in general, it remains to
be established at which point after initial
cap-binding the eIF4 factors dissociate from the
mRNA and from PABP. Translation may also be
initiated in cap-independent fashion, for instance
by binding of the 43S complex to an internal
ribosome entry site (IRES), which is typically
located directly upstream of the AUG start codon
(not shown; see Hellen & Sarnow 2001). Some
factors (e.g., eIF5) have been omitted for clarity. 