У большинства видов животных половое размножение нуждается в слиянии двух гаплоидных гамет, Мейоз, который гарантирует образование этих высоко специализированных клеток является длительным процессом. В ооцитах животных короткий период, называемый мейотическим созреванием, который включает и мейоз, абсолютно критический для продукции функциональных гамет. Во время этого периода ооцит подвергается двум клеточным делениям без промежуточной фазы репликации ДНК. Эти деления состоят из последовательных клеточных событий, которые контролируются с помощью цитоскелета ооцита и высоко регулируются во времени (Рис. 1). Микротрубочки формируют веретено и разводят гомологичные хромосомы во время первого мейотического деления (MI, редукционное деление) и сестринские хроматиды во время второго деления (MII, эквационное деление). Кроме того, микротрубочки веретена и активновые микрофиламенты контролируют асимметрию этих мейотических делений. Оба деления продуцируют малые клетки, наз. полярными тельцами, и крупную клетку ооцит, которы сохраняет свои размеры и все материнские запасы, накопленные во время оогенеза.
Spindle assambly in the oocyte relies on chromosomes
Chromosomes control bipolar spindle assembly
Во время митозов сборка веретена управляется в значительной степени центросомами, основными местами полимеризации микротрубочек ( Ou & Rattner,2004). C началом митоза одиночная центросома удваивается и две центросомы отделяются и мигрируют к противоположным сторонам ядра. В результате, как только ядерная оболочка разрывается растущие микротрубочки, исходящие из центросом взаимодействуют с хромосомами и быстро организуются в биполярное веретено. Ооциты, лишенные центросом и микротрубочек, полимеризуют в дискретных сайта цитоплазмы т.наз. MTOCs (Microtubule organizing centres). В ооцитах мышей, где множественные MTOCs разбросаны по цитоплазме, хромосомы ведут к образованию веретена. В начале MI сразу после GVBD (Germminal vesicle breakdown) MTOCs преимущественно активируются и/или рекрутируются вблизи хромосом, а микротрубочки преимущественно стабилизируются в этой области. Случайно ориентированные растущие микротрубочки затем прогрессивно организуются в биполярный массив вокруг хромосом (Рис. 2).
Соотв. роли хромосом, микротрубочек и ассоциированных факторов в сборке мейотического веретена прояснены в исследованиях микротрубочек во фрагментах ооцитов мышей, лишенных хромосом, наз. цитопластами (Brunet et al., 1998). В цитопласте микротрубочки формируют стабильное биполярное веретено. Это указывает на то. что в ооцитах мышей микротрубочки обладают потенциалом полимеризоваться и организовываться в отсутствие хромосом в биполярные структуры благодаря активности моторных белков и MAPs (Microtubule associated proteins). Это свойство играет существенную роль в формировании веретена ооцитов мышей. Часто несколько биполярных веретен формируются в ооцитарных цитопластах мышей, демонстрируя, что хромосомы необходимы для ограничения активности MTOCs и организации микротрубочек в их близи. Это ограничение является критическим для формирования уникального веретена в большом объеме ооцита. Более того, размер наблюдаемого биполярного веретена м. варьировать от одного цитопласта к др. Это указывает на то, что хромосомы вовлекаются в контроль размера веретена, наиболее вероятно посредством локальной активации факторов, стабилизирующих микротрубочки. Недавно, центральная роль хромосом в сборке веретена подтверждена на др. экспериментальных системах. Эта роль необходима для сборки веретена в присутствии или без центросом и базируется на активности малой GTPase 'Ran' (Karsenti & Vernos, 2001; Kalb et al. 2002; Zheng 2004). Во время М фазы Ran связывается с GTP (RanGTP) концентрируется вблизи хромосом и локально активирует различные факторы, необходимые для формирования веретена (Hetzer et al., 2002), Caudron et al., 2005). Этот механизм наиболее вероятно играет роль во время мейотических делений ооцитов мыши. Среди охарактеризованных эффекторов RanGTP, TPX2 (Targeting protein for Xenopus kinesin-like protein 2) ответственен за RanGTP зависимую полимеризацию микротрубочек вокруг хромосом (Wittman et al., 2000, Gruss et al., 2001). TPX2 экспрессируется в ооцитах мыши и ассоциирует с микротрубочками веретена, как и в др. системах. TPX2 скорее всего участвует в формировании веретена в ооцитах мышей путем поддержания сборки микротрубочек вблизи хромосом. Др. RanGTP эффекторы участвуют в сборке веретена путем стабилизации микротрубочек или контроля организации микротрубочек ещё не изучены на ооцитах мышей. DOC12R (Deleted oral cancer 1 related), первоначально идентифицированный в ооцитах мышей как субстрат для МАР киназы, м.б. новым RanGTP эффектором (Terret et al., 2003a). Этот белок взаимодействует с importins (Terret and Verlhac личн. сообщение), как показывают др. RanGTP эффекторы. Он локализуется на веретене во время мейотической М фазы. DOC1R истощение в ооцитах индуцирует образование звезд микротрубочек во всей цитоплазме (Terret et al., 2003a). DOC1R м.б. необходим для ограничения градиента RanGTP вблизи хромосом в ооцитах.
Chromatin contrals methaphase plate formation
Как только достигается сборка биполярного веретена, хромосомы располагаются на экваторе веретена и формируют метафазную пластинку. Во время митозов это расположение отслеживается с помощью кинетохор, структур ассоциированных с центромерами обеих сестринских хроматид. Кинетохоры отлавливают, стабилизируют микротрубочки и формируют стабильное 'kinetochore fiber' (K-fiber). Если К-волокна соединяют обе кинетохоры одной хромосомы с противоположными полюсами веретена, то хромосомы транспортируются к экватору веретена (Biggins & Walczak, 2003). В мышиных ооцитах во время первой мейотической М фазы расположение бивалентов хромосом в метафазной пластинке использует альтернативные механизмы. В противоположность ситуации, описанной для митозов, кинетохоры, ассоциирующие с бивалентами, не компетентны закреплять и/или стабилизировать микротрубочку во время большей части первой мейотической М фазы. Однако, в отсутствие К-волокон биваленты хромосом тем не менее транспортируются в направлении эксатора веретена и сохраняются в этой области в течение нескольких часов (Brunet et al., 1999) Было показано, что микротрубочки веретена развивают толкающие силы на хромосомные плечи. Эти силы, называемые также 'polar wind', обеспечиваются микротубулярными моторами, ассоциированными с хроматином (Brunet & Vernos, 2001). Два ассоциированных с хроматином мотора Kif 4 и Kif 2, соотв. гомологи kinesin-like proteins Xklp1 и Xkid Xenopus, по-видимому, необходимы для congression бивалентов в ооците. Xklp1 может закреплять микротрубочки на хромосомных плечах путем 'freezing' динамических свойст микротрубочек, контактирующих с плечами (Vernon et al., 1995; Bringmann et al., 2004). Xkid необходим для конгрессии хромосомных плеч (Antonio et al., 2000, Funabiki & Murray 2000). Хотя в соматических клетках polar wind не существенен (Levesque & Compton, 2001), он управляет конгрессией хромосом в ооцитах.
После этой продолжительной прометафазы активация кинетохор запускает формирование К-волокон, ведущих к аккуратному расположению хромосом в метпафазной пластинке (Brunet et al., 1999). Механизм, ведущий к поздней активации кинетохор в ооцитах мышей еще предстоит выяснить. Кинетохоры могут быть подвержены очень медленному и оригинальному созреванию. Молекулярные компоненты кинетохор, включая членов SAC (Spindle assembly checkpoint) кухни или моторы, подобные kinesin CENP-E, присутствуют на кинетохорах непосредственно после GVBD. Это подтверждает, что созревание кинетохор не регулируется с помощью рекрутирования компонентов кинетохор, а скорее всего с помощью пост-трансляционных модификаций некоторых из этих факторов. MI продолжительность предопределяется кинетикой активности MPF (Maturation promoting factor). Высокий уровень активности MPF достигается только позднее в MI, и может индуцировать пост-трансляционные модификации компонентов кинетохор, ведущих к образованию К-волокон. Фактически формирование К-волокон остается единственным "черным ящиком" митозов. Лишь немногие белки, участвующие в этом процессе, были охарактеризованы (Biggins & Walczak, 2003) и их роль и регуляцию во врмея MI еще предстоит изучить в ооцитах.
The assymmetry of oocyte divisions depends on chromosomes
Spindle motility depends on interactions between actin and the chromosomes
Оба мейотических деления ооцитов мыши асимметричны. Они продуцируют маленькую клетку, наз. полярным телом и ооцит, который сохраняет исходные размеры. Такая асимметрия гарантируется позиционированием веретена на периферии огромного ооцита. MI веретено обычно формируется в центре ооцита и мигрирует по направлению периферии (Longo & Chen, 1985; Maro &Verlhac, 2002). Первое поялрное тельце выталкивается по оси миграции. MII веретено образуется на периферии ооцита и сохраняется под плазматической мембраной во время ареста метафазы. Оплодотворение или экспериментальная активация запускает ротацию веретена и выталкивание второго полярного тельца (Maro & Verlhac, 2002; Maro et al., 1984). Наши знания о механизмах асимметричных делений получены в исследованиях митотических клеток (Betschinger & Knoblich, 2004), у которых позиционирования веретена зависит от от взаимодействий между клеточным кортексом и 'astral' микротрубочками, которые связывают полюса веретена с клеточным кортексом (Cowan & Hyman, 2004). Ооциты, лишенные центросом и веретена, лишены в свою очередь и астральных микротрубочек: альтернативные механизмы могут обеспечивать положение веретена в ооците. В ооцитах мышей миграция и закрепление ветертена нуждаются в актиновых микрофиламентах, но не в микротрубочках (Longo & Chen, 1985; Maro et al., 1986, Van Blerkom & Bell, 1986; Verlhac et al., 2000a, Leader et al., 2002; Maro & Verlhac 2002) в противоположность тому. что описано для ооцитов у др. видов (Weber et al., 2004; Yang et al., 2005). В ооцитах мышей эти процессы покоятся на оригинальных взаимодействиях между микрофиламентами и самими хромосомами, но молекулярные основы таких взаимодействий не известны. Во-первых, организация и активация актиновых микрофиламент в ооцитах остается еще охарактеризовать. Необходимы ли ассоциированные с актином моторы (миозины)? Возможная роль miosin II в формировании полярных тел была предположена Simerly et al (1998), но механизм с ним связанные неизвестен. Каковы компоненты связи хромосом с актиновой сетью? ParD6A, член семейства PAR (PARtitioning defective; Ahringer, 2003) может быть вовлечен в этот процесс. Во время MI, PARD6A концентрируется на той половине веретена, которая ведет к миграции. После деполимеризации микротрубочек он концентрируется на поверхности хромосом, ориентированных в направлении кортекса (Vinot et al., 2004). Он может быть частью мультибелкового комплекса, связывающего хромосомы, микротрубочки актиновые филаменты и поддерживает подвижность и закрепление веретена.
Chromosomes control the cortical reorganization of the mouse oocyte
В ооцитах мышей эксцентрическая позиция веретена ассоциирует с локальной реорганизацией кортекса ооцита (Рис. 1). Этот кортикальный домен появляется во время миграции веретена и сохраняется поверх веретена во время MII. Реорганизация проявляется локальной потерей микроворсинок (Johnson et al., 1975), накоплением актиновых микрофиламент под плазматической мембраной (Maro et al., 1984; Longo & Chen, 1985) и удалением кортикальных гранул (Deng et al., 2005). Функция этого процесса неясна. Он может служить для генерации домена ограничения для сборки контрактильного актинового кольца и цитокинеза, чтобы минимизировать размер полярного тельца. Реорганизация кортекса зависит от актиновой сети, хромосом, но не микротрубочек (Maro et al., 1986; Van Blerkom & Bell, 1986; Verlhac et al., 2000a; Maro & Verlhac, 2002). Кроме того, она не нуждается в физических взаимодействиях между хромосомами и кортексом. Т.о., хромосомы сами по себе запускают реорганизацию с помощью дистанционного эффекта. Молекулярный механизм не изучен.
Итак, асимметрия делений мышиного ооцита зависит от оригинальной роль хромосом на организацию актиновой сети. Прямые взаимодействия между хромосомами и актином управляют положением веретена. Кроме того, хромосомы обеспечивают кортикальную реорганизацию актина путем дистанционного эффекта. Сходство с ролью хромосом в организации микротрубочек в ооците разительно. Поскольку микротрубочки имеют отношение, то ассоциированные с хроматином моторы обеспечивают физические взаимодействия между хромосомами и микротрубочками веретена. Кроме того, хромосомы контролируют в их близи активацию факторов, необходимых для сборки веретена (Karsenti & Vernos, 2001; Kalab et al., 2002; Zheng, 2004). На базе этого сходства мы предполагаем, что у мышей и в целом в ооцитах млекопитающих, хромосомы действуют как 'territory landmark' для организации как микротрубочек, так и актиновых филамент внутри крупной цитоплазмы. Этот пространственный контроль существенен для достижения двух асимметричных делений, ведущих к образованию функциональных гамет.
Cyclin B coordinates meiotic maturation
Во время клеточного цикла М-фаза контролируется посредством активации и инактивации MPF (Masui & Markert, 1971), состоящего из киназы p34cdk1 и её регуляторной субъединицы, cyclin В (Lohka et al., 1988; Doree & Hunt, 2002). Модуляция концентрации циклина с помощью синтеза и деградации является очень важной для контроля активности MPF (Murray & Kirschner, 1989). Митотические циклины синтезируются в течение всего клеточного цикла и распадаются во время короткого периода при переходе от метафазы к анафазе (Evans et al., 1983) с помощью 6 ubiquitin пути (Glotzer et al.,1991; Hershko et al., 1991). В ооцитах все клеточные события имеют место во время мейотического созревания и ведут к двум асимметричным делениям клеток у упорядоченной по времени последовательности. Контроль времени мейотического созревания наиболее вероятно зависит от cyclin B. Изменения в уровне циклина В, как полагают, меняют активность MPF, регулируя не только время фаз клеточного цикла во время мейоза, но и упорядоченность событий, ведущих к формированию функциональных мейотических веретен и асимметричных делений.
Cyclin B metabolism control the timing of meiotic maturation
MPF активируется при GVBD (Рис. 3) и увеличивается вплоть до достижения плато в конце первой мейотической М фазы (Choi et al., 1991; Verhlac et al., 1994). Временное снижение активности MPF происходит во время перехода между мейозом I и мейозом II. MPF быстро реактивируется перед началом вступления в мейоз II и поддерживается на высоком уровне во время ареста метафазы II.
Созревший ооцит содержит только небольшое количество cyclin B, но достаточное для индукции вступления в первую мейотическую М-фазу (Hampl & Eppig, 1995; Winston, 1997; Hashimoto & Kishimoto, 1988; Ledan et al., 2001). Он проникает в зародышевый пузырек непосредственно перед GVBD (Marangos & Carroll, 2004). После GVBD уровень синтеза cyclin B прогрессивно увеличивается, достигая максимума в конце первой мейотической М фазы и вновь синтезированный белок ассоциирует немедленно с p34cdk1 kinase, чтобы сформировать активный комплекс (Hampl & Eppig, 1995; Winston, 1997; Ledan et al., 2001). Деградация cyclin B необходима для выталкивания полярного тела (Ledan et al., 2001; Herbert et al., 2003; Terret et al., 2003b). Т.о., активность MPF регулируется с помощью зависимого от трансляции механизма, который предопределяет уровень синтеза циклина.
Роль синтеза cyclin B1 в контроле продолжительности мейотического созревания демонстрируется с использованием двух линий мышей, CBA/Kw и КЕ, которые отличаются существенно по времени мейотического созревания (Polanski et al., 1998). KE ооциты требуют приблизительно на 3-4 ч дольше, чем ооциты CBA/Kw для вычленения первого полярного тела. Скорость синтеза cyclin B1 во время прометафазы I выше у CBA/Kw, чем у КЕ ооцитов, хотя общий уровень белкового синтеза и количество мРНК cyclin B1 идентичны в обеих линиях. Это указывает на то, что трансляция cyclin B1 контролируется по-разному в этих линиях (Polanski et al., 1998). Среди разных механизмов, которые контролируют экспрессию материнских мРНК, полиаденилирование участвует в трансляции cyclin B1 в ооцитах Xenopus и мышей (Barkoff et al., 2000; de Moor & Richter, 1999; Ledan et al., 2001; Tay et al., 2000). Наконец, повышение синтеза cyclin B1 в КЕ ооцитах ускоряет выталкивание первого полярного тельца.
The formation of the first meiotic spindle is regulated by cyclin B levels
Во время MI образование функционального веретена очень медленный процесс. Эта кинетика коррелирует с прогрессивным увеличением активности MPF (Polanski et al., 1998, Рис. 3). Активность MPF необходима для GVBD (необходимого для вхождения в М-фазу), она позволяет образование только одиночной звезды из микротрубочек вокруг конденсирующихся хромосом (Рис. 4). Первый порог в активности MPF необходим для организации микротрубочек в биполярную структуру. Напротив, дальнейшая миграция хромосом в направлении экватора веретена не зависит от изменений в уровнях MPF. Второй порог активности MPF необходим в конце MI для активации кинетохор (Polanski et al., 1998; Brunet et al., 1999), это позволяет отлавливать и стабилизировать микротрубочки с помощью кинетохор и производить дальнейшую сборку устойчивых К-волокон. Образование полного набора К-волокон быстро сопровождает начало анафазы. Эти данные указывают на то, что активность MPF контролирует образование функционального веретена в ооците. MPF может также косвенно контролировать положение веретена. Подобно активации кинетохор, миграция веретена единственно оказывается инициированной как только активность MPF достигает наивысшего уровня. Т.о., MPF может контролировать активность белков ассоциированных с микрофиламентами (Satterwhite et al., 1992) и в свою очередь индуцировать миграцию ветерена: участвующие механизмы и молекулы остаются не известны.
Coupling time and space
В митозах механизм контроля качества, наз. spindle assembly chechpoint гарантирует аккуратное расхождение хромосом путем задержки начала анафазы до тех пор, пока все хромосомы не прикрепятся корректно к веретену посредством своих кинетохор. Checkpoint веретена предупреждает анафазу путем ингибирования anaphase promoting complex/cyclosome (APC/C), Е3 ubiquitin ligase, чья активность необходима для начала анафазы и выхода из митоза (Taylor et al., 2004). Этот checkpoint зависит от активности Bub (Budding uninhibited by benzimidazole) и Mad (Mitotic arrest-deficient) кинетохорных белков (Рщне уе al., 1991; Li & Murray, 1991). До недавнего времени считалось, что мейотические деления у самок млекопитающих склонны к ошибкам, т.к. они лишены функционального checkpoint веретена ( у людей определяется 20% зародышей с аномальным содержанием хромосом как следствие ошибок, возникающих во время мейоза I). Сегодня четко установлено, что активность APC/C необходима для хода мейоза и что checkpoint сборки веретена активен в ооцитах мышей (Brunet et al., 2003) посредством компонентов checkpoint Bub1 (Tsurumi et al., 2004; Homer et al., 2005).
Как и ожидалось инактивация КПП сборки веретена в ооцитах мышей ускоряет ход MI. Однако, первая мейотическая М-фаза укорачиваться только на 2-3 ч (Tsurumi et al., 2004; Homer et al., 2005), указывая тем самым, что АРС/С неактивен в течение большей части первой мейотической М-фазы. Т.о., активация АРС/С д. происходить только, когда активность MPF достигает второго порогового уровня, необходимого также для активации кинетохор. Checkpoint сборки веретена не контролирует продолжительность первой мейотической М-фазы, а скорее задерживает переход от метафазы к анафазе до тех пор, пока микротрубочки веретена не присоединятся к кинетохорам и хромосомы не расположатся в виде метафазной пластинки (Рис. 4).
Т.к. этот переход осуществляется, когда веретено достигает кортекса яйца (Verlhac et al., 2000a), то было бы удивительным, если бы существовал checkpoint отслеживания положения веретена. Такой checkpoint существует у почкующихся дрожжей: mitotic exit network (MEN), определяющий правильное положение одного полюса веретена во вновь формируемой почке (D'Armours & Amon, 2004). Уникальный случай в ооцитах мышей: в mos-/- ооцитах веретено не мигрирует, переход от метафазы к анафазе происходит своевременно (Verlhac et al., 1996: 2000а), приводя к образованию крупных полярных тел. Крупные полярные тела наблюдались таже, когда мейотической созревание ускорялось при инактивации checkpoint сборки веретена (Homer et al., 2005).
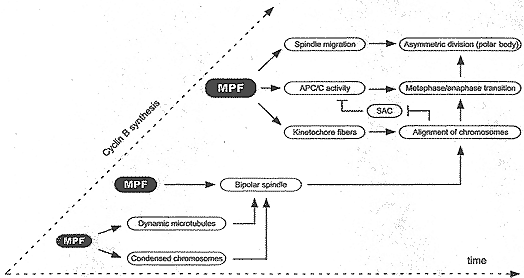 Figure 4. Cyclin B synthesis control the timing of meiotic maturation through the level of MPF activity
Figure 4. Cyclin B synthesis control the timing of meiotic maturation through the level of MPF activity
Т.о., уровни cyclin B посредством регуляции активности MPF, по-видимому, синхронизируют разные события, ведущие к формированию полярных тел (Рис. 4): закладка К-волокон (необходимых для финального расположения хромосом в метафазной пластинке), активация АРС/С (необходимого для разделения хромосом и выхода из первой мейотической М-фазы) и миграция веретена (необходимая для асимметричных делений). Время необходимое для образования кинетохорных волокон и последующего расположения пар гомологичных хромосом д. позволять мигрировать веретену до инактивации checkpoint сборки веретена , приводящей к переходу от метафазы к анафазе.
The peculiar case of the metaphase II spindle
В противоположность первому мейотическому делению вступление во второе сходно с митозом: активность MPF быстро увеличивается и быстро формируется веретено. Более того, хромосомы мейоза II идентичны митотическим хромосомам, состоящим из сестринских хроматид с активными кинетохорами. Однако, происходит арест ооцита в метафазе на многие часы до оплодотворения, при этом хромосомы точно расположены в метафазной пластинке благодаря активности высоких уровней MPF. Этот арест метафазы поддерживается благодаря активности Cytostatic factor (CSF; Masui & Markert, 1971).
Присутствие CSF продемонстрировано в ооцитах позвоночных путем переноса цитоплазмы из в метафазе II арестованных ооцитов в делящихся эмбрионов лягушек (Masui & Market, 1971) и мышей (Masui & Market, 1971; Kubiak et al., 1993), что приводило к аресту митозов. Активность CSF необходима для активации пути Mos-MAP kinase (Sagata et al., 1989; Haccard et al., 1993; Colledge et al., 1994; Hashimoto et al., 1994; Verlhac et al., 1996). Сигнальный путь, выявленный в работах с Xenipus в основном на экстарктах ооцитов, вглядит подобно линейному треку от синтеза Mos до АРС/С ингибитора Mad2 (Tunquist & Maller, 2003). Mos путь в ооцитах мышей (Рис. 5), выявленый в исследованиях in vivo на Mos-/- ооцитах, боле сложен (Verlhac et al., 1996; 200b; Lefebvre et al., 2002; Terret et al., 2003a; Dumont et al., 2005). Хотя считается, что только потребность индуцировать собственно арест метафазы нужна для поддержания высокой активности MPF, а недавно было продемонстрировано, что организация веретена поддерживается с помощью специфического механизма (Рис. 5).
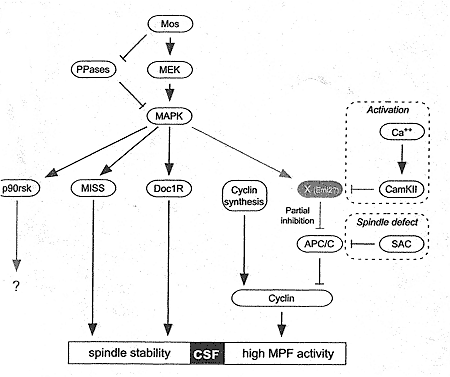 Figure 5 The metaphase it arrest in mouse oocytes. The com-ponents and interactions shown in grey remain to be discovered.
Figure 5 The metaphase it arrest in mouse oocytes. The com-ponents and interactions shown in grey remain to be discovered.
Keeping a metaphase spindle
Метафаза является временным состоянием митоза. В CSF арестованных ооцитах она может длиться несколько ч. или даже дней. Т.к. микротрубочки веретена замещаются очень быстро, как и в митозах, то мейотическое веретено остается стабильной структурой в течение всего ареста (de Pennart et al., 1988; Gorbsky et al., 1990) с хромосомами корректно расположенными на экваторе веретена (Brunet et al., 1999). Специфический механизм и компоненты необходимы для поддержания такой стабильной структуры (Lefebvre et al., 2002, Terret et al., 2003a). MISS (Map kinase-interacting and spindle-stabilising protein) и DOC1R являются двумя субстратами МАР киназ, которые ассоциированы с веретеном в метафазе II арестованных ооцитов (Lefebvre et al., 2002; Terret et al., 2003a). DOC1R накапливается во время мейотического созревания, тогда как MISS присутствует только во время MII. DOC1R истощение ведет к формированию удлиненного веретена, обогащенного астральными микротрубочками с многочисленными звеждочками из микротрубочек в цитоплазме во время MII. ООциты, истощенные по MISS, обнаруживают дизорганизованные веретена MII, часто лишенные одного полюса или имеющие длинные микротрубочки, исходящие из обоих полюсов и цитоплазматические звездочки. В обоихз случаях MII веретено образуется нормально, но позднее становится дизорганизованным, указывая тем самым на роль обоих белков в поддержании структуры веретена во время ареста. MISS и DOC1R регулируются с помощью множественных фосфорилирований благодаря активности МАР киназы и др. киназ, подобных MPF. Т.о., кооперация между MPF и МАР киназным путем (ведущим к активности CSF) действует для поддержания структуры веретена, когда состояние метафазы сильно затягивается.
Keeping MPF high
Снова метаболизм циклина играет ключевую роль во время ареста метафазы II (Рис. 5). Он поддерживается благодаря постоянному сбалансированному синтезу и деградации циклина (Kubiak et al., 1993). Равновесие между этими двумя процессами зависит от CSF, который замедляет деградацию и постоянного синтеза cyclin B, который поддерживается на высоком уровне (Winston, 1997). После отделения первого полярного тельца деградация циклина останавливается (Ledan et al., 2001)? а АРС/С реактивируется только после вступления во вторую мейотическую М-фазу с помощью высокого уровня MPF. Деградация циклина может происходить только в ооцитах мейоза II как только завершится формирование веретена и хромосомы расположатся в метафазную пластинку благодаря удалению ингибирующего эффекта checkpoint сборки веретена. Во время ареста CSF, SAC неактивен, но он может быть реактивирован, если организация веретена нарушена, что ведет к полному ингибированию пути деградации циклина (Kubiak et al., 1993; Winston et al., 1995; 1997). Было предположено у Xenopus, что CSF арест обеспечивается благодаря активности p90rsk (Bhatt & Ferrell, 1999; Gross et al., 1999) и белков checkpoint сборки веретена Bub 1 и Mad 2 (Tunquist et al., 2002; 2003), стоящих ниже пути Mos-MAP kinase. Однако, в ооцитах мышей было установлено, что ни p90rsk ( характерный субстрат для МАР киназы в ооцитах мышей; Kalb et al., 1996), ни Bub1 или Mad2 не нужны для ареста метафазы II (Tsurumi et al., 2004; Dumont et al., 2005). Т.о., АРС/С ингибитор, ответственный за поддержания высокого уровня активности MPF во время ареста метафаза II, ещё не идентифицирован. Наиболее вероятным кандидатом является Emi2/Xerp1 (Liu & Maller et al., 2005; Rauh et al., 2005; Schmidt et al., 2005; Tung et al., 2005), хотя он, по-видимому, не регулируется с помощью пути Mos-MAP kinase в экстрактах яиц Xenopus. Emi2/Xerp1 является мишенью для CamKII, киназы, которая временно активируется с помощью Са++ при оплодотворении и обеспечивает CSF инактивацию (Lorca et al., 1993; Winston and Maro, 1995).
Т.о., ооцит во время ареста метафазы II находится в очень динамичном состоянии, с высоко динамичным состоянием микротрубочек веретена, удерживающих хромосомы точно расположенными в метафазной пластинке (Brunet et al., 1999) со стабильным уровнем MPF, зависящим от постоянного синтеза cyclin B, сбалансированного с помощью регулируемой деградации (Kubiak et al., 1993). Это равновесие регулируется с помощью нижестоящий мишеней пути Mos-MAP kinase, некоторые из которых ещё предстоит выявить.
Conclusion
The production erf functional female gametes is essential for the propagation of all mammalian species. It is dependent to a large extent on the dynamic organization of the oocyte cytoskeleton during the two successive meiotic divisions. Defects in the cytoskeleton organization during these divisions can first lead to chromosome segregation emirs with dramatic consequences. In humans, it is estimated that 15-20% of oocytes display chromosome abnormalities linked to segregation errors (Pellestor ef a/. 2005). Moreover, at least 5% of all pregnancies are aneuploid as a result of such errors in oocytes, that strongly correlate with increased maternal age (Hassold & Hunt 2001). The recent demonstration of the existence of a functional spindle checkpoint in mammalian oocytes is essential. It implies that in addition to spindle checkpoint deficiencies (intensively studied in mitotic systems), other uncharacterized mechanisms contribute to the high frequency of missegregations in the mammalian oocyte. The elucidation of the chromosome-dependant mechanisms controlling microtubule and actin networks organization in the oocyte may be of a great importance to identify the cellular and molecular basis of aneuploidy.
In addition, the formation of a mature oocyte also relies on microtubule and actin microfilament-dependent processes. Anomalies in any of these processes can prevent the production of competent oocytes and lead to fertility problems. A striking example is the female sterility of formin 2 knockout mice, formin 2 encodes an actin-poly-merizing protein involved in spindle migration in the oocyte (Leader ef a/. 2002). Similarly, cytoskeleton-depen-dent asymmetry of the meiotic division maintains the maternal stores accumulated during oogenesis in the oocyte (Matzuk ef a/. 2002). Loss of asymmetry in the meiotic division, and more generally disorganization of the oocyte cytoskeleton are characteristics of ageing or low-quality gametes (Webb ef al. 1986, Diaz & Esponda 2004).
Understanding all the dynamic processes involved in the formation of a mammalian oocyte competent for fertilization is a major goal for reproductive biologists. Some of the principles at play during the meiotic divisions of the mammalian oocytes are just starting to be understood, but the mechanisms remains to be elucidated at the cellular and molecular levels. The mouse oocyte, which allows the combination of molecular cell biology with genetics, appears more and more as the system to investigate these questions.
Сайт создан в системе
uCoz Figure 4. Cyclin B synthesis control the timing of meiotic maturation through the level of MPF activity
Figure 4. Cyclin B synthesis control the timing of meiotic maturation through the level of MPF activity Figure 5 The metaphase it arrest in mouse oocytes. The com-ponents and interactions shown in grey remain to be discovered.
Figure 5 The metaphase it arrest in mouse oocytes. The com-ponents and interactions shown in grey remain to be discovered.