Посещений:  ТАЙНА ПРОГРАММИРОВАНИЯ СЛОЖНЫХ ОРГАНИЗМОВ
ТАЙНА ПРОГРАММИРОВАНИЯ СЛОЖНЫХ ОРГАНИЗМОВ
|
|
Джон Маттик  В Мире Науки, 2005.- №1, С 27-35 |
Долгое время считалось, что за регуляцию работы генов человека отвечают исключительно белки. Ученые были в этом столь уверены, что просмотрели другую регуляторную систему, возможно, играющую ключевую роль в развитии и эволюции живых систем. Центральное место в ней занимает РНК.
ОБ АВТОРЕ:
Джон Маттик (John Mattick) – директор Института молекулярной биологии при Квинслендском университете. Был организатором и руководителем работ, связанных с исследованием генома, которые проводились в Австралии, первым в стране создал вакцину с помощью методов генной инженерии.
|
Coherent but overlapping expression of microRNAs and their targets during vertebrate development
Alena Shkumatava, Alexander Stark, Hazel Sive and David P. Bartel
doi: 10.1101/gad.1745709 Genes & Dev. 2009. 23: 466-481 | |
MicroRNAs (miRNAs) небольшие некодирующие РНК, которые управляют пост-транскрипционной репрессией белок-кодирующих генов. У позвоночных каждая высоко законсервированная miRNA обычно регулирует сотни мРНК мишеней. Однако точные взаимоотношения между экспрессией miRNAs и их мишенями остаются неясными, частично из-за скудости количественных данных по экспрессии на уровне клеток. Описывается количественный анализ уровней мРНК в miRNA-экспрессирующих клетках эмбрионов рыбок данио, захватывающий целиком домены экспрессии miRNA, после очищения до клеточного разрешения с помощью fluorescent-activated cell sorting (FACS). Основное внимание было уделено регуляции с помощью miR-206 и miR-133 в развивающихся сомитах и с помощью miR-124 в развивающейся ЦНС. Сравнение эмбрионов дикого типа с эмбрионами, лишенными miRNAs выявило предполагаемые мишени, которые реагируют на miRNAs, и выявило miRNA-обусловленную дестабилизацию мРНК от др. регуляторных эффектов. Для всех трех изученных miRNAs экспрессии miRNAs и их прогнозируемых мишеней обычно перекрывались. Немногие мишени экспрессировались на высоких уровнях в miRNA-экспрессирующих клетках в сравнении с остальной частью эмбриона, демонстрируя тем самым, что miRNA-обусловливаемая репрессия может действовать оппозитно остальным регуляторным процессам. Однако для большинства мишеней экспрессия была ниже в miRNA-экспрессирующих клетках, чем в остальной части эмбриона, указывая тем самым, что miRNAs обычно оперируют сочетано с др. регуляторными аппаратами клетки.
| |
|
Dnm3os, a Non-Coding RNA, Is Required for Normal Growth and Skeletal Development im Mice
T. Watanabe, T, Sato, T.Amano, Y.Kawamura, N.Kawamura, H. Kawaguchi, N. Yamashita, H. Kurihara, T. Nakaoka
Dev. Dyn. 2008.- V. 237.- P. 3738-3748 |
Ген Dnm3os транскрибируется в некодирующую РНК, состоящую из трех микроРНК , miR-199a, miR-199* и miR-214. После рождения Dnm3oslacZ/lacZ мыши обнаруживали некоторые аномалии скелета, включая черепно-лицевую гипоплазию, дефекты дорсальных нервных дужек и спинальных отростков позвонков и остеопению. При этом экспрессия miR-199a, miR-199* и miR-214 была существенно снижена.
Гипотеза – вещь небезопасная, особенно в науке. Обычно она возникает как наиболее приемлемое объяснение тех или иных фактов. Однако когда правомерность гипотезы сразу подтвердить не удается, она превращается в догму. А когда данных, не укладывающихся в ее рамки, становится слишком много, гипотеза в конце концов рушится.
Сегодня мы становимся свидетелями подобного развития событий в области
биологии, изучающей механизмы регуляции работы генов. Согласно центральной догме молекулярной биологии, господствовавшей более полувека, генетическая информация, заключенная в ДНК, сначала переводится на язык рибонуклеотидов (ДНК транскрибируется
в РНК), а затем – аминокислот (РНК транслируется в белки). Догма, кратко формулирующаяся как «один ген – один белок», предполагает,
что гены – это только те сегменты ДНК, которые кодируют белки. Как следствие, считается, что белки помимо структурных и ферментативных функций выполняют и регуляторные обязанности – они отвечают за активацию
и экспрессию генов.
Все эти положения основываются на результатах экспериментов, проводившихся на бактериях, таких как Escherichia coli, и других прокариотах (одноклеточных организмах, не имеющих
ядра). Их ДНК почти целиком состоит из белок-кодирующих последовательностей, разделенных короткими сегментами, которые регулируют работу примыкающих к ним генов.
Считалось, что белки отвечают за регуляцию работы генетического аппарата и у эукариот (многоклеточных организмов, чьи клетки содержат ядро) – животных, растений и грибов. Известный французский биохимик Жак Моно так сформулировал гипотезу универсальности центральной догмы: «То, что верно для E.coli, верно и для слона».
Но Моно оказался прав лишь отча-сти. Появляется все больше данных, что молекулярная биология эукариот не укладывается в рамки догмы. Белки действительно участвуют в регуляции работы эукариотических генов, но параллельно белковой функционирует другая, менее явная регуляторная система. Основной ее инструмент – особые РНК, действующие непосред-ственно на ДНК, другие РНК и белки. Возможно, эта РНК-система и отвечает за структурную сложность высших организмов (в том числе человека), немыслимую для одноклеточных. Далеко не все молекулярные биологи принимают эту революционную идею, хотя она позволяет ответить
на многие вопросы, касающиеся развития и эволюции живых организмов, и представляется весьма перспективной с точки зрения молекулярной медицины и фармакологии. Более того, с ее появлением открываются невиданные возможности в сфере создания сложных программируемых систем, как кибернетических, так и биологических.
Вездесущий «хлам»
В 1997 г. Филип Шарп (Phillip A. Sharp) и Ричард Робертс (Richard J. Roberts) из Массачусетского технологического института обнаружили, что устоявшиеся представления о системе регуляции генов дали трещину. Независимо друг от друга они показали, что гены эукариот – это не непрерывные белок-кодирующие нуклеотидные последовательности,
а мозаика из экзонов (сегментов ДНК, кодирующих участки белковых
молекул) и интронов (сегментов ДНК, обычно весьма протяженных, не кодирующих никаких белков). В ядре эукариотической клетки гены копируются от начала до конца, включая и все интроны, в результате образуется длинный первичный РНК-транскрипт. Он подвергается сплайсингу:
из него вырезаются интроны, а оставшиеся экзоны соединяются друг с другом, и образуется непрерывная белок-кодирующая последовательность
– матричная РНК (мРНК). На ней в цитоплазме синтезируется белок, а вырезанные интроны, казалось бы, не выполняющие никаких функций, просто разрушаются.Но если интроны совершенно бесполезны, то почему их так много в геноме эукариот? У человека на их долю приходится 95% длины среднестатистического белок-кодирующего гена. Вся эта масса генетического материала долгое время считалась эволюционным
«хламом», неким рудиментом, оставшимся с тех времен, когда еще не было никаких клеточных организмов, а фрагменты белок-кодирующих
нуклеотидных последовательно-стей каким-то образом соединялись друг с другом, образуя первые гены. Возможно, интроны сохранились в ходе эволюции сложных организмов, потому что были им чем-то полезны,
например, облегчали перетасовку сегментов белковых молекул и создание
новых, более выгодных комбинаций. А что касается прокариот, то они утратили интроны под давлением отбора, в ходе острейшей конкуренции в микромире. Для микроорганизмов они служили балластом.Возможно, интроны (а вместе с ними и межгенные сегменты ДНК) были отнесены к «хламу», потому что не было четкой корреляции между количеством
геномной ДНК организмов и степенью их сложности. Так, у некоторых
амфибий клеточной ДНК в пять раз больше, чем у млекопитающих.
Предполагалось, что степень сложности организмов гораздо лучше коррелирует с числом белок-кодирующих генов, но это не столь очевидно на фоне хаотического нагромождения интронов и других некодирующих последовательностей.
Затем, когда были секвенированы геномы самых разных организмов, обнаружилось, что корреляция между степенью их сложности и числом генов на самом деле низка. Геном совсем простого организма, круглого червя Caenorhabditis elegans (он состоит всего из 1000 клеток), содержит 19000 белок-кодирующих генов, что почти на 50% больше, чем у насекомых (13500), и примерно столько же, сколько у человека (~25000). Гораздо отчетливее со степенью сложности коррелирует количество некодирующей ДНК.
Парадоксально, но на долю белок-кодирующих последовательностей в геномной ДНК человека приходится менее 1,5%, основная же ее часть кодирует только РНК. Либо геном человека (и других сложных организмов) транскрибируется в значительной степени попусту, либо РНК, на которых не синтезируются белки, выполняют какие-то неизвестные функции.
Все эти рассуждения вместе с экспериментальными данными свидетельствуют о том, что многие гены в геноме сложных организмов (а возможно, и большинство генов) кодируют не белки, а только РНК, непосредственно выполняющие регуляторные функции (см. «Теневая часть генома», «В мире науки», №2 и 3, 2004 г. ). Возможно, РНК участвуют в передаче специфической информации, существенной для развития организмов и их эволюционных изменений.
Неутомимые труженики
Недавно появились данные, что интроны возникли в генах высших организмов на поздних этапах эволюции. Скорее всего они представляют собой производное от самосплайсирующихся мобильных генетических элементов, аналогичных тем, которые
 У прокариот на долю последовательностей, не кодирующих никаких белков, приходится незначительная часть геномной ДНК. У эукариот же – чем сложнее организм, тем больше в его геноме некодирующих последовательностей. Долгое время их считали балластом, но, по-видимому, именно они отвечают за степень сложности организмов. У прокариот на долю последовательностей, не кодирующих никаких белков, приходится незначительная часть геномной ДНК. У эукариот же – чем сложнее организм, тем больше в его геноме некодирующих последовательностей. Долгое время их считали балластом, но, по-видимому, именно они отвечают за степень сложности организмов.
называют интронами группы II. Эти элементы-паразиты, небольшие фрагменты ДНК, обладают удивительной способностью: встроившись в геном ДНК хозяина, они вырезаются из него сразу же после транскрипции. У бактерий интроны группы II были обнаружены случайно. Бактериальные клетки не содержат ядра, поэтому транскрипция и трансляция у них происходят почти одновременно: белок на РНК начинает синтезироваться сразу же, как только РНК образуется.
На вырезание интронной РНК из белок-кодирующей РНК просто нет времени, и в результате в большинстве случаев интроны выводят из строя гены, в которых они оказались – с печальными последствиями для бактериальной клетки. У эукариот транскрипция протекает в ядре, а трансляция – в цитоплазме, тем самым возникает временной интервал, в течение которого интронная РНК успевает подвергнуться сплайсингу. В результате для эукариот интроны оказываются не столь губительными.
Пока интроны сами отвечали за свое встраивание в геном и вырезание из него, их последовательности мало чем отличались от таковых у интронов группы II. Но затем у эукариот появилась особая структура, обеспечивающая сплайсинг, – сплайсосома, т.е. комплекс
множества белков и небольших молекул РНК, обладающих ферментативной
активностью. Ее функция заключается в правильном вырезании интронов из первичного РНК-транскрипта.
Освободив нейтроны от необходимости заниматься самосплайсингом, сплайсосомы фактически подтолкнули процесс эволюции и экспансии интронов. Любая случайная мутация в них, дающая хозяйскому организму преимущество, закреплялась в ходе естественного отбора. Интронные РНК смогли эволюционировать фактически независимо от белков. По существу
вторжение интронов в царство эукариот могло стать стимулом к новому
этапу эволюции на молекулярном уровне, и основными игроками на поле были не белки, а РНК. Место интронов – вовсе не на свалке эволюционной
истории, а у руля механизма, направляющего эволюцию.
Если это так, то нас ждут удивительные открытия. По-видимому, эукариоты (и особенно наиболее сложные) изобрели генетическую операционную систему и регуляторные сети гораздо более сложные, чем те, что имеются у прокариот: РНК и белки у них осуществляют регуляцию независимо друг от друга.
Считалось, что всю функциональную работу в клетках выполняют
белки, т.к. они имеют большое структурное и химическое разнообразие.
Однако РНК способны передавать информацию и осуществлять
регуляцию непосредственно на уровне генома: РНК могут содержать
короткие сигнальные участки со строго определенной последовательностью.
Руководствуясь внутренними инструкциями, они безошибочно распознают цель – специфические участки в других РНК и ДНК, а РНК/РНК- и РНК/ДНК-взаимодействия, в свою очередь, приводят к образованию структур, которые заставляют белки трансформировать сигналы в действия. Наличие у РНК «битовой строки» повышает точность системы и обеспечивает переход на качественно иной уровень, сходный с переходом от аналоговых систем к цифровым.Свидетельства существования регуляторной
системы на основе РНК многочисленны, хотя и фрагментарны. Если такая система имеется, то вполне резонно предположить, что многие гены эволюционировали исключительно благодаря изменениям в РНК, которая является звеном регуляторной системы более высокого порядка. И тому есть подтверждение: в ходе недавних исследований транскрипции у млекопитающих были обнаружены тысячи РНК, которые никогда не транслируются в белки (некодирующие РНК). К этой категории относится не менее половины (а возможно, 3/4) всех РНК-транскриптов.
Многие из РНК могут подвергаться процессингу с образованием небольших сигнальных молекул, специфичных в отношении определенных мишеней в регуляторной сети. У растений, животных и грибов уже обнаружены сотни «микроРНК», продуктов расщепления интронов и более длинных РНК-транскриптов, не кодирующих белки. Многие из них контролируют важные для развития организма процессы: поддержание стволовых клеток, клеточную пролиферацию, апоптоз.
РНК-сигналы, четко нацеленные на конкретные участки в РНК, ДНК и белках, могут самыми различными способами влиять на генетическую программу организма. Например, они могут сообщать тому или иному гену о транскрипции некой белок-кодирующей последовательности, и эта цепь обратной связи запустит механизм параллельной регулировки. Однако более важно то, что РНК-сигналы могут служить звеньями эффективной генетической программы, обеспечивающей регуляцию путей экспрессии генов. В таком случае ученые смогут хотя бы частично приподнять завесу тайны, окутывающую процессы клеточной дифференцировки и развития организма.
Регуляция развития
Формирование человеческого эмбриона начинается с оплодотворенной яйцеклетки. Претерпевая множество превращений, она развивается в совершенный организм, состоящий из 100 триллионов клеток, где каждая точно знает свое место и роль. Стержень трансформации – строжайшая регуляция экспрессии генов, которая, в свою очередь, опосредуется модификацией хроматина и альтернативным сплайсингом.
Хроматин – это нуклеопротеидный комплекс, составляющий хромосомы.
В клетке к входящим в его состав ДНК, белкам и другим молекулам могут
присоединяться специфические группы (например, метильные или ацетильные), которые дают команду к транскрипции соответствующих генов или, наоборот, заставляют их молчать. Согласно недавним исследованиям,
экспрессией генов заведуют РНК. От биохимических процессов
с участием РНК зависят сложные превращения в клетке, например, митоз (деление) или мейоз (образование предшественников яйцеклеток и спермиев), а также многие события на генетическом уровне.Альтернативный слайсинг обеспечивает образование широкого спектра разных РНК и белков в клетках различных тканей (при том, что клетки содержат одинаковый набор генов).
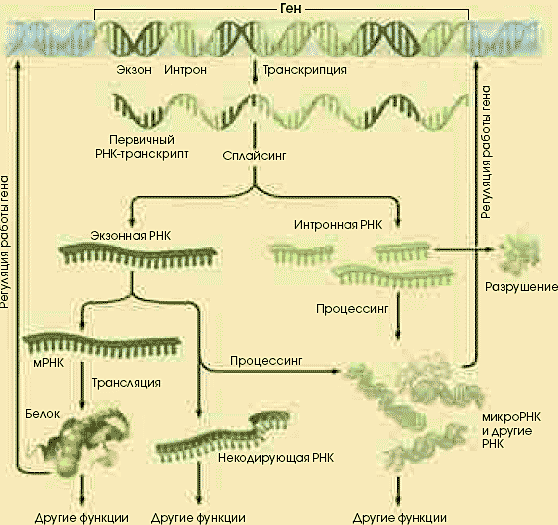 НОВЫЙ ВЗГЛЯД НА РЕГУЛЯЦИЮ РАБОТЫ ГЕНОВ ЭУКАРИОТ НОВЫЙ ВЗГЛЯД НА РЕГУЛЯЦИЮ РАБОТЫ ГЕНОВ ЭУКАРИОТ
Некоторые интронные РНК и даже часть экзонных принимают участие в регуляции работы генов, связываясь с молекулами ДНК, другими РНК и белками. Воздействуя на синтез белков на различных уровнях, некодирующие РНК могут служить дополнительным источником генетической
информации.
У млекопитающих альтернативному сплайсингу подвергается большая
часть первичных транскриптов. Их кодирующие участки после вырезания
интронов могут соединяться разными способами, в результате образуются белки более чем одного вида. Альтернативный сплайсинг имеет фундаментальное значение для развития животных и растений, правда, остается непонятным, как клетки узнают, какие белки им нужно синтезировать. Идентифицировано несколько белковых факторов, регулирующих альтернативный сплайсинг первичных транскриптов ряда генов. Ученые полагают, что альтернативность в разных условиях обеспечивают многочисленные комбинации нескольких основных факторов, незначительно отличающихся друг от друга. Однако так это или нет – до конца не установлено. Более вероятным и логичным представляется другой механизм – прямая регуляция сплайсинга с помощью РНК. Эти молекулы могут осуществлять беспрецедентно гибкую регуляцию, маркируя определенные последовательности в первичном транскрипте и диктуя сплайсосоме, как соединять фрагменты. Косвенным подтверждением идеи служат данные о сохранении в ходе эволюции нуклеотидной последовательности ДНК в местах сочленения интронов с экзонами. Кроме того, показано, что искусственно синтезированная антисмысловая РНК, связывающаяся в этих местах с ДНК, изменяет характер сплайсинга в культуре клеток и у животных. Конечно, было бы замечательно, если подобный феномен удалось бы продемонстрировать in vivo, но пока этого не произошло.
Регуляция уровня сложности
Такие рассуждения логично подводят нас к более общему вопросу: какая необходима информация, чтобы запро-ГРАММИРОВАть развитие сложного организма? Для создания любого сложного объекта (будь то какое-нибудь здание или живое существо) нужна документация
двух типов. Первая относится к строительным материалам, вторая
содержит инструкции по сборке. В биологии, в отличие от строитель-ства, оба типа документации исходят из одного источника – молекулы ДНК.
Белки (строительные блоки, из которых
состоят разные организмы) у разных видов в основном одинаковы: так, у человека и мыши аналогичны 99% белков. Многие из них есть и у других животных, а те, что принимают участие в основных внутриклеточных процессах, у всех эукариот сходны. Таким образом, разница в строении
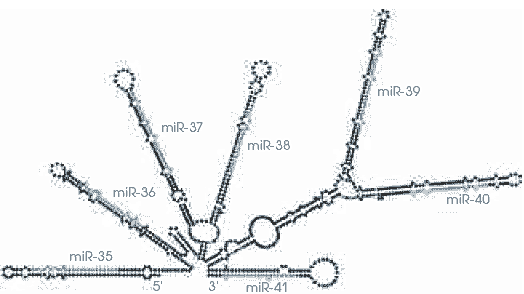 Молекулы микроРНК (синий цвет), образующиеся в результате процессинга некодирующих РНК, могут складываться сами на себя и связываться с другими, комплементарными им РНК с образованием самых причудливых структур. Таким образом они выполняют функции, которые обычно приписывают белкам. Молекулы микроРНК (синий цвет), образующиеся в результате процессинга некодирующих РНК, могут складываться сами на себя и связываться с другими, комплементарными им РНК с образованием самых причудливых структур. Таким образом они выполняют функции, которые обычно приписывают белкам.
животных происходит из различий в замыслах «архитекторов».Информация о самих структурных белках содержится в генах, которыми кодируются белки, но где находится таинственный архитектурный план? Большинство биологов полагает, что «сборкой» сложных организмов управляют внутриклеточные регуляторные факторы, которые по ходу строительства образуют между собой комплексы и связываются с молекулами
ДНК и РНК. Однако по данным Дэниела Деннета (Daniel C. Dennett) из Университета Тафта, подавляющее большинство возможных комплексов регуляторных факторов образуется случайным образом и не может выполнять
никаких функций. Организм же в своем развитии должен следовать четкому плану, иначе он будет нежизнеспособен. Создать замысловатую конструкцию не так уж сложно, гораздо труднее добиться ее функционирования. Для этого необходима информация совсем другого уровня и масштаба. Как показывают математические расчеты, объем информации с увеличением числа генов возрастает нелинейно (чаще всего имеет место квадратичная зависимость). Таким образом, процесс усложнения организмов имеет внутреннее ограничение, налагаемое непропорциональным увеличением объема данных, необходимых для контроля за их работой.
Число регуляторных белков у прокариот увеличивается пропорционально квадрату размера генома. Более того, экстраполяция показывает, что точка, в которой число новых регуляторных белков начинает превышать предел, налагаемый максимально возможным числом функциональных генов, близка к верхнему порогу размера бактериального генома.
Таким образом, усложнение прокариот в ходе эволюции могло сдерживаться не биохимическими и средовыми факторами, а недостаточностью регуляторной информации. Об этом свидетельствует и тот факт, что жизнь на Земле очень долго была представлена
исключительно микроорганизмами. Простое увеличение числа регуляторных факторов не могло удовлетворить все возрастающим требованиям,
предъявляемым усложняющейся системой.Выходом из тупика мог стать переход к совершенно другой системе регуляции, в которой действовали не белковые факторы, а особые молекулы РНК. Возможно, именно с таким
переходом связан быстрый рост числа многоклеточных организмов за последний миллиард лет. Этим же можно объяснить почти мгновенное в историческом масштабе появление самых разнообразных беспозвоночных
примерно 525 млн. лет назад, в Кембрийский период. Разумеется, феномен качественного скачка при переходе к иному, более тонкому механизму регуляции должен быть свойственен не только биологическим
системам. Резкое усложнение – это всегда результат появления более совершенных способов регуляции на более глубоком уровне.
Возможно, мы вообще неправильно понимали механизм геномного программирования и первопричины изменчивости организмов. 95% генома сложных организмов – это не «хлам», а очень важная функциональная
часть, имеющая огромное эволюционное значение.
Недавно ученые обнаружили, что геном позвоночных содержит тысячи некодирующих последовательностей, почти не изменившихся за миллионы лет. Они гораздо более консервативны, чем те, что кодируют белки, – а это уже полная неожиданность. Механизм подобного «замораживания
» неизвестен, но если какие-то участки ДНК абсолютно не изменились за время эволюции, значит, они участвуют в жизненно важной для организмов системе сетевого управления. Таким образом, геном человека и других сложных организмов нельзя рассматривать как безбрежную пустыню с немногочисленными оазисами – белок-кодирующими последовательностями. Это скорее информационный океан, в котором разбросаны островки генов, и жизнь на них регулируется с помощью РНК.
Существование разветвленной регуляторной сети на уровне РНК может
иметь большое значение для создания новых лекарственных средств и генетического скрининга. Такие известные наследственные заболевания,
как муковисцидоз и талассемия, связаны с катастрофическими повреждениями специфических белков, выводящими их из строя. Однако большинство генетических вариаций, которые детерминируют предрасположенность к различным болезням или индивидуальные особенности, определяются архитектурой некодирующей части генома. Уже установлена связь между некодирующими РНК и такими заболеваниями,
как В-клеточная лимфома, рак легких, рак простаты, аутизм и шизофрения.
Дефекты в РНК-регуляторной системе будет нелегко выявить методами
молекулярно-генетической эпидемиологии и столь же трудно исправить. Но понимание устройства системы поможет установить, чем определяется наша физическая и психологическая индивидуальность.
Кроме того, это создаст предпосылки к выработке тончайших
методов воздействия на наш организм для улучшения состояния здоровья.
Помимо интронов к генетическому «хламу» относили транспозоны и другие повторяющиеся элементы, при том, что на их долю приходится
40% генома человека. Они считались молекулярными паразитами, которые когда-то давно колонизировали наш геном. Поначалу, как и все иммигранты, они чувствовали себя неуютно, однако постепенно освоились,
и их потомки стали неотъемлемой частью «общества» и эволюционировали
вместе с ним.Убедительные данные свидетель-ствуют о том, что транспозоны участ-вуют в регуляции работы генома выс-ших организмов и играют ключевую роль в эпигенетическом наследовании признаков. Более того, в июле 2003 г. Erev Y. Levanon of Compugen и другие ученые сообщили об интереснейшем феномене, который они назвали «A-to-I (adenosine-to-inosin)-editing» («А–И-редактирование»). Он состоит в изменении нуклеотидной последовательности РНК в строго определенном
сайте. У человека такое «редактирование» РНК-транскриптов происходит в 100 раз чаще, чем думали раньше, и почти всегда в так называемых
Alu-повторах – элементах, находящихся в некодирующих последовательностях. Особенно активно процесс протекает в клетках головного мозга, а если в нем возникает сбой, то могут появиться патологии – эпилепсия и депрессия.
РНК-редактирование происходит у всех животных, но Alu-последовательности есть только у приматов. Очень заманчивой представляется идея, что «заселение» Alu-элементами именно генома линии приматов привело к появлению более сложных и динамичных нейронных сетей, ставших предпосылкой к формированию
памяти и высших познавательных функций, характерных для человека.
Поняв, как устроена чрезвычайно запутанная регуляторная сеть у сложных организмов, можно будет использовать эту информацию для конструирования самоорганизующихся самоконтролируемых систем,
т.е. для создания искусственных живых систем и искусственного интеллекта. Тот генетический материал, который долгое время считался «хламом», вполне может стать ключом к разгадке необычайной сложности
человеческого организма и путеводной нитью к программированию
всевозможных сложных систем.
|
Сайт создан в системе
uCoz У прокариот на долю последовательностей, не кодирующих никаких белков, приходится незначительная часть геномной ДНК. У эукариот же – чем сложнее организм, тем больше в его геноме некодирующих последовательностей. Долгое время их считали балластом, но, по-видимому, именно они отвечают за степень сложности организмов.
У прокариот на долю последовательностей, не кодирующих никаких белков, приходится незначительная часть геномной ДНК. У эукариот же – чем сложнее организм, тем больше в его геноме некодирующих последовательностей. Долгое время их считали балластом, но, по-видимому, именно они отвечают за степень сложности организмов.  НОВЫЙ ВЗГЛЯД НА РЕГУЛЯЦИЮ РАБОТЫ ГЕНОВ ЭУКАРИОТ
НОВЫЙ ВЗГЛЯД НА РЕГУЛЯЦИЮ РАБОТЫ ГЕНОВ ЭУКАРИОТ Молекулы микроРНК (синий цвет), образующиеся в результате процессинга некодирующих РНК, могут складываться сами на себя и связываться с другими, комплементарными им РНК с образованием самых причудливых структур. Таким образом они выполняют функции, которые обычно приписывают белкам.
Молекулы микроРНК (синий цвет), образующиеся в результате процессинга некодирующих РНК, могут складываться сами на себя и связываться с другими, комплементарными им РНК с образованием самых причудливых структур. Таким образом они выполняют функции, которые обычно приписывают белкам.