GTPases RHOA, RAC1 и CDC42 контролируют динамику актинового цитоскелета, который обеспечивает силой клеточную подвижность. Все три GTPases активируются по фронту клетки и регулируют др. др.; однако их тонкая пространственно-временная координация и взаимная регуляция не охарактеризованы. В двух исследованиях сообщается о разработке технологии, которая позволяет точно контролировать и отслеживать активность Rho GTPases.
Klaus Hahn с коллегами разработали фотоактивируемую версию RAC1 (PA-RAC1) путем слияния остатков 404-547 от Avena sativa phototropin 1 с N-концом постоянно активной RAC1. Фрагмент phototropin содержит flavin-связывающий LOV домен и спиральное расширение, которое воспринимает закрытую конформацию в темноте, блокируя связывание эффекторов с RAC1. В ответ на освещение спираль разматывается и запускается стерическое ингибирование, приводя тем самым к активации RAC1. Это белковое слияние обладает преимуществами перед ранее предложенными светом-контролируемыми системами тем, что оно полностью контролируется генетически и использует нетоксичную длину волны (458 nm), и обратимо (с периодом полу-жизни 43 сек и восстановлением в темноте) , это делает возможным субклеточную локализацию активации точно контролируемой, т.к. обнаруживается очень мало остаточной активации вокруг излучающей точки.
Излучающие 20 µm точки на клеточном крае мышиных эмбриональных фибробластов (MEFs) стабильно экспрессируют PA-RAC1 индуцированную локальное фосфорилирование RAC1 эффекторной p21-activated kinase (PAK), полимеризацию актина и выпячивающегося ведущего края, противоположная сторона подтягивается. Напротив, иррадиация доминантно-негативного PA-RAC1 ведет к локальной ретракции и выпячиванию др. областей, указывая тем самым, что локальная активация или деактивация RAC1 достаточна для индукции поляризованного перемещения.
Gaudenz Danuser с коллегами использовали два метода для изучения пространственно-временной координации активности GTPase по отношению к перемещениям клеточного края во время постоянных циклов выпячивания и втягивания. В их 'computational multiplexing' подходе активности CDC42, RAC1 и RHOA были измерены в отдельных экспериментах. Сигналы для каждого из трех GTPase биосенсоров измеряли каждые 10 сек.в 40-80 строб-импульсах, которые перемещались вместе с ведущим краем. Скорость перемещения края также исследовалась в выборках и данные были проанализированы так, что активация GTPase оказалось связанной с выпячиванием или втягиванием. Используя эти функциональные корреляции, авт. показали, что GTPases активируются в течение фиксированного интервала времени относительно динамики ведущего края. Анализ корреляции затем был повторён в выборках окошек на разных расстояниях от края клетки, чтобы получить пространственную информацию. Анализы показали, что активация RHOA происходит на клеточном крае синхронно с выпячиванием, тогда как RAC1 и CDC42 активируются 2 µm позади края с задержкой в 40 сек. Это указывает на то, что RHOA может инициировать выпячивание, а CDC42 и RAC1 могут его стабилизировать.
В комплементарных подходах биосенсоры для RHOA и CDC42 экспрессировали одновременно в одиночной клетке, чтобы визуализовать их активацию, используя 4-х-канальное получение картинок. Этот метод дал беспрецедентное пространственно-временное разрешение, показав, что CDC42 активируется после RHOA и подтвердив сигнальные взаимоотношения, полученные с помощью computational multiplexing.
Т.о., исследования групп Hahn и Danuser предоставлили мощные методы для визуализации непосредственной связи между состояниями сигнальных путей и их морфологическими исходами.
|
| A. Shindo, J. B. Wallingford, PCP and septins compartmentalize cortical actomyosin to direct collective cell movement. Science 343, 649–652 (2014). |
Передача сигналов Planar cell polarity (PCP) обеспечивает направленность эпителиальных слоёв и важна для различных морфогенных событий, включая convergent extension (CE) при гаструляции эмбрионов позвоночных. Во время CE, медиолатеральные клетки перемещаются в направлении дорсальной срединной линии и интеркалируют, чтобы удлинить ось тела, а дефекты нервной трубки, такие как spina bifida возникают при нарушении CE. Shindo and Wallingford исследовали связь между PCP и изменениями формы клеток в мезодерме гаструлирующих эмбрионов Xenopus. Когда эти почти гексагональные клетки интеркалируют, то передений и задний конец каждой клетки выстраиваются почти перпендикулярно срединной линии эмбриона, а границы между задней стороной одной клетки и передней стороной соседней клетки укорачиваются и оказываются обогащеными фосфорилированным myosin II (pMyoII). Actin накапливается на вершинах гексогональных клеток между передне-задними границами и медио-длатеральными сторонами клеток (медио-латеральные вершины), а кортикальный актин перемещается вдоль передне-задних границ, но не вдоль медо-латеральных краёв. В то время как медио-латеральные края находились почти под постоянным натяжением, передне-задние границы становились всё более туго натянутыми по мере укорочения. Septins являются GTP-связывающими каркасными белками, которые формируют филаменты, участвующие в цитоскелетной динамике, включая направляемую с помощью PCP миграцию клеток и цилиогенез. Флюоресцентно меченный Septin 7 (Sept7) оказывался обогащенным на медио-латеральных вершинах, а нокдаун Sept7 предупреждал накопление актина в этих местах, блокировал напряженность передне-задних границ, увеличивал количества pMyoII и устранял поляризованное распределение pMyoII. Нокдаун стержневого PCP компонента Dishevelled вмешивался в полярное распределение как Sept7, так и pMyoII и снижал количества pMyoII. pMyoII необходим для напряжения передне-задних границ и для нормального CE. Эти результаты подтверждают модель, согласно которой PCP сеть, которая способствует фосфорилированию MyoII, также способствует локализации Sept7 на медиолатаральных вершинах гесогональных клеток, создавая тем самым отдельные компартменты кортикального актомиозина, позволяющие передне-задней актомиозиновой сети сокращаться и управлять интеркаляцией.
Эукариотические клетки перемещаются путем выпячивания фронта и подтягивания тыла, а степень сочетанности между этими процессами влияет на эффективность передвижения. Выпячивание возникает в результате поляризованного роста актиновых филамент, тогда как подтягивание нуждается в организации анти-параллельных ансамблей актина, компетентных давать контрактильные массивы (arrays) с with myosin II. Простейшая гипотетическая 'motility unit' представлена на Figure 1a, в ней одни и те же активновые филаменты используются в выпячивании и в контракции. В этой модели принцип очень простой и эффективный, т.к. процесс выпячивания сам по себе регенерирует филаменты, необходимые для ретракции. Важным правилом этой схемы является образование прикрепления на фронте клетки, чтобы поддержать подтягивание тыла.
У подвижных клеток фронтом выпячивания является lamellipodium, тонкий листок цитоплазмы ~200 nm толщиной и в несколько микрометров шириной (от основания до кончика), состоящий из поляризованного массива актиновых филамент. Выпячивание обеспечивается добавлением актиновых молекул на концы филамент, обращенных лицом к ведущей мембране, осуществляемое сигналами комплексов белков на кончике lamellipodium [1,2]. Ламелиподиум обладает рядом очевидных характеристик, из которых только три упоминаются здесь. Во-первых, более или менее постоянная ширина, около 1-5 mm, что может быть объяснено регулируемым оборотом актина для поддержания выпячивания и treadmilling. Во-вторых, актиновые филаменты в ламеллиподиуме расположены диагональным способом, так что они движутся латерально через фронт клетки, когда они полимеризуются ([3], Figure 1b). В-третьих, ламмелиподиум инициирует сайты адгезии с внеклеточным матриксом, создавая тем самым точки подтягивания фронта клетки [4].
Тогда как полимеризация и оборот актина в ламелиподиуме рассматривались в многочисленных исследованиях, но меньшее внимание привлекло то, как генерируется остальная часть цитоскелета и как она связана с ламеллиподиумом, чтобы завершить единицу подвижности (motility unit).
Actin turnover and flow
Оборот актина изучался в живых клетках, используя некоторые подходы, базирующиеся на флюоресцентном мечении молекул актина: fluorescence recovery after photo-bleaching (FRAP) [5]; photo-activation of fluorescence (PAF) [6]); fluorescent localization after photo-bleaching (FLAP)[7]; и fluorescent speckle microscopy (FSM) [8,9]. Техники FRAP и PAF оказались пригодными для отслеживания treadmilling актина в ламеллиподиуме, которое приводило к ретроградному току [5,6]. А новый метод
FLAP, который базируется на избирательном photobleaching одной из частей актиновых зондов, показал, что большая часть актиновых мономеров в области позади ламеллиподиума, обозначаемой как lamella, отправляется обратно на фронт клетки, чтобы подпитывать выпячивание ламеллиподиума со скоростью боле быстрой, чем простая диффузия [7]. Fluorescent speckle microscopy (FSM) использует или инъекции отслеживаемых количеств флюоресцентного актина в клетку, чтобы пометить только субпопуляцию молекул [8] или трансфекцию GFP-actin, чтобы создать низкие уровни экспрессии [9,10]. При FSM с инъекцией актина, индивидуальные пятнышки предпочитают образовывать кластеры из молекул меченного актина в одних и тех же или соседних филаментах. Данные по пятнышка подверглись серьезному анализу
[11,12,13]. Были разработаны алгоритмы, чтобы автоматически отслеживать траектории крпинок, а также их появление и исчезновение при time-lapse video frames. Различные предложения были сделаны, чтобы
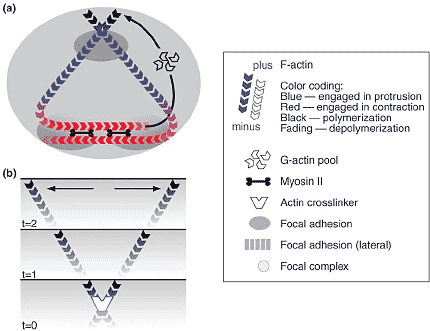 Рис. 1. Minimal motility unit and lateral flow of filaments. (a) Hypothetical motility unit composed of two actin filaments. At the front, the filaments polymerize to drive protrusion and at the rear they interact with myosin to drive retraction. Adhesion at the front is required to support protrusion and to provide anchorage for retraction; adhesions are continuously generated at the base of protrusions and are stationary relative to the substrate. Adhesions at the rear are necessary to bring filaments together in contractile assemblies with myosin; they can slide relative to the substrate during retraction. (b) Lateral flow of filaments in lamellipodia: the geometry of actin filaments in the network dictates that they move laterally as they polymerize (see three time-points). The direction of net retrograde flow is perpendicular to the cell front. Рис. 1. Minimal motility unit and lateral flow of filaments. (a) Hypothetical motility unit composed of two actin filaments. At the front, the filaments polymerize to drive protrusion and at the rear they interact with myosin to drive retraction. Adhesion at the front is required to support protrusion and to provide anchorage for retraction; adhesions are continuously generated at the base of protrusions and are stationary relative to the substrate. Adhesions at the rear are necessary to bring filaments together in contractile assemblies with myosin; they can slide relative to the substrate during retraction. (b) Lateral flow of filaments in lamellipodia: the geometry of actin filaments in the network dictates that they move laterally as they polymerize (see three time-points). The direction of net retrograde flow is perpendicular to the cell front.
отличать пятнышки от фоновых шумов, чтобы следовать за индивидуальными крупинками в последовательных кадрах и чтобы объяснить эффекты out-of-
focus потери крупинок. Согласно последним исследованиям одиночных молекул actin-GFP крупинок Watanabe и Mitchison [9] появление пятнышек соответствует полимеризации, а исчезновение пятнышек деполимеризации, т.к. свободно диффундирующий актин д.б. слишком подвижным, чтобы быть зарегистрированным как пятнышко. Микроскопия пятнышек подтвердила ретроградный ток в ламеллиподиуме, но дополнительно высветила дальнейшие зоны медленного течения актина в области lamella позади ламеллиподиума. lamellipodium. С помощью фазового контраста и дифференциальной интерференционной микроскопии более ранние исследователи постоянно документировали переход от быстрого к медленному ретроградному току из lamellipodium в lamella [14]; FSM позволила продемонстрировать, что полимерный актин является главным компонентом этого цитоплазматического тока [12,15]. Полимеризация актина была подсчитана как ~ 10-раз более высокая на фронте ламмелиподиума, чем в lamella [12,13] и что интересно, деполимеризация актина была более высокой в областях в областях конвергенции пятнышек, что соответствовало местам контрактильности [13]. Данные по пятнышкам, полученные от медленно движущихся типов клеток, были интерпретированы, как указывающие на существование двух отдельных, перекрывающихся сетей актина: выпячивание
lamellipodium, которое зависит от успеха увеличения в объеме позади
lamella сети [12]. Учитывая существенные технические помехи в микроскопии пятнышек, корреляция между динамикой пятнышек и детальной организацией подлежащей сети актина, остается косвенной. Помимо ограничений в разрешении в Z-направлении (около 1 mm), неясно, какова судьба крупинок, соответствующих множественным сайтам на разных филаментах, ассоциированных с ними. Мы расскажем о доказательствах, подтверждающих, что ток филамент является диагностическим функционального купирования между lamellipodium
и lamella, причем lamellipodium играет дминирующую роль в генерации сети lamella.
Optimized coupling: the keratocyte
Наиболее эффективная взаимосвязь между выпячиванием и ретракцией выявляется в эпидермальных кератоцитах рыб, у которых тело клетки тела тянется тесно за широким, веерообразным lamellipodium ([16]; Figure 2, inset). Филаменты в центральной области lamellipodium не
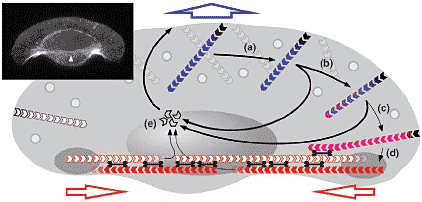 Рис. 2. Model for filament recycling in keratocyte motility. For key see Figure 1. (a) Filaments formed at the leading edge move laterally as a result of their diagonal arrangement in the mesh, the extent of movement depending on their lifetime. (b) A subpopulation of filaments accumulates at the base and in the flanks of the lamellipodium. The shape of the flanks is maintained by a combination of (c) reduced polymerization and (d) filaments being drawn into the contractile bundles at the rear by interaction with myosin. Contraction at the rear, between sliding lateral adhesions, drives cell body translocation. (e) Filaments de-polymerize around the cell body to replenish the pool of actin monomer. Inset: Trout keratocyte stained with fluorescently labeled phalloidin. Arrowhead: posterior bundles. Рис. 2. Model for filament recycling in keratocyte motility. For key see Figure 1. (a) Filaments formed at the leading edge move laterally as a result of their diagonal arrangement in the mesh, the extent of movement depending on their lifetime. (b) A subpopulation of filaments accumulates at the base and in the flanks of the lamellipodium. The shape of the flanks is maintained by a combination of (c) reduced polymerization and (d) filaments being drawn into the contractile bundles at the rear by interaction with myosin. Contraction at the rear, between sliding lateral adhesions, drives cell body translocation. (e) Filaments de-polymerize around the cell body to replenish the pool of actin monomer. Inset: Trout keratocyte stained with fluorescently labeled phalloidin. Arrowhead: posterior bundles.
скользят относительно субстрата [6] в результате того, что полимеризация актина в lamellipodium в основном передается в выпячивание. Недавно были подтверждены [10,15] эти ранние находки. Перемещение тела клетки осуществляется за счет контракции задних актомиозиновых пучков, ориентированных параллельно к оси ротации и перпендикулярно к направлению движения [16,17](Figure 2). ЭМ данные по организации актина (JV Small, unpublished), подкрепляют фазово -контрастную микроскопию [18] и микроскопию пятнышек [15], показывая, что филаменты поперечных пучков поставляются из lamellipodium, наиболее вероятно с флангов lamellipodium. Т.к. филаменты с двух флангов имеют противоположную полярность, то они могут сотрудничать с миозином по контракции, чтобы продвинуть тело клетки вперед (Figure 2). Связь между сетью lamellipodium на фронте и контрактильными пучками, содержащими миозин, в тылу даже более очевидна в подвижных цитопластах, происходящих из keratocytes ([18]; JV Small, unpublished). В этой схеме только небольшая пропорция филамент, генерируемых в lamellipodium персистирует достаточно долго, чтобы быть рекуртированной в контрактильные пучки в тылу. Мы подсчитали менее 50 филамент в задних пучках keratocyte cytoplasts, по сравнению с ~ 2000 растущими концами на кончике lamellipodium (JV Small, unpublished). Как результат непрерывной поставки филамент на концы пучков на флангах lamellipodium, филаменты д. удаляться из середины тела клетки после участия в контракции; это возможно происходит в результате деполимеризации [16], что согласуется с находками микроскопии пятнышек в зонах контракции [13].
Хотя др. клетки менее эффективны в подвижности, чем keratocyte, собранные данные указывают, что сходные принципы купирования между выпячивающимися и сокращающимися массивами приняты в целом с некоторыми интересными модификациями.
Weaving from the front
Для большинства клеток выпячивание и ретракция не скооррдинированы во времени и разделены пространственно, так что имеются менее прямые связи между фронтом и тылом. Чтобы обеспечить связь, контрактильные ансамбли актиновых филамент конструируются, чтобы связать клетку. Существуют три генеральных класса контрактильных ансамблей: арки, вогнутые периферические пучки и линейные стрессовые волокна (Figure 3). Арко-подобные пучки актина параллельные клеточному фронту наиболее выдаются в некоторых клетках, чем в др. и первоначально были описаны Heath [14]. Они хорошо видны в основании lamellipodia и движутся в ретрогирадном направлении через клетку. Предполагается, что они происходят из сети lamellipodium [14] и что это происходит путем закладки филамент с противоположной полярностью в ходе их латерального тока [19,20] (Figure 3). В подтверждение этой идеи, арко-подобные пучки связаны в lamellipodia [14,19] и может видеть, как они возникают из оснований филопоидальных пучков, которые изгибаются (sweep) в lamellipodia в ходе латерального тока (Figure 4; K Rottner, personal communication). Недавние исследования ростовых конусов нейронов у Aplysia подтвердили идею, что филаменты поставляются из lamellipodia в арки [21]. Актиновые филаменты в Aplysia bag клетках визуализируются с помощью микроинъекций флюоресцентного phalloidin при низких концентрациях, что не нарушает актиновой динамики. В таких клетках арко-подобные филаменты доминируют
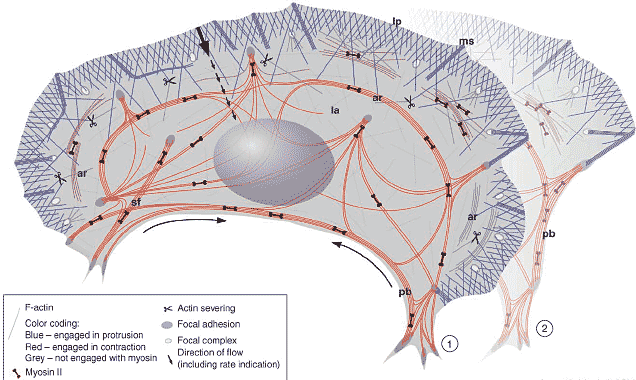 Рис. 3. Schematic illustration of the actin cytoskeleton in a migrating B16 melanoma cell. A sub-population of filaments generated in the lamellipodium (lp) is shed into the lamella (la) after severing (scissors) and incorporated into contractile assemblies with myosin - arcs (ar), stress fibers (sf) and peripheral bundles (pb). The contractile network is interconnected through the cell and anchored at adhesion foci that are stationary at the front and can slide at the rear. The right side of the figure illustrates the formation of a peripheral bundle, of which two steps are depicted here: step 1, arc-like arrays generated at the base of a lamellipodium are recruited into a contractile bundle that forms between adhesions at the ends of the lamellipodium segment; step 2, the lamellipodium retracts, leaving a concave bundle at the cell periphery. Ms, microspike bundle. Рис. 3. Schematic illustration of the actin cytoskeleton in a migrating B16 melanoma cell. A sub-population of filaments generated in the lamellipodium (lp) is shed into the lamella (la) after severing (scissors) and incorporated into contractile assemblies with myosin - arcs (ar), stress fibers (sf) and peripheral bundles (pb). The contractile network is interconnected through the cell and anchored at adhesion foci that are stationary at the front and can slide at the rear. The right side of the figure illustrates the formation of a peripheral bundle, of which two steps are depicted here: step 1, arc-like arrays generated at the base of a lamellipodium are recruited into a contractile bundle that forms between adhesions at the ends of the lamellipodium segment; step 2, the lamellipodium retracts, leaving a concave bundle at the cell periphery. Ms, microspike bundle.
в переходной зоне позади lamellipodium и видно, как они возникают в основании ростового конуса lamellipodium [21]. Т.к. основание lamellipodium является местом минимума полимеризации актина [9,12], то арки могут происходить только из lamellipodium. Сходная ситуация наблюдается в coelomocyte морских ежей, у которых арко-подобные пучки актиновых филамент формируются позади lamellipodium и перемещаются в тыл [22]. Если миозин ингибируется, то ток в lamellum
затухает и формируются поперечно ориентированные актиновые филаменты в переходной зоне между lamellipodium и lamella. В ростовом конусе Aplysia ингибирование Rho или Rho kinase вызывает уменьшение плотности арок и скорости транслокации тела без нарушения ретроградного тока в lamellipodium [21], это согласуется с тем, что myosin рекрутируется для образования и транслокации арок. Следует подчеркнуть, что сеть ламеллиподиума обладает способностью "ткать" антипараллельные множества актина для поставки в сеть цитоскелета, а дуги - одна из форм выражения этого процесса. И только часть продуцированных в ламеллиподиуме филамент необходима, чтобы удовлетворить потербность менее плотной сети lamella.
Вогнутые пучки актина на периферии втягиваемых краёв подвижных клеток являются др. проявлением активности ламеллиподиумов. В этом случае lamellipodium, прикрепленный с двух концов к субстрату, поставляет филаменты к своему основанию, прежде чем они будут отправлены в др. выпячивание где-либо в клетке, оставляя контрактильные пучки на краю клетки (Figure 3; JV Small, K Rottner and GP Resch, unpublished). Тем же самым типом активности может объяснить образование межклеточных соединений, где взаимодействия между сморщенными (ruffling) краями предшествуют сборке соединений [23].
Supplying filaments for contractility:
a role for lateral flow and ruffling
Для разных исследованных клеточных моделей имеется генеральное следствие, что ингибирование myosin II не влияет существенно на ретроградный ток в lamellipodia, в то же время он останавливает ток в lamella [13,21,22]. Взаимодействие actin с myosin, следовательно, играет
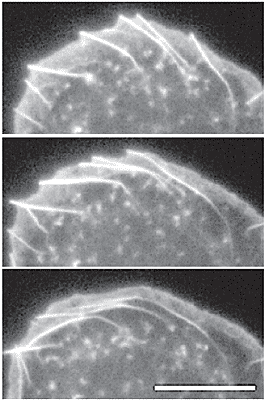 Рис.4. Arc-like bundles in the lamella arising from the lateral flow of actin bundles (microspikes) in the lamellipodium. The video frames show a EGF-stimulated B16 mouse melanoma cell transfected with
GFP-actin. Time between frames = 42 s. Scale bar = 10 mm.
Courtesy of Klemens Rottner. Рис.4. Arc-like bundles in the lamella arising from the lateral flow of actin bundles (microspikes) in the lamellipodium. The video frames show a EGF-stimulated B16 mouse melanoma cell transfected with
GFP-actin. Time between frames = 42 s. Scale bar = 10 mm.
Courtesy of Klemens Rottner.
центральную роль в организации и динамике сети lamella, возможно благодаря рекрутированию анти-параллельных массивов актина в контрактильные множества (arrays) [24-26]). Сборка актиновых филамент в контрактильные пучки, по-видимому, происходит главным образом благодаря привлечению пред-существующих филамент [27,28], это согласуется с низкой скоростью полимеризации актина в lamella [13]. Сходным образом, появление актиновых пучков в прикрепленных клетках в ответ на воздействие механического стресса может быть объяснено только рекрутированием филамент из пред-существующей актиновой сети [29]. Процесс связи между выпячиванием и ретракцией нуждается в установлении адгезий на передней стороне клетки: они инициируются под lamellipodia и filopodia [29]. Сайты адгезии, которые поддерживают подтягивание тела клетки - фокальные адгезии - д.б. связаны с контрактильной сетью lamella и в самом деле их возникновение зависит от этого контрактильных пучков (linkage) [30]. Фокальные адгезии являются местами полимеризации актина, продуцируют однополярные ряды, которые становятся контрактильными только благодаря рекрутированию филамент противоположной полярности. Мы полагаем, что боковой ток филамент вдоль lamellipodium (Figure 1b) является единственным путем обеспечения анти-параллельных ансамблей. Кроме того, важным побочным продуктом ruffling активности на передней части клетки может быть снабжение филаментами с обратной полярностью. Бросается в глаза, что
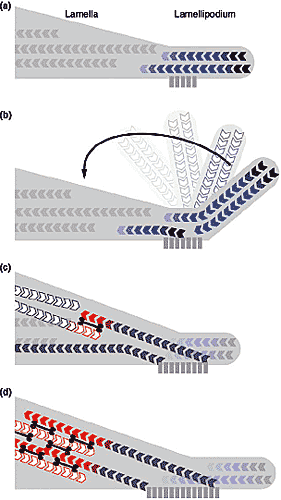 Рис. 5. Supplying anti-parallel filaments to the lamella by ruffling. For key see Figure 1. (a) Vertical section through the lamella and lamellipodium of a motile cell. (b) The ruffling of the lamellipodium
back onto the lamella might constitute a mechanism for (c) creating
antiparallel arrays of actin filaments in the lamella - white subunits
in (a), (b) and (c) - that could engage with myosin in the formation
of contractile bundles, such as a stress fiber (d). Рис. 5. Supplying anti-parallel filaments to the lamella by ruffling. For key see Figure 1. (a) Vertical section through the lamella and lamellipodium of a motile cell. (b) The ruffling of the lamellipodium
back onto the lamella might constitute a mechanism for (c) creating
antiparallel arrays of actin filaments in the lamella - white subunits
in (a), (b) and (c) - that could engage with myosin in the formation
of contractile bundles, such as a stress fiber (d).
интенсивное сморщивание (ruffling) происходит поверх мест образования фокальных адгезий [31], где локальная поставка филамент с обратной полярностью может быть благоприятным для инициации сборки стрессовых волокон (Figure 5). Для клеток, начинающих распластываться по субстрату или подвергаться случайной подвижности, конструкция актинового цитоскелета зависит от вклада от выпячивания и ретракции со всех сторон [32]. Доля направленного движения, как в случае хемотксиса, имеющиеся движения в одном направлении испытывают меньше препятствий для построения анти-параллельных ансамблей,, выстраивающихся вдоль оси движения, напр., на латеральных краях. Ruffling может в таких случаях быть важным фактором для поставки антипараллельного пула филамент.
Conclusions
We have attempted here to make a case for a functional
coupling between the protruding front of a cell and the
retracting rear. In particular, we suggest that the lamellipodia
and ruffling membranes play a major role in the
generation of filaments for cytoskeleton construction.
This is not to say that the protruding front is the only
source of filament assembly. Polymerization and depolymerization
apparently also occur in the body of the cell
[7,12], although the data on polymerization needs to
be reconciled with the demonstration that phalloidinlabelled
actin filaments injected into cells do not serve
as seeds for filament assembly [33]. Nucleation of actin
assembly occurs primarily at cell membranes, predominantly
in lamellipodia, membrane ruffles and adhesion
foci, marking these as major production sites.
From recent studies in which lamellipodia were suppressed
and bundles enhanced by the injection of tropomyosin,
it was concluded that lamellipodia are not
essential for cell motility [34]. So there is no shortage
of even basic questions to resolve. It will be necessary to
focus attention anew on more motile cells, applying the
techniques available to map the turnover of actin monomers,
actin filaments and actin-associated proteins in
different regions of a moving cell. Can filament ends
be mapped with specific markers in vivo, what is the
length of filaments in bundles and arcs and how is actin
depolymerization regulated in the sink of retrograde flow?
What determines the width of the lamellipodium and how
are ruffles generated? Finally, how are actin molecules
recycled back to the lamellipodium to feed protrusion, if
not by diffusion [7]? The field of cell movement still has
a long way to go.
|

 Рис. 1. Minimal motility unit and lateral flow of filaments. (a) Hypothetical motility unit composed of two actin filaments. At the front, the filaments polymerize to drive protrusion and at the rear they interact with myosin to drive retraction. Adhesion at the front is required to support protrusion and to provide anchorage for retraction; adhesions are continuously generated at the base of protrusions and are stationary relative to the substrate. Adhesions at the rear are necessary to bring filaments together in contractile assemblies with myosin; they can slide relative to the substrate during retraction. (b) Lateral flow of filaments in lamellipodia: the geometry of actin filaments in the network dictates that they move laterally as they polymerize (see three time-points). The direction of net retrograde flow is perpendicular to the cell front.
Рис. 1. Minimal motility unit and lateral flow of filaments. (a) Hypothetical motility unit composed of two actin filaments. At the front, the filaments polymerize to drive protrusion and at the rear they interact with myosin to drive retraction. Adhesion at the front is required to support protrusion and to provide anchorage for retraction; adhesions are continuously generated at the base of protrusions and are stationary relative to the substrate. Adhesions at the rear are necessary to bring filaments together in contractile assemblies with myosin; they can slide relative to the substrate during retraction. (b) Lateral flow of filaments in lamellipodia: the geometry of actin filaments in the network dictates that they move laterally as they polymerize (see three time-points). The direction of net retrograde flow is perpendicular to the cell front.  Рис. 2. Model for filament recycling in keratocyte motility. For key see Figure 1. (a) Filaments formed at the leading edge move laterally as a result of their diagonal arrangement in the mesh, the extent of movement depending on their lifetime. (b) A subpopulation of filaments accumulates at the base and in the flanks of the lamellipodium. The shape of the flanks is maintained by a combination of (c) reduced polymerization and (d) filaments being drawn into the contractile bundles at the rear by interaction with myosin. Contraction at the rear, between sliding lateral adhesions, drives cell body translocation. (e) Filaments de-polymerize around the cell body to replenish the pool of actin monomer. Inset: Trout keratocyte stained with fluorescently labeled phalloidin. Arrowhead: posterior bundles.
Рис. 2. Model for filament recycling in keratocyte motility. For key see Figure 1. (a) Filaments formed at the leading edge move laterally as a result of their diagonal arrangement in the mesh, the extent of movement depending on their lifetime. (b) A subpopulation of filaments accumulates at the base and in the flanks of the lamellipodium. The shape of the flanks is maintained by a combination of (c) reduced polymerization and (d) filaments being drawn into the contractile bundles at the rear by interaction with myosin. Contraction at the rear, between sliding lateral adhesions, drives cell body translocation. (e) Filaments de-polymerize around the cell body to replenish the pool of actin monomer. Inset: Trout keratocyte stained with fluorescently labeled phalloidin. Arrowhead: posterior bundles. 
 Рис.4. Arc-like bundles in the lamella arising from the lateral flow of actin bundles (microspikes) in the lamellipodium. The video frames show a EGF-stimulated B16 mouse melanoma cell transfected with
GFP-actin. Time between frames = 42 s. Scale bar = 10 mm.
Courtesy of Klemens Rottner.
Рис.4. Arc-like bundles in the lamella arising from the lateral flow of actin bundles (microspikes) in the lamellipodium. The video frames show a EGF-stimulated B16 mouse melanoma cell transfected with
GFP-actin. Time between frames = 42 s. Scale bar = 10 mm.
Courtesy of Klemens Rottner.  Рис. 5. Supplying anti-parallel filaments to the lamella by ruffling. For key see Figure 1. (a) Vertical section through the lamella and lamellipodium of a motile cell. (b) The ruffling of the lamellipodium
back onto the lamella might constitute a mechanism for (c) creating
antiparallel arrays of actin filaments in the lamella - white subunits
in (a), (b) and (c) - that could engage with myosin in the formation
of contractile bundles, such as a stress fiber (d).
Рис. 5. Supplying anti-parallel filaments to the lamella by ruffling. For key see Figure 1. (a) Vertical section through the lamella and lamellipodium of a motile cell. (b) The ruffling of the lamellipodium
back onto the lamella might constitute a mechanism for (c) creating
antiparallel arrays of actin filaments in the lamella - white subunits
in (a), (b) and (c) - that could engage with myosin in the formation
of contractile bundles, such as a stress fiber (d).