Хотя недавние исследования показали, что ядрышко может участвовать в процессах, таких как продолжительность жизни (Guarente 1997), вступление в митоз (Olson et al, 2000) и survellance опухолей (Visintin,Amon 2000), но транскрипции тРНК, процессинг рРНК и сборка рибосом представляют главные функции ядрышка. На ультраструктурном уровне, 4 самостоятельных морфологических компонента постоянно видны внутри ядрышка у млекопитающих, не зависимо от типа клеток и функциональной активности ядрышка: fibrillar center (FC), dense fibrillfr component (DFC), granular component (GC) и ассоциированный с ядрышком хроматин (Thiry,Goessens 1996)(Рис. 1). FCs являются сферическими структурами разных размеров с очень низкой электронной плотностью и состоящие из рыхлых взаимно переплетенных фибрил. Их количество чрезвычайно изменчиво в пределах от одного до нескольких десятков на ядрышко. DFC является более электрон непрозрачным, чем FCs и состоит из плотно упакованных фибрил. Обычно DFC располагается около FCs. GC состоит из гранул примерно в 15 нм в диаметре, которые окружают фибриллярные компоненты. Ядрышковый хроматин может быть подразделен на околоядрышковый и внутриядрышковый. Околоядрышковый хроматин может составлять регулярную корку (shell) варьирующей толщины или представлен в виде небольших глыбок вокруг ядрышка. Ответвления от этого околоядрышкового хроматина проникают глубоко в тело ядрышка и приходят в контакт с FCs. В этом меcте DFC, окружающий FCs? прерывается. На ультратонких срезах эти инвагинации выглядят как небольшие компактные глыбки или более расширившиеся волокна различной толщины.
Определена точная локализация рибосомальных генов в ядрышковых компонентах. Были идентифицированы структуры внутри ядрышка, которые представляют собой аналоги nucleolar organizer regions (NORs) метафазных хромосом (Goessens 1984). В этих характерных хромосомных регионах, так называемых из-за ядрышков, снова образующихся вокруг них в конце телофазы, эксперименты по гибридизации выявили исключительно рибосомальные гены. Ряд argyrophilic негистоновых белков ассоциирует избирательно с NORs (AgNOR белки). Установлено, что единственными структурами, окрашиваемыми серебром в интерфазных ядрах, были FCs и в меньшей степени, часть DFC вокруг них (Bourgeois et al., 1979; Hernandez-Verdun et al., 1980; Howell 1982; Derenzini et al., 1990; Ploton et al., 1987). Однако, со строго морфологической точки зрения только FCs могут быть идентифицированы в качестве интерфазных аналогов метафазных NORs, т.к. не обнаружено структурного сходства с DFC даже вокруг NORs. Эквивалентность FCs с метафазными NORs затем была дополнена демонстрацией присутствия рибосомальных генов внутри них. Присутствие ДНК в FCs строго подтверждено данными, полученными путем комбинирования ЭМ, процедуры окрашивания серебром на AgNOR белки с Фёльген-подобрным окрашиванием osmium ammine, специфичным для ДНК (Derenzini et al., 1981a; Hernandez-Verdun et al., 1982): наблюдалось постоянное перекрывание гранул серебра с ДНК филаментами в интерфазных клеточных ядрышках линий клеток человека ( Hernandez-Verdun et al 1984ж Derenzini et al., 1990). Затем присутствие ДНК внутри FCs многократно демонстрировалось в разных типах клеток (Thiry 1992фбиж 1993б 1995ж Thiry et al., 1993). ЭМ
in situ гибидизация (Thiry, Thiry-Blaise 1989, 1991; Puvon-Dutilleul et al., 1991, 1992) показала также, что некоторые рРНК гены обычно локализуются во внутри- и околоядерном хроматине, но присутствуют также и в FCs. Наконец, белковый состав также указывает на соответствие между NORs и FCs. Иммуногистохимические исследования фактически показали, что белки кухни транскрипции рибосомальных генов, такие как РНК полимераза I, ДНК топоизомераза I, и выше стоящий связывающий фактор присутствуют как в NORs, так и в FCs (Thiry, Goessens 1996).
Structure of Ribosomal Genes in Situ
Изучение структурной организации хроматина с помощью сложной техники, позволяющей окрашивать только ДНК in situ с очень высоким разрешением окрашиваемых структур не ограничивалось очень тонкими конечными продуктами. Для детального описания техники и её использования для выявления организации in situ ДНК-содержащих структур см. Derenzini et al., 1982a, 1990; Derenzini et al., 1995). На тонких срезах клеток млекопитающих, окрашенных Фёльген-подобным osmium ammine выявляются только структуры, содержащие ДНК и электрон плотные, тогда как все остальные ядерные компоненты полностью не окрашены (Рис. 2). Ядрышко легко идентифицируется по присутствию почти непрерывного электрон-плотного кольца (околоядрышковый хроматин), который отделяет его от электрон-прозрачного пространства (ядрышковой области). В клетках млекопитающих, характеризующихся интенсивным биогенезом рибосом, многие глубоко окрашенные структуры присутствуют внутри ядрышка (внутриядрышковый хроматин). Этот хроматин, по-видимому, состоит из из компактных, нерегулярной формы глыбок и расширенных фибрилл, часто достигающих толщины от 11 до 30 нм. В ряде экспериментов при высоком увеличении установлено, что глыбки хроматина и волокна состоят из повторяющихся округлых субъединиц с диаметром около 11 нм. Эти субъединицы состоят из примерно в 3 нм толщиной филамент ДНК, которые охватывают неокрашенную внутреннюю сердцевину. Форма, размер и структурная организация этих частиц указывает на то, что они могут быть идентифицированы как нуклеосомы (Derenzini et al. 1981b, 1982a,b, 1983a,b 1984; Derenzizni 1995). Как показано на Рис. 3 и при высоком увеличении на Рис. 4, организация субъединиц не всегда четко видна внутри хроматиновых структур. Фактически, диаметр нуклеосом составляет примерно в 6-8 раз меньше толщины среза. Перекрывающиеся нуклеосомы в структурах хроматина часто не позволяют увидеть одиночные субъединцы. Более того нуклеосомы по-разному ориентированы в пространстве, так что только когда электронный пучок перпендикулярен основанию нуклеосом, то четко выявляются типичные кольцеобразные частицы с диаметром в 11 нм. Помимо хроматиновых глыбок и волокон видны спутанные рыхлые агломераты из очень тонких искривленных филамент ДНК внутри ядрышковой области. Толщина этих филамент ДНК составляет 2-3 нм, что соответствует молекуле двойной спирали ДНК. Филаменты никогда не дают нуклеосом-подобных конфигураций (Рис. 3 и 4). Такая характерная структурная организация филамент ДНК наблюдается только внутри ядрышка и отсутствует во внеядрышковом компартменте. Размер и количество этих рыхлых агломератов филамент ДНК сильно варьируют. Обычно они небольшие и многочисленные в высоко транскрипционно неактивных ядрышках, такие, как в покоящихся лимфоцитах (Derenzini 1995; Derenzini et al., 1982b,1983b,c1984,1990). На срезах, окрашенных osmium ammine, очень специфическая реакция не позволяет определить взаимоотношения между этими структурами хроматина и др. компонентами ядрышка. Это затруднение было преодолено комбинацией селективного окрашивания ДНК с окрашиванием серебром на NOR белки или использованием ядрышек с очень простой организацией, такой как кольцеобразные ядрышки. В первом случае постоянное перекрывание отложений серебра наблюдалось только в рыхлых агломератах расширенных филамент ДНК, но ассоциации не обнаруживалось с глыбками и волокнами толщиной в 11-30 нм внутриядрышкового хроматина (Derenzizni et al. 1981a,1990; Hernandez-Verdun et al. 1982,1984). Ко-локализация отложений серебра и ДНК филамент указывает на то, что последние в основном локализованы в FCs. Тот факт, что FCs являются местом основного накопления филамент ДНК толщиной в 2-3 нм подтверждается также исследованиями по распределению структур внутриядрышкового хроматина в ядрышках лимфоцитов (Derenzini et al. 1983c,1990). В покоящихся лимфоцитах человека ядрышки организованы очень просто. После рутинного uranium и lead окрашивания выявляется единичный, крупный, округлый FC, по-видимому, присутствующий в средине ядрышковой области, окруженный каймой рибонуклеопротеиновых компонентов (Рис. 5А). На срезах, селективно окрашенных на ДНК, небольшие, очень компактные глыбка хроматина видны внутри ядрышковой области. Крупные, одиночные, округлые, слегка электрон непрозрачные агломераты очень рыхлых ДНК структур всегда присутствуют в центральной части ядрышка (Рис. 5С). По своему размеру, форме и локализации эти агломераты в точности соответствуют крупному FC, видимому в ядрышках, окрашенных на AgNOR белки (Рис. 5А и В). При большом увеличении структуры рыхлой ДНК выглядят как состоящие из коротких искривленных ДНК филамент толщиной в 2-3 нм, которые по-разному ориентированы внутри пространства и часто располагаются как петли и открытые кольца (Рис. 6). Присутствие структур очень рыхлых ДНК в средней части покоящихся лимфоцитов может также выявить с использование ДНК окрашивания, предложенной Testillano et al.(1991). Хотя этот метод не позволяет четко визуализовать структурную организацию хроматина, который выглядит фактически гомогенно упакованным, тем не менее он демонстрирует присутствие увеличенных ДНК структур в ядрышковой области, занимаемой FC (Рис. 7). Структурная организация ДНК филамент и их взаимоотношения с внутри- и околоядрышковым хроматином лучше всего исследовать, используя толстые срезы ( примерно в 100 нм). На Рис. 8 показаны Lowicryl срезы покоящихся лимфоцитов, в которых ДНК филаменты выглядят униформно распределенными внутри агломерата и возникающими из компактных масс около- и внутриядрышковго хроматина. Трудно получение трехмерных структур. На Рис. 9 представлена суммарная картина по компьютерному суперналожению двух картин, полученных под разными углами. В этом случае ДНК филаменты могут быть прослежены как очень длинные треки по всему рыхлому агломерату. Эти филаменты, которые никогда не дают нуклеосом-подобных структур, находятся в одном целом с компактными глыбками хроматина, образующими кайму FCs. Переход между глыбками и филаментами всегда острый.
Присутствие растянутых (extended) ДНК филамент в FCs также согласуется с фактом, что ДНК FCs особенно подвержена атакам ферментов. На ультратонких срезах, инициация транскрипции с помощью Escherichia coli РНК полимеразы, по-видимому, происходит преимущественно в FCs (Thiry,Goessena 1991). Чувствительные к ДНКазе-I последовательности также преимущественно выявляются в FCs ядрышек клеток опухоли Эрлиха (Thiry 1991).
Итак, четко показано, что рДНК находится в форме растянутых и искривленных ДНК филамент толщиной 2-3 нм в FCs и присутствует в виде нуклеосомной организации в около- и внутриядрышковом хроматине.
Identification of Nucleolar Sites Where prerRNA Synthesis Occurs
Идентификация FCs как ядрышковых сайтов, где рибосомальные гены располагаются вместе с энзимами, необходимыми для рибосомальной транскрипции, привело нас к пересмотру установившегося мнения (Fakan, Puvion 1980), что синтез пре-рРНК происходит в DFC. Scheer и Rose (1984) впервые поставили под сомнение это мнение, показаd, что FCs является местом транскрипции рРНК на базе ко-локализации рибосомальных генов и молекул РНК-полимеразы I в этом ядрышковом компоненте. В настоящее время нет однозначного ответа. Соответственно, активно транскрибируемые рибосомальные гены были локализованы или в FCs или в FCs вместе с FC/DFC пограничной зоной или в DFC вместе с DFC/FC пограничной зоной (Huang 2002). Тем не менее, мы полагаем, что следует сосредоточиться на тех данных, в которых достигнуто согласие, а также на некоторых новых находках, полученных с помощью томографического анализа высокого разрешения. Применение этой техники (Hozak et al., 1994) позволило некоторым авторам картировать синтезируемые рРНК транскрипты на DFC и в меньшей степени на DFC/FC соединительной зоне. DFC, следовательно, можно рассматривать как место, где постоянно находится Новогодняя елка, не исключая, что рибосомные гены с немногими пре-рРНК транскриптами могут также находиться в кортикальной зоне FCs (Raska 2003). Принимая во внимание, что РНК полимераза I приблизительно в течение 140 сек транскрибирует один рРНК ген со скоростью элонгации в 95 нуклеотидов в сек (Dundr et al. 2002; Cheutin et al. 2004), тогда как рРНК транскрипты быстро вступают в сайт процессинга, др. авторы, использовали изолированные ядрышки для очень быстрого BrUTP мечения (свыше 1 мин) чтобы получить точную информацию о месте транскрипции рРНК. Они нашли, что синтезируемые транскрипты были в основном локализованы в кортексе FCs и в меньшей степени в DFC (Cheutin et al., 2002). В той же работе изучали пространственное расположение РНК полимеразы I внутри всего объема FCs с помощью электронной томографии толстых срезов клеток, меченных анти-РНК полимеразными I антителами. Было установлено, что молекулы РНК полимеразы I располагаются в кортексе FCs, где они группируются в виде нескольких витков в 60 нм в диаметре. Всё это позволило авт. предложить модель, согласно которой активно транскрибируемые рибосомальные гены располагаются внутри кортекса FCs (Cheutin et al., 2002; Ploton et al. 2004). Удлиняющиеся рРНК транскрипты со своим концом вблизи молекул РНК полимеразы I присутствуют в кортексе FCs, тогда как др. конец транскриптов присутствует внутри DFC (Рис. 10). Эта модель прекрасно согласуется с находками, что ДНК филаменты, наблюдаемые в FCs после специфического окрашивания osmium ammine часто организованы в виде петель и открытых окружностей и что 5' наружный транскрибируемый спейсер рРНК - селективный маркер синтезируемого транскрипта - локализуется как на периферии FCs, так и в DFC (Puvion-Dutilleul et al. 1997).
Итак, хотя консенсус о точной локализации транскрибируемых рибосомальных генов в фибриллярных ядрышковых компонентах ещё не достигнут, разные группы исследователей согласны с фактом, что внутренняя часть FC не является местом синтеза рРНК. Это особенно наглядно в больших FCs транскрипционно молчащих клеток, таки х как циркулирующие лимфоциты человека.
Structural-Functional Relationship of Ribosomal Genes In Situ
Наблюдение, что ДНК в растянутой не-нуклеосомной конфигурации присутствует в очень небольших FCs из клеток, характеризующихся очень высокой скоростью транскрипции рДНК, таких как регенерирующие гепатоциты, согласуется с имеющимися доказательствами по анализу препаратов с растянутым хроматином и из экспериментов по ДНКазном у перевариванию транскрибируемых рибосомных генов, которые показали отсуствие нуклеосомной организации хроматина, ассоциированного с транскриптами рРНК (Scheer, Zentgraf 1982). Фактически в случае очень маленьких FCs разумно предположить, что небольшие фрагменты ДНК с не-нуклеосомной конфигурацией присутствуют в этом ядрышковом компоненте, где все приспособлено к синтезу рРНК. С др. стороны, этого может и не быть в случае расправленных ДНК филамент, присутствующих во внутренней части крупных FCs, особенно если рассматривать FCs из транскрипционно молчащих ядрышек, где транскрипты рРНК никогда не обнаруживались. Согласно одной гипотезе они могут соответствовать межгенным спейсерам транскрибируемых рРНК генов. В самом деле, хорошо известно, что в клетках млекопитающих межгенные спейсеры очень длинны. У мышей они представляют 2/3 от 44т.п.н. рДНК повторов. Однако, при ЭМ гибридизации in situ межгенные спейсерные последовательности стоящие выше спейсера промотора, как было показано, преимущественно локализуются вне FCs в хроматиновых глыбках, которые прерывают окружающий DFC (Thiry, Thiry-Blaise 1991). Эта ДНК в отличие от ДНК, содержащейся в FCs, обладает нуклеосомной конфигурацией. Это согласуется с результатами, наблюдаемыми на протяженных (spread) препаратах транскрибируемых рибосомальных повторов из клеток млекопитающих, показывающими, что межгенные спейсеры представляют нуклеосомную организацию (Puvion-Durilleul et al. 1977; Puvion-Durilleul, Bachellerie 1979). Мы м., следовательно, исключить, что расправленная ДНК представляет внутреннюю порцию FCs и может состоять из межгенных спейсеров транскрибируемых рРНК генов. Согласно второй гипотезе расправленные филаменты ДНК д. представлять транскрипционно неактивные рРНК гены, которые тем не менее в не-нуклеосомной конфигурации. Наличие расправленных ДНК филамент в FCs, не зависимых от транскрипции, не являются сюрпризом, т.к. в ряде исследований было показано, что рДНК в расправленной, не-нуклеосомной структуре присутствует в FCs, также тогда, когда транскрипция рРНК гена блокирована хим. соединениями, такими как актиномицин Д (Derenzini et al. 1983c; Hernandez-Verdun et al., 1984; Puvion-Durilleul et al. 1992). Более того, когда синтез РНК останавливается во время митоза, то ДНК, присутствующая в метафазных NORs, всегда поддерживается в расправленной не-нуклеосомной конфигурации (Hernandez-Verdun, Derenzini 1983; Heliot et al., 1997).
Присутствие транскрипционно неактивных рибосомальных генов с не-нуклеосомной структурой как в FCs, так и в метафазных NORs согласуется с результатами, полученными при psoralen photo-crosslinking анализе организации рибосомального хроматина. С помощью этого подхода Conconi et al. (1989) показали, что два самостоятельных и сосуществующих типа рибосомального хроматина присутствует в Friend клетках: один, который содержит нуклеосомы и представлен неактивными копиями и др, который лишен повторяющихся структур и соответствует транскрибируемым генам. Относительные количества двух типов рибосомального хроматина не меняются в зависимости от изменчивости транскрипционной активности полимеразы I или во время фаз клеточного цикла, указывая тем самым, что регуляция синтеза рРНК не происходит за счет изменений в структуре хроматина от закрытой (нуклеосомной) к открытой (не-нуклеосомной) конфигурации и
vice versa и что часть открытого хроматина может быть транскрипционно активной и неактивной. В зависимости от расправленной не-нуклеосомной структуры транскрипционно неактивная рДНК присутствует во внутренней порции крупных FCs, эта рДНК может представлять рибосомальные гены, которые структурно готовы к транскрипции. Стимулирование биогенеза рибосом может, следовательно, происходить за счет простой активации транскрипции РНК полимеразы I на рибосомальных генах, которые уже в открытой, готовой к транскрипции конфигурации. Данные по изменениям распределения расправленной ДНК, которые происходят в покоящихся лимфоцитах человека после стимуляции phytohemagglutinin (PHA), показывают, что это действительно имеет место (Derenzini etal.1983c,1987a,1993). Обработка в течение 24 ч лимфоцитов с помощью РНА индуцирует 8-кратное увеличение синтеза рРНК и фрагментацию единственного крупного рДНК агломерата покоящихся лимфоцитов в многочисленные рДНК агломераты с объемом примерно в 15 раз меньшим (Рис. 11). Эти маленькие агломераты расправленных ДНК филамент соответствуют очень небольшим FCs, окруженным DFC, тем самым показывают, что часть расправленной рДНК локализуется во внутренней части единого FC покоящихся лимфоцитов, она становится транскрипционно активной. Эти структурные измпенения, которые происходят в крупных FCs транскрипционно молчащих клеток млекопитающих после стимуляции синтеза рРНК, схематически представлены
на Рис. 12.
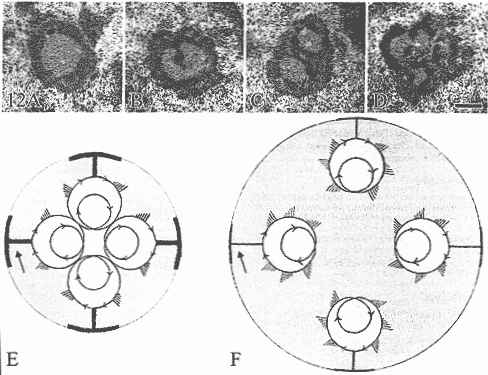 Figure 12 Structural changes occurring in human lymphocyte nucleoli after stimulation of rDNA transcription by 20 hr phytohemaggtutJiiift treatment Aldehyde osmium fixation, uranium and lead staining. (A) Resting lymphocyte nucleolus with a solitary, large FC. (B-D) The progressive increase of rRNA transcripts constituting the dense fibrillar component induced the partition of the solitary FC into smaller FCs. Bar = 0.4 |Lim. With permission, Derenzini et al. Exp Cell Res 170:31-41, 1987. (E,F) Schematic representation of the changes occurring in the distribution of ribosomal genes after stimulation of rDNA transcription. (E) In this nucleolus, characterized by low rRNA synthesis, few transcription units are present in four ribosome DNA loops that are clustered in a unique FC (F) After rRNA synthesis stimulation, the number of transcription units increases, and the steric hindrance separates the four ribosome DNA loops that now constitute four distinct FCs. In this model, the activation of rDNA transcription occurs without changing the structure of ribosomal genes that, in fact, are always in an extended non-nudeosomai configuration. FCs in gray, rRNA transcripts in red, DNA m blue, and granular component in light blue. Arrows indicate compact chromatin.
large rDNA agglomerate of the resting lymphocytes into numerous rDNA agglomerates with a volume ~15-fold smaller (Figure 11). These small agglomerates of extended DNA filaments corresponded to very small FCs surrounded by the DFC, thus indicating that the portion of the extended rDNA located in the inner part of the solitary *FC of resting lymphocytes had become transcriptionally active. These structural changes that occur in large FCs of transcriptionally silent mammalian cells upon stimulation of rRNA synthesis are schematically illustrated in Figure 12.
Figure 12 Structural changes occurring in human lymphocyte nucleoli after stimulation of rDNA transcription by 20 hr phytohemaggtutJiiift treatment Aldehyde osmium fixation, uranium and lead staining. (A) Resting lymphocyte nucleolus with a solitary, large FC. (B-D) The progressive increase of rRNA transcripts constituting the dense fibrillar component induced the partition of the solitary FC into smaller FCs. Bar = 0.4 |Lim. With permission, Derenzini et al. Exp Cell Res 170:31-41, 1987. (E,F) Schematic representation of the changes occurring in the distribution of ribosomal genes after stimulation of rDNA transcription. (E) In this nucleolus, characterized by low rRNA synthesis, few transcription units are present in four ribosome DNA loops that are clustered in a unique FC (F) After rRNA synthesis stimulation, the number of transcription units increases, and the steric hindrance separates the four ribosome DNA loops that now constitute four distinct FCs. In this model, the activation of rDNA transcription occurs without changing the structure of ribosomal genes that, in fact, are always in an extended non-nudeosomai configuration. FCs in gray, rRNA transcripts in red, DNA m blue, and granular component in light blue. Arrows indicate compact chromatin.
large rDNA agglomerate of the resting lymphocytes into numerous rDNA agglomerates with a volume ~15-fold smaller (Figure 11). These small agglomerates of extended DNA filaments corresponded to very small FCs surrounded by the DFC, thus indicating that the portion of the extended rDNA located in the inner part of the solitary *FC of resting lymphocytes had become transcriptionally active. These structural changes that occur in large FCs of transcriptionally silent mammalian cells upon stimulation of rRNA synthesis are schematically illustrated in Figure 12.
Conclusion
A peculiar type of chromatin organization appears to emerge in the mammalian cell nucleolus. Results presented in the current review indicated that ribosomal genes located within the FCs are in an extended non-nucleosomal organization independent of their transcriptional activity. It is very interesting to note that FCs are only detected in the amniotes, i.e., they have been acquired recendy during evolution (Thiry and Lafontaine 2005). The-FCs contain all the molecules necessary for rRNA synthesis and, very likely, also for maintaining ribosomal chromatin in an extended configuration. Little is known about the mechanisms that establish the "open" chromatin state of rRNA genes, even if die action of an ATP-dependent chromatin remodeling complex has been postulated (Grummt and Pikaard 2003) as well as an ATPase activity actually located in the FCs of human fibroblasts (Fox et al. 1981). The FC could represent an evolution-linked structural-functional unit by which—by maintaining rRNA genes in a "ready to transcribe" state throughout the cell cycle—mammalian cells may develop a more rapid and appropriate adjustment of die ribosome production according to environmental conditions without being obliged to previously modify the chromatin structure. In this context, the importance of the FCs has been stressed by the observation that in cells lacking FCs, unlike in cells with FCs, natural or drug-induced rRNA synthesis inhibition induced changes of the extended rDNA filaments that are transformed into small clumps of condensed chromatin (Thiry et al. 1991; Mineur et al. 1998).
 G.Pasquinelli, M-F.O'Donohue, D.Ploton, M.Thiry
G.Pasquinelli, M-F.O'Donohue, D.Ploton, M.Thiry
