План тела артропод, таких как насекомые, ракообразные, пауки и centipedes многоножки, состоит из метамерных единиц, называемых сегментами. Исследования на дрозофилах выявили иерархический генетический каскад, который подразделяет ось голова-хвост у эмбрионов дрозофил в сегменты и придает каждому сегменту качественные особенности. Сегментационные gap гены дрозофилы действуют на ранние стадии в этом регуляторном каскаде. Известные члены этого класса кодируют транскрипционные факторы. специфичные для последовательностей ДНК, которые экспрессируются в синцитиальных ядрах в полосах вдоль оси голова-хвост эмбрионов (Liu, Kaufman, 2005). Транскрипционные факторы gap регулируют каждый иной паттерн экспрессии и помогают предопределить ограниченные периодические паттерны pair-rule генов сегментации, которые являются первыми молекулярными проявлениями сегментной организации эмбрионов. Транскрипционные факторы gap Drosophila помогают также регулировать паттерны транскрипции Нох генов, которые разнообразят судьбы сегментов тела так, что они в конечном итоге развиваются в голову, торакс и абдомен.
Svard et al., (2006) охарактеризовали gap ген у жука
Tribolium castaneum и показали, что он кодирует полицистронный транскрипт с необычными свойствами. У дрозофилы gap гены являются первыми генами, классического каскада сегментации, активируемыми в эмбриональном зиготическом геноме. Потеря их функции ведет к "gap фенотипу": отсутствию сегментации в и к последующей потере области тела, которая является доменом экспрессии gap гена в плане эмбрионального тела (Nusslein-Volhard, Wieshaus, 1980).
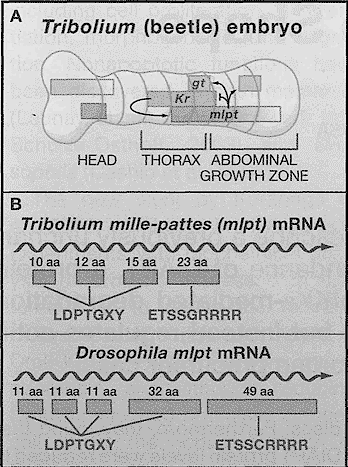 Expression Pattern and Structure of the mille-pattes Gene
Expression Pattern and Structure of the mille-pattes Gene
(A) Schematic representation of an ~ 14 hr Tribolium embryo. Horizontal bars represent the transcription domains of the gap genes Kruppel (Kr), giant (gt), and mille-pattes (mlpt). The arrows indicate some of the crossregulatory interactions between these genes observed at this stage: mlpt limits the posterior border of Kr and activates the two posterior domains of gt transcription. Kr activates mlpt in thorax and growth zone and perhaps helps limit the anterior border of mlpt transcription. (B) In Tribolium, mlpt RNA is predicted to encode three or four short peptides, the first three containing the conserved amino acid sequence motif LDPTGXY. The stop codon of the third peptide overlaps with the first methionine of the fourth peptide, containing the conserved ETSSGRRRR motif. The Drosophila mlpt RNA is predicted to encode four peptides containing the LDPTGXY and a fifth peptide containing the ETSSCRRRR motif.
Хотя у
Tribolium ортологи gap генов Kruppel (Kr) и giant (gt) экспрессируются в локальных полосах из эмбриональных клеток (Рис. 1А), домены их экспрессии и функции не соответствуют в точности их аналогам у дрозофилы. Напр., истощение белков Kruppel или Giant у
Tribolium приводит к gap-подобной элиминации некоторых абдоминальных сегментов, приблизительно соответствующих наиболее заднему домену экспрессии этих генов. Но истощение Kruppel и Giant вызывает также трансформации в качественных особенностях сегментов в областях, соответствующих доменам передней экспрессии этих генов (Bucher, Klingler, 2004; Cerny et al,m 2005; Sulston, Anderson, 1996). Возможным объяснением этих фенотипов является то, что
Kr и gt являются необходимыми для сегментации в абдоминальной ростовой зоне
Tribolium с помощью регуляции нижестоящих pair-rule генов сегментации, тогда как в головной и торакальной областях
Tribolium Kr и gt не регулируют гены типа rair-rule, а только паттерны экспрессии Нох генов, отвечающих за качественные особенности сегментов.
Однако, стараясь понять сегментацию у др. насекомых с помощью изучения только гомологов генов сегментации дрозофилы, может уйти в сторону. Чтобы избежать этой склонности производится скрининг новых генов сегментации у Tribolium (Sulston, Anderson, 1996)? который был разработан на удобном модельном организме для изучения развития и эволюции (Brown et al., 2003). Поиски проводились также для генов, которые экспрессируются в формировании сегментных паттернов у ранних эмбрионов, чья функция может быть оценена с помощью фенотипов частичной потери функции, индуцированных с помощью double strand RNA interference (dsRNAi). Используя этот подход Savard et al., (2006) идентифицировали новый gap ген у Tribolium, mille-pattes (mlpt, в приблизительном переводе "множество ног"). Интересно, что mlpt HYR имеет необычную и неожиданную структуру для gap генов.
Подобно всем gap генам mlpt обнаруживает сложный паттерн экспрессии на разных эмбриональных стадиях, но мы подчеркиваем паттерн, который соответствует лучше всего мутантным фенотипам у Savard et al., (2006). На 14-15 ч эмбрионального развития Tribolium РНК mlpt экспрессируется в виде слабого узкой полоски в gnathal зачатке головы и экспрессируется обильно в широкой полоске от серидины торакального зачатка до середины абдоминальной ростовой зоны (Рис. 1А). На более ранних стадиях mlpt HYR наиболее экстенсивно экспрессируется в абдоминальной ростовой зоне.
Истощение mlpt с помощью dsRNAi давало в результате stubby (обрубок) личинок жука, которые были лишены своих терминальных абдоминальных сегментов. Более того, эти мутантные личинки обладают импозантными трансформациями качественных особенностей сегментов, в которых 7 передних абдоминальных сегментов приобретали торакальные качественные особенности с добавочным ростом (также stubby) конечностей. Сходные эксперименты по функциональной деплеции с использованием daRNAi выявляли также взаимные регуляторные взаимодействия между mlpt, Kr и gt (Рис. 1А) и в меньшей степени взаимодействия этих генов с gap геном hunchback. Хотя и не сообщалось о степени деплеции РНК mlpt? но успешность использования dsRNAi-обусловленной деплеции др. продуктов ранних эмбриональных генов Tribolium (Brown et al., 2003) строго подтверждает, что mlpt выполняет gap patterning функцию как и Kr и gt.
Сюрпризом явилось то, что примерно 750 нуклеотидов mlpt РНК не кодировали типичного белка и не содержала предполагаемых шпилечных структур, характерных для микроРНК. Вместо этого она, по-видимому, является полицистронной мРНК, которая кодирует 4 коротких пептида. Подтверждением, что эти пептиды действительно продуцируются, является их эволюционная консервация в предполагаемых mlpt генах генома дрозофилы и др. насекомых (Рис. 1В). У дрозофилы гомолог mlpt HYR идентифицирована с помощью Berkeley Drosophila Genome Project (pncr001:3, Tupy et al., 2005) первоначально был классифицирован как полиаденилированный некодирующий транскрипт, но этот вывод оказался преждевременным. Первые три из 4-х предполагаемых кодируемых mlpt пептидов в РНК насекомых содержат те же самые стержневые мотивы leucine-aspartate-proline-threonine-glicine-x-tyrosine (LDPTGXY). Последний из предсказанных mlpt пептидов содержит другой богатый серином и аргинином эволюционно законсервированный мотив (Рис. 1В). Хотя ещё нет прямых доказательств, что один или более из этих пептидов обеспечивают функцию gap гена mlpt РНК, но это заключение наиболее вероятно.
Как могут такие пептиды участвовать в иерархии gap сегментации? Savard et al., (2006) предполагают. что пептиды могут обеспечивать общение между gap генами в эмбриональной ростовой зоне, вообще-то путем переноса поперек мембран по способу пептидов, проникающих в клетку. Они также предполагают, что polycistronic peptide coding RNAs (ppcRNAs) могут быть новым классом регуляторов, которые подобно микроРНК, остаются скрытыми из-за своих размеров и необычных генетических свойств. Это может заставить исследователей осуществить биоинформационный поиск консервативных кодирующих пептиды областей в "некодирующих РНК" и Savard et al., (2006) сообщают об успешном поиске новых законсервированных ppcRNAs.
Существует и др. возможный механизм mlpt действия, хотя как отмечают Savard et al., механизм полностью спекулятивный. Сходные пептиды, кодируемые генами mlpt насекомых напоминают некоторые нейропептиды. такие как melanocortins. Однако, в этом классе нейропептидов, сходные пептиды продуцируются с помощью протеолитического расщепления крупных белков предшественников. Подобно этим нейропептидам mlpt пептиды могут действовать посредством П-protein-coupled receptors (Mountjoy et al., 1992), чтобы регулировать формирование паттерна в ростовых зонах эмбрионов насекомых. Возможно также, что mlptпептиды могут напоминать сигнальные epitheliopeptides, которые были идентифицированы у cnidaruan Hydra. Эти epitheliopeptides - хотя и возникающие в результате процессинга крупных белков предшественников по способу нейропептидов - оказывают эффекты на формирование паттерна тела, которые напоминают те, что обеспечиваются gap генами в клеточных популяциях, располагающихся вдоль орально0-аборальной оси Гидры (Bosch, Fujisawa, 2001). Будущие исследования мутаций mlpt жуков и дрозофил и рецепторных белков. которые взаимодействуют с Mlpt пептидами, обещают пролить новый свет на мистические ростовые зоны у насекомых.
