Мейоз является специализированным типом клеточных делений, которые генерирует неидентичные гаплоидные гаметы из диплоидных клеток предшественников. Это достигается за счет одиночного раунда репликации ДНК. сопровождаемого двума фазами сегрегации хромосом: сегрегация гомологов (meiosis I) сопровождаемаемая исчезновением слипчивости центромер и сегрегацией сестринских хроматид (meiosis II). Предыдущие исследования на дрожжах показали, что shugoshin ассоциирует с белком phosphatase-2A (PP2A) в ходе мейоза I и предупреждает фосфорилирование центромерного cohesin — мультибелкового комплекса, который подерживает тесную ассоциацию сестринских хроматид. Это предупреждает отщепление cohesin с помощью протеазы separase и последующее разделение сестринских хроматид.
Чтобы исследовать роль shugoshins SGO1 и SGO2 у млекопитающих во время мейоза, группа, руководимая Watanabe, использовала мышиные ооциты, которые культивировали in vitro. Сначала авт. показали, что SGO1 и SGO2 локализуются в центромерах во время двух фаз расхождений хромосом в мейозе, а также во время митоза, но SGO2 более многочисленен, чем SGO1 в ооцитах. Более того, REC8, мейоз-специфический компонент cohesin колокализуется вместе SGO2 во время мейоза I и защищается от расщепления с помощью PP2A
Затем они подвергали деплеции ооциты или по каждому из или по обоим shugoshins с помощью RNA interference и установили, что SGO2, но не SGO1, является важным для защиты слипчивости центромер в мейозе I. Напротив, SGO1, по-видимому, более важен во время митоза,
Итак, почему центромерные cohesins не защищены от распада во время мейоза II и митозов, несмотря на присутствие SGO2? Авт. полагают, что натяжение, генерируемое с помощью микротрубочек, когда они тянут кинетохоры в противопложных направлениях — которое происходит во время митозов и мейоза II, но не во время мейоза I — может влиять на локализацию SGO2 и тем самым влиять на защиту
Чтобы проверить эту гипотезу, Watanabe с сотрудниками сначала подтвердили предыдущие наблюдения, что SGO2 релокализуется из центромер в направлении кинетохор во время метафазы II. На этой стадии, REC8 сохраняет свою исходную центромерную позицию и может быть отщеплен и тем самым запускается разделение сестринскрих хроматид. Затем с помощью искусственного устранения натяжения с центромер во время перехода от метафазы к анафазе в митозе, сохраняли колокализацию shugoshin и cohesin и поэтому центромерный cohesin оказывался защищенным от расщепления с помощью
Во время клеточного цикла хромосомы реплицируются в S фазе и все части реплицированных хромосом (сестринские хроматиды) расходятся в две дочерние клетки во время митоза. Сестринские хроматиды не д. разделяться до метафазы, пока микротрубочки веретена не отловят их кинетохоры, т.к. собственно отлавливание сестринских хроматид зависит от их ассоциации в пары. Ассоциация сестринских хроматид - слипчивость - обеспечивается с помощью мульти-субъединичных комплексов, cohesin, представленных двумя
SMC (structural maintenance of chromosome) семействами белков, Smc1 и Smc3, и двумя добавочными субъединицами, Scc1 (также называемой Mcd1 у S. cerevisiae и Rad21 у S. pombe) и Scc3 [1,2]. Несколько линий доказательств подтверждают мнение, что оба конца Smc1-Smc3 палочек взаимодействуют с одиночным белком Scc1, формируя при этом кольцевую структуру, которая охватывает сестринские хроматиды [3]. С началом анафазы, когда сестринские хроматиды начинают разделяться, Scc1 расщепляется с помощью специфической endo-peptidase, separase, тем самым открывается cohesin кольцо, чтобы высвободить охваченные сестринские хроматиды.
Чтобы уменьшить количество хромосом вдвое, как часть процесса полового размножения, эукариотические клетки подвергаются специфической сегрегации хромосом, называемой мейозом, который состоит из двух раундов расхождения хромосом с одним раундом репликации ДНК. Во время первого мейотического деления (meiosis I), гомологичные хромосомы (гомологи) спариваются для рекомбинации, формируя хиазмы, в которых одна сестринская хроматида из одного гомолога ковалентно присоединяется к сестринской хроматиде из др. гомолога. Следовательно, чтобы гомологи могли разойтись в meiosis I, слипание сестринских хроматид д.б. устранено вдоль хромосомных плеч, чтобы освободиться от хиазм. Однако, слипание сестринских хроматид сохраняется в центромерах вплоть до мейоза II, когда сестринские хроматиды расходятся, как они это делают в митозах, используя остаточную центросомную слипчивость. Т.о., мейотические деления нуждаются в освобождении от слипания сестринских хроматид в два этапа, сначала вдоль хромосомных плеч, а затем в центромерах [1,4-6] (see Figure 1). Этот сложный паттерн сегрегации мейотических хромосом заметно законсервирован от дрожжей до человека. Однако, молекулярные основы защиты центромерной слипчивости во время мейоза I долго были предметом споров, хотя некоторые факторы, включая MEI-S332, Spo13 и Bub1, как было установлено, необходимы для этого пути [7-10].
Недавно было установлено, что дрожжевой белок shugoshin (Sgo) вносит вклад в этот процесс путем защиты центромерных cohesin Rec8 комплексов от расщепления [11-13]. Установлено, что shugoshin, который обнаруживает ограниченное сходство с Drosophila MEI-S332, а также с менее охарактеризованными белками у разных эукариот, входит в состав законсервированного семейства белков.
Shugoshin confers a conserved mechanism
to protect centromeric cohesion at meiosis I
Cohesin комплексы модифицируются в мейозе. Наиболее важной модификацией является то, что Rad21(Scc1) субъединица в основном замещается своим мейотическим аналогом, Rec8. Во время анафазы мейоза I, Rec8 расщепляется только вдоль хромосомных плеч с помощью separase, тогда как центромерный Rec8 сохраняется вплоть до мейоза II. Если Rec8 замещен Rad21 во время мейоза, то слипчивость сестринских хроматид, но не защита её в центромерах, восстанавливается, приводя к разделению
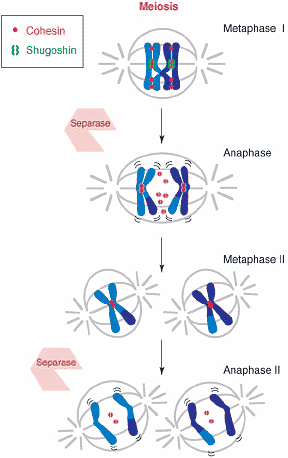 Рис. 1 Shugoshin protects centromeric cohesin from separase cleavage during meiosis I. Homologs are connected by recombinational exchange of
chromosomes during prophase I. At the onset of anaphase I, cohesin
complexes are cleaved only along the arm regions, while centromeric
complexes are protected by Sgo1. This allows separation of the
homologs but not of the sister chromatids. Sgo1 is degraded,
presumably by APC, prior to meiosis II in fission yeast. At the onset of
anaphase II, centromeric cohesin is cleaved by separase, thereby
segregating the sister chromatids.
Рис. 1 Shugoshin protects centromeric cohesin from separase cleavage during meiosis I. Homologs are connected by recombinational exchange of
chromosomes during prophase I. At the onset of anaphase I, cohesin
complexes are cleaved only along the arm regions, while centromeric
complexes are protected by Sgo1. This allows separation of the
homologs but not of the sister chromatids. Sgo1 is degraded,
presumably by APC, prior to meiosis II in fission yeast. At the onset of
anaphase II, centromeric cohesin is cleaved by separase, thereby
segregating the sister chromatids.
сестринских хроматид в мейозе I. Следовательно, прирожденным свойством субъединицы Rec8, которое отсутствует у Rad21, является вклад в защиту центромер в мейозе I [14,15]. Центромерный гетерохроматин играет критическую роль в обогащении cohesin комплексами и тем самым в укреплении центромерного слипания в митозах [16-18]. Мутанты по гетерохроматину у делящихся дрожжей, которые не способны обогащать гетерохроматин Rec8 комплексами, особенно перицентромерных регионов, теряют слипчивость центромер во время мейоза I, подчеркивая важность перицентромерных Rec8 для сохранения слипчивости мейотических центромер [19].
Функциональный скрининг делящихся дрожжей выявил Rec8 protector как ген, который вызывает расхождение хромосом, и который является токсичным во врмемя митотического роста только тогда, когда ко-экспрессируется с Rec8, но не тогда, когда ко-экспрессируется с Rad21 [11]. Этот ген кодирует специфичный для мейоза белок, названный shugoshin (Sgo1), что означает 'guardian spirit' по- японски. Sgo1 локализуется исключительно в перицентромерных гетерохроматиновых регионах, месте, где Rec8, как предполагается, выполняет роль по защите центромер в мейозе I [19]. Независимый нокаутный скрининг у делящихся и почкующихся дрожжей также идентифицировал ген sgo1/SGO1 [12,13] в качестве Rec8 протектора в мейозе. Установлено, что shugoshin обладает до сих пор незамеченным ограниченным сходством с MEI-S332, белком Drosophila, который, как известно, необходим для сохранения слипчивости центромер во время мейоза I [4,7,20], но потерял преимущества в качестве Rec8 протектора из-за очевидного отсутствия гомологии. Более того, shugoshin обнаруживает сходство с не охарактеризованными белками у большинства эукариот, хотя гомология ограничена супер-скрученными (coiled-coil) последовательностями, расположенными вблизи N конца и базовыми последовательностями вблизи C конца [11,13]. Т.о., shugoshin/MEI-S332 составляют семейство законсервированных белков у эукариот (Figure 2). У sgo1 дрожжевых мутантов Rec8 cohesin комплексы не способны персистировать на центромерах во время мейоза I, обусловливая преждевременное разделение сестринских хроматид до метафазы II. Как результат отсутствия слипания сестринские хроматиды подвергаются случайному расхождению в мейозе II. У Drosophila Rec8-подобная молекула C(2)M, по-видимому, не функционирует в когезии хромосом в метафазе I; поэтому остается неясным, защищает ли в самом деле MEI-S332 cohesin комплексы в мейозе [21].
Недавно идентифицирован shugoshin у кукурузы (ZmSgo1) при исследовании мутаций стерильности, у которых слипание центромер исчезало преждевременно до метафазы II [22]. Как и в случае Sgo1 делящихся дрожжей, кукурузный Sgo1 локализуется в центромерах только во время мейоза I и не обнаруживается во время митозов и мейоза II. Из-за фенотипического сходства shugoshin мутантов у дрожжей, мух и растений, предполагается, что shugoshin эукариот выполняет консервативную роль по защите слипчивости центромер в мейозе I, преимущественно защищая от расщепления центромерный Rec8 с помощью separase (Figure 1). Rec8 комплексы ко-преципитируют с Sgo1 in vivo у делящихся дрожжей [11], a кукурузный Sgo1 нуждается в Rec8 для своей центромерной локализации [22], указывая, что защита может осуществляться непосредственно с помощью закрытого взаимодействия этих белков. Тем не менее, точный механизм защиты остается неизвестным.
Mitotic chromosomes are protected at
centromeres by shugoshin in vertebrate cells
Цитологические наблюдения хромосом матазоа показывают, что слипание метафазных сестринских хроматид снижается вдоль плеч хромосом, но не в центромерах, и что продолжительный арест на этой стадии путем добавления лекарств, дестабилизирующих микротрубочки, таких как nocodazole, ведет к полному разделению хромосомных плеч, при этом возникают 'X-образные' хромосомы.
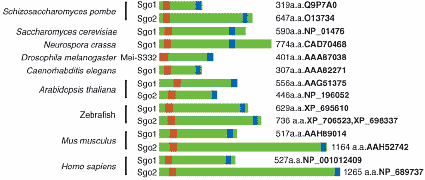 Рис. 2. Shugoshin is a protein conserved among various eukaryotic organisms. The conserved coiled-coil (red box) locates near the N terminus and the basic regions (blue box) near the C terminus. Some organisms have only one shugoshin, but others have two. The functional conservation of
Sgo1 and Sgo2 in various organisms remains to be tested. The protein length and accession number of each gene are indicated on the right.
Рис. 2. Shugoshin is a protein conserved among various eukaryotic organisms. The conserved coiled-coil (red box) locates near the N terminus and the basic regions (blue box) near the C terminus. Some organisms have only one shugoshin, but others have two. The functional conservation of
Sgo1 and Sgo2 in various organisms remains to be tested. The protein length and accession number of each gene are indicated on the right.
В самом деле, большинство, но не все, cohesin комплексы отделяются от хромосомных плеч во время профазы и прометафазы [23], в то время как существенные количества cohesin персистируют в центромерах (Figure 3a). Отделение cohesin в профазе не зависит от расщепления с помощью separase, но в основном зависит от активности двух митотических киназ, Aurora B и polo-like kinase (Plx1) [24,25] (Figure 3a). Plx1, но не Aurora B фосфорилирует непосредственно cohesin комплексы. Фосфорилирование SA2 с помощью Plx1 является особенно критическим для отделения cohesin, т.к. не фосфорилировнная форма SA2 обнаруживает потенциал персистировать во время профазы вдоль всей длины хромосом и тем самым сохранять слипчивость [26].
Млекопитающие имеют два shugoshins, Sgo1 и Sgo2 [11], и оба экспрессируются в митотических клетках, таких как HeLa клетки (T S
Kitajima et al., unpublished). Репрессия Sgo1 человека в пролиферирующих клетках ведет к отделению cohesin комплексов даже от центромер во время прометафазы; др. словами, хромосомы не способны сохранять cohesin на центромерах [27-29]. Поэтому сестринские хроматиды преждевременно разделяются до метафазы, вызывая остановку клеточного цикла с аберрантными митотическими хромосомами. Т.о., центромерная защита cohesin с помощью shugoshin действует также и в митозах, по крайней мере, у позвоночных (Figure 3a). Не смотря на эту защитную роль во время профазы и прометафазы человеческий Sgo1, по-видимому, не защищает cohesin от расщепления с помощью separase в начале митотической анафазы. Как же человеческий Sgo1 защищает cohesin от диссоциации? Т.к. экспрессия не фосфорилированной формы SA2 супрессирует преждевременное разделение сестринских хроматид и т.о. предупреждает митотический арест истощенных по Sgo1 клеток, было предположено, что Sgo1 может предупреждать фосфорилирование cohesin комплексов с помощью Plx1 [29]. В этих экспериментах, однако, экспрессия не способного к фосфорилированию SA2 восстанавливала также слипчивость вдоль хромосомных плеч, это же может восстанавливать саму по себе congression хромосом без слипания центромер, это делает интерпретацию менее убедительной. Интересно, что протеомный анализ показал, что shugoshin формирует комплекс с protein phosphatase 2A (PP2A) у людей, а функция PP2A необходима для слипания центромер (T S Kitajima et al., unpublished), это открывает возможность, что Sgo1-ассоциированная PP2A
конкурирует с Plx1-зависимым фосфорилированием SA2. Мейотическую роль shugoshin у позвоночных еще предстоит исследовать.
Shugoshin may sense the loss of tension at
the centromeres to generate a spindle checkpoint signal
В то время как почкующиеся дрожжи и
Drosophila имеют по одному
shugoshin, делящиеся дрожжи, растения и млекопитающие имеют два shugoshin-подобных белка (Sgo1 и Sgo2, хотя их функциональную консервацию еще предстоит проверить). В противоположность мейоз-специфичной экспрессии Sgo1 у делящихся дрожжей, Sgo2 повсеместно экспрессируется в течение всего митотического и мейотического клеточного цикла. Делеция Sgo2 продуцирует скромный дефект в точности митотической, а также мейотической сегрегации хромосом [11,13]. Sgo2, подобно Sgo1, локализуется в перицентромерной области; однако, Sgo2 в целом безразличен для центромерной защиты Rec8 во время мейоза I, а также для защиты Rad21 во время митозов [11]. Скрининг мутаций у почкующихся дрожжей, дефектных по spindle checkpoint, который отслеживает отсутствие натяжения хромосом, идентифицировал мутации в sgo1, указывая тем самым, что Sgo1 у почкующихся дрожжей необходим не только для защиты cohesin в мейозе, но также в отслеживании отсутствия натяжения центромер, по крайней мере, в митозе [30]. Соответственно Sgo2 делящихся дрожжей необходим для сходной функции spindle checkpoint (S A Kawashima et al., unpublished).
 Рис. 3. Vertebrate Sgo1 protects centromeric cohesin from dissociation during
prophase and prometaphase and may function to sense the tension
between chromatids. (a) In vertebrate cells, Aurora B and Polo kinases
act to dissociate much of the cohesin (red oval) from the arm regions of
chromosomes (blue and right blue) in prophase, which facilitates the
resolution of chromosomes before separation. Sgo1 (green shield)
protects centromeric cohesin from prophase dissociation but not from
cleavage by separase at the onset of anaphase. (b) Sgo1 closely
localizes with centromeric cohesin at the pericentromeric regions, the
sites responsible for centromeric cohesion and sensing tension between
chromatids
Рис. 3. Vertebrate Sgo1 protects centromeric cohesin from dissociation during
prophase and prometaphase and may function to sense the tension
between chromatids. (a) In vertebrate cells, Aurora B and Polo kinases
act to dissociate much of the cohesin (red oval) from the arm regions of
chromosomes (blue and right blue) in prophase, which facilitates the
resolution of chromosomes before separation. Sgo1 (green shield)
protects centromeric cohesin from prophase dissociation but not from
cleavage by separase at the onset of anaphase. (b) Sgo1 closely
localizes with centromeric cohesin at the pericentromeric regions, the
sites responsible for centromeric cohesion and sensing tension between
chromatids
Т.о., может предположить, что канонические молекулы shugoshin выполняют двойную роль в кинетохорах, ка у почкующихся дрожжей; функция shugoshin у делящихся дрожжей может быть распределена между Sgo1 и Sgo2.
Drosophila MEI-S332 может играть некоторую роль в слипании центромер во время митозов; однако, очевидно он не действует как защита cohesin Rad21 [31]. Следовательно, остается неустановленной его митотическая роль по защите центромер. Интересно, что MEI-S332 необходим для
для точного расхождения гомологов в мейозе I, т.к. в случае почкующихся дрожжей Sgo1 и делящихся дрожжей Sgo2 [7,11,13,32], возникает возможность, что MEI-S332 необходим для мониторинга натяжения между гомологами и для гарантии биполярного прикрепления гомологов. Sgo1 позвоночных был очищен от фракций, которые стабилизируют микротрубочки
in vitro,и было подтверждено, что он играет непосредственную роль в регуляции динамики веретена [27]. Истощение Sgo1 в самом деле вызывает некоторые изменения в динамике веретена клеток HeLa; однако, это может быть не прямым эффектом преждевременного расхождения сестринских хроматид, т.к. Sgo1 не локализуется вдоль микротрубочек веретена
in vivo, а потеря сестринскими хроматидами слипчивости и натяжения с веретеном д. изменять динамику веретена, как это наблюдается в cohesin-истощенных клетках
[33]. Несмотря на это, возможно, что Sgo1 взаимодействует с микротрубочками вокруг центромер, отслеживая тем самым натяжение [30].
Regulation of shugoshin function
Spindle checkpoint (КПП) также действует во время мейоза, чтобы гарантировать правильное прикрепление гомологичных хромосом. Курьезно, но Bub1, хорошо законсервированная spindle checkpoint киназа, необходима для обеспечения центромерной защиты во время мейоза I у делящихся дрожжей [10]. Установлено, что Sgo1 не способен локализоваться в центромерах у bub1 мутантов, это указывает на причину, почему сестринские хроматиды неспособны склеиваться в мейозе I у этих мутантов [11]. Сходным образом, Sgo2 у делящихся дрожжей нуждается в Bub1 для центромерной локализации и две эти функции генетически связаны [11]. Т.о., spindle checkpoint функция Bub1 частично, если не целиком, приписывается функции Sgo2. Центромерная локализация Sgo1 человека также зависит от Bub1 [28,34], указывая тем самым, что функциональная связь между этими белками законсервирована. В истощенных по Bub1 клетках HeLa, однако, Sgo1 не только устраняется из центромер, но и ре-локализуется вдоль всей длины хромосом, провоцируя эктопическую защиту cohesin вдоль хромосомных плеч [28]. Т.о., Bub1 выполняет роль по ограничению мест защиты слипания центромерами путем регуляции локализации Sgo1. Более того, этот результат указывает на то, что способность Sgo1 защищать от диссоциации cohesin
не нуждается в центромерных условиях, что подчеркивает непосредственную роль shugoshin в защите cohesin.
Регуляция локализации shugoshin интенсивно изучалась и у Drosophila. Инактивация CID (CENP-A гомолог у Drosophila) устраняет центромерную локализацию MEIS332 [35]. Законсервированные терминальные (coiled-coil и basic) области MEI-S332 необходимы для центромерной локализации [36,37]. MEI-S332 несет сайт для связывания POLO (polo-like kinase) и ассоциирует с POLO, и фосфорилируется in vivo [38]. POLO-зависимое фосфорилирование действует для диссоциации MEI-S332 от центромер, т.к. мутация домена POLO box в MEI-S332, которая устраняет фосфорилирование с помощью POLO, предупреждает диссоциацию MEI-S332 в анафазе [38]. У Xenopus, почкующихся и делящихся дрожжей Sgo1 деградирует способом, зависящим от APC [11,12,27], тогда как Sgo2 у делящихся дрожжей и MEI-S332 Drosophila удаляются из центромер, но, по-видимому, не деградируют во время анафазы [11,31]. Т.о., механизм инактивации shugoshin до некоторой степени различен.
Conclusions
For chromosome segregation, the centromere is more than
an essential region where the kinetochore is assembled to
attach the spindle microtubules. Proper microtubule
attachment is ensured by tension generated at the centromeres,
a process that depends totally on the cohesion
between sister chromatids. Therefore, cohesion and tension,
which together ensure proper chromosome segregation,
are two sides of one coin (Figure 3b). Shugoshin is
directly involved in these fundamental processes by protecting
cohesin at the centromeres and sensing the lack of
tension, despite being originally isolated as a protector of
meiosis-specific cohesin Rec8. Thinking about evolution,
the shugoshin in budding yeast may be a prototype that
carries all these functions in a single molecule. One could
speculate as towhether the original role of shugoshin was to
sense tension or to ensure proper attachment, because this
role is more crucial for chromosome segregation; yeast
shugoshin has little role in protecting cohesion during
mitosis. The protection role, once acquired, might facilitate
the generation of tension by counteracting the spindle
force, improving the fidelity of chromosome segregation.
Whatever the protective role of shugoshin, it is reasonable
to speculate that this function has beenmodified in meiosis
to be more robust in combination with meiosis-specific
cohesin Rec8. Obviously, shugoshin is one of the most
fundamental regulatory molecules of chromosome segregation
in eukaryotes; however, the molecular mechanisms
of its action largely remain unknown. We are just on the
threshold of uncovering the true character of the ‘guardian
spirit’ of chromosome segregation.
|
|
Yuya Yamagishi, Takashi Honda, Yuji Tanno, Yoshinori Watanabe
Two Histone Marks Establish the Inner Centromere and Chromosome Bi-Orientation
Science 2010:
Vol. 330. no. 6001, pp. 239 - 243
DOI: 10.1126/science.1194498
Для собственно расщепления хромосом в митозе chromosomal passenger complex (CPC), включающий Aurora B и survivin должен быть локализован в центре спаренных кинетохор, в сайте, называемом внутренней центромерой. В основном неизвестно, что определяет внутреннюю центромеру и как CPC доставляется на этот сайт. Авт. показали, что фосфорилирование гистон H3–threonine 3 (H3-pT3), обеспечиваемое Haspin, кооперирует с Bub1-обеспечиваемым фосфорилированием histone 2A–serine 121 (H2A-S121) осуществялется в процессе доставки CPC на внутреннюю центромеру у делящихся дрожжей и в клетках человека. H3-pT3 способствует связыванию нуклеосомами survivin, тогда как фосфорилированный H2A-S121 облегчает связывание shugoshin, центромерного адаптора CPC. Haspin локализуется совместно с cohesin путем ассоциации с Pds5, тогда как Bub1 локализуется на кинетохорах. Т.о., внутренняя центромера определяется пересечением двух гистоновых киназ. |
Сайт создан в системе
uCoz 
 Рис. 1 Shugoshin protects centromeric cohesin from separase cleavage during meiosis I. Homologs are connected by recombinational exchange of
chromosomes during prophase I. At the onset of anaphase I, cohesin
complexes are cleaved only along the arm regions, while centromeric
complexes are protected by Sgo1. This allows separation of the
homologs but not of the sister chromatids. Sgo1 is degraded,
presumably by APC, prior to meiosis II in fission yeast. At the onset of
anaphase II, centromeric cohesin is cleaved by separase, thereby
segregating the sister chromatids.
Рис. 1 Shugoshin protects centromeric cohesin from separase cleavage during meiosis I. Homologs are connected by recombinational exchange of
chromosomes during prophase I. At the onset of anaphase I, cohesin
complexes are cleaved only along the arm regions, while centromeric
complexes are protected by Sgo1. This allows separation of the
homologs but not of the sister chromatids. Sgo1 is degraded,
presumably by APC, prior to meiosis II in fission yeast. At the onset of
anaphase II, centromeric cohesin is cleaved by separase, thereby
segregating the sister chromatids.  Рис. 2. Shugoshin is a protein conserved among various eukaryotic organisms. The conserved coiled-coil (red box) locates near the N terminus and the basic regions (blue box) near the C terminus. Some organisms have only one shugoshin, but others have two. The functional conservation of
Sgo1 and Sgo2 in various organisms remains to be tested. The protein length and accession number of each gene are indicated on the right.
Рис. 2. Shugoshin is a protein conserved among various eukaryotic organisms. The conserved coiled-coil (red box) locates near the N terminus and the basic regions (blue box) near the C terminus. Some organisms have only one shugoshin, but others have two. The functional conservation of
Sgo1 and Sgo2 in various organisms remains to be tested. The protein length and accession number of each gene are indicated on the right.  Рис. 3. Vertebrate Sgo1 protects centromeric cohesin from dissociation during
prophase and prometaphase and may function to sense the tension
between chromatids. (a) In vertebrate cells, Aurora B and Polo kinases
act to dissociate much of the cohesin (red oval) from the arm regions of
chromosomes (blue and right blue) in prophase, which facilitates the
resolution of chromosomes before separation. Sgo1 (green shield)
protects centromeric cohesin from prophase dissociation but not from
cleavage by separase at the onset of anaphase. (b) Sgo1 closely
localizes with centromeric cohesin at the pericentromeric regions, the
sites responsible for centromeric cohesion and sensing tension between
chromatids
Рис. 3. Vertebrate Sgo1 protects centromeric cohesin from dissociation during
prophase and prometaphase and may function to sense the tension
between chromatids. (a) In vertebrate cells, Aurora B and Polo kinases
act to dissociate much of the cohesin (red oval) from the arm regions of
chromosomes (blue and right blue) in prophase, which facilitates the
resolution of chromosomes before separation. Sgo1 (green shield)
protects centromeric cohesin from prophase dissociation but not from
cleavage by separase at the onset of anaphase. (b) Sgo1 closely
localizes with centromeric cohesin at the pericentromeric regions, the
sites responsible for centromeric cohesion and sensing tension between
chromatids