Транспорт белка через ER мембрану у эукариот является ранней и решающей ступенью биосинтеза многих белков (rev. Hegde & Lingappa 1997, Johnson & van Waes 1999, Matlack et al. 1998). Эти белки могут быть подразделены на две группы: растворимые белки, такие как те. что секретируются клетками или локализуются в просвете ER, и мембранные белки, таке как те, что в плазматической мембране или др. органеллах секреторного пути. У eubacteria и archaea, транспорт белков происходит непосредственно через плазматическую мембрану и является также важной ступенью в биосинтезе секретируемых и мембранных белков. Растворимые белки пересекают мембрану полностью и обычно имеют N-терминальные отщепляемые сигнальные последовательности, чьим основным признаком является короткий гидрофобный сегмент (обычно в 7-12 аминокислотных остатков). Мембранные белки имеют др. топологию с одним или несколькими TM сегментами, каждый содержит около 20 гидрофобных остатков. Мембранные белки имеют растворимые домены, которые транслоцируются через мембрану, а также растворимые домены, которые остаются в цитозоле. Оба типа белков используют одни и те же приспособления (machinery) для транслокации через мембрану: белок-проводящий канал с гидрофильной внутренностью (Crowley
et al. 1993, Simon&Blobel 1991). Этот канал в противопложность тем, что транспортируют ионы и малые молекулы, имеет необычные свойства, благодаря свой способности открываться в двух направлениях: перпендикулярно плоскости мембраны, что позволяет полипептидному сегменту пересекать ее, а внутри мембраны позволяет гидрофобному ТМ сегменту мембранного белка выходить вбок в липидную фазу. Белок-проводящий канал формируется с помощью эволюционно законсервированного гетеротримерного мембранного белкового комплекса, названного Sec61 комплексом у эукариот и SecY комплексом у eubacteria и archaea.
THE Sec61/SecY COMPLEX
Самой крупной субъединицей гетеротримерного Sec61/SecY комплекса является α-субъединица, названная Sec61α у млекопитающих, Sec61p у Saccharomyces cerevisiae и SecY у eubacteria и archaea
(rev. Rapoport et al. 1996). Эта субъединица пронизывает мембрану 10 раз, её N- и C концы находятся в цитозоле. β-субъединица, наз. Sec61β у млекопитающих, Sbh1p у S. cerevisiae, SecG у eubacteria и Secβ у archaea. У эукариот и archaea, эта субъединица пронизывает мембрану один раз с N-концом в цитозоле. SecG у eubacteria
пронизывает мембрану дважды. γ-субъединица, наз.
Sec61γ у млекопитающих, Sss1p у S. cerevisiae и SecE у eubacteria и archaea. У большинства видов эта субъединица является белком один раз пронизывающим мембрану с N концом в цитозоле. У некоторых eubacteria, напр., Escherichia coli, γ-субъединица имеет два дополнительных N терминальных TM сегмента. которые не существенны для его функции. α- и γ-субъединицы Sec61/SecY комплекса обнаруживаются во всех организмах и обнаруживают низкую, но достоверную консервацию последовательностей. β-субъединицы являются гомологичными среди эукариот и archaea, но не обнаруживают очевидного сходства с eubacterial SecG. α- и γ-субъединицы существенны для жизнеспособности ждрожжей и eubacteria, тогда как β-субъединца нет. Всё это указывает на то, что α- и γ-субъединицы составляют основу канал-формирующего комплекса. Некоторые организмы имеют по две копии Sec61 или SecY (Bensing & Sullam 2002, Rapoport et al. 1996), и в некоторых случах вторая копия может транспортировать специфические субстраты (Bensing & Sullam 2002). У S. cerevisiae, имеется второй Sec61 комплекс (Ssh1 комплекс), который не существенен для жизнеспособности и, по-видимому, функционирует исключительно в ко-трансляционной транслокации (Finke et al. 1996).
Первоначальные доказательства, что Sec61/SecY комплекс формирует белок-проводящий канал, были получены cross-linking экспериментах, при которых фотореактивные зонды помещали в разные позиции полипептидного субстрата (Mothes et al. 1994). Субстраты с зондами в позициях предположительно внутри мембран оказывались поперечно связанными с α-субъединицей Sec61 комплекса, но не с др. мембранными белками. Эти данные показали, что α-субъединица окружает полипептидную цепь, когда цепь проходит через мембрану. Строгое подтверждение этому мнению, что Sec61/SecY комплекс формирует канал, получено в экспериментах, в которых очищенный комплекс был восстановлен в протеолипосомах и было показано, что он является существенным мембранным компонентом для транслокации белков (Akimaru et al. 1991, Brundage et al. 1990, Gorlich & Rapoport 1993).
THREE DIFFERENT MODES OF TRANSLOCATION
Белок-проводящий канал, формируемый с помощью Sec61/SecY комплекса, является пассивной порой, которая позволяет полипептидной цепи скользить вперед и обратно. Канал, следовательно, д.б. ассоциирован с партнерами, которые обеспечивают движущуюся силу для транслокации. В зависимости от партнера канал может функционировать в трех разных типах транслокаций.
Первый способ, ко-трансляционная транслокация, использует рибосомы в качестве основного партнера канала (Figure 1). Это наиболее распространенный механизм транслокации у всех организмов и в клетках и он ответственен за интеграцию большинства мембранных белков. Ко-трансляционная транслокация начинается с фазы доставки во время которой комплекс рибосома-синтезируемая цепь направляется на мембрану с помощью signal recognition particle (SRP) и её мембранного рецептора (SRP рецептора) (rev. Halic & Beckmann 2005, Luirink & Sinning 2004). Как только рибосомы оказываются связаны с белок-проводящим каналом, удлиняющаяся полипептидная цепочка движется с рибосомы в мембранный канал; GTP гидролиз во время транслокации обеспечивает её энергией (Figure 1). Когда рибосома синтезирует цитозольный домен мембранного белка, то полипептидная цепочка появляется из соединения рибосома-канал вбок в цитозоль (Mothes et al. 1997).
У эукариот, имеется второй способ транслокации, с помощью которого белки транспортируются после завершения своего синтеза (пост-трансляционная транслокация). Белки, которые используют этот способ имеют менее гидрофобные сигнальные последовательности могут, следовательно, избегать взаимодействия с SRP во время своего синтеза (Ng
et al. 1996). Механизм пост-трансляционной транслокации выявлен у
S. cerevisiae (Matlack et al. 1999), и скорее всего он тот же самый и у высших эукариот. При этом способе транслокации партнером канала является др. мембранный белковый комплекс (Sec62/63 комплекс) и lumenal белок BiP, член семейства Hsp70 ATPases. У дрожжей комплекс Sec62/63 является тетрамером, который вместе с Sec61 комплексом формирует семи-компонентный Sec комплекс (Deshaies et al. 1991, Panzner et al. 1995). Помимо существенных белков Sec62p и Sec63p этот комплекс содержит
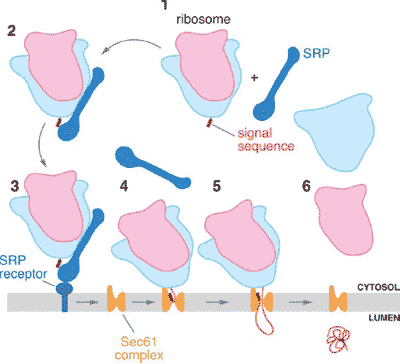 Figure 1
Cotranslational translocation of a secretory protein. The scheme shows different steps in the translocation of a eukaryotic secretory protein. (1 and 2) The signal recognition particle (SRP) binds to the signal sequence in a growing polypeptide chain as well as to the ribosome (large subunit, light blue; small subunit, pink). (3) The entire complex is targeted to the membrane by an interaction of the SRP with the SRP receptor. (4 and 5) The SRP is released, and the ribosome binds to the protein-conducting
channel formed by the Sec61 complex. The polypeptide inserts into the channel as a loop, with the N and C termini in the cytosol. The signal sequence is intercalated into the wall of the channel, and the
following polypeptide segment is located in the pore proper. (6) The remainder of the polypeptide chain moves from the ribosome tunnel, through the channel, and to the other side of the membrane. The signal sequence is cleaved at some point during translocation.
Figure 1
Cotranslational translocation of a secretory protein. The scheme shows different steps in the translocation of a eukaryotic secretory protein. (1 and 2) The signal recognition particle (SRP) binds to the signal sequence in a growing polypeptide chain as well as to the ribosome (large subunit, light blue; small subunit, pink). (3) The entire complex is targeted to the membrane by an interaction of the SRP with the SRP receptor. (4 and 5) The SRP is released, and the ribosome binds to the protein-conducting
channel formed by the Sec61 complex. The polypeptide inserts into the channel as a loop, with the N and C termini in the cytosol. The signal sequence is intercalated into the wall of the channel, and the
following polypeptide segment is located in the pore proper. (6) The remainder of the polypeptide chain moves from the ribosome tunnel, through the channel, and to the other side of the membrane. The signal sequence is cleaved at some point during translocation.
несущественные компоненты Sec71p и Sec72p. Клетки млекопитающих содержат Sec62p и Sec63p, но лишены двух др. белков (Meyer et al. 2000,
Tyedmers et al. 2000).
Движущая сила для пост-трансляционной транслокации генерируется с помощью храпового (ratcheting) механизма (Figure 2) (Matlack et al. 1999).
Полипептид в канале может скользить в любом направлении, но его связывание с BiP внутри просвета ER предупреждает движение обратно в цитозоль, в результате происходит транслокация дальше. ATФ-связанный BiP, с открытым пептид-связывающим карманом, взаимодействует с просветным доменом Sec63p, названным J доменом. Это взаимодействие стимулирует быстрый гидролиз ATФ
и закрытие пептид-связывающего кармана вокруг вошедшей полипептидной цепочки. Когда полипептид перемещается на достаточное расстояние в направлении вперед, то др. BiP молекула может связать его; этот процесс повторяется до тех пор, пока полипептидная цепочка
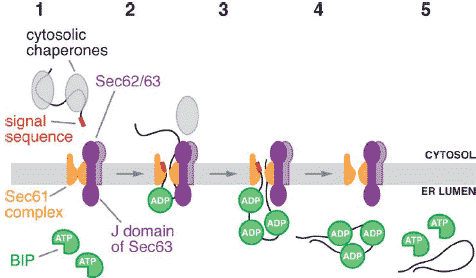 Figure 2
Posttranslational translocation in eukaryotes. (1) After it is synthesized in the cytosol, an unfolded polypeptide is kept in solution by cytosolic chaperones. (2) It is targeted by its signal sequence to the
translocation channel, comprised of the Sec61 complex and the Sec62/63 complex, and the cytosolic chaperones are released. The J domain of Sec63 stimulates ATP hydrolysis by BiP, and ADP bound BiP binds to the polypeptide chain emerging into the ER lumen. (3) When the polypeptide has moved a sufficient distance into the ER lumen, another BiP molecule can bind to it. (4) This process is repeated until the polypeptide chain has completely traversed the channel. (5) BiP is released upon exchange of
ADP for ATP; this exchange opens the peptide-binding pocket.
Figure 2
Posttranslational translocation in eukaryotes. (1) After it is synthesized in the cytosol, an unfolded polypeptide is kept in solution by cytosolic chaperones. (2) It is targeted by its signal sequence to the
translocation channel, comprised of the Sec61 complex and the Sec62/63 complex, and the cytosolic chaperones are released. The J domain of Sec63 stimulates ATP hydrolysis by BiP, and ADP bound BiP binds to the polypeptide chain emerging into the ER lumen. (3) When the polypeptide has moved a sufficient distance into the ER lumen, another BiP molecule can bind to it. (4) This process is repeated until the polypeptide chain has completely traversed the channel. (5) BiP is released upon exchange of
ADP for ATP; this exchange opens the peptide-binding pocket.
не пройдет целиком через канал. Когда ADP заменяется на ATP, то пептид-связывающий карман открывается и BiP высвобождается.
Некоторые аспекты этого лентопротяжного механизма нуждаются в комментариях. Во-первых, перед транслокацией, полипептидный субстрат теряет все связанные цитозольные хапероны (chaperones), облегчая тем самым его пассивное движение вперед. Эксперименты по поперечному связыванию показали, что несколько разных хаперонов связывается с завершенным полипептидом с возможным циклом вкл. и выкл. (Plath & Rapoport 2000).
Однако, как только полипептидная цепь соединяется с комплексом Sec посредством его N-терминальной сигнальной последовательности, то даже хапероны, взаимодействующие с С концом, отсоединяются. Комплекс Sec
не стимулирует диссоциацию хаперонов, а скорее предупреждает их повторное связывание, вообще-то посредством подходящих по размеру цитозольных доменов Sec62p и Sec63p. Специфические молекулы поставщики, сходыне с SRP при ко-транлсяционной транслокации, не найдены. Во-вторых, BiP соединяется с разными наборами субстратов и внутри каждого полипептида с с разными сегментами. Хотя BiP преимущественно связывает гидрофобные пептиды в равновесных условиях, он обнаруживает мало сиквенс-специфичности, когда активирован с помощью J домена Sec63p (Misselwitz et al. 1998). При неравновесных условиях даже сегменты, которые не согласуются в точности с пептид-связывающим карманом, могут быть связаны. В-третьих, локализация J домена гарантирует, что активация BiP будет происходить только вблизи канала, где связывание BiP с полипептидной цепью наиболее эффективно для предупреждения её скольжения назад (Figure 2). Когда полипептидный сегмент перемещается прочь от канала новая молекула BiP не будет присоединяться пока присоединенная ранее не будет диссоциирована. В-четвертых, движение вперед полипептидной цепочки очен сходно с Броуновским движением. Это подтверждается наблюдением, что в протеолипосомах, содержащих Sec комплекс,
ATФ-независимая транслокация происходит, если BiP замещен антителами к субстрату (Matlack et al. 1999). Математическое моделирование также показывает, что Броуновский храповой механизм достаточен для объяснения кинетики транслокации (Liebermeister et al. 2001).
Третьий способ транслокации найден только у eubacteria, он также происходит пост-трансляционно; он используется большинством секреторных белков (rev. Mori & Ito 2001). В этом случае партнером канала является цитозольная ATPase, наз. SecA. SecA скорее всего подвергается конформационным изменениям, связанным с её ATPase циклом, и проталкивает полипептиды через SecY канал ступенчато-образным способом (Figure 3) (Economou&Wickner 1994).
Archaea, по-видимому, обладают как ко-, так и пост-трансляционной транслокацией (Irihimovitch & Eichler 2003, Ortenberg & Mevarech 2000),
но неясно, как они осуществляют последний, т.к. они лишены и SecA и Sec62/63 комплекса.
THE X-RAY STRUCTURE OF THE SecY COMPLEX AND ITS
IMPLICATIONS
Важная информация о функции белок-проводящего канала получена с помощью 3.2 A разрешения рентгеновской структуры комплекса detergent-solubilized SecY из archaebacterium Methanococcus jannaschii (van den Berg et al. 2004). Учитывая сходство последовательностей, упомянутое выше, очень вероятно, что структура характерна для всех видов. Кроме того, была определена структура E. coli SecY комплекса с помощью EM двухмерных кристаллов (Breyton et al. 2002), показавшая, что все TM сегменты действительно соответствуют таковым в
комплексе archaeal (van den Berg et al. 2004). Это наблюдение также показало, что структура SecY комплекса в детергенте очень сходна с таковой в липидном бислое.
Согласно рентгеновской картине SecY комплекс содержит по одной копии каждой из трех субъединиц (Figure 4). Видимый со стороны цитозоля комплекс имеет приблизительно квадратную форму. Две небольшие субъединицы (SecE и Sec.) располагаются на периферии комплекса.
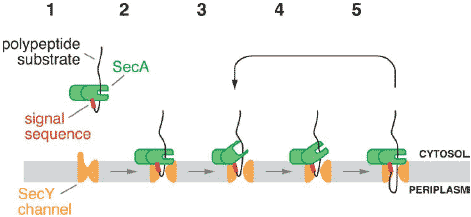 Figure 3
SecA-mediated posttranslational translocation in eubacteria. The scheme shows a model for the different steps in translocation. (1) SecA binds to a polypeptide substrate bearing an N-terminal signal sequence.
(2) The complex binds to SecY, and the polypeptide substrate inserts as a loop into the channel. (3) The SecA polypeptide-binding groove opens and moves away from the channel, leaving a polypeptide segment in the channel. (4) The binding groove grabs the next section of the polypeptide chain and then closes. (5) The polypeptide-binding domains move toward the channel, pushing the polypeptide segment into the channel. Steps (3)-(5) are repeated until the polypeptide chain is fully translocated (not shown).
Figure 3
SecA-mediated posttranslational translocation in eubacteria. The scheme shows a model for the different steps in translocation. (1) SecA binds to a polypeptide substrate bearing an N-terminal signal sequence.
(2) The complex binds to SecY, and the polypeptide substrate inserts as a loop into the channel. (3) The SecA polypeptide-binding groove opens and moves away from the channel, leaving a polypeptide segment in the channel. (4) The binding groove grabs the next section of the polypeptide chain and then closes. (5) The polypeptide-binding domains move toward the channel, pushing the polypeptide segment into the channel. Steps (3)-(5) are repeated until the polypeptide chain is fully translocated (not shown).
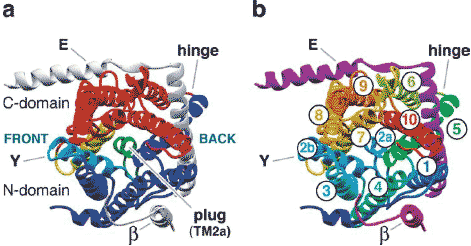 Figure 4
(a) The structure of the M. jannaschii SecY complex viewed from the cytoplasm. The N-terminal domain of SecY (TM1-5) is shown in dark blue, with the exception of TM2b (bright blue). The C-terminal
domain (TM6-10) is shown in red, with the exception of TM7 (yellow). The signal sequence intercalates at the front, between TM2b and TM7. The plug (TM2a), which blocks the pore of the closed channel, is
shown in green. The proposed hinge region between TM segments 5 and 6 is labeled. (b) A cytoplasmic view of the M. janaschii SecY complex with individual helices colored and labeled.
Figure 4
(a) The structure of the M. jannaschii SecY complex viewed from the cytoplasm. The N-terminal domain of SecY (TM1-5) is shown in dark blue, with the exception of TM2b (bright blue). The C-terminal
domain (TM6-10) is shown in red, with the exception of TM7 (yellow). The signal sequence intercalates at the front, between TM2b and TM7. The plug (TM2a), which blocks the pore of the closed channel, is
shown in green. The proposed hinge region between TM segments 5 and 6 is labeled. (b) A cytoplasmic view of the M. janaschii SecY complex with individual helices colored and labeled.
SecE субъединица экстенсивно контактирует с SecY, занимая две стороны квадрата. Субъединица SecY содержит 10 TM сегментов, организованных в N- и C-терминальные домены, представленные TM1-5 и TM6-10, соотв. (Figure 4). Два домена соединены на задней части комплекса петлей между TM5 и TM6. SecY обладает псевдо-симметрией так, что его C-терминальный домен является в основном перевернутой версией его N-терминального домена. Доменовая организация SecY и расположение двух малых субъединиц на периферии делают фронт комплекса в качестве единственного места, которое может открываться латерально по направлению к липидной фазе. такой боковой выход необходим для функции SecY комплекса. Комплекс может, следовательно, быть связан с подобием створок раковины моллюска (clamshell), которые могут открываться по фронту в направлении липидов с шарниром, расположенным в задней части комплекса между TM5 и TM6. SecE субъединица может служить в качестве скрепления, которое предупреждает полное разъединение двух доменов.
Рентгеновская структура подтверждает, что пора канала располагается в центре одиночной копии SecY комплекса (van den Berg et al. 2004) скорее, чем на обращенных др. к др. сторонах трех или четырех комплексов (Beckmann et al. 1997, Breyton et al. 2002, Manting et al. 2000, Morgan et al. 2002). Образование дисульфидных мостиков между cysteines в субстрате для транслокации и цистеинами в SecY подтверждает мнение, что полипептидная цепь движется через центр одиночной SecY молекулы (Cannon et al. 2005). Кроме того, почти все законсервированные остатки в SecY комплексе располагаются не по периферии, а в центре комплекса (van den Berg et al. 2004). Мутации, которые позволяют белкам с дефектными или отсутствующими сигнальными последовательностями транспортироваться (prl mutations; Bieker et al. 1990, Derman et al. 1993), также локализуются в центре SecY комплекса. Более того, интерфейс латерально ассоциированных комплексов не может сформировать гидрофильную пору; подобно всем др. мембранным белкам одиночный SecY комплекс имеет целиком гидрофобный пояс ~ в 25 A толщиной вокруг её. В мембране этот пояс д. подвергаться воздействию гидрофобной внутренности липидного бислоя. Всё это указывает на то, что пора содержится внутри одиночного SecY комплекса. В самом деле, структура показывает цитоплазматическую воронку, которая может маркировать вход в канал. Воронка суживается к вблизи средины мембраны и блокируется на вне-цитоплазматической стороне за счет присутствия небольшого спирального сегмента (TM2a) дублирующего (dubbed) "затычку" (Figure 4a) (van den Berg et al. 2004). Кристаллическая структура archaebacterial SecY комплекса, следовательно, соотвествует этому закрытому каналу; это ожидалось, учитывая, что комплекс был кристаллизован в отсутствие партнеров транслокации и субстрата.
Открытие канала, по-видимому, нуждается в движении затычки (Figure 5). Цистеины, внесенные в заслонку и в TM сегмент SecE E. coli SecY комплекса, образуют дисульфидные мостики in vivo (Harris & Silhavy
1999), подтверждая, что заслонка движется в направлении задней части комплекса, в полось на внеклеточной стороне. Образование дисульфидных мостиков не может быть объяснено с помощью структуры закрытого канала, в котором цистеины д. находиться слишком далеко др. от др. (более 20 A ). Как и ожидалось блокирование канала в постоянно открытом состоянии с помощью индукции образования дисульфидных мостиков является летальным для клетки (Harris & Silhavy 1999).
Канал находится, по-видимому, в динамическом равновесии с заслонкой, движущейся между позициями закрыто и открыто. В незанятом канале равновесие на стороне закрытого состояния, но оно может сдвигаться в направлении открытого состояния, путем связывания сигнальной последовательности или, в случае множественных мембранных белков, TM сегмента. Эксперименты по поперечному связыанию показали, что гидрофобная сердцевина из сигнальной последовательности формирует короткую спираль примерно в два витка. Эта спираль вставляется между TM2b и TM7 в Sec61/SecY
по фронту молекулы и контактирует с фосфолипидами (Plath et al. 1998). Транслокационный субстрат вставляется в виде петли; сигнальная последовательность интеркалируется в стенку канала, а следующий полипептидный сегмент располагается собственно в поре. Интеркаляция сигнальной последовательности нуждается в шарнирном движении на задней части Sec61/SecY, чтобы открыть "рот створок раковины"
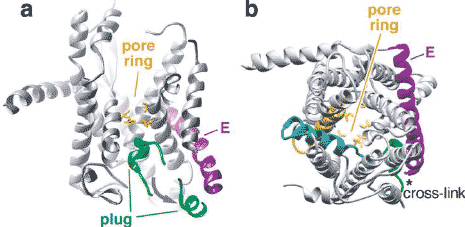 Figure 5
Plug movement leads to opening of the SecY channel. (a) View from the side of the channel with the front half of the model cut away. The modeled movement of the plug toward the SecE subunit is indicated by an arrow. The side chains of residues in the pore ring are colored in gold. (b) Cytosolic
view, with the plug modeled in its open position. TM2b and TM7 located at the front of the complex are shown in blue and yellow, respectively. The asterisk indicates the region where introduced cysteines result in cross-links between the plug and the TM segment of SecE (Harris & Silhavy 1999).
Figure 5
Plug movement leads to opening of the SecY channel. (a) View from the side of the channel with the front half of the model cut away. The modeled movement of the plug toward the SecE subunit is indicated by an arrow. The side chains of residues in the pore ring are colored in gold. (b) Cytosolic
view, with the plug modeled in its open position. TM2b and TM7 located at the front of the complex are shown in blue and yellow, respectively. The asterisk indicates the region where introduced cysteines result in cross-links between the plug and the TM segment of SecE (Harris & Silhavy 1999).
Расхождение двух половинок молекулы может дестабилизировать взаимодействия, которые удерживают заслонку в центре молекулы, тем самым способствуя открытию канала. В подтверждение этой модели многие супрессорные мутации сигнальной последовательности в SecY, по-видимому, дестабилизируют структуру закрытого канала (van den Berg et al. 2004). Как только сигнальная последовательность проникает в стенку канала, полипептидный сегмент дистальнее сигнальной последовательности может двигаться через пору и мешать заслонке возвратиться в ее позицию закрытого состояния (Figure 1).
Связывание партнеров канала (SecA или рибосом) также может регулировать открытие канала. Подтверждает это мнение то, что рибосомы дестабилизируют закрытое состояние канала, это было показано в электофизиологических экспериментах, в которых повышенное проведение ионов наблюдалось, когда не транслирующие рибосомы соединялись с каналом (Simon & Blobel 1991). Рибосомы соединяются исключительно с цитозольной петлей, расположенной в С-терминальной половине Sec61/SecY (Raden et al. 2000) и, следовательно, не предупреждают расхождения половинок молекулы. Открытый канал принимает форму песочных часов с гидрофильными воронками на обоих сторонах сужения в центре мембраны. Это согласуется с наблюдением, что транслоцирующаяся полипептидная цепочка движется через мембрану в жидкую среду (Crowley et al. 1993, Simon & Blobel 1991). Во время транслокации субстрат может в первую очередь устанавливать контакт с остатками в сужении канала, минимизируя взаимодействия субстрат-канал. Ограничение контактов между транслоцирующейся цепью и каналом в узкой области подтверждено недавними экспериментами (Cannon et al. 2005).
Точка сужения канала или кольцо поры состоит из 6 гидрофобных аминокислотных остатков, которые у многих видов являются изолейцинами (Figure 5) (van den Berg et al. 2004). Кольцо поры может быть сравнено с подобием сальника вокруг транслоцирующейся полипептидной цепи, осуществляющего тем самым печать (seal), которая ограничивает прохождение ионов и др. малых молекул во время транслокации белка. В этой модели трансмембранный барьер м. поддерживаться при всех способах транслокации. При альтернативной модели печать (seal) на все малые молекулы обеспечивается путем связывания рибосомы с цитозольной стороной канала или путем связывания BiP со стороной просвета ER (Crowley et al. 1994, Hamman
et al. 1998). Эта модель подкрепляется дополнительными структурными данными (Rapoport et al. 2004). Кроме того, не объяснено, как мембранный барьер поддерживается в отсутствие рибосом (при пост-трансляционной транслокации) или в отсутствие BiP (у прокариот).
В дополнение к движениям заслонки, расширение поры скорее всего необходимо для транслокации полипептидной цепи. Диаметр кольца поры, как наблюдается на кристаллической структуре, слишком мал, чтобы позволить пройти даже расправленной вытянутой полипептидной цепи. Расширение канала может происходить за счет движения спирали, к которой остатки поры прикреплены. Гибкие богатые глицином последовательности в цитозольных петлях между TM4 и TM5 и между TM9 и TM10 могут позволять каналу приспосабливаться к движению этой спирали. Расширение поры необходимо, чтобы объяснить экспериментально наблюдаемые транслокации α-helices,
из 13 остатков связанных дисульфидными мостиками полипептидной петли (Tani et al. 1990) или аминокислотной боковой цепи, модифицированной громоздкими группами (De Keyzer et al. 2002, Kurzchalia et al. 1988). Гибкость области поры подтверждается моделированием молекулярной динамики, которое показало, что шарик в 10-12A или спираль диаметром 10 A может проходить через пору (P. Tian & I. Andricioaei, J. Gumbart & K. Schulten, personal communications). Введение сигнальной последовательности во фронт Sec61/SecY (отверстие створок раковины) может вызывать добавочное расширение поры, т.к.это необходимо для инсерции петли полипептидной цепи.
Подсчитанные максимальные размеры поры, базирующиеся на рентгеновской структуре составляют ~ 15 x 20 A . Это значительно меньше, чем подсчеты диаметра поры в 40 A; исходя из наблюдения крупных реагентов, проходящих через мембранные каналы, чтобы потушить флюоресцентные зонды в синтезируемой полипептидной цепи (Hamman et al. 1997). Такой крупный гидрофильный канал может быть получен только если несколько Sec61/SecY
молекул ассоциируют своими фронтальными поверхностями и открываются, чтобы слить свои поры. Однако, по крайней мере, у eubacteria, SecY молекулы, по-видимому, ассоциируют спина-к-спине. Такое расположение у димеров видно с помощью EM в двухмерных кристаллах в
E. coli SecY комплексе (Figure 6) (Breyton et al. 2002), a функциональная важность этой ориентации для пост-трансляционной транслокации подтверждена в экспериментах по поперечному сцеплению (Kaufmann et al. 1999). Данные по тушению флюоресценции также подтверждают рентгеновскую структуру крупных рибосомальных субъединиц, т.к. те же самые реагенты quench зондов внутри рибосомальных воронок, которые диаметром значительно уже, чем 40 A (Hamman et al. 1997). Относительно узкая пора также согласуется с тем фактом, что даже небольшой полипептидный домен не может уложиться внутри канала (Kowarik et al. 2002).
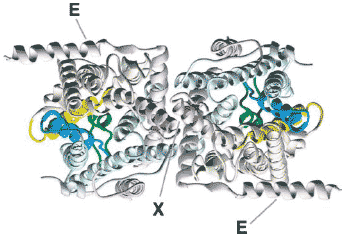 Figure 6
Back-to-back arrangement of E.coli SecY complexes in the dimer as seen
in the EM structure derived from two-dimensional crystals (Breyton et al.
2002). TM2b and TM7 at the front of the complexes are colored in blue
and yellow, respectively. The plug is shown in dark green. Cysteines
introduced at the positions indicated by the red spheres result in efficient disulfide formation (X) between two SecE subunits (Kaufmann et al. 1999).
Figure 6
Back-to-back arrangement of E.coli SecY complexes in the dimer as seen
in the EM structure derived from two-dimensional crystals (Breyton et al.
2002). TM2b and TM7 at the front of the complexes are colored in blue
and yellow, respectively. The plug is shown in dark green. Cysteines
introduced at the positions indicated by the red spheres result in efficient disulfide formation (X) between two SecE subunits (Kaufmann et al. 1999). MECHANISM OF COTRANSLATIONAL TRANSLOCATION
Ribosome-Channel Interaction
Комплекс рибосомы-канал у эукариот был выявлен с помощью single-particle EM (Beckmann et al. 1997, 2001, Menetret et al.
2000, Morgan et al. 2002). Рибосомы скорее всего ассоциированы с 4 копиями комплекса Sec61. Область низкой плотности в центре ансамбля первоначально интерпретировалась как центральная пора, но при дальнейших реконструкциях с разрешением 15-17 A с улучшенным уровнем контурирования, пора становилась не видимой (Beckmann et al. 2001, Morgan et al. 2002). Хотя разрешение EM данных недостаточно для выяснения рентгеновской структуры SecY комплекса, но вполне правдоподобное расположение четырех Sec61
молекул состоит из двух бок-о-бок ассоциированных димеров, которые в свою очередь формируются из спина-к-спине собранных мономеров (Figure 7)
(Menetret et al. 2005). Такая сторона-к-стороне упаковка димеров видна в двухмерных кристаллах E. coli SecY комплекса (Breyton et al. 2002). Такое расположение создает центральную область низкой плотности, но эта область целиком гидрофобна и может быть заполнена липидами или после solubilization, детергентом. β-субъединицы вносят существенный вклад в интерфейс между димерами (Bessonneau et al. 2002, Breyton et al. 2002),
но не являются существенными, указывая тем самым, что связывание рибосомы может играть важную роль в сборке тетрамера.
Соединение между рибосомой и 4 копиями Sec61 комплекса состоит из примерно 4-7 контактов (Beckmann et al. 2001, Menetret et al. 2005,
Morgan et al. 2002). Некоторые рибосомальные белки и области рибосомальных РНК, которые могут участвовать во взаимодействии, были идентифицированы (Beckmann et al. 2001, Morgan et al. 2002).
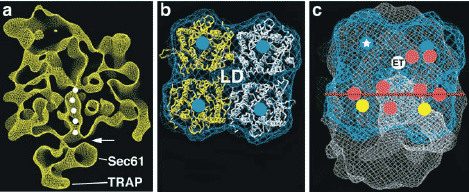 Figure 7
EM structure of ribosome-Sec61 channel complexes and possible oligomeric arrangement of Sec61 complexes (Menetret et al. 2005). (a) Ribosome-channel complexes derived from native ER membranes
were analyzed by single-particle EM. A cross section through the ribosome-channel complex, viewed from the side, is shown. The ribosomal exit tunnel, from which a growing polypeptide chain would
emerge, is marked by white dots. The gap between the ribosome and channel is labeled with an arrow. A lumenal protrusion is formed by the TRAP (translocon-associated protein) complex. (b) A tetrameric
assembly of SecY complexes, as seen in the EM structure of two-dimensional crystals of the E. coli SecY complex (Breyton et al. 2002). The position of the pores within each SecY molecule is indicated by a blue
dot. The expected position of a low-density central region is labeled LD. A mask generated to encompass the whole volume of the tetramer is shown as a blue mesh. (c) A lumenal view of the Sec61 channel bound
to the ribosome. The blue mask enveloping the tetrameric SecY assembly shown in (b) is docked into the density. The ribosomal exit tunnel is marked by a white dot and labeled ET. Connections between the
ribosome and the channel are marked by red dots. The prominent line of connections is indicated by a red line. The pores of the two copies of Sec61 that are separated from the ribosome exit site by the line of
connections are labeled with yellow dots. One of the other two pores (in blue) may translocate a polypeptide chain. The Sec61 complex with only weak or no connections to the ribosome is additionally labeled with a white asterisk. The region of density not occupied by the blue meshwork is assigned to TRAP.
Figure 7
EM structure of ribosome-Sec61 channel complexes and possible oligomeric arrangement of Sec61 complexes (Menetret et al. 2005). (a) Ribosome-channel complexes derived from native ER membranes
were analyzed by single-particle EM. A cross section through the ribosome-channel complex, viewed from the side, is shown. The ribosomal exit tunnel, from which a growing polypeptide chain would
emerge, is marked by white dots. The gap between the ribosome and channel is labeled with an arrow. A lumenal protrusion is formed by the TRAP (translocon-associated protein) complex. (b) A tetrameric
assembly of SecY complexes, as seen in the EM structure of two-dimensional crystals of the E. coli SecY complex (Breyton et al. 2002). The position of the pores within each SecY molecule is indicated by a blue
dot. The expected position of a low-density central region is labeled LD. A mask generated to encompass the whole volume of the tetramer is shown as a blue mesh. (c) A lumenal view of the Sec61 channel bound
to the ribosome. The blue mask enveloping the tetrameric SecY assembly shown in (b) is docked into the density. The ribosomal exit tunnel is marked by a white dot and labeled ET. Connections between the
ribosome and the channel are marked by red dots. The prominent line of connections is indicated by a red line. The pores of the two copies of Sec61 that are separated from the ribosome exit site by the line of
connections are labeled with yellow dots. One of the other two pores (in blue) may translocate a polypeptide chain. The Sec61 complex with only weak or no connections to the ribosome is additionally labeled with a white asterisk. The region of density not occupied by the blue meshwork is assigned to TRAP.
Биохимические данные подтверждают, что РНК создает основные контакты с каналом (Prinz et al. 2000). Как и ожидалось, исходя из асимметрии рибосом, 4 копии комплекса Sec61 соединяются по-разному; одна из них не имеет или имеет очень слабый контакт (Figure 7c), тогда как др. имеют множественные контакты. Две молекулы Sec61 находятся на одной стороне линии соединений, которая отделяет их от от места выхода, где синтезируемая цепь появляется из рибосомы, заставляя одну из двух копий формировать активную пору. Соединение между рибосомой и каналом открыто и тем самым создается путь для полипептида от места выхода из рибосомы в цитозоль, как это требуется, когда рибосома синтезирует цитозольные домены мембранных белков. Щель толщиной в 12-15 A между рибосомой и каналом согласуется с размером цитозольных петель в С-терминальной половине Sec61/SecY (van den Berg et al. 2004), которая содержит основные рибосом-связывающие сайты (Raden et al. 2000). Размер щели может предотвращать попытку проникновения многих больших цитозольных молекул в пору и прохождения через неё, но кольцо поры внутри канала скорее всего является основным устройством, которое поддерживает мембранный барьер.
Если канал формируется одиночной копией комплекса Sec61, то какова роль олигодимеризации? Ответ пока неизвестен, но возможно, что олигомеризация служит для создания сайтов связывания по рекрутированию др. компонентов. У эукариот, эти др. компоненты могут включать сигнальные полипептиды, которые отщепляют сигнальные последовательности от транслоцирующихся полипептидов; oligosaccharyl transferase, которая прикрепляет углеводные цепочки к ним и TRAM многократно пронизывающий мембрану белок, который может служить в качестве мембранного хаперона (chaperone). Все эти белки располагаются вблизи канала, но не обладают строгим сродством к изолированному Sec61 комплексу или рибосомам (Gorlich & Rapoport 1993). Олигомеризация может также запускаться для рекрутирования TRAP комплекса, тетрамерного мембранного белкового комплекса с неизвестной функцией. ЭМ анализ комплексов рибосома-канал, полученных из нативных ER мембран, показал, что TRAP соединяется с двумя Sec61 комплексами, которые недоступны для синтезируемой цепи (Figure 7c) (Menetret et al. 2005). Это указывает на то, что функция этих Sec61 комплексов в рекрутировании TRAP скорее, чем в транслокации синтезируемой цепи. Олигомеризация Sec61 комплексов может также регулировать связывания рибосом. Тетрамеры могут обеспечивать большее число связей, приводя к более сильному связыванию рибосомы во время транслокации, в то время как диссоциация тетрамеров может ослаблять взаимодействие и способствовать высвобождению рибосомы до окончания транслокации.
Взаимодействия рибосома-канал у eubacteria и archaea не были изучены столь детально. Неясно, настроено ли оно столь же тонко, как и у эукариот и используются ли тетрамеры комплексов SecY. Некоторые бактериальные мембранные белки нуждаются в SecA для транслокации своих внеклеточных доменов (Neumann-Haefelin et al. 2000). По причине steric взаимоотношений рибосома и SecA не могут соединяться одновременно с каналом. Это указывает на то, что в противоположность ситуации у эукариот, рибосомы у eubacteria и archaea могут диссоциировать во время транслокации.
Membrane Protein Integration
Интеграция мембранных белков более сложна, чем транслокация растворимых белков. Мы коротко суммируем наше сегодняшнее понимание (Rapoport et al. 2004). В противоположность сигнальным последовательностям, которые всегда удерживают свои N концы в цитозоле, первый TM сегмент синтезируемого мембранного белка может держать свой N конец на любой стороне мембраны в зависимости от аминокислотных последовательностей в белке. У много раз пересекающих белков первый TM сегмент часто предопределяет ориентацию последующих, которые чередуются соответ. Модель того, как ориентация первого TM сегмента может предопределять представлена на Рис. 8. пассивная ориентация нижестоящих TM сегментов подтверждается тем фактом, что многие мембранные белки, по-видимому, эволюционируют путем слияния двух половинок, которые имеют противоположную ориентацию. В этом отношении интересно отметить, что транспортер EmrE по-видимому, является димером из идентичных субъединиц с противоположными топологиями (Ma & Chang 2004), одинаково с постулируемыми эволюционными predecessors из современных мембранных белков, обладающих псевдо двух-складчатой симметрией. Имеются, однако, исключения, в которых внутренние TM сегменты обладают преимущественной ориентацией не зависимой от поведения предстоящих TM сегментов (Gafvelin & von Heijne 1994, Goder et al. 1999, Locker et al. 1992, McGovern et al. 1991, Nilsson et al. 2000, Sato et al. 1998).
Во время синтеза мембранного белка TM сегменты д. перемещаться от жидкой (aqueous) внутренности канала через его латеральный вход в липидную фазу. Боковой вход формируется с помощью относительно коротких сегментов TM8, TM7, TM2b и TM3 (van den Berg et al. 2004). Т.к. TM2b и TM3 расположены в N-терминальной половине SecY, а TM7 и TM8 располагаются в C-терминальной половине, то вход может подвергаться дыхательным движениям ("breathing"), т.e., постоянно открываться и закрываться. Это может облегчаться в открытом канале, когда заслонка движется в направлении задней части канала и не контактирует больше с TM сегментами входа.
"Дыхание" бокового входа может случайным образом открывать возможность , воздействия гидрофобной среды липидного слоя на сегменты полипептидной цепи, расположенной в жидкой части канала,
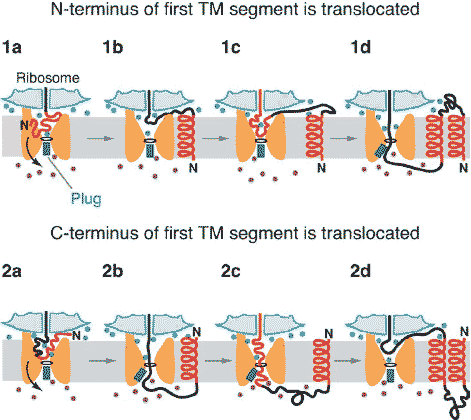 Figure 8
Model of membrane protein integration. (1a, 1b) When the first TM segment (red) of a membrane protein has fully emerged from the ribosome, the N-terminus can flip across the membrane (arrow) if the
TM segment is long and hydrophobic and the preceding polypeptide segment is not positively charged or folded (N terminus translocated; upper panel) (Wahlberg & Spiess 1997). The N terminus may be translocated through the channel after a brief displacement of the plug, and the TM segment partitions into the lipid. (1c, 1d) The following hydrophilic polypeptide segment emerges into the cytosol through the gap between the ribosome and the channel. The next TM segment (red) inserts into the channel as a
loop, destabilizing its closed state. The channel opens by movement of the plug, and the second TM segment of the polypeptide partitions into the lipid. As this occurs, the next hydrophilic segment enters
the channel and will ultimately be translocated to the other side of the membrane. (2a, 2b) In the cases of other proteins with a short first TM segment or a preceding region that is either folded or positively
charged, the N terminus may stay in the cytosol. The TM segment inserts into the channel as a loop, destabilizing its closed state. Upon chain elongation, the C-terminal end flips across the membrane
(arrow), allowing the TM segment to partition into the lipid and leaving the channel occupied by the following hydrophilic region of the polypeptide chain. (2c) The N terminus of the second TM segment
enters the open channel. (2d) When sufficient hydrophobic residues have emerged from the ribosome, they will exit laterally into the lipid, allowing the plug to return to its closed state position. The following
hydrophilic segment will emerge into the cytosol through the gap between the ribosome and the channel. During translocation and membrane integration of a polypeptide, either the plug or the nascent chain
hinders the passage of small molecules (green and purple) through the channel.
Figure 8
Model of membrane protein integration. (1a, 1b) When the first TM segment (red) of a membrane protein has fully emerged from the ribosome, the N-terminus can flip across the membrane (arrow) if the
TM segment is long and hydrophobic and the preceding polypeptide segment is not positively charged or folded (N terminus translocated; upper panel) (Wahlberg & Spiess 1997). The N terminus may be translocated through the channel after a brief displacement of the plug, and the TM segment partitions into the lipid. (1c, 1d) The following hydrophilic polypeptide segment emerges into the cytosol through the gap between the ribosome and the channel. The next TM segment (red) inserts into the channel as a
loop, destabilizing its closed state. The channel opens by movement of the plug, and the second TM segment of the polypeptide partitions into the lipid. As this occurs, the next hydrophilic segment enters
the channel and will ultimately be translocated to the other side of the membrane. (2a, 2b) In the cases of other proteins with a short first TM segment or a preceding region that is either folded or positively
charged, the N terminus may stay in the cytosol. The TM segment inserts into the channel as a loop, destabilizing its closed state. Upon chain elongation, the C-terminal end flips across the membrane
(arrow), allowing the TM segment to partition into the lipid and leaving the channel occupied by the following hydrophilic region of the polypeptide chain. (2c) The N terminus of the second TM segment
enters the open channel. (2d) When sufficient hydrophobic residues have emerged from the ribosome, they will exit laterally into the lipid, allowing the plug to return to its closed state position. The following
hydrophilic segment will emerge into the cytosol through the gap between the ribosome and the channel. During translocation and membrane integration of a polypeptide, either the plug or the nascent chain
hinders the passage of small molecules (green and purple) through the channel.
позволяя им тем самым эквилибрировать между двумя фазами. Если достаточно длинный и гидрофобный, то сегмент выходит в липидную фазу (Duong&
Wickner 1998, Heinrich et al. 2000). Т.к. TM сегменты отличаются широко по последовательностям, то они вряд ли играют активную роль в олткрытии бокового входа. Модель пассивного расчленения (partitioning) также подтверждается наблюдениями, что шкала гитдрофобности, происходящая из взаимодействий пептидов с органическим растворителем, может использоваться для предсказания тенденции TM сегмента интегрироваться в мембрану (Hessa et al. 2005).
Открытый канал наиболее вероятно слишком мал, чтобы позволить "хранение" нескольких TMs; во время синтеза многократно пронизывающих мембрану, TMs покидают канал один за одни или вообще парами. После прохождения через боковой вход, некоторые гидрофобные TMs непосредственно окружаются липидами, тогда как др. TMs, которые содержат заряды остаются вблизи канала (Heinrich et al. 2000), иногда до окончания трансляции (Do
et al. 1996). Факторы иные, чем гидрофобность TM, вообще-то свойства фланкирующей области, также могут влиять на то, как долго TM остаётся вблизи канала (McCormick et al. 2003, Meacock et al. 2002). TMs, которые остаются вблизи канала продолжительный период времени, по-видимому, ассоциируют с TRAM, белком. локализованным по фронту Sec61 канала (Mothes et al. 1998). TRAM может быть поперечно связан с сигнальными последовательностями секреторных белков и с заряженными TMs синтезируемых мембранных белков (Do et al. 1996, Gorlich et al. 1992, Heinrich et al. 2000), и он необходим для транслокации секреторных белков со слабыми гидрофобными сигнальными последовательностями (Voigt et al. 1996). Он может действовать как мембранный хаперон, чтобы стабилизировать TMs с гидрофильными остатками и облегчать ассоциацию этих TMs до тех пор, пока они не смогут высвобождены как гидрофобный ансамбль в массу липидов. Бактериальный белок YidC, который обладает сходной топологией, что и TRAM и который необходим для интеграции и укладки некоторых мембранных белков, может выполнять аналогичную функцию (Dalbey & Kuhn 2004).
Во время синтеза цитозольного домена мембранного белка, рибосомы остаются связанными с каналом (Mothes et al. 1997). Синтезируемая цепь д., следовательно, проникать в щель между рибосомой и каналом в цитозоль (Figure 8). Такой боковой путь может быть обеспечен с помощью щели в 12-15 A между двумя партнерами, как показывает ЭМ реконструкция. Напротив модель, в которой соединение рибосома-канал открывается и закрывается ( Johnson & vanWaes 1999), junction модель представленная на Рис. 8 всегда открыта, что позволяет синтезируемой цепи двигаться боковым путем в цитозоль.
SecA-MEDIATED POSTTRANSLATIONAL TRANSLOCATION IN
EUBACTERIA
Механизм, с помощью которого цитоплазматическая ATPase SecA движет полипептидную цепь через SecY канал, всё ещё мало понятен, но некоторые новые сведения предоставляются структурными исследованиями. SecA состоит из 5 доменов: двух RecA-подобных складок, обозначаемых как nucleotide binding folds 1 и 2 (NBF1 and NBF2); preprotein cross-linking domain (PPXD); helical scaffold domain (HSD) и helical wing domain (HWD) (Figure 9a and b) (Hunt et al. 2002, Osborne et al. 2004, Sharma et al. 2003). ATPase сайт в SecA сходен с таковым в сверхсемействе 1 и 2 helicases, с нуклеотидным мостиком между NBF1 и NBF2. Зависимые от нуклеотидов перемещения доменов в SecA м., следовательно, быть сходными с теми, что наблюдаются в helicase PcrA (Velankar et al. 1999). В противоположность более ранним предположениям, имеется только один нуклеотид-связывающий сайт в SecA, с обоими NBF доменами, предоставляющий критические остатки для АТФ гидролиза (Mitchell & Oliver 1993, Or et al. 2002, Papanikou et al. 2004, Schmidt et al. 2001, Sianidis et al. 2001). Законсервированные остатки аргинина в NBF2, по-видимому, распознают присутствие или отсутствие γ-фосфата и запускают соотв. перемещения доменов (Or et al. 2002). Эти изменения могут передаваться в
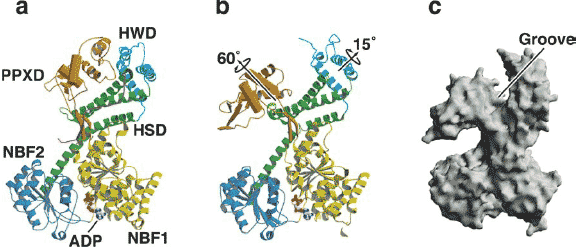 Figure 9
The structure of SecA. (a) Dimeric Bacillus subtilis SecA in a closed conformation (Hunt et al. 2002). A single subunit is shown. Nucleotide-binding fold 1 (NBF1) is shown in yellow, nucleotide-binding fold 2 (NBF2) in blue, the preprotein cross-linking domain (PPXD) in orange, the helical scaffold domain (HSD) in green, and the helical wing domain (HWD) in cyan. ADP is shown in a ball and stick
representation. (b) Monomeric B. subtilis SecA in an open conformation (Osborne et al. 2004), colored as in (a). The arrows indicate movements required to convert the open conformation to the closed conformation. (c) A surface representation of SecA in the open conformation. The groove is proposed to close around the translocating polypeptide.
Figure 9
The structure of SecA. (a) Dimeric Bacillus subtilis SecA in a closed conformation (Hunt et al. 2002). A single subunit is shown. Nucleotide-binding fold 1 (NBF1) is shown in yellow, nucleotide-binding fold 2 (NBF2) in blue, the preprotein cross-linking domain (PPXD) in orange, the helical scaffold domain (HSD) in green, and the helical wing domain (HWD) in cyan. ADP is shown in a ball and stick
representation. (b) Monomeric B. subtilis SecA in an open conformation (Osborne et al. 2004), colored as in (a). The arrows indicate movements required to convert the open conformation to the closed conformation. (c) A surface representation of SecA in the open conformation. The groove is proposed to close around the translocating polypeptide.
и амплифицироваться с помощью др. доменов, которые связывают полипептидный субстрат и проталкивают его в SecY канал.
SecA находится в равновесии между мономерным и димерным состоянием (Benach et al. 2003, Ding et al. 2003, Or et al. 2002, Woodbury et al. 2002). Когда он изолирован, то в основном димер. Рентгеновская структура по Hunt et al. (2002) м. соотв. физиологическому димеру, хотя постулированы и др. димерные формы (Sharma et al. 2003). Диссоциация на мономеры стимулируется взаимодействием с лигандами, такими как липиды (Benach et al. 2003, Bu et al. 2003, Or et al. 2002) или синтетические сигнальные пептиды (хотя последние дискуссионны), тем самым подтверждается, что мономер является активным видом в транслокации. Это подтверждается наблюдением, что поперечно связанные продукты, соответствующие SecA димерам, теряются после взаимодействия с SecY комплексом (Or et al. 2002). Мономерный мутант SecA сохраняет некоторую активность, по крайней мере, в некоторых условиях (Or et al. 2004), хотя тот же самый мутант обнаруживается неактивным в др. исследованиях (Jilaveanu et al. 2005, Randall et al. 2005). После солюбилизации одиночная копия SecA обнаруживается в комплексе, содержащем арестованный субстрат для транслокации и SecY (Duong 2003). Однако, точная природа комплекса во врмя транслокации белка неясна, т.к. было установлено, что две SecAs могут ассоциировать с двумя или 4 SecY комплексами (Duong 2003, Manting et al. 2000, Tziatzios et al. 2004). SecA-индуцированные тетрамеры SecY комплексов, наблюдаемые с помощью ЭМ, могут располагаться сходным образом как и ассоциированные с рибосомами Sec61/SecY комплексы (Veenendaal et al. 2004).
По сравнению со структурой у Bacillus subtilis SecA димера, мономерная SecA находится в открытой конформации, в которой PPXD, HSD и HWD подвергаются драматическим перемещениям, тогда как NBF домены остаются в той же самой позиции (Figure 9a and b). В открытой конформации HSD/HWD и PPXD образуют большую борозду (Figure 9c) (Osborne et al. 2004), которая скорее всего является местом связывания полипептида, как это показано при поперечном связывании и исследованиях по мутагенезу (Kimura et al. 1991, Kourtz & Oliver 2000). Борозда сходна по своим dimensions с той, что обнаруживается у др. белков - таких как OppA, DnaK и SecB - которые взаимодействуют с широким кругом пептидных субстратов (Sleigh et al.
1999, Xu et al. 2000, Zhu et al. 1996). В каждом из этих белков появляется глубокая борозда связывания, чтобы обернуться вокруг пептида, позволяя тем самым осуществлять связывание с субстратами, которые отличаются своими последовательностями. Связывает ли SecA сигнальные последовательности более специфическим способом, неясно, но потенциальным сайтом связывания является гидрофобная борозда, расположенная между обращенными др. к др. сторонами NBF1, HSD и PPXD (Hunt et al. 2002).
Вполне возможно, что, как было предположено, SecA проталкивает полипептидный субстрат через SecY канал (Economou & Wickner 1994), но неясно в точности, как это происходит. Механизм проталкивания предполагает, что имеются два полипептид-связывающих сайта, которые чередуются в отношении своего сродства к полипептидному субстрату и которые могут двигаться относительно др. др. Одна из возможностей, что оба сайта локализованы в SecA, подобно helicases. Однако, как только одна пептид-связывающая борозда становится очевидной в структуре SecA, то кажется наиболее вероятным, что SecY представляет собой второй сайт связывания.
Было предположено, что SecA внедряется глубоко в SecY канал, достигает др. стороны мембраны (Economou & Wickner 1994, Eichler&Wickner 1997, Kim et al. 1994, Ramamurthy & Oliver 1997, van der Does et al. 1996). Этот механизм вытекает из факта, что SecA доступна для proteases и метящих реагентов, добавляемых извне клеток. Однако, структурные данные показывают, что SecA слишком велика, чтобы проникать в канал. Т.о., предыдущие данные могут быть лучше объяснены, если предположить, что SecA принимает резистентную к protease конформацию связывания SecY (van der Does et al. 1998) и становится доступной для метящих реагентов посредством открытого SecY канала. Сайты модификации и в самом деле распределены по всей SecA молекуле (Hunt et al. 2002).
Учитывая недавние структурные данные, кажется вполне вероятным, что SecA проталкивает полипептид в SecY канал без того, чтобы самой проникать гбулоко в канал (Figure 3). Согласно этой модели SecA соединяется с полипептидным сегментом, толкает его в канал и затем освобождается от него. Обратное соскальзывание полипептидного субстарат редуцируется за счет взаимодействий с SecY каналом. Затем SecA освобождается от субстрата и подвергается конформационным изменениям, перемещая пептид-связывающий сайт прочь от канала, чтобы связать след. полипептидный сегмент. Этот цикл повторяется до тех пор, пока весь полипептид не будет транслоцирован. Хотя современные данные подтверждают, что SecA-обеспечиваемая транслокация является processive [т.e., одиночная SecA транслоцирует каждый полипептидный субстрат целиком ( Joly & Wickner 1993, Schiebel et al. 1991)], случайные сбои SecA или даже nonprocessive способ транслокации, не могут быть полностью исключены. Кроме того, хотя ранние эксперименты подтвердили, что во время каждого цикла SecA проталкивает 20-30 остатков через канал (Schiebel et al. 1991, Uchida et al. 1995, van derWolk et al. 1997), этот размер шага, по-видимому, очень большой (он соответствует ~100 A развернутого полипептида). Необходимы дальнейшие исследования.
PERSPECTIVES
Structural studies of ribosome/Sec61 complexes,
of SecA, and particularly of the SecY channel have significantly advanced our understanding of the mechanism of protein
translocation. Interpretation of these structures
has been made possible by equally important
genetic and biochemical data accumulated
in many laboratories over the years. The recent data have led to new hypotheses that need to be tested experimentally. In addition,
these data highlight a number of unresolved
issues. For example, how exactly does SecA move polypeptides through the SecY channel? What is the role of the oligomerization
of the Sec61/SecY channel? How do interacting partners of the Sec61/SecY channel regulate its function? How are membrane
proteins integrated and folded? Progress will depend on a combination of different approaches, with the structure of an active
channel being a major goal for the future.
SUMMARY POINTS
1. The protein-conducting channel, formed by the Sec61/SecY complex, is required for both the translocation of polypeptides across cellular membranes and for the integration of these polypeptides into lipid bilayers.
2. The X-ray structure of the SecY complex provides new insight into how the proteinconducting channel functions.
3. Polypeptide translocation may occur posttranslationally or cotranslationally.
4. Each different mode of translocation requires different channel partners.
Сайт создан в системе
uCoz  Figure 1
Cotranslational translocation of a secretory protein. The scheme shows different steps in the translocation of a eukaryotic secretory protein. (1 and 2) The signal recognition particle (SRP) binds to the signal sequence in a growing polypeptide chain as well as to the ribosome (large subunit, light blue; small subunit, pink). (3) The entire complex is targeted to the membrane by an interaction of the SRP with the SRP receptor. (4 and 5) The SRP is released, and the ribosome binds to the protein-conducting
channel formed by the Sec61 complex. The polypeptide inserts into the channel as a loop, with the N and C termini in the cytosol. The signal sequence is intercalated into the wall of the channel, and the
following polypeptide segment is located in the pore proper. (6) The remainder of the polypeptide chain moves from the ribosome tunnel, through the channel, and to the other side of the membrane. The signal sequence is cleaved at some point during translocation.
Figure 1
Cotranslational translocation of a secretory protein. The scheme shows different steps in the translocation of a eukaryotic secretory protein. (1 and 2) The signal recognition particle (SRP) binds to the signal sequence in a growing polypeptide chain as well as to the ribosome (large subunit, light blue; small subunit, pink). (3) The entire complex is targeted to the membrane by an interaction of the SRP with the SRP receptor. (4 and 5) The SRP is released, and the ribosome binds to the protein-conducting
channel formed by the Sec61 complex. The polypeptide inserts into the channel as a loop, with the N and C termini in the cytosol. The signal sequence is intercalated into the wall of the channel, and the
following polypeptide segment is located in the pore proper. (6) The remainder of the polypeptide chain moves from the ribosome tunnel, through the channel, and to the other side of the membrane. The signal sequence is cleaved at some point during translocation.  Figure 2
Posttranslational translocation in eukaryotes. (1) After it is synthesized in the cytosol, an unfolded polypeptide is kept in solution by cytosolic chaperones. (2) It is targeted by its signal sequence to the
translocation channel, comprised of the Sec61 complex and the Sec62/63 complex, and the cytosolic chaperones are released. The J domain of Sec63 stimulates ATP hydrolysis by BiP, and ADP bound BiP binds to the polypeptide chain emerging into the ER lumen. (3) When the polypeptide has moved a sufficient distance into the ER lumen, another BiP molecule can bind to it. (4) This process is repeated until the polypeptide chain has completely traversed the channel. (5) BiP is released upon exchange of
ADP for ATP; this exchange opens the peptide-binding pocket.
Figure 2
Posttranslational translocation in eukaryotes. (1) After it is synthesized in the cytosol, an unfolded polypeptide is kept in solution by cytosolic chaperones. (2) It is targeted by its signal sequence to the
translocation channel, comprised of the Sec61 complex and the Sec62/63 complex, and the cytosolic chaperones are released. The J domain of Sec63 stimulates ATP hydrolysis by BiP, and ADP bound BiP binds to the polypeptide chain emerging into the ER lumen. (3) When the polypeptide has moved a sufficient distance into the ER lumen, another BiP molecule can bind to it. (4) This process is repeated until the polypeptide chain has completely traversed the channel. (5) BiP is released upon exchange of
ADP for ATP; this exchange opens the peptide-binding pocket.  Figure 3
SecA-mediated posttranslational translocation in eubacteria. The scheme shows a model for the different steps in translocation. (1) SecA binds to a polypeptide substrate bearing an N-terminal signal sequence.
(2) The complex binds to SecY, and the polypeptide substrate inserts as a loop into the channel. (3) The SecA polypeptide-binding groove opens and moves away from the channel, leaving a polypeptide segment in the channel. (4) The binding groove grabs the next section of the polypeptide chain and then closes. (5) The polypeptide-binding domains move toward the channel, pushing the polypeptide segment into the channel. Steps (3)-(5) are repeated until the polypeptide chain is fully translocated (not shown).
Figure 3
SecA-mediated posttranslational translocation in eubacteria. The scheme shows a model for the different steps in translocation. (1) SecA binds to a polypeptide substrate bearing an N-terminal signal sequence.
(2) The complex binds to SecY, and the polypeptide substrate inserts as a loop into the channel. (3) The SecA polypeptide-binding groove opens and moves away from the channel, leaving a polypeptide segment in the channel. (4) The binding groove grabs the next section of the polypeptide chain and then closes. (5) The polypeptide-binding domains move toward the channel, pushing the polypeptide segment into the channel. Steps (3)-(5) are repeated until the polypeptide chain is fully translocated (not shown).  Figure 4
(a) The structure of the M. jannaschii SecY complex viewed from the cytoplasm. The N-terminal domain of SecY (TM1-5) is shown in dark blue, with the exception of TM2b (bright blue). The C-terminal
domain (TM6-10) is shown in red, with the exception of TM7 (yellow). The signal sequence intercalates at the front, between TM2b and TM7. The plug (TM2a), which blocks the pore of the closed channel, is
shown in green. The proposed hinge region between TM segments 5 and 6 is labeled. (b) A cytoplasmic view of the M. janaschii SecY complex with individual helices colored and labeled.
Figure 4
(a) The structure of the M. jannaschii SecY complex viewed from the cytoplasm. The N-terminal domain of SecY (TM1-5) is shown in dark blue, with the exception of TM2b (bright blue). The C-terminal
domain (TM6-10) is shown in red, with the exception of TM7 (yellow). The signal sequence intercalates at the front, between TM2b and TM7. The plug (TM2a), which blocks the pore of the closed channel, is
shown in green. The proposed hinge region between TM segments 5 and 6 is labeled. (b) A cytoplasmic view of the M. janaschii SecY complex with individual helices colored and labeled.  Figure 5
Plug movement leads to opening of the SecY channel. (a) View from the side of the channel with the front half of the model cut away. The modeled movement of the plug toward the SecE subunit is indicated by an arrow. The side chains of residues in the pore ring are colored in gold. (b) Cytosolic
view, with the plug modeled in its open position. TM2b and TM7 located at the front of the complex are shown in blue and yellow, respectively. The asterisk indicates the region where introduced cysteines result in cross-links between the plug and the TM segment of SecE (Harris & Silhavy 1999).
Figure 5
Plug movement leads to opening of the SecY channel. (a) View from the side of the channel with the front half of the model cut away. The modeled movement of the plug toward the SecE subunit is indicated by an arrow. The side chains of residues in the pore ring are colored in gold. (b) Cytosolic
view, with the plug modeled in its open position. TM2b and TM7 located at the front of the complex are shown in blue and yellow, respectively. The asterisk indicates the region where introduced cysteines result in cross-links between the plug and the TM segment of SecE (Harris & Silhavy 1999).  Figure 6
Back-to-back arrangement of E.coli SecY complexes in the dimer as seen
in the EM structure derived from two-dimensional crystals (Breyton et al.
2002). TM2b and TM7 at the front of the complexes are colored in blue
and yellow, respectively. The plug is shown in dark green. Cysteines
introduced at the positions indicated by the red spheres result in efficient disulfide formation (X) between two SecE subunits (Kaufmann et al. 1999).
Figure 6
Back-to-back arrangement of E.coli SecY complexes in the dimer as seen
in the EM structure derived from two-dimensional crystals (Breyton et al.
2002). TM2b and TM7 at the front of the complexes are colored in blue
and yellow, respectively. The plug is shown in dark green. Cysteines
introduced at the positions indicated by the red spheres result in efficient disulfide formation (X) between two SecE subunits (Kaufmann et al. 1999).  Figure 7
EM structure of ribosome-Sec61 channel complexes and possible oligomeric arrangement of Sec61 complexes (Menetret et al. 2005). (a) Ribosome-channel complexes derived from native ER membranes
were analyzed by single-particle EM. A cross section through the ribosome-channel complex, viewed from the side, is shown. The ribosomal exit tunnel, from which a growing polypeptide chain would
emerge, is marked by white dots. The gap between the ribosome and channel is labeled with an arrow. A lumenal protrusion is formed by the TRAP (translocon-associated protein) complex. (b) A tetrameric
assembly of SecY complexes, as seen in the EM structure of two-dimensional crystals of the E. coli SecY complex (Breyton et al. 2002). The position of the pores within each SecY molecule is indicated by a blue
dot. The expected position of a low-density central region is labeled LD. A mask generated to encompass the whole volume of the tetramer is shown as a blue mesh. (c) A lumenal view of the Sec61 channel bound
to the ribosome. The blue mask enveloping the tetrameric SecY assembly shown in (b) is docked into the density. The ribosomal exit tunnel is marked by a white dot and labeled ET. Connections between the
ribosome and the channel are marked by red dots. The prominent line of connections is indicated by a red line. The pores of the two copies of Sec61 that are separated from the ribosome exit site by the line of
connections are labeled with yellow dots. One of the other two pores (in blue) may translocate a polypeptide chain. The Sec61 complex with only weak or no connections to the ribosome is additionally labeled with a white asterisk. The region of density not occupied by the blue meshwork is assigned to TRAP.
Figure 7
EM structure of ribosome-Sec61 channel complexes and possible oligomeric arrangement of Sec61 complexes (Menetret et al. 2005). (a) Ribosome-channel complexes derived from native ER membranes
were analyzed by single-particle EM. A cross section through the ribosome-channel complex, viewed from the side, is shown. The ribosomal exit tunnel, from which a growing polypeptide chain would
emerge, is marked by white dots. The gap between the ribosome and channel is labeled with an arrow. A lumenal protrusion is formed by the TRAP (translocon-associated protein) complex. (b) A tetrameric
assembly of SecY complexes, as seen in the EM structure of two-dimensional crystals of the E. coli SecY complex (Breyton et al. 2002). The position of the pores within each SecY molecule is indicated by a blue
dot. The expected position of a low-density central region is labeled LD. A mask generated to encompass the whole volume of the tetramer is shown as a blue mesh. (c) A lumenal view of the Sec61 channel bound
to the ribosome. The blue mask enveloping the tetrameric SecY assembly shown in (b) is docked into the density. The ribosomal exit tunnel is marked by a white dot and labeled ET. Connections between the
ribosome and the channel are marked by red dots. The prominent line of connections is indicated by a red line. The pores of the two copies of Sec61 that are separated from the ribosome exit site by the line of
connections are labeled with yellow dots. One of the other two pores (in blue) may translocate a polypeptide chain. The Sec61 complex with only weak or no connections to the ribosome is additionally labeled with a white asterisk. The region of density not occupied by the blue meshwork is assigned to TRAP.  Figure 8
Model of membrane protein integration. (1a, 1b) When the first TM segment (red) of a membrane protein has fully emerged from the ribosome, the N-terminus can flip across the membrane (arrow) if the
TM segment is long and hydrophobic and the preceding polypeptide segment is not positively charged or folded (N terminus translocated; upper panel) (Wahlberg & Spiess 1997). The N terminus may be translocated through the channel after a brief displacement of the plug, and the TM segment partitions into the lipid. (1c, 1d) The following hydrophilic polypeptide segment emerges into the cytosol through the gap between the ribosome and the channel. The next TM segment (red) inserts into the channel as a
loop, destabilizing its closed state. The channel opens by movement of the plug, and the second TM segment of the polypeptide partitions into the lipid. As this occurs, the next hydrophilic segment enters
the channel and will ultimately be translocated to the other side of the membrane. (2a, 2b) In the cases of other proteins with a short first TM segment or a preceding region that is either folded or positively
charged, the N terminus may stay in the cytosol. The TM segment inserts into the channel as a loop, destabilizing its closed state. Upon chain elongation, the C-terminal end flips across the membrane
(arrow), allowing the TM segment to partition into the lipid and leaving the channel occupied by the following hydrophilic region of the polypeptide chain. (2c) The N terminus of the second TM segment
enters the open channel. (2d) When sufficient hydrophobic residues have emerged from the ribosome, they will exit laterally into the lipid, allowing the plug to return to its closed state position. The following
hydrophilic segment will emerge into the cytosol through the gap between the ribosome and the channel. During translocation and membrane integration of a polypeptide, either the plug or the nascent chain
hinders the passage of small molecules (green and purple) through the channel.
Figure 8
Model of membrane protein integration. (1a, 1b) When the first TM segment (red) of a membrane protein has fully emerged from the ribosome, the N-terminus can flip across the membrane (arrow) if the
TM segment is long and hydrophobic and the preceding polypeptide segment is not positively charged or folded (N terminus translocated; upper panel) (Wahlberg & Spiess 1997). The N terminus may be translocated through the channel after a brief displacement of the plug, and the TM segment partitions into the lipid. (1c, 1d) The following hydrophilic polypeptide segment emerges into the cytosol through the gap between the ribosome and the channel. The next TM segment (red) inserts into the channel as a
loop, destabilizing its closed state. The channel opens by movement of the plug, and the second TM segment of the polypeptide partitions into the lipid. As this occurs, the next hydrophilic segment enters
the channel and will ultimately be translocated to the other side of the membrane. (2a, 2b) In the cases of other proteins with a short first TM segment or a preceding region that is either folded or positively
charged, the N terminus may stay in the cytosol. The TM segment inserts into the channel as a loop, destabilizing its closed state. Upon chain elongation, the C-terminal end flips across the membrane
(arrow), allowing the TM segment to partition into the lipid and leaving the channel occupied by the following hydrophilic region of the polypeptide chain. (2c) The N terminus of the second TM segment
enters the open channel. (2d) When sufficient hydrophobic residues have emerged from the ribosome, they will exit laterally into the lipid, allowing the plug to return to its closed state position. The following
hydrophilic segment will emerge into the cytosol through the gap between the ribosome and the channel. During translocation and membrane integration of a polypeptide, either the plug or the nascent chain
hinders the passage of small molecules (green and purple) through the channel. 