Финальный сигнальный путь, который д.б. рассмотрен, как возможно играющий роль в просенсорном образовании, это путь fibroblast growth factor. Fgfs представляют собой семейство из 22 лигандов, но только 4 рецепторов (rev. Itoh and Ornitz, 2004). Т.к. сигнальный путь Fgf играет ключевую роль в ряде различных систем во время раннего эмбриогенеза, включая раннюю индукцию отоциста, ушей или целых эмбрионов, у многих Fgf мутантных мышей он нарушен ещё до образования улитки (rev. Wright and Mansour, 2003). Однако, роль Fgfr1 в развитии внутреннего уха была изучена у Fgfr1 гипоморфов и при условных делециях Fgfr1 с использованием FoxG1-Cre (Pirvola et al., 2002). В каждом случае наблюдалось дозово-зависимое снижение размера органа Корти и экспрессии Atoh1. Напротив вестибулярная система была нормальной. Эти результаты указывают на роль Fgfr1 в развитии улитки, но из-за отсутствия соотв. маркеров во время этого исследования затруднило определение специфической роли Fgfr1. Однако, необходимо отметить, что p75
, который первоначально экспрессируется в субнаборе клеток внутри просенсорного домена улитки всё ещё экспрессируется у Fgfr1
мутантов, указывая на то, что Fgfr1 может действовать иерархически ниже образования просенсорных доменов. Недавно Millimaki et al. (2007) продемонстрировали, что Fgf3 и Fgf8 необходимы для экспрессии
в отоцистах рыбок данио, подтверждая роль пути Fgf в детерминации волосковых клеток.
После спецификации просенсорного домена следующей важной ступенью является регуляция количества клеток внутри этого домена. Во многих развивающихся системах нейронов, таких как спинной мозг, количество предшественников, которые обычно возникают превосходит финальное число зрелых нейронов и глиальных клеток. Как результат, ненужные предшественники элиминируются посредством апоптической гибели клеток (rev. Martin, 2001). Однако, уровень апоптической гибели клеток, наблюдаемый внутри просенсорного домена улитки удивительно мал (Chen et al., 2002), демонстрируя, что элиминации ненужных предшественников не происходит. Следовательно, инициальное количество клеток внутри просенсорного пула играет ключевую роль в его развитии. Как обсуждалось выше положение границ просенсорного домена детерминируется рядом всё ещё плохо изученных молекулярных путей передачи сигналов. Кроме того, т.к. формирование просенсорного домена происходит до завнршения терминальных митозов, то начало экспрессии регуляторов клеточного цикла используется как вторичный регуляторный механизм. В частности, cyclin kinase ингибитор p27kip1 первоначально экспрессируется в канале улитки начиная со ст. E12.5 в виде паттерна, который предзнаменует апикально-базальный градиент терминальных митозов (Chen and Segil, 1999; Lee et al., 2006). Первоначально, p27kip1 экспрессируется во всех просенсорных клетках, но в более поздний эмбриональный период экспрессия ограничивается развивающимися поддерживающими клетками. В соответствии с ролью в выходе из клеточного цикла, делеция p27kip1 ведет к временному увеличению клеточной пролиферации и генерации добавочных волосковых и поддерживающих клеток (Chen and Segil, 1999; Lowenheim et al.,1999). Присутствие лишних клеток внутри улитки у мутантов p27kip1 подтверждает гипотезу, что апоптическая гибель клеток не играет существенной роли в формировании паттерна клеток внутри кортиева органа.
Второй ингибитор клеточного цикла, pocket белок pRb, также регулирует терминальные митозы в канале улитки. Однако, экспрессия pRb , по-видимому, задержана относительно p27kip1, с началом действия около E15.5 (Mantela et al., 2005). Более того, экспрессия pRb происходит в виде базально-апикального градиента, который направлен против апикально-базального градиента экспрессии p27kip1 и терминальных митозов (Mantela et al., 2005). Наконец, клеточное распределение pRb не установлено. И Mantela et al. (2005)и Sage et al. (2005) описывают слабую экспрессию pRb белка в большей части клеток внутри улитки на ст. E12.5, в более поздние моменты времени Sage et al. описывают экспрессию pRb как в волосковых, так и поддерживающих клетках, тогда как Mantela et al. наблюдали экспрессию pRb только в волосковых клетоках. Однако, важность pRb была продемонстрирована в исследованиях, которые использовали или cre-lox ( pRbflox/flox ;Col1A1Cre/+) или гипоморфную
(mgRb:Rb-/- )стратегии восстановления, чтобы генерировать pRb мутантных мышей, которые доживали до рождения (Sage et al., 2005; Mantela et al., 2005). Интересно, что оба исследования описывают дефекты пролиферации, которые согласуются с их наблюдаемыми паттернами экспрессии. Sage et al. описывают начало пролиферации как волосковых, так и поддерживающих клеток внутри улитки, тогда как Mantela et al. наблюдали пролиферацию только волосковых клеток. Однако, в обоих исследованиях наблюдалась большая избыточная продукция как волосковых, так и поддерживающих клеток. Повышенные количества поддерживающих клеток подтверждают заключение Sage et al. (2005), однако, также возможно, что дополнительные поддерживающие клетки возникают как результат рекрутирования из окружающих избыточных волосковых клеток. Необходимы дополнительные исследования для разрешения этих противоречивых выводов. Помимо избыточной продукции волосковых клеток antela et al. (2005) описали также заметное увеличение апоптической гибели волосковых клеток у mgRb:Rb-/- мышей между E17.5 и E18.5. Основы этой клеточной гибели неясны. Инактивация pRb, как было установлено, непосредственно индуцирует апоптоз посредством E2f1/p53/Apaf1 пути (Morgenbesser et al., 1994; MacLeod et al., 1996; Tsai et al., 1998), но делеция или E2f1 или Apaf1 на фоне mgRb:Rb-/- не устраняла апоптоза, указывая тем самым, что др. аспекты делеции pRb ответственны за индукцию клеточной гибели. Sage et al. (2005) отмечают отсутствие увеличения апоптической гибели клеток в улитке в своем инициальном исследовании, но наблюдали апоптоз в последующем исследовании с использованием альтернативного Cre-driver (Sage et al., 2006).
Наконец, уникальные апикально-базальные паттерны экспрессии p27
kip1 и терминальных митозов подчеркивают один из наиболее интригующих аспектов развития улитки. Начало клеточной дифференцировки в улитке также происходит в виде градиента, распространяющегося вдоль улитки, но в данном случае это базально-апикальный градиент, который возникает примерно на ст. E14.5 и не завершается вплоть до E16.5. Как результат просенсорные клетки, расположенные в верхушке улитки становятся постмитотическими на ст. E12.5, но не начинают дифференцироваться в течение последующих 4-х дней. В наиболее разработанных системах существуют очень тесные взаимоотношения между выходом из клеточного цикла и началом дифференцировки (rev. Gotz and Huttner, 2005; Nguyen et al., 2006). Фактически, гены bHLH как было показано, конкурентно противодействуют клеточной пролиферации и индуцируют детерминацию и дифференцировку клеток (Farah et al., 2000; Le et al., 2006; Battiste et al., 2007). Следовательно, присутствие недетерминированных постмитотических просенсорных клеток представляет собой сохранение довольно редкого клеточного состояния. Факторы, которые обеспечивают этот статус, и что более важно, биологическую основу их существования, еще предстоит определить.
Specification of individual phenotypes within the co-
chlear prosensory domain
Atoh1 is a commitment factor for the hair cell fate
Вследствие спецификации просенсорного домена, индивидуальные просенсорные клетки д. детерминироваться к развитию всех уникальных клеточных типов внутри органа Корти. Первой ступенью в этом процессе является начало экспрессии basic helix-loop-helix транскрипционного фактора, Atoh1 (первоначально Math1), который первоначально экспрессируется в относительно широкой и диффузной полосе клеток, начиная с основания улитки приблизительно на ст. E12.5 и быстро распространяется в направлении верхушки (Lanford et al., 2000; Woods et al., 2004). Внутри этой полосы Atoh1 слабо экспрессируется в клетках, локализованных по всей толщине эпителия между базальной мембраной и поверхностью, обращенной в просвет. По ходу развития индивидуальные клетки, с повышенными уровнями экспрессии Atoh1, могут быть идентифицированы внутри первоначально диффузной полосы (Woods et al., 2004). На ст. E16, клетки, которые строго экспрессируют Atoh1, могут быть идентифицированы как развивающиеся волосковые клетки, тогда как находящиеся между ними Atoh1-негативные клетки развиваются в поддерживающие. Базируясь на этом паттерне экспрессии, Atoh1 является самым ранним экспрессирующимся геном, который в конечном итоге ограничивается волосковыми клетками. Необходимо отметить, что существуют некоторые противоречия относительно времени и паттерна экспрессии Atoh1. Паттерн, описанный выше, базируется на исследованиях, использовавших Atoh1 knock-in репортерных мышей или гибридизацию in situ. Однако, трансгенные Atoh1 репортерные мыши и иммуногистохимия указывают на то, что экспрессия Atoh1 не начинается вплоть до ст. E14 и ограничена развивающимися волосковыми клетками (Chen et al., 2002; Fritzsch et al., 2005). Наконец, PCR амплификация была использована, чтобы продемонстрировать, что транскрипты для Atoh1 присутствуют в отоцисте на ст. E11.5 (Matei et al., 2005). Однако, т.к. вестибулярный сенсорный эпителий также присутствует в этих выборках, то невозможно сделать вывод относительно экспрессии Atoh1 в улитке в этот момент времени. Причина наблюдаемых различий времени и паттерна экспрессии Atoh1 не вполне ясна. Задержка между промоторной активностью и мРНК в противовес белку может быть результатом задержки трансляции или ограниченной чувствительности к антителам. Если антитела обладают ограниченным уровнем чувствительности, то он может быть обнаружен только в клетках с высокми уровнем экспрессии Atoh1. Для трансгенного Atoh1 репортера задержка, по-видимому, возникает в результате того, что трансгенная конструкция не включает всех элементов промотора Atoh1 в частности отсутствуют регеионы промотора, которые регулируют инициальную экспрессию Atoh1 (Lumpkin et al., 2003). Однако, возможно также, что результаты анализа промоторной активности и мРНК могут включать или неспецифическую экспрессию β-galactosidase в случае репортерной линии мышей или трудностей в дискриминации между низкими уровнями мРНК Atoh1 и фоновыми уровнями щелочной фосфатазной активности в случае гибридизации in situ. Ясно, что необходимо отслеживание клонов с использованием Atoh1-Cre knock-in мышей для решения вопроса об инициальной экспрессии Atoh1. Сходные эксперименты проведены с использованием Atoh1-Cre трансгенных линий (Matei et al., 2005), но т.к. эта конструкция также не содержала полного набора промоторных элементов Atoh1, то результаты имели те же самые ограничения. Даже если так, то результаты этих клональных экспериментов демонстрируют экспрессию Atoh1 в некоторых типах поддерживающих клеток, что согласуется идеей, что инициальный паттерн экспрессии Atoh1 не ограничен волосковыми клетками. Контрастирующие данные относительно паттерна и времени экспрессии Atoh1привели к множественным гипотезам относительно специфической роли Atoh1. Было предположено, что Atoh1 действует как просенсорный ген, который специфицирует популяцию просенсорных клеток. Напротив, более ограниченный паттерн экспрессии, наблюдаемый с помощью меченных антител ведет к гипотезе, что Atoh1 действует исключительно как фактор дифференцировки волосковых клеток (Chen et al., 2003). Фенотип мышей с целенаправленной делецией Atoh1, которая вызывает полное отсутствие волосковых и поддерживающих клеток внутри улитки (хотя некоторые поддерживающие клетки или клетки, подобные поддерживающим, присутствуют в вестибулярном эпителии) более согласуется с просенсорной ролью, но этот фенотип может быть также объяснен ролью волосковых клеток в формировании поддерживающих клеток (Woods et al., 2004). Напротив, паттерны экспрессии Sox2 и p27kip1, оба из которых экспрессируются по всему просенсорному домену, не затронуты у Atoh1 мутантов, указывая тем самым, что Atoh1 не играет роли в просенсорном формировании.
Чтобы понять роль Atoh1 в некоторых лаб. форсировали клетки внутри Kolliker's органа, чтобы экспрессировать Atoh1. Zheng et al. (2000) продемонстрировали, что непрерывная экспрессия Atoh1 ведет к формированию эктопических волосковых клеток в Kolliker's органе культур эксплантов улитки от новорожденных крыс. Woods et al. (2004) временно экспрессировали Atoh1 в культурах клеток внутри Kolliker's органа, чтобы протестировать гипотезу, что временная активация достаточна, чтобы индуцировать просенсорные характеристики. Хотя временная активация Atoh1 оказалась достаточной для индукции кластеров клеток, которые включали и волосковые клетки, последующие эксперименты продемонстрировали, что присутствие волосковых клеток достаточно, чтобы индуцировать соседние клетки внутри Kolliker's органа, которые развивались как поддерживающие клетки. Экспрессия Atoh1 не нужна в этих соседних клетках, это указывает на то, что хотя Atoh1 может экспрессироваться в клетках, которые в конечном итоге станут поддерживающими клетками, эта экспрессия не нужна этим клеткам, чтобы приобрести судьбу поддерживающих клеток. Woods et al. (2004) полагают, что Atoh1 действует как фактор спецификации волосковых клеток после экспрессии во внутреннем ухе, запуская молекулярную программу, которая если не ослабевает, то д. в конечном итоге заставить просенсорные клетки развиваться по пути волосковых.
Демонстрация, что клетки внутри Kolliker's органа могут быть индуцированы к развитию или как волосковые клетки, благодаря экспрессии Atoh1 или как поддерживающие клетки, благодаря непосредственной близости к волосковым клеткам, подтверждает, что концепция просенсорного домена, как уникального, компетентного к развитию волосковых и поддерживающих клеток, может быть не корректной. Вместо этого просенсорные домены могут представлять собой регионы внутри внутреннего уха, которые являются пермиссивными по или обладают более высокой вероятностью развития в качестве сенсорного эпителия. Альтернативно, регионы внутреннего уха, которые не развиваются как сенсорные, могут испытывать влияние с помощью ингибирующих сигналов, которые обычно предупреждают клетки в этих регионах от приобретения судеб или просенсорных. Наконец, возможно также, что Kolliker's представляет собой уникальную клеточную популяцию, которая сохраняет повышенную способность развиваться как просенсорные клетки. Основы такой способности неясны, но она может быть связана с эволюционной историей этой области канала улитки.
Результаты, представленные выше подчеркивают критическую роль Atoh1 в формировании волосковых клеток и органа Корти. Если
Atoh1 первоначально экспрессируется слабо по всему просенсорному домену, то эта экспрессия, по-видимому, ведет к инициальной детерминации во всех этих клетках судьбы волосковых клеток и, следовательно, к необходимости последующих межклеточных взаимодействий, чтобы ограничить количества просенсорных клеток, которые в конечном итоге будут давать волосковые клетки. Однако, недавнее исследование вносит сомнение относительно веры. что Atoh1 является абсолютно необходимым для образования волосковых клеток. Du et al. (2007) получили химерных мышей их клеток дикого типа (WT) и Atoh1
-/-. Как и ожидалось, волосковые клетки, происходящие из WT клеток, обнаруживались во внутреннем ухе этих животных. Но неожиданно
Atoh1-/- также давали волосковые клетки. Этот результат указывает на то, что хотя Atoh1 и необходим для образования волосковых клеток, потребность в нем может быть меньшей в присутствии уже существующих волосковых клеток. Объяснение того, как такое восстановление судеб волосковых клеток происходит не очевидно, но существует одна возможность, что существующие волосковые клетки способны индуцировать др клетки, чтобы активировать программы детерминации и дифференцировки волосковых клеток, стоящие ниже Atoh1.
Id and notch signaling act to limit Atoh1 expression and hair
cell formation
Atoh1 является членом родоначального семейства bHLH транскрипционных факторов (Jones, 2004; Rebeiz et al., 2005). Множественные исследования на др. системах, в частности на нервной системе Drosophila, выявляют специфические ингибирующие взаимодействия между bHLH молекулами и некоторыми др. сигнальными путями. Среди них notch и id пути, регулирующие экспрессию Atoh1 во внутреннем ухе. Ids (Inhibitors of differentiation and DNA binding) являются HLH молекулами, которые тесно родственны bHLHs по структуре, но лишены basic домена (rev. Norton, 2000; Perk et al., 2005). Чтобы регулировать транскрипцию, bHLH молекулы д. прежде всего сформировать гетеродимеры с повсеместно экспрессируемыми bHLHs, обозначаемыми E-proteins (E2-2, HEP, E12 и E47), посредством своих HLH доменов. После гетеродимеризации basic домены соединяются со специфическими сайтами распознавания ДНК. Ids, лишенные basic домена и поэтому неспособны связывать ДНК, поэтому они действуют как антагонисты bHLHs благодаря конкуренции за и секвестрации E-proteins. Во время эмбриогенеза экспрессия Id обычно снижается приблизительно во время, когда клетки предшественники выходят из клеточного цикла и начинают дифференцироваться, паттерн, который согласуется с ролью в регуляции времени дифференцировки (Jen et al., 1996; 1997).
Внутри улитки 3 из 4-х Id генов, Ids1,2 и 3 широко экспрессируются между E12 и E14 (Jen et al., 1996; Jones et al., 2006). Однако, на ст. E16 экспрессия всех трех Id генов подавляется в развивающихся волосковых клетках (Jones et al., 2006). Подавление экспрессии Id коррелирует с увеличением экспрессии Atoh1 в тех же самых клетках и указывает на то, что потеря экспрессии Id
может приводить к усилению экспрессии Atoh1, что и наблюдается в развивающихся волосковых клетках приблизительно в то же самое время. В соответствии с этой гипотезой больше 90% просенсорных клеток, которые форсированы для поддержания экспрессии Id3 после момента времени негативной регуляции, формируются как поддерживающие клетки (Jones et al., 2006). Напротив, только 50% просенсорных клеток, которых заставляли экспрессировать контрольный вектор, развивались как поддерживающие клетки.
Путь передачи сигналов notch обсуждался в разделе просенсорной детерминации как позитивный регулятор просенсорной судьбы. Однако, классическая передача сигналов notch обычно ассоциирует с ингибирующими взаимодействиями, при которых активация notch предупреждает клетки предшественники от принятия предпочтительной или "primary" клеточной судьбы (rev. Ehebauer et al., 2006). Т.к. и notch лиганды и рецепторы связаны с мембранами, то эти сигнальные взаимодействия часто ассоциируют с образованием клеточного мозаицизма. Исходя из этих результатов, не является неожиданным, что передача сигналов notch играет критическую роль в формировании мозаицизма в улитке. Было продемонстрировано, что Notch1, широко экспрессируется в канале улитки, включая просенсорный домен (Lanford et al., 1999). Как только клетки начинают развиваться как волосковые, в этих клетках усиливается экспрессия двух notch лигандов, Jagged2 (Jag2) и Delta-like 1 (Dll1) , первые признаки экспрессии появляются приблизительно на ст. E14 в базальном регионе улитки и затем она распространяется в направлении верхушки (Lanford et al., 1999; Morrison et al., 1999). В течение 24 ч экспрессии лиганда активированный Notch1 обнаруживается в соседних клетках (Murata et al., 2006), также как и экспрессия, по крайней мере, двух notch генов мишеней, HES1 и HES5 (Zheng et al., 2000; Zine et al., 2001;
Lanford et al., 2000). Клетки, которые экспрессируют HES1 или HES5 д. развиваться как поддерживающие клетки. Два др. notch гена мишени, Hey и HeyL, также могут экспрессироваться в поддерживающих клетках, но их паттерны внутри улитки ещё не определены. Такой паттерн экспрессии полностью согласуется с notch-обусловленной латеральной ингибицией и указывает на то, что развивающиеся волосковые клетки удерживают своих соседей от принятия сходной судьбы. Имеется большое количество данных о развивающейся эмбриональной улитке мышей и о развивающейся и регенерирующей basilar papilla кур, которые подтверждают эту гипотезу. В обеих системах устранение развивающихся или существующих волосковых клеток позволяет соседним, не-волосковым клеткам, изменять свои судьбы и развиваться как замещающие волосковые клетки (Kelley et al., 1995; Adler et al., 1996; Roberson et al., 1996; Roberson et al., 2004; Duncan et al., 2006). На молекулярном уровне данные, согласующиеся с гипотезой, подтверждают, что передача сигналов notch действует, чтобы подавлять слабую экспрессию Atoh1, которая первоначально обнаруживается в просенсорных клетках. В частности, делеция Notch1, Jag2, Dll1, HES1 или HES5 ведет к избыточной продукции волосковых клеток (Lanford et al., 1999; Zheng et al., 2000; Zine et al., 2001; Keirnan et al., 2006). Более того, компаундная делеция Jag2 и Dll1 приводит к еще большей избыточной продукции, чем у одиночных мутантов, указывая на аддитивный эффект (Kiernan et al., 2006). Делеция др. генов, которые регулируют предачу сигналов Notch, таких как Rbp-J (Yamamoto et al., 2006) или COUP-TFI (Tang et al., 2006) также ведет к усилению продукции волосковых клеток. Наконец, инициальная экспрессия Atoh1, по-видимому, не затрагивается у Jag2 мутантов, но в большее количество клеток остается Atoh1 позитивными после нормального начала Jag2 (Lanford et al., 2000), указывая на то, что роль передачи сигналов notch заключается в ингибировании Atoh1. Эта гипотеза подтверждается также демонстрацией, что ко-экспрессия HES1 достаточна, чтобы ингибировать способность Atoh1 индуцировать волосковые клетки в Kolliker's органе (Zheng et al., 2000) и наблюдением, что временная активация Atoh1 в кластерах клеток Kolliker's органа ведет к активации пути notch (Woods et al., 2004).
Результаты, рассмотренные выше, подтверждают, что рассортировка просенсорных клеток на волосковые и поддерживающие клетки происходит благодаря последующим взаимодействиям. Первоначально все просенсорные клетки инициируют слабую экспрессию Atoh1, которая, если не ослабевает, то д. приводить к развитию волосковых клеток. В то же самое время те же самые клетки являются позитивными по Ids 1,2,3. Присутствие Ids предупреждает Atoh1 от соединения с E-белками и активирует транскрипцию генов, специфичных для волосковых клеток. Кроме того, Atoh1, как было показано, способствует своей собственной транскрипции (Helms et al., 2000), так что экспрессия Id может также предупреждать активацию позитивной петли обратной связи для Atoh1. Вскоре после начала экспрессии Atoh1, экспрессия Id подавляется в субнаборе клеток внутри просенсорного домена. Факторы, которые обеспечивают это подавление только в небольшом наборе клеток, неизвестны. Однако, как только оказываются подавленными Ids в этих клетках, репрессия позитивной петли обратной связи Atoh1 устраняется и эти клетки оказываются способными увеличивать уровень экспрессии Atoh1.
Среди инициальных мишеней для этой увеличенной экспрессии Atoh1 находятся notch лиганды Jag2 и Dll1. Экспрессия этих лигандов в развивающихся волосковых клетках ведет к активации Notch1 (Murata et al., 2006) и экспрессии нижестоящих мишеней HES1 и HES5 в соседних клетках. Комбинация экспрессии Id вместе с HES1/5 достаточна, чтобы погасить экспрессию
Atoh1 и детерминацию волосковых клеток в этих клетках.
Development of supporting cells
В результате сигнальных взаимодействий Atoh1/Id/Notch клетки внутри просенсорного домена достигают точки, на которой экспрессия Atoh1 или усиливается и клетки оказываются в процессе развития волосковых клеток, или экспрессия Atoh1 падает или теряется приводя в результате к потере детерминации волосковых клеток. Эта вторая популяция клеток, которая предположительно развивается как поддерживающие клетки. Факторы, которые индуцируют эти клетки, в основном неизвестны. Однако, эктопические волосковые клетки в Kolliker's органе рекрутируют окружающие клетки, чтобы сформировать из них поддерживающие клетки, демонстрируют, что волосковые клетки генерируют индуктивные сигналы для развития поддерживающих клеток (Woods et al., 2004).
Молекулярная природа индуктивных сигналов для общего развития поддерживающих клеток не установлена. Однако, имеются доказательства роли сигнального пути fibroblast growth factor в развитии pillar клеток, уникального типа поддерживающих клеток внутри кортиева органа. Fgfr3 первоначально экспрессируется в популяции клеток внутри просенсорного домена улитки, начиная с E15.5 (Peters et al., 1993; Pirvola et al., 1995, Mueller et al., 2002). Домен экспрессии Fgfr3, по-видимому, включает клетки, которые развиваются как pillar клетки, наружные волосковые клетки и Deiters' клетки, хотя не было проведено отслеживание дефинитивных клонов. Медиальная граница этого домена очень острая и располагается непосредственно рядом с развивающимися внутренними волосковыми клетками. Делеция или ингибирование передачи сигналов Fgfr3 ведет к нарушению как детерминации. так и дифференцировки pillar клеток (Colvin et al., 1996; Mueller et al., 2002; Puligilla et al., 2007). В частности, многие внутренние pillar клетки отсутствуют, подтверждая дефект детерминации, тогда как наружные pillar присутствуют, но, по-видимому, не дифференцированы (Puligilla et al., 2007). Напротив, делеция Sprouty2, антагониста
Fgfr, который экспрессируется в виде паттерна, сходного с Fgfr3, приводит к формированию дополнительных pillar клеток (Shim et al., 2005).
Наконец, Fgf8, Fgf с высокой связывающей активностью в отношении Fgfr3, инициально экспрессируется исключительно в развивающихся внутренних волосковых клетках, начиная с E15.5, указывая на индуктивное взаимодействие между внутренними волосковыми клетками и соседними клетками предшественниками (Pirvola et al., 2002; Jacques et al., 2007). В согласии с этой гипотезой условная делеция Fgf8 также приводит к дефектам в развитии pillar клеток, хотя фенотип менее тяжелый, чем у мутантов Fgfr3 mutants (Jacques et al., 2007). Более того, повышенные уровни Fgf8 ведут к усилению экспрессии маркеров pillar клеток внутри домена экспрессии
Fgfr3 (Jacques et al., 2007). В дополнение к уменьшению количества pillar клеток улитка у мутантных
Fgfr3 мышей также содержит достоверно более высокое количество наружных волосковых клеток, указывая тем самым, что Fgfr3 может также действовать, чтобы ингибировать образование волосковых клеток возможно в области между внутренними и наружными pillar клетками (Puligilla et al., 2007). Анализ изменений в экспрессии генов показывает усиление передачи сигналов Bmp4 в улитке мутантов
Fgfr3, а
in vitro эксперименты демонстрируют, что Bmp4 действует, чтобы индуцировать образование наружных волосковых клеток. Эти результаты предоставляют интригующие данные, указывающие на то, что пути передачи сигналов Fgf и Bmp могут взаимодействовать внутри домена pillar cell/outer hair cell, чтобы сформировать правильный паттерн этой области в органе Корти.
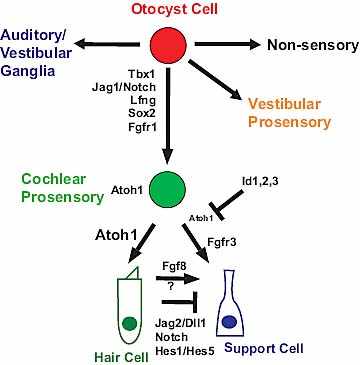 Fig. 4. Determination of cell fates in the organ of Corti. Cells located
within the otocyst can develop along one of four different pathways. As
cochlear prosensory cells, as closely related vestibular prosensory cells,
as cells that will give rise to neurons in the auditory and vestibular ganglia
or as non-sensory epithelia. Cells that will develop as cochlear prosensory
cells initially express a number of genes that have been shown to play a
role in prosensory specification, including Tbx1, Jag1, Lfng, Fgfr1 and
Sox2 (see text for details). Following prosensory specification, all
prosensory cells express Atoh1 leading to the initiation of a hair cell
specification program. At the same time, prosensory cells also express
Ids1, 2 and 3 which act to inhibit Atoh1 activity. Id expression is
subsequently down-regulated in cells that will develop as hair cells,
leading to an increase in the level of Atoh1 expression and the initiation
of expression of the notch ligands, Jag2 and Dll1. Expression of notch
ligands leads to activation of the Notch1 and the downstream target
genes HES1 and HES5, in neighboring cells. The presence of HES genes
along with continued expression of Ids leads to loss of Atoh1 expression.
At the same time, developing hair cells produce inductive signals,
including activation of the Fgf signaling pathway, that recruit surrounding
cells to develop as supporting cells. While Fgf signaling clearly plays a role
in the development of some types of pillar cells, other unidentified
inductive signals (indicated by “?”) are also assumed to exist.
Fig. 4. Determination of cell fates in the organ of Corti. Cells located
within the otocyst can develop along one of four different pathways. As
cochlear prosensory cells, as closely related vestibular prosensory cells,
as cells that will give rise to neurons in the auditory and vestibular ganglia
or as non-sensory epithelia. Cells that will develop as cochlear prosensory
cells initially express a number of genes that have been shown to play a
role in prosensory specification, including Tbx1, Jag1, Lfng, Fgfr1 and
Sox2 (see text for details). Following prosensory specification, all
prosensory cells express Atoh1 leading to the initiation of a hair cell
specification program. At the same time, prosensory cells also express
Ids1, 2 and 3 which act to inhibit Atoh1 activity. Id expression is
subsequently down-regulated in cells that will develop as hair cells,
leading to an increase in the level of Atoh1 expression and the initiation
of expression of the notch ligands, Jag2 and Dll1. Expression of notch
ligands leads to activation of the Notch1 and the downstream target
genes HES1 and HES5, in neighboring cells. The presence of HES genes
along with continued expression of Ids leads to loss of Atoh1 expression.
At the same time, developing hair cells produce inductive signals,
including activation of the Fgf signaling pathway, that recruit surrounding
cells to develop as supporting cells. While Fgf signaling clearly plays a role
in the development of some types of pillar cells, other unidentified
inductive signals (indicated by “?”) are also assumed to exist.
Summary
As the cochlear duct extends, its floor becomes partitioned into
three regions, a central prosensory domain and two non-sensory
flanking domains. Our understanding of the factors that specify
the prosensory domain remains limited, but activation of the notch
signaling pathway and the transcription factor Sox2 play impor-
tant roles. Within the prosensory domain, expression of Atoh1
initiates a genetic program that, if unabated, will ultimately lead to
the development of a hair cell. However, as a result of cellular and
genetic interactions involving the Id and notch signaling pathways, only a subset of cells within the prosensory domain are able to develop as hair cells. Other prosensory cells are diverted from the hair cell fate and are subsequently induced to develop as supporting cells (Fig. 4).
From this summary it is clear that our understanding of the
development of the organ of Corti has improved dramatically in
the last 10 years. But it should be emphasized that at this point we
have only elucidated general signaling interactions that apply to
essentially all hair cell epithelia. With the exception of Fgf signal-
ing, the interactions and molecules that regulate the development
of the many unique aspects of the organ of Corti, such as the
development of inner and outer hair cells and the alignment of
cells into ordered rows, remain unknown. Hopefully the continu-
ing examination of the effects of different genetic mutants on
cochlear development and the development of better and more
specific mouse lines for inner ear or cochlear specific genetic
deletion will result in a better understanding of how this fascinat-
ing structure develops.
Сайт создан в системе
uCoz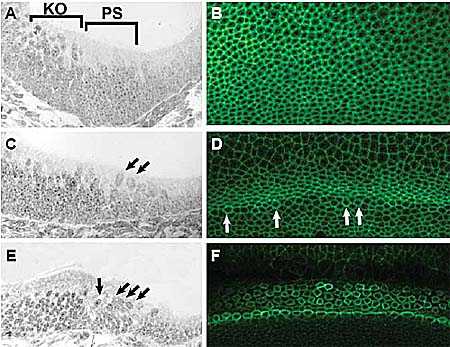 Fig. 1. Development of cellular pattern in the organ of Corti. (A) Cross-section through the mid-basal region of the cochlear duct at E13.5. Nuclei of cells located in the prosensory domain (PS bracket) have moved to a basal position. In contrast, internuclear migration is still ongoing in cells located in Kolliker's organ (KO bracket). (B) View of the lumenal surface of
the developing organ of Corti at E13.5. Cell boundaries have been labeled with phalloidin. There are no indications of cellular organization. (C) Cross-section through the cochlear duct at E14.5. Putative developing hair cells (arrows) can be identified in the developing organ of Corti. (D) Lumenal view at E14.5. A few developing inner hair cells are present (arrows). Also, the lumenal projections of adjacent prosensory cells have become constricted. (E) Cross-section of the developing organ of Corti at E16.5. Developing inner and outer hair cell nuclei can now be identified (arrows). (F) In a lumenal view, the basic pattern of the organ of Corti is now evident
Fig. 1. Development of cellular pattern in the organ of Corti. (A) Cross-section through the mid-basal region of the cochlear duct at E13.5. Nuclei of cells located in the prosensory domain (PS bracket) have moved to a basal position. In contrast, internuclear migration is still ongoing in cells located in Kolliker's organ (KO bracket). (B) View of the lumenal surface of
the developing organ of Corti at E13.5. Cell boundaries have been labeled with phalloidin. There are no indications of cellular organization. (C) Cross-section through the cochlear duct at E14.5. Putative developing hair cells (arrows) can be identified in the developing organ of Corti. (D) Lumenal view at E14.5. A few developing inner hair cells are present (arrows). Also, the lumenal projections of adjacent prosensory cells have become constricted. (E) Cross-section of the developing organ of Corti at E16.5. Developing inner and outer hair cell nuclei can now be identified (arrows). (F) In a lumenal view, the basic pattern of the organ of Corti is now evident 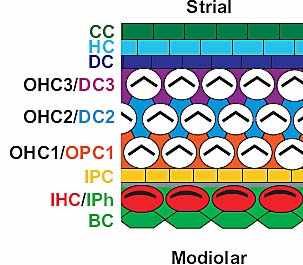 Fig. 2. Schematic diagram of cellular patterning in the organ of Corti
at P0. Inner hair cells (IHC) are arranged in a single row located on the
modiolar side. Inner hair cells are surrounded by border cells (BC) on their
modiolar side and inner phalangeal cells on both their lateral (Iph) and
strial (gray) sides. On the strial side of the inner hair cells are single rows
of inner (IPC) and outer (OPC) pillar cells. Outer pillar cells also form the
interdigitations between first row outer hair cells (OHC1). Second and
third row outer hair cells (OHC2/3white) are separated by single Deiters'
cells (DC2/3). Finally, a third row of Deiters' cells (DC3) from a boundary
between the outer hair cells and the adjacent Claudius and Hensen's
cells (CC and HC).
Fig. 2. Schematic diagram of cellular patterning in the organ of Corti
at P0. Inner hair cells (IHC) are arranged in a single row located on the
modiolar side. Inner hair cells are surrounded by border cells (BC) on their
modiolar side and inner phalangeal cells on both their lateral (Iph) and
strial (gray) sides. On the strial side of the inner hair cells are single rows
of inner (IPC) and outer (OPC) pillar cells. Outer pillar cells also form the
interdigitations between first row outer hair cells (OHC1). Second and
third row outer hair cells (OHC2/3white) are separated by single Deiters'
cells (DC2/3). Finally, a third row of Deiters' cells (DC3) from a boundary
between the outer hair cells and the adjacent Claudius and Hensen's
cells (CC and HC). 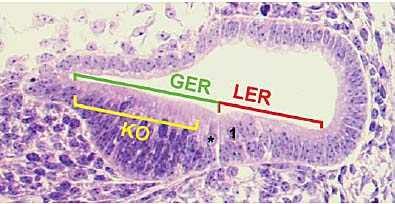 Fig. 3. Kolliker's organ, GER and LER. Cross section through the
cochlear duct at E15 illustrating the morphological boundaries of Kolliker's
organ (KO), the greater epithelial ridge (GER) and the lesser epithelial
ridge (LER). Note the distinct notch that is formed at the GER/LER
boundary, marking the position of the pillar cells between the single inner
д. предоставить информацию о молекулярной регуляции просенсорной спецификации.
Fig. 3. Kolliker's organ, GER and LER. Cross section through the
cochlear duct at E15 illustrating the morphological boundaries of Kolliker's
organ (KO), the greater epithelial ridge (GER) and the lesser epithelial
ridge (LER). Note the distinct notch that is formed at the GER/LER
boundary, marking the position of the pillar cells between the single inner
д. предоставить информацию о молекулярной регуляции просенсорной спецификации.  Fig. 4. Determination of cell fates in the organ of Corti. Cells located
within the otocyst can develop along one of four different pathways. As
cochlear prosensory cells, as closely related vestibular prosensory cells,
as cells that will give rise to neurons in the auditory and vestibular ganglia
or as non-sensory epithelia. Cells that will develop as cochlear prosensory
cells initially express a number of genes that have been shown to play a
role in prosensory specification, including Tbx1, Jag1, Lfng, Fgfr1 and
Sox2 (see text for details). Following prosensory specification, all
prosensory cells express Atoh1 leading to the initiation of a hair cell
specification program. At the same time, prosensory cells also express
Ids1, 2 and 3 which act to inhibit Atoh1 activity. Id expression is
subsequently down-regulated in cells that will develop as hair cells,
leading to an increase in the level of Atoh1 expression and the initiation
of expression of the notch ligands, Jag2 and Dll1. Expression of notch
ligands leads to activation of the Notch1 and the downstream target
genes HES1 and HES5, in neighboring cells. The presence of HES genes
along with continued expression of Ids leads to loss of Atoh1 expression.
At the same time, developing hair cells produce inductive signals,
including activation of the Fgf signaling pathway, that recruit surrounding
cells to develop as supporting cells. While Fgf signaling clearly plays a role
in the development of some types of pillar cells, other unidentified
inductive signals (indicated by “?”) are also assumed to exist.
Fig. 4. Determination of cell fates in the organ of Corti. Cells located
within the otocyst can develop along one of four different pathways. As
cochlear prosensory cells, as closely related vestibular prosensory cells,
as cells that will give rise to neurons in the auditory and vestibular ganglia
or as non-sensory epithelia. Cells that will develop as cochlear prosensory
cells initially express a number of genes that have been shown to play a
role in prosensory specification, including Tbx1, Jag1, Lfng, Fgfr1 and
Sox2 (see text for details). Following prosensory specification, all
prosensory cells express Atoh1 leading to the initiation of a hair cell
specification program. At the same time, prosensory cells also express
Ids1, 2 and 3 which act to inhibit Atoh1 activity. Id expression is
subsequently down-regulated in cells that will develop as hair cells,
leading to an increase in the level of Atoh1 expression and the initiation
of expression of the notch ligands, Jag2 and Dll1. Expression of notch
ligands leads to activation of the Notch1 and the downstream target
genes HES1 and HES5, in neighboring cells. The presence of HES genes
along with continued expression of Ids leads to loss of Atoh1 expression.
At the same time, developing hair cells produce inductive signals,
including activation of the Fgf signaling pathway, that recruit surrounding
cells to develop as supporting cells. While Fgf signaling clearly plays a role
in the development of some types of pillar cells, other unidentified
inductive signals (indicated by “?”) are also assumed to exist.