Несмотря на случайные индивидуальные вариации внешняя билатеральная симметрия тела позвоночных почти безупречна. И поэтому почти невозможно отличить одну половину тела от др. Они не идентичны, но симметричны. В глубине тела позвоночных, однако части не идентичны и не симметричны. Можно легко отличить левую сторону позвоночного (содержащую верхушку и большую часть сердца, легкое с меньшим числом долей, желудок и селезенку) от правой (которая содержит легкое с большим числом долей, большую часть печени и желчный пузырь). Эта нормальная диспозиция внутренних органов и структур вдоль лево-правосторонней (left-right (LR)) оси известна как situs solitus, и очень хорошо законсервирована среди всех индивидов данного вида, а также среди др. видов позвоночных. Отклонения от situs solitus характеризуются полной зеркальной диспозицией внутренних органов (situs inversus), помещением внутреннего органа так, как если бы были две левые или две правые стороны (left or right isomerism), и корректна LR ориентация некоторых органов, но обратная для др. (heterotaxia). Большинство нормальных situs у людей приводят к тяжелым заболеваниям.
В связи со здоровьем человека исследования морфогенеза LR асимметрии ставят фундаментальные биологические вопросы в области Биологии Развития. Какого типа сигналы и механизмы оперируют так, что инициальный симметричный статус эмбриона систематически нарушается в одном и том же направлении, генерируя тем самым кажущуюся произвольной левую и правую качественную особенность? Как такая информация об асимметрии превращается и поддерживается в развивающемся эмбрионе, чрезвычайно динамичной системе с константным ростом и при непрерывных морфогенетических изменениях? Как зачатки эмбриональных органов в конце концов интерпретируют асимметричную информацию, так что возникает морфологическая асимметрия?
Во время последних 10 лет информация по этм вопросам была получена в результате анализа модельных эмбрионов, таких как куры, Xenopus, мыши и рыбки данио (rev. Capdevila et al., 2000; Mercola and Levin, 2001; Hamada et al., 2002; Bisgrove et al., 2003). Картина. возникающая в результате таких анализов, подчеркивает дивергенцию механизмов, с помощью которых эмбрионы позвоночных специфицируют LR ось. Однако эволюционно законсервированные признаки также отмечены. ,Так эмбриональный узелок (организатор у Xenopus, Hensen's узелок у кур, вентральный узелок у мышей и Kupffer's пузырек у рыбок данио) играет важную роль в генерации LR асимметричного паттерна. Также все проанализированные эмбрионы позвоночных обладают соотв. левосторонней экспрессией транскриптов, кодирующих TGF-β сигнал Nodal в lateral plate mesoderm (LPM). Более того, присутствие подобной асимметрии в экспрессии Nodal коррелирует с направленной склонностью к формированию LR паттерна во время эмбрионального развития. Выше левосторонней экспрессии Nodal в LPM,дивергентные механизмы. по-видимому, оперируют у эмбрионов разных видов. Т.о., серия асимметрично экспрессируемых генов была обнаружена исключительно у эмбрионов кур (rev. Raya and Izpisua Belmonte, 2004b), механизм, связанный с движениями нодальных ресничек экспериментально был описан в деталях только у мышей (rev. Hiro-kawa, 2000), а LR асимметрия локализации мРНК была найдена только у эмбрионов Xenopus уже на двухклеточной стадии (rev. Levin, 2003).
Здесь мы рассмотрим недавние исследования ранних ступеней по передаче информации LR асимметрии в и из узелка. Мы проделаем это с целью выяснить различия и общности среди различных видов позвоночных. Во-первых, мы анализировали экспериментальные и теоретические указания на роль узелка как генератора LR информации у эмбрионов мышей. Во-вторых, мы оценим доказательства, подтверждающие роль узелка как интегратора LR
информации, для чего мы предлагаем минимальный набор тестируемых показателей. Затем рассмотрим недавнюю литературу по поиску механизмов, которые регулируют предполагаемые индикаторы узелка. Наконец, принимая во внимание эволюционно законсервированные свойства, мы предлагаем общую модель спецификации LR оси.
The Initial Symmetry-Breaking Step
В отличие от dorsal-ventral (DV) and anterior-posterior (AP) осей, для которых установление полярности не влияет на исход асимметрии плана тела вдоль этих осей, детерминация лево-правосторонней плоскости асимметрии может давать два возможных chiral решения. То, что эмбрионы позвоночных постоянно предпочитают одно из решений по сравнению с др. указывает на существование сильного механизма(ов), который передаёт laterality информацию в широкие, многоклеточные поля развивающегося эмбриона. Более того, если мы предположим (как это обычно и делается) , что эмбрион начинает своё развитие как действительно билатерально симметричное существо, то факт, что лево-правосторонняя асимметрия сообразно склоняется в направлении одного из возможных chiral решений можно понять только, если эмбрион обеспечен механизмом отличать левое от правого.
Теоретическое понимание этого механизма Brown и Wolpert (1990) всё ещё является стандартным мнением в этой области, согласно которому "F-shaped" молекула с фиксированной ориентацией относительно AP и DV осей, д. "превращать" молекулярную хиральность (handedness) в хиральность на клеточном уровне. Эмпирический подход к этому механизму нарушения симметрии, однако чрезвычайно трудно доказать и кстати проделана единственная попытка на эмбрионах мышей. Благодаря их морфологической характеристике (мышиный эмбрион напоминает цилиндр), эмбрионы этого вида гаструлируют своеобразным способом по сравнению с др. позвоночными, включая и др. млекопитающих. Узелок образует большое вдавление в основании цилиндра на его вентральной стороне, которое покрыто Reichert's мембраной. Это необычное архитектурное устройство дает в результате ~20-pl жидкостью заполненную полость, чьё основание (если смотреть с вентральной стороны) выстлано нодальными клетками с одиночными ресничками. В серии значительных сообщений членов лаб. Nobutaka Hirokawa's было продемонстрировано, что монореснички в этой маленькой полости ротируют в фиксированном направлении (по часовой стрелке, если смотреть с вентральной стороны), и что эти ротирующие движения вызывают в конечном счете лево-направленный ток жидкости, если измерять на её поврехности и что правильное происхождение обоих феноменов коррелирует с генерацией нормального образования LR паттерна (Nonaka et al., 1998; Okada et al., 1999; Takeda et al., 1999). Значение нодального тока для детерминации LR асимметричного паттерна далее было подтверждено, тем фактом, что формирование LR паттерна может быть изменено у эмбрионов мышей в культуре путём манипуляций с интенсивностью и/или направлением тока, осуществляемыми экзогенно (Nonaka et al., 2002).
Предположение, вытекающее из этих наблюдений, таково, что инициальная симметрия эмбриона нарушается за счет накопления на левой стороне морфогена, вызываемого направленным нодальным током, генерируемым за счет ротации нодальных моноресничек, однако это встречает некоторую критику (Levin, 2003; Tabin and Vogan, 2003). В первую очередь возражения касаются интегральных пробелов знания в гипотезе нодального тока. Так, биологически ориентированная точка зрения не объясняет, как ротационное (vortical) движения нодальных моноресничек могут транслироваться в направленный (transversal) ток жидкости поперек узелка, или как этот ток жидкости д. в конечном итоге приводить к накоплению морфогена на одной из сторон узелка. Экспериментальные биологи также ощущают беспокойство, когда центральную роль в гипотезе играет "неизвестный" морфоген. Последние два возражения (идентификация морфогена и механизм его накопления на левой стороне) были решительно устранены в альтернативной "two-cilia" модели (Tabin and Vogan, 2003), согласно которой механические ощущения скорее, чем химические ощущения являются механизмом считывания информации. В этой модели, нодальный ток д. приводить к увеличению давления жидкости на левой стороне узелка, что ощущается неподвижными механосенсорными моноресничками, инициируя тем самым асимметричную Ca2+-обеспечиваемую передачу сигналов. Экспериментальные доказательства этой модели получены в результате идентификации двух популяций нодальных моноресничек: центрально локализованных, подвижных ресничек. которые экспрессируют Left-right dynein (Lrd) и polycystin-2 (кодирующий катионный канал) и неподвижные реснички на периферии узелка. экспрессирующие polycystin-2 но лишенные экспрессии Lrd (McGrath et al., 2003). Более того, McGrath et al. (2003) открыли существование накопления внутриклеточного Ca2+ в энтодерме на левом краю узелка. Важно, что увеличение на левой стороне уровня внутриклеточного Ca2+ нарушается у мутантных эмбрионов или по Lrd или polycystin-2, что ведет к изменению формирования LR паттерна.
Хотя модель "двух ресничек" не объясняет механизма, с помощью которого генерируется нодальный ток, но нет нужды накопления морфогена на левой стороне узелка-в самом деле, то, что морфоген не нужен совсем, может облегчить дискомфорт экспериментальным биологам, для которых картина изгибающихся ресничек под давлением жидкости более приемлема, чем картина того, как вмешиваются законы диффузии. Но apbrb жидких сред смотрят на проблему с др. точки зрения. Cartwright et al. (2004) смоделировали характеристики жидкостной динамики в узелке мыши. Их первым выводом было то, что при низком числе Reynolds системы (подсчитана авт. между 10-3 и 5 x 10-4), поведение нодального тока очень отлично от нашего каждодневного восприятия. В этих условиях, известных как ползучее движение жидкости, вязкость доминирует над инерцией, это значит, что если ротация была бы остановлена, то нодальный ток немедленно бы загас. Из этих наблюдений также следует, что даже в присутствие направленного тока, магнитуды сдирающих (shear) стрессов и скорости течения д. быть симметричными поперек узелка и, следовательно, д. быть неспособными к асимметричному сгибанию monocilia на одной из сторон узелка (Cartwright et al., 2004). Вместо этого авт. склоняются в пользу базирующегося на морфогене хемосенсорном механизме. Если включить пути рециркуляции тока в трехмерной модели всего узелка, то станет ясно, что транспорт морфогена зависит как от его advection за счет тока, так и его молекулярной диффузии. При условии, что морфоген инактивируется вскоре после своего высвобождения (на временной шкале, подсчитанной авт. между 0.25 и 2.5 сек), модель авт. предполагает накопление морфогене на левой стороне у эмбрионов дикого типа, а также на правой стороне у inv мутантов, которые, имеют время advection значительно более долгое, чем в норме (Fig. 1). Т.к. для идентификации морфогена несколько молекул соответствуют критериям, предсказанным Cartwright et al., включая Nodal, Growth and differentiation factor 1 (Gdfl), Fibroblast growth factor 8 (FGF-8) и Hedgehog (HH)- like signal Sonic Hedgehog (SHH). Из них, Nodal, как было предположено, является строгим кандидатом, исходя из недавних доказательств (Brennan et al., 2002; Saijoh et al., 2003) . В последней части статьи мы аргументируем. что SHH является наиболее вероятным морфогеном, накапливающимся на левой стороне узелка в результате нодального тока.
Cartwright et al. (2004) также использовали инструменты физики жидкостей, чтобы исследовать вопрос, как ротационные движения могут создавать направленный ток жидкости. После отказа от давнего предположения, что треугольная форма узелка д. быть ответственна за генерацию направленного влево нодального тока, авт. нашли решение, если реснички согнуты по AP оси в направлении кзади. В биологических терминах это можно выразить или как активное наклонение ресничек или как пассивный изгиб ориентации ресничек, которые во всем остальном имеют прямолинейную ось. Первая возможность не подтверждается многочисленными доказательствами с помощью микроскопической визуализации нодальных ресничек. Однако недавняя информация от мутантов Rfx3 может быть совместима с существованием дистально изогнутых нодальных monocilia. RXF3 является членом семейства Regulatory factor X (RFX), состоящего из содержащих домен helix-turn-helix транскрипционных факторов. Члены семейства RFX были идентифицированы у C. elegans (DAF-19, Swoboda et al., 2000) и Drosophila (dRFX, Dubruille et al., 2002), где они играют важные роли в регуляции сборки сенсорных ресничек. Из 5 членов RFX описанных у млекопитающих, Rfx3 преимущественно экспрессируется в реснитчатых клетках, включая и таковые узелка эмбрионов мыши (Bonnafe et al., 2004). В соответствии с ролью в контроле образования ресничек, мышиные эмбрионы, мутантные по Rfx3 обнаруживают часто дефекты формирования LR паттерна, включая situs inversus и heterotaxia (Bonnafe et al., 2004). Важно, что нодальные моноцилии у мутантных Rfx3 эмбрионов почти вдвое меньшей длины по сравнению с нормальными сибсами (Bonnafe et al., 2004), это открывает интригующую возможность, что отсутствующие части ресничек могут представлять собой изогнутый компонент. постулированный Cartwright et al. (2004). Несмотря на это отсутствуют позитивные экспериментальные доказательства для такого типа сообразно ориентированных, изогнутых или наклоненных нодальных моноцилий. Однако др. теоретические решения превращения движений нодальных ресничек в направленный ток жидкости также возможны. Наша группа успешно моделировала одно из таких решений, предположив не плоскостное (nonplanar) ритмическое биение моноцилий, предположение, согласующееся с экспериментальными результатами, полученными с помощью анализа микроскопического видео движений нодальных ресничек (Buceta etal., 2005).
Помимо аспектов ещё необъясненных гипотезой нодального тока, второй тип критики
L
Figure 1. (A) Sketch of how fluid will recirculate within the node in vivo with diffuse return flows above and below the more intense outward flow in the center. Also shown is the putative placement of morphogen sources (gray areas) at the left and right sides adjacent to the upper recirculatory vortex. (B,C) Numerical simulations of the model by Cartwright et al. (2004) depicting the steady-state concentration of a morphogen with a finite lifetime within the node with normal (B) and inv (C) mice. The color scale is a rainbow, with red being the highest concentration and violet the lowest. (D-E) Graphs of the concentration of morphogen at the floor of the node in the simulations above with normal (D) and inv (E) mice (arbitrary units). Reproduced from Cartwright et al., 2004, copyright ©1993-2004 by The National Academy of Sciences of the United States of America, all rights reserved.
проистекает из того факта, что она нарушает интеллектуально удовлетворяющий принцип эволюционной консервации. Др. словами, она стала для биологов вызовом, сталкиваясь с теоретическим и эмпирическим механизмом, который д. гарантировать направленное нарушение симметрии и следовательно, трудно представить себе, что это м. возникнуть несколько раз во время эволюции, генерируя разные механизмы для каждого вида. Т.о., независимо от того, действительно ли направленный влево ток жидкости нарушает инициальную симметрию у эмбрионов мышей, вопрос д. стоять так: является ли это общим механизмом, с помощью которого все эмбрионы позвоночных инициируют свою LR асимметрию? И очевидно, ответ должен звучать: нет, это не так. Несмотря на попытки примирить роль ресничек у разных модельных организмов, базируясь на том факте, что клетки в эквивалентах узелка у этих видов имеют реснички и экспрессируют Lrd (Essner et al., 2002), доказательства эволюционной консервации механизма нодального тока пока косвенные. Эмбрионы рыбок данио, хотя позднее попали в поле исследований LR асимметрии, они представляют собой прекрасную модельную систему для анализа вопроса. играют ли нодальные реснички важную роль в событиях нарушения симметрии у этого вида. Используя эту модель, Amack and Yost (2004) продемонстрировали осуществимость подавления продуктов специфических генов локально в дорсальных клетках предшественниках и их потомках в Kupffer's пузырьке (который скорее всего представляет собой у рыбок данио эквивалент вентрального узелка мышей), с помощью инъекций morpholino-модифицированных антисмысловых олигонуклеотидов на стадии средины бластулы эмбрионов zebrafish. Подавление
no tail {ntl, гомолог Brachyury у рыбок данио) таким способом приводило к дефектам морфогенеза Kupffer's пузырька и ассоциированным дефектам формирования LR паттерна (Amack and Yost, 2004). Интересно, что клетки, которые выстилают основание Kupffer's пузырька имеют реснички, хотя роль таких ресничек (if any) для установления LR асимметрии остается неизвестной. С др. стороны, было установлено, что по крайней мере у эмбрионов лягушек и кур информация о LR асимметрии существует до появления морфологически различимого узелка (rev. Levin, 2003), указывая тем самым, что механизм, отличный от нодального тока нарушает инициальную симметрию эмбриона у этих видов/
Figure 2. Domains of Nodal expression relevant for LR patterning in vertebrate model embryos. (A, B) In the chick embryo perinodal expression of Nodal begins at HH6, exclusively on the left side of Hensen's node (A); at HH8-9, Nodal expression extends to the left LPM and is also detectable on the right side of the node (B). Panels reproduced with permission from Raya et al. (2004). (C, D) In the mouse embryo, symmetric expression of Nodal around the ventral node is detected in pre-somite 7.5 dpc embryos (C), this perinodal domain of Nodal expression becomes biased toward the left in embryos between 3-6-somite stages (not shown). (D) Lateralized expression in the left LPM in mouse embryos begins at the 4-5-somite stage and extends throughout the LPM by the 7-8-somite stage. Panels reproduced with permission from Raya et al. (2003). (E, F) The perinodal expression of Xnrl of stage-22 Xenopus embryos appears symmetrical (E), and extends to the left LPM by stage 24 (F). Panels reproduced with permission from Lustig et al. (1996). (G, H) The symmetric perinodal expression of southpaw {span) around Kupffer's vesicle in zebrafish embryos begins at the 4-5-somite stage (G). Asymmetric spaw expression in the left LPM is detected by the 10-12-somite stage (not shown) and extends throughout the LPM by the 20-23-somite stage (H). Panels reproduced with permission from Long et al. (2003). In all panels, anterior is to the top. Embryo views are ventral in (A-D) and dorsal in (E-H). In all panels, arrows point to perinodal expression domains of Nodal, and arrowheads to the expression in the left LPM.
Однако природа такого механизма остается неизвестной и поэтому не может быть проверена у эмбрионов мышей. Следовательно, вопрос открыт, законсервирован ли механизм нарушения симметрии у позвоночных. В свете эволюционной консервации нижестоящих эпигенетических механизмов и генетических каскадов (see below), мы склонны предположить, что инициальное событие нарушения симметрии эмбриона законсервировано у позвоночных. В последней части мы представим общую модель формирования LR паттерна.
The Left-Right Organizer
Хотя узелок может быть не той структурой, где нарушается инициальная симметрия у эмбрионов кур и лягушек, он определенно играет ключевые роли в установлении LR асимметрии у всех проанализированных видов позвоночных. Мы полагаем, что узелок у Xenopus, Гензеновский узелок у кур, Kupffer's пузырек у рыбок данио и также вентральный узелок у мышей действуют как LR информационные передатчики. Следовательно, эта структура д. создавать мост между инициальным событием нарушения симметрии и появлением самых ранних законсервированных признаков асимметрии у эмбрионов позвоночных, т.е. левосторонней экспрессии Nodal в lateral plate mesoderm (LPM). Чтобы это осуществить узелок способен (i) получать сигналы laterality, (ii) интегрировать их и (iii) обеспечивать трансляцию направленного сигнала в соседнюю мезодерму. Молекулярные механизмы, лежащие в основе напрпавленного переноса информации от ужелка к LPM рассматриваются в др. местах (Raya and Izpisua Belmonte, 2004a). Экспериментальные доказательства. подтверждающие первую точку ( сигналы laterality в узелок) будут рассмотрены в след. разделе. В этой части мы рассмотрим данные, подтверждающие роль узелка как интегратора LR информации. До появления широкой левосторонней экспрессии Nodal в LPM, транскрипты этого гена обнаруживаются в дискретном домене вокруг узелка у всех проанализированных видов позвоночных (Fig. 2). Экспрессия Nodal вокруг узелка и в LPM контролируется различными механизмами и, в самом деле, регулируется разными энхансерами в Nodal гене (Adachi et al., 1999; Norris and Robertson, 1999). Важно, что недавние эксперименты на эмбрионах мышей и кур выявили потребность в этом малом домене экспрессии Nodal около узелка для установления левосторонней экспрессии Nodal в LPM и для собственно формирования LR паттерна (Brennan et al., 2002; Krebs et al., 2003; Raya et al., 2003; Raya et al., 2004; Saijoh et al., 2003). У мышей, Brennan and colleagues (2002) устраняли домен перинодальной экспрессии Nodal избирательно путем комбинирования двух целенаправленно измененных аллелей Nodal, одного нулевого и др., у которого делетирован 2.7-kb node-specific enhancer (NDE) элемент. Как следствие эмбрионы оказались неспособны индуцировать левостороннюю экспрессию Nodal в LPM, и обнаруживали измененную LR асимметрию органов, указывающую на то, что домен перинодальной экспрессии Nodal необходим для развития специфичного для левой
Figure 3. SHH activity regulates Nodal expression in the LPM, but not around Hen-sen's node. All panels are ventral views, anterior to the top. The position of Hensen's node is marked by an oval. Implantation of SHH beads on the right side of the node at HH5, while able to induce ectopic expression of Nodal in the right LPM (arrow in panel B), did not increase its peri-nodal expression at earlier stages (arrowheads in panels A and B). Conversely, blockage of SHH activity by specific antibodies could not alter the normal peri-nodal expression of Nodal (C and D), but was nonetheless able to prevent the appearance of Nodal transcripts in the left LPM (panel E). Modified figure reproduced with permission from Raya et al. (2004).
стороны модуля в LPM. Независимое подтверждение этого заключения было предоставлено Saijoh et al. (2003) , которые анализировали разные гипоморфные аллели Nodal , случайно полученные с помощью инсерции селекционной кассеты в предполагаемый вторичный энхансер Nodal асимметрии. Эмбрионы, несущие такие измененные аллели Nodal , обнаруживали строгое подавление и отсутствие доменов перинодальной и LPM экспрессии Nodal , соотв., и рандомизированную LR асимметрию органов. Важно. что как молекулярные, так и фенотипические альтерации устранялись избыточной экспрессией Nodal специфически в перинодальной области (Saijoh et al., 2003). Дополнительные доказательства зависимости левосторонней экспрессии Nodal в его раннем перинодальном домене получены при анализе подавления передачи сигналов Notch у эмбрионов мышей и кур. Такие манипуляции, которые приводили к отсутствию перинодальной экспрессии Nodal, оказались ассоциированными с неспособностью инициировать экспрессию Nodal в LPM, и с дефектами формирования LR паттерна (Krebs et al.# 2003; Raya et al., 2003; Raya et al., 2004). Все эти исследования показывают критическую роль узелка в генерации временного дискретного домена экспрессии Nodal вокруг этой структуры, которая позднее транслируется в широкие, более стабильные домены генной экспрессии в левой LPM. Мы полагаем, что появление перинодального домена экспрессии Nodal является одним из показателей узелка как интегратора LR информации.
Важно отметить, что необходимым для последующей экспрессии Nodal в LPM является присутствие перинодального домена экспрессии Nodal, и не факт, что этот домен является LR асимметричным сам по себе. Действительно, врожденная LR асимметрия экспрессии Nodal вокруг узелка сильно зависит от анализируемого вида, варьируя от явной асимметрии у кур доя едва заметной асимметрии у мышей до отсутствия обнаружимой асимметрии у Xenopus или рыбок данио (Fig. 2). Следовательно, исходом того, что мы предполагаем узелок как интегратор LR информации является генерация перинодального домена экспрессии Nodal независимо от того является ли этот домен симметричным или асимметричным. Как обсуждается ниже, асимметрия этого домена экспрессии Nodal может быть показателем более ранних событий LR асимметрии, которые принимаются во внимание узелком для выдачи обработанной LR информации. Необходимо также отметить, что перинодальная экспрессия Nodal, также необходимая для последующей экспрессии этого гена в LPM, недостаточна для инициации её. Так, некоторые экспериментальные условия приводят к неспособности генерировать экспрессию Nodal в LPM несмотря на безусловно нормальный домен экспрессии Nodal вокруг узелка. Такие условия возникают при мутации Gdf1 (Rankin et al., 2000), Cryptic (Gaio et al., 1999; Yan et al., 1999) или Smoothened (Smo, Zhang et al., 2001) генов у мышей и при использовании антител, чтобы блокировать передачу сигналов HH у кур (Fig. 3, Raya et al., 2004). Важно, что экспрессия Gdf1 и Cryptic в узелке мышей находтся под контролем передачи сигналов HH (Zhang et al., 2001). Базируясь на этих результатах мы предполагаем. что критическая роль передачи сигналов HH во время установления LR асимметрии заключается в переносе экспрессии Nodal из перинодального домена в LPM. Это не является единственной ролью передачи сигналов HH, убедительно продемонстрирована ещё одна функция SHH во время образования барьера срединной линии (Meyers and Martin, 1999; Tsukui et al., 1999). Важно, что результаты разных экспериментальных условий у эмбрионов Xenopus, рыб, кур и мышей, которые ведут к гипотезе эволюционной дивергенции в функции SHH во время формирования LR паттерна (Meyers and Martin, 1999), могут быть интерпретированы по другому, если обе роли рассматриваются вместе. Т.о., тот факт. что избыточная экспрессия Shh или Banded hedgehog (Bhh) на правой стороне у эмбрионов кур и Xenopus соотв., индуцирует билатеральную экспрессию Nodal в LPM (Levin et al., 1995; Sampath et al., 1997), и что неправильная экспрессия shh на правой стороне у эмбюрионов рыбок данио приводят к дефектам сердца и асимметрии органов (Schilling et al., 1999), трудно объяснить вмешательством в функцию HH белков при формировании барьера срединной линии. Однако эти результаты согласуются с нашим предположением о более ранней роли активности HH в переносе экспрессии Nodal с перинодальной области в LPM. Т.о., т.к. Nodal обычно также экспрессируется на правой стороне узелка у эмбрионов кур, Xenopus и рыбок данио (see Fig, 2), усиление активности HH в этом регионе д. приводить к аномальному переносу этого домена на правую LPM. Мы полагаем, что уровень активности HH является вторым считыванием информации узелком в качестве интегратора LR информации.
Итак, мы рассмориваем узелок как LR организатор, который интегрирует laterality информацию и генерирует двукратное считывание информации: о непосредственном домене экспрессии
Nodal и характерном уровне активности HH, оба считывания необходимы для переноса экспрессии
Nodal в LPW. Мы также постулируем, что комбинированное действие обоих считываний ведет к увеличению передачи сигналов с помощью специфических TGF-β лигандов на левую перинодальную область, что в конце концов обеспечивает laterality переноса информации в направлении LPM. Недавно получены доказательства серии сложных взаимодействий между компонентами TGF-β сигнального пути Nodal, Gdf1 и ко-рецепторами из EGF-CFC семейств (такого как Cryptic), которые могут инициировать аутокаталитическую петлю (reviewed in Raya and Izplsua Belmonte, 2004a). Как только оказывается сгенерированным перинодальный домен экспрессии
Nodal то легко представить, что небольшие изменения в доступности дополнительных лигандов (Gdf1) или ко-рецептолров (Cryptic), обеспечиваемые за счет реакционной способности, д. приводить к само-ускоряющемуся увеличению общей активности TGF-β на одной стороне узелка. В такой системе направляющий компонент может быть предоставлен за счет асимметрии любого или обоих считываний узелком; т.е., асимметричный LR домен экспрессии
Nodal вокруг узелка и/или LR асимметрия активности HH.
Laterality Inputs to the Node
По крайней мере у эмбрионов Xenopus и кур, LR информация уже существует до появления узелка (rev. Levin, 2003). Экспериментальные доказательства также указывают, что ранние сигналы laterality передаются в узелок кур из соседней ткани (Psychoyos and Stern, 1996; Pagan-Westphal and Tabin, 1998; Levinand Mercola, 1999; Yiian and Schoenwolf, 1999). Тщательная проверка механизмов такого переноса LR информации может помочь в идентификации законсервированных и дивергентных механизмов срдаи эмбрионов разных видов. Учитывая интегративную роль узелка, предположенную выше, мы, во-первых, рассмотрим доказательства, касающиеся импульсов laterality, которые регулируют асимметрию активности HH и, во-вторых, механизмы, предположительно контролирующие домен перинодальной экспрессии Nodal.
У эмбрионов кур в основополагающей работе Levin et al. (1995) идентифицирован регуляторный каскад, который в конечном итоге позиционирует экспрессию
Shh на левой стороне узелка. Мы пролили свет на две концепции, которые наиболее очевидны для большинства исследователей в этой области, но часто происходит неправильное цитирование. Во-первых, активация этого регуляторного каскада, как предполагают результаты экспрессии Nodal, оказываются ограниченной левой LPM. Домен более ранней экспрессии Nodal вокруг узелка, как было показано, не модифицируется после манипуляций с передачей сигналов activin с активностью SHH (Levin et aL, 199S). Перинодальная экспрессия Nodal , по-видимому, контролируется разными механизмами. Во-вторых, экспрессия Shh не активируется на левой стороне Гензеновского узелка у кур, но репрессируется на его правой стороне. Т.о., экспрессия
Shh обнаруживается симметричной на обоих сторонах пузырька вплоть до стадии HH4
+ (ст. развития эмбрионов кур по Hamburger and Hamilton, 1951), когда она подавляется на правой стороне (Levin et al., 1995). Регуляторный каскад, открытый Levin et al. (1995) , в дальнейшем был подчищен и довершен у эмбрионов кур, чтобы включить несколько промежуточных сигнальных факторов и внутриклеточных белков, которые связывают активацию activin-родственного сигнала на правой стороне Гензеновского узелка с локальной репрессией экспрессии
Shh (rev. Raya and Izpisua Belmonte, 2004b). Большинство компонентов этого каскада обнаруживает четкий сторона-специфический паттерн экспрессии у эмбрионов кур (Table 1), который не выявляется в эмбрионов др. видов. Это один из главных аргументов в пользу дивергенции механизмов спецификации LR оси среди эмбрионов позвоночных
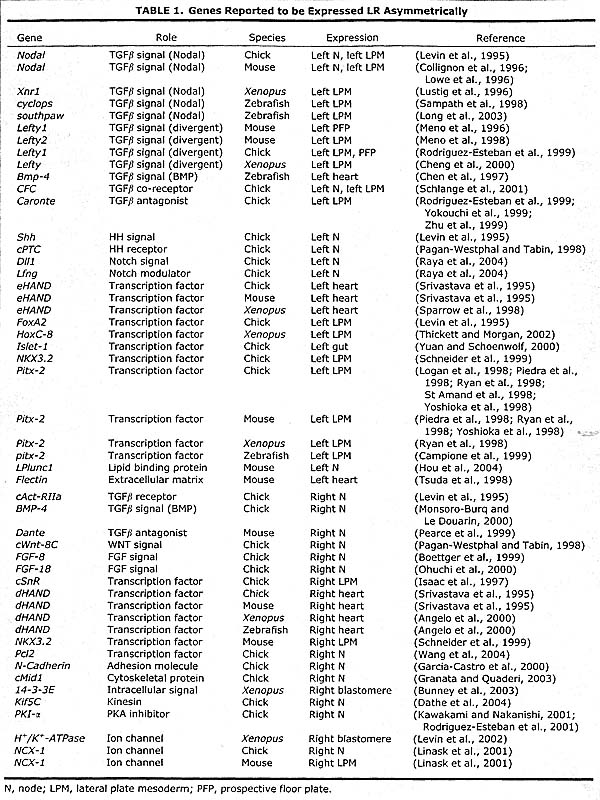
Однако мало доказательств, подчеркивающих эволюционную консервацию механизмов стоящих выше этого регуляторного каскада. Опять же ориентир, описанный Levin et al (2002), идентифицирует очень ранний механизм, который контролирует асимметрию экспрессии
Shh в узелке. В этом случае авторы выявляют LR различия в voltage potential мембран эмбрионов кур, левая сторона узелка оказывается боле деполяризованной, чем правая до ( и выше) установления асимметричной экспрессии
Shh expression (Levin et al., 2002). Механизм, ответственный за такую LR асимметрию в мембранном потенциале кур, и приписывают LR различиям в активности ионного насоса H
+/K
+-ATPase. Важно, что локализация транскриптов, кодирующих этот ионный насос, была обнаружена асимметричной у эмбрионов
Xenopus уже начиная с двухклеточной стадии (Levin et al., 2002), указывая тем самым, что генерация различий в мембранном потенциале между левой и правой сторонами эмбрионов, по-видимому, является критическим признаком в трансляции инициального события нарушения симметрии у эмбрионов кур и законсервирована также у
Xenopus. Более того, фармакологическое ингибирование активности H
+/K
+-ATPase у эмбрионов рыбок данио ведет к изменению формирования LR паттерна (Kawakaml et aL, 2005), указывая на более широкую эволюционную консервацию этого механизма. В целом эти результаты указывают на то, что контроль одной из характеристик узелка, предположенный выше (о латеризации активности HH) достигается у эмбрионов кур путем негативной регуляции экспрессии Shh на правой стороне узелка посредством молекулярного каскада, который зависит от LR различий в мембранном потенциале. Т.к. конечные результаты блокирования активности H
+/K
+-ATPase у эмбрионов
Xenopus и рыбок данио сходны с таковыми у эмбрионов кур (потеря направленной LR асимметрии), то мы полагаем, что асимметрия по мембранному потенциалу контролирует также латеризацию активности HH у этих видов, хотя на уровене, отличном от транскрипционной регуляции Shh.
Относительно др. признака узелка (установления домена перинодальной экспрессии Nodal), недавние доказательства также указывают на то, что он регулируется за счет эволюционно законсервированного механизма. Перинодальная экспрессия Nodal у мышей зависит от node-specific enhancer (NDE), картируемого в 0.8- kb (Adachi et al." l999) или 2.7-kb (Norris and Robertson, 1999} элементах на 9.1 kb выше гена Nodal и в дальнейшем приписанного 0.35-kb фрагменту (Brennan et at, 2002). Недавний анализ этого элемента показал существование двух функциональных сайтов связывания для CSL DNA-binding protein (CBF1/RBPjk у позвоночных, Su(H) у Drosophila, Lag-1 у C. elegans), транскрипционного медиатора передачи сигналов Notch (Krebs et aL, 2003; Raya et al., 2003). Более того, эмбрионы мышей, мутантные по компонентам Notch пути, таким как , such as Dll1 (Krebs et al., 2003; Raya et al., 2003), RBPjk (Raya et al., 2003), или Notch1 и Notch2 (Krebs et al., 2003), обнаруживают дефекты формирования LR паттерна, согласующиеся с потерей направленной LR асимметрии. Важно, что Nodal не способен экспрессироваться в перинодальной области (а значит и в LPM) у этих мутантных эмбрионов, что подтверждает мнение, что экспрессия Nodal вокруг узелка необходима для установления левостороннего домена Nodal в LPM (Brennan et al., 2002; Saijoh et at, 2003). Доказательства, демонстрирующие эволюционную консервацию роли передачи сигналов Notch в установлении LR асимметрии, получены на эмбрионах рыбок данио (Raya et al., 2003) и кур (Raya et al., 2004). Эти результаты показывают, что регуляция перинодальной экспрессии Nodal, которая была нами предположена в качестве характеристики узелка как интегратора LR информации, достигается за счет законсервированного механизма, имеющего отношение е активности Notch.
Наша группа сегодня использует комбинацию математического моделирования и экспериментальные подходы, чтобы исследовать природу этого механизма (Raya etal., 2004). Кстати, нами была проанализирована динамика генной экспрессии и взаимодействия среди компонентов сигнального пути Notch во время стадий, которые предшествуют перинодальной экспрессии
Nodal у эмбрионов кур, и была сформулирована математическая модель, учитывающая результаты такого анализа. Модель предсказывает, что экспрессия
Nodal может быть индуцирована раньше и более строго на одной из сторон узелка путем симуляции небольших изменений в скорости связывания Notch и его лигандов, Dll1 или Serrate1. Экспериментальные доказательства этого предположения были получены в результате наблюдения, что скорость связывания комплексов Notch-Dll1 и Notch-Serrate1 зависит от внеклеточной концентрации Ca
2+, и что повышенные уровни внеклеточного Ca
2+ временны, но постоянно наблюдаются на левой стороне Гензеновского узелка. Важно, что обычная асимметрия в уровнях внеклеточного Ca
2+ попрек узелка, а, следовательно, LR асимметричная активация передачи сигналов Notch, как было показано, зависит от активности K
+/ H
+-ATPase (Fig. 4), но не от активности HH (Raya et al., 2004). Т.о., очевидно, что общераспространенная эпигенетическая асимметрия мембранного voltage потенциала обеспечивает laterality информацию для узелка за счет двух параллельных и независимых механизмов, которые регулируют как характеристики узелка, перинодальную экспрессию
Nodal , так и уровень активности HH , по крайней мере. у эмбрионов кур.
A General Model for Vertebrate Left-Right Axis Specification
Мы предлагаем генеральную модель установления LR асимметрии у эмбрионов позвоночных. Раннее и неизвестное событие нарушения симметрии предоставляет информацию laterality узелку, который в свою очередь трансформируется и передает эту информацию в виде двойной характеристики: перинодального домена экспрессии Nodal и определенного уровня активности HH. Специфические уровни обоих показателей на левой стороне узелка предопределяют выше порога сигнал TGF-β , который затем передаётся соседней левой LPM...(fig. 5). События, стоящие ниже этой точки, здесь не обсуждаются, т.к. их эволюционная консервация рассмотрена в др. месте. Вкратце, как только инициируется экспрессия Nodal is в левой LPM, соседней с узелком, то аутокаталитическая петля, которая использует др. TGF-β лиганды и ко-рецепторы (rev. Raya and Izpisua Betmonte, 2004a) гарантирует её широкое распространение вдоль левой LPM, где она активирует "leftness" генетическую программу и репрессирует эквивалентную программу на правой LPM (rev. Gapdevila et al., 2000; Mercola and Levin, 2001; Hamada et al., 2002; Bisgrove et aL, 2003). В предыдущих разделах мы мы подчеркивали главные элементы этой модели, исходя из доказательств, предоставленных разнообразными экспериментальными и теоретическими подходами на эмбрионах разных позвоночных. Здесь мы обсуждаем, как эта общая модель приложима к специфическим эмбрионам и какие предсказания и специфические экспериментальные предположения могут быть сделаны на её основе.
У эмбрионов кур самым ранним признаком асимметрии является LR градиент мембранного потенциала, обеспечиваемый за счет различий в активности H
+K
+-ATPase (Levin et aL, 2002), В нашей модели эта асимметрия д. быть частью каскада эпигенетической информации, которая передает информацию laterality, генерируемую за счет всё ещё не идентифицированного события нарушения симметрии в узелке. Этот каскад ветвится, чтобы
Figure 4. Early left-right asymmetries in the levels of extracellular Ca2+. (A-D), Epigenetic asymmetries are evident in the early chick embryo, such as the distribution of extracellular Ca2 + , which is incremented in the left side of Hensen's node relative to the right side from HH4-6. Extracellular Ca2 + levels are visualized in live chick embryos by two-photon excitation microscopy using the cell-impermeant indicator Calcium Green-5N, and are overtly asymmetric between HH4-6 (A-C) becoming bilaterally symmetrical at HH8 (D). (E-H), Inhibition of H+/K+-ATPase activity by incubation with omeprazole (F, H) abolishes the asymmetric distribution of extracellular Ca2+ at either HH5 (F) or HH6 (H). Incubation with DMSO does not alter the normal asymmetric distribution of extracellular Ca2+ at either stage (E), (G). All embryo views are ventral, anterior to the top. The gray levels scale representing fluorescence intensities was replaced with a purple to white scale for easier visualization. The line scans at the bottom of the images are traced through Hensen's node to quantify differences in fluorescence within the same embryo. Arrows point to local accumulations of extracellular Ca2+ around Hensen's node, whose position is marked by ovals. Modified figure reproduced with permission from Raya et al. (2004).
генерировать асимметрию в уровнях внеклеточного Ca
2+ (эпигенетическая информация) и (с помощью ещё не идентифицированного механизма) индуцировать activin-подобный сигнал на правой стороне узелка. Асимметрия в уровнях внеклеточного Ca
2+ затем прямо транслируется с помощью активности Notch в четкий домен асимметричной экспрессии
Nodal вокруг Гензеновского узелка, левая сторона, экспрессирующая
Nodal раньше и более интенсивно. Генетический каскад, инициируемый с помощью передачи activin-подобного сигнала в конечном счете приводит к исключению
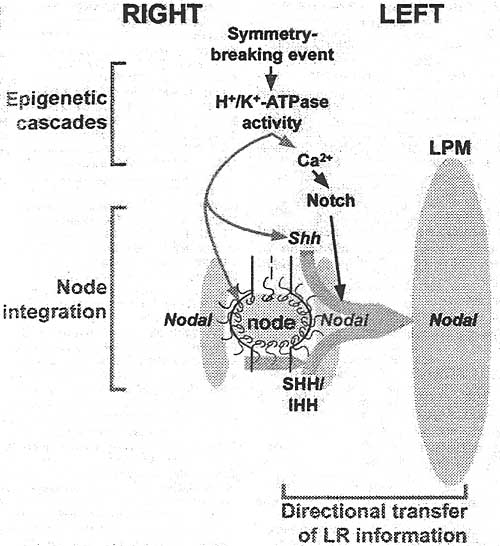 Figure 5. A general model for vertebrate LR axis specification. An early unknown sym-metry-breaking event generates laterality information, which t$ transferred to the node with epigenetic cascades. Known epigenetic mechanisms that form part of such cascades include the LR differences in membrane voltage potential originated by differences, in H+-K+-AtPase activity and downstream asymmetry in extracellular Ca2+ levels. Other epigenetic mecnanisms are likely to exist, but their identity, and the nature of their relationships with known epigenetic and genetic steps remain to be uncovered. In our model, the node plays the role of integrating epigenetic LR information. Some of this information is directly transduced by the Notch signaling pathway to generate a perinodal expression of Nodal. This is one of the two key: roles of the node as an integrator of LR information in our model, which we refer to as a node readout (shown in blue type). The second readout of the node in. our model is the lateralization of HH activity. This is accomplished in the chick embryo by restricting Shh expression to the left side of the node. In the mouse, we proposed that the nodal flow generated by the cilia (green arrow) amplifies pre-existing LR information and piay a conserved role accumulating HH-like ligands (SHH, IHH, or both) on the left side of the node; the specific levels of both readouts on the left side of the node determine an above-threshold TGF-β signal, which is then transferred to the adjacent left LPM to induce Nodal expression. Throughout the diagram, direct and indirect relationships are indicated with back and gray arrows, respectively.
Figure 5. A general model for vertebrate LR axis specification. An early unknown sym-metry-breaking event generates laterality information, which t$ transferred to the node with epigenetic cascades. Known epigenetic mechanisms that form part of such cascades include the LR differences in membrane voltage potential originated by differences, in H+-K+-AtPase activity and downstream asymmetry in extracellular Ca2+ levels. Other epigenetic mecnanisms are likely to exist, but their identity, and the nature of their relationships with known epigenetic and genetic steps remain to be uncovered. In our model, the node plays the role of integrating epigenetic LR information. Some of this information is directly transduced by the Notch signaling pathway to generate a perinodal expression of Nodal. This is one of the two key: roles of the node as an integrator of LR information in our model, which we refer to as a node readout (shown in blue type). The second readout of the node in. our model is the lateralization of HH activity. This is accomplished in the chick embryo by restricting Shh expression to the left side of the node. In the mouse, we proposed that the nodal flow generated by the cilia (green arrow) amplifies pre-existing LR information and piay a conserved role accumulating HH-like ligands (SHH, IHH, or both) on the left side of the node; the specific levels of both readouts on the left side of the node determine an above-threshold TGF-β signal, which is then transferred to the adjacent left LPM to induce Nodal expression. Throughout the diagram, direct and indirect relationships are indicated with back and gray arrows, respectively.
экспрессии
Shh на правой стороне узелка, а следовательно, вызывает латерализацию активности HH на его левой стороне. Т.о., конечным результатом этого механизма у эмбрионов кур является комбинация повышенной активности HH и более строгая (и более ранняя) экспрессия
Nodal в левой перинодальной области, обнаруживая сильную склонность к переносу экспрессии
Nodal левую LPM.
У эмбрионов мышей, мы полагаем. что ещё не идентифицированное событие нарушения симметрии происходит очень рано в развитии и тем же самым способом, что у др. эмбрионов позвоночных. Это предположение базируется на принципах эволюционной консервации скорее, чем на экспериментальных данных. Т.о., случай, похожий на таковой у эмбрионов Xenopus, у которых такое событие определенно имеет место (хотя его также предстоит ещё идентифицировать у этого вида), и существует LR асимметрия уже с двухклеточной стадии, но не может быть найдена экспериментально снова вплоть до более позднего периода, не столь уж невероятно, что такие различия существуют также у эмбрионов мышей, но еще не выявлены. Однако эти различия не проявляются в столь значительном объеме у эмбрионов мышей, две характеристики узелка лишь едва, если вообще, латерализуются по сравнению с эмбрионами кур. Наша модель не связана с эволюционной консервацией "amount" LR информации, переносимой на каждой данной ступени, а скорее с консервацией механизмов, лежащих в основе такого переноса. Т.о.. узелок мышей получает вышестоящую информацию, важную для генерации LR-biased характеристик, точно также как это делает узелок кур. Это мнение может делать вызов основной гипотезе нодального тока и до некоторой степени делает это. первый аргумент является концептуальным. Независимо от того, могут ли нодальные реснички создавать направленный ток жидкости, который воспринимается (chemo- или mechano-sensed не важно для аргумента) на левой стороне узелка, мы подчеркиваем. что такой механизм недостаточен для индукции экспрессии Nodal в левой LRM. Чтобы это осуществить нодальный ток д. регулировать обе характеристики узелка, перинодальную экспрессию Nodal и уровень активности HH, которые как мы полагаем, независимо интегрируются в узелке. В самом деле экспериментальные доказательства демонстрируют, что перинодальная экспрессия Nodal у эмбрионов мышей регулируется с помощью активности Notch, независимо от функции ресничек (Krebs et af" 2003; Raya et aU 2003), Хотя на первый взгляд это может показаться несущественной точкой, это важно, т.к. это подчеркивает значение эволюционно законсервированных механизмов для спецификации LR оси у позвоночных. в
Второй аргумент гипотезы в том, что если механизмы, используемые эмбрионами любого данного вида для передачи laterality, законсервированы у др. позвоночных, то скорее всего, их функция также будет законсервирован. Т.о., мы полагаем, что небольшие LR асимметрии существуют выше узелка мышей, которые транслируются с помощью консервативных механизмов (включая. связанные с Notch активностью) в слегка асимметричный домен экспрессии Nodal вокруг узелка. Асимметрия в этом домене, однако может быть экспериментально отделена от таковой для экспрессии Nodal в LPM (Lowe et al., 1996), и, следовательно, др. механизм д. обеспечивать направленность переноса экспрессии Nodal. Согласно нашей модели такой механизм д. будет действовать на латеральность второй характеристики узелка, т.е. активности HH. Это предположение согласуется с тем фактом, что активность HH необходима эмбрионам мышей для генерации лево-сторонней экспрессии Nodal в LPM, но не для его экспрессии вокруг узелка (Zhang et al., 2001). В отличие от случая с эмбрионами кур, однако , не найдено HH-родственных лигандов, ассиметрично экспрессирующихся вокруг узелка мыши. Наиболее вероятный сценарий, который согласуется с нашей моделью , тот, что латерализация активности HH достигается в узелке мыши за счет механизма типа нодального тока морфогена, морфоген д. быть HH-родственным лигандом: SHH, Indian Hedgehog (IHH),или скорее всего комбинацией обоих. Это предсказание легко может быть проверено экспериментально путем визуализации латерализации репортеров активности HH или SHH/IHH белка внутри узелка мыши. Т.о., мы полагаем путём предположения, что роль тока, обеспечиваемого нодальными ресничками у эмбрионов мышей заключается в умножении уже существующей асимметрии, так чтобы сделать laterality характеристикой узелка. Наша модель также предсказывает, что информация о предсуществующей латеральности скорее всего оказывает влияние на сами нодальные реснички, т.к. детерминация их наклона или компонента не-плоскостного движения предсказывается теоретическим моделированием. Финальным предсказанием, которое может быть извлечено из нашей модели может быть то, что у эмбрионов др. позвоночных ни перинодальная экспрессия Nodal, ни hh-родственных лигандов могут быть четко не латерализованы, как в случае Xenopus и рыбок данио, интегративная роль узелка поэтому нужна в качестве механизма амплификации, похожего на нодальный ток, генерируемый с помощью ресничек у эмбрионов мышей.
Инновационными аспектами нашей модели являются, с концептуальной точки зрения, мнение о узелке как интеграторе информации о вышестоящей латеральности , а в практической перспективе, как упрощение роли узелка по генерации двух характеристик узелка, одной легко измеряемой (перинодальной экспрессии Nodal), и др. легко выводимой (HH активности).
Сайт создан в системе
uCoz
 Figure 5. A general model for vertebrate LR axis specification. An early unknown sym-metry-breaking event generates laterality information, which t$ transferred to the node with epigenetic cascades. Known epigenetic mechanisms that form part of such cascades include the LR differences in membrane voltage potential originated by differences, in H+-K+-AtPase activity and downstream asymmetry in extracellular Ca2+ levels. Other epigenetic mecnanisms are likely to exist, but their identity, and the nature of their relationships with known epigenetic and genetic steps remain to be uncovered. In our model, the node plays the role of integrating epigenetic LR information. Some of this information is directly transduced by the Notch signaling pathway to generate a perinodal expression of Nodal. This is one of the two key: roles of the node as an integrator of LR information in our model, which we refer to as a node readout (shown in blue type). The second readout of the node in. our model is the lateralization of HH activity. This is accomplished in the chick embryo by restricting Shh expression to the left side of the node. In the mouse, we proposed that the nodal flow generated by the cilia (green arrow) amplifies pre-existing LR information and piay a conserved role accumulating HH-like ligands (SHH, IHH, or both) on the left side of the node; the specific levels of both readouts on the left side of the node determine an above-threshold TGF-β signal, which is then transferred to the adjacent left LPM to induce Nodal expression. Throughout the diagram, direct and indirect relationships are indicated with back and gray arrows, respectively.
Figure 5. A general model for vertebrate LR axis specification. An early unknown sym-metry-breaking event generates laterality information, which t$ transferred to the node with epigenetic cascades. Known epigenetic mechanisms that form part of such cascades include the LR differences in membrane voltage potential originated by differences, in H+-K+-AtPase activity and downstream asymmetry in extracellular Ca2+ levels. Other epigenetic mecnanisms are likely to exist, but their identity, and the nature of their relationships with known epigenetic and genetic steps remain to be uncovered. In our model, the node plays the role of integrating epigenetic LR information. Some of this information is directly transduced by the Notch signaling pathway to generate a perinodal expression of Nodal. This is one of the two key: roles of the node as an integrator of LR information in our model, which we refer to as a node readout (shown in blue type). The second readout of the node in. our model is the lateralization of HH activity. This is accomplished in the chick embryo by restricting Shh expression to the left side of the node. In the mouse, we proposed that the nodal flow generated by the cilia (green arrow) amplifies pre-existing LR information and piay a conserved role accumulating HH-like ligands (SHH, IHH, or both) on the left side of the node; the specific levels of both readouts on the left side of the node determine an above-threshold TGF-β signal, which is then transferred to the adjacent left LPM to induce Nodal expression. Throughout the diagram, direct and indirect relationships are indicated with back and gray arrows, respectively.