В спинном мозге, sonic hedgehog (SHH) и RA необходимы для установления вентральной судьбы, которая генерирует двигательные нейроны (Sockanathan and Jessell, 1998; Del Corral et al., 2003; Novitch et al., 2003; Molotkova et al., 2005). Транскрипционные факторы, необходимые для дифференцировки двигательных нейронов включают Pax6 (экспрессируется дорсально), Nkx6.1 (экспрессируется вентрально) и Olig2 экспрессируется в области, где перекрываются Pax6 и Nkx6.1 и где развиваются двигательные нейроны (Marquardt and Pfaff, 2001). RA, синтезируемая RALDH2 в соседней соматической мезодерме, путешествует в нейроэктодерму спинного мозга. Мышиные эмбрионы, лишенные этого источника RA неспособны экспрессировать Pax6 и Olig2 в спинном мозге, в то время как экспрессия Nkx6.1 не затрагивается (Molotkova et al., 2005). В отсутствие передачи сигналов RA недифференцированная нейроэктодерма спинного мозга не приобретает клеточных судеб моторных нейронов (Novitch et al., 2003; Molotkova et al., 2005). RA была использована в качестве дифференцирующего агента вместе с SHH, чтобы генерировать двигательные нейроны из мышиных (Wichterle et al., 2002) и человеческих (Li et al., 2005) эмбриональных стволовых клеток, предоставляя мощный источник замещения клеток при болезнях двигательных нейронов и повреждениях спинного мозга.
Сомитогенез является процессом, при котором параксиальная мезодерма туловища последовательно сегментируется вдоль передне-задней оси в билатерально парные эпителиальные структуры, известные как сомиты. Ритмическое образование сомитов имеет отношение к "clock и wavefront" механизму, при котором молекулярный осциллятор зависит от передачи сигналов Notch и Wnt, контролирующих ритмическую экспрессию генов вдоль пресомитной мезодермы (Pourquie, 2003). Движение фронта волны экспрессии гена Fgf8 в первичной полоске регрессирует сзади по мере удлинения оси тела, тем самым генерируется детерминация фронта сомита непосредственно впереди домена экспрессии Fgf8 (Dubrulle et al., 2001). Роль RA в развитии сомитов была предположена, исходя из исследований, показавших, что RA необходима для каудальной экспрессии Cdx1, который необходим собственно для развития осевого скелета (Houle et al., 2003). Передне-заднее положение фронта детерминации также зависит от RA, генерируемой в пресомитной мезодерме, которая репрессирует каудальную экспрессию Fgf8 (Del Corral et al., 2003).
Эксперименты на эмбрионах мышей, кур и рыбок данио демонстрируют, что RALDH2 генерирует RA, необходимую для поддержания билатеральной симметрии левого и правого столбов сомитов (Kawakami et al., 2005; Vermot et al., 2005; Vermot and Pourquie, 2005; Sirbu and Duester, 2006). Потеря передачи сигналов RA ведет к потере лево-правосторонней билатеральной симметрии, так что одна сторона имеет меньше сомитов, чем другая. Пресомитная мезодерма у RA-дефицитных эмбрионов обнаруживает аномальную лево-правовстороннюю асимметричную экспрессию Hes7 и Lfng, которые необходимы для Notch-зависимой осцилляторной функции во время сомитогенеза (Kawakami et al., 2005; Vermot et al., 2005; Vermot and Pourquie, 2005). Т.о., потеря RA делает возможным появление лево-правосторонней асимметрии в пресомитной мезодерме, где она обычно не появляется, но не меняет лево-правостронней асимметрии, обычно наблюдаемой в латеральной пластинке мезодермы.
Экспрессия Fgf8 мРНК в эпибласте (примитивной эктодерме) сдвигается кпереди у RALDH2-дефицитных эмбрионов, так что она вступает в узелковую эктодерму и нейроэктодерму; поэтому было предположено, что избыточная передняя передача сигналов FGF из эктодермы в энтодерму может быть ответственна за дефекты сомитов (Sirbu and Duester, 2006). Эта гипотеза подтверждается двумя наблюдениями. Во-первых, детерминация фронта сомита обычно происходит в пресомитной мезодерме непосредственно кпереди от домена экспрессии
Fgf8 в первичной полоске, а сдвиг кпереди в передаче сигналов FGF приводит к переднему сдвигу в позиции сомита вдоль передне-задней оси (Dubrulle et al., 2001). Во-вторых, т.к. передача сигнала FGF8 в узелок необходима для лево-правосторонней асимметрии в латеральной пластинке мезодермы (напр., петлеобразование сердечной трубки) (Meyers and Martin, 1999), то возможно, что избыточная передача сигналов FGF8 в узелок во время дефицита RA может приводить к лево-правосторонней асимметрии, появляющейся также в пресомитной мезодерме, где она обычно не возникает.
Regulation of Heart Patterning
RA необходима для передне-заднего формирования паттерна сердечной трубки. Потеря синтеза RA ведет к тяжелой редукции в домене предсердий и тракта притока, а тракт оттока и желудочковый домен формирует аномальную полость, которая раздувается скорее медиально, чем подвергается правостороннему петлеобразованию и разделению правого и левого желудочков (Niederreither et al., 2001). У эмбрионов мышей и кур
Raldh2 впервые экспрессируется в пресомитной мезодерме и затем во время ранних стадий сомитогенеза каудо-ростральная волна экспрессии
Raldh2 возникает в латеральной пластинке мезодермы вплоть до местоположения непосредственно позади кардиального полумесяца (Hochgreb et al., 2003). RA, генерируемая с помощью RALDH2, в заднюю сердечную мезодерму и оказывается способной индуцировать экспрессию RA-reporter в сердце мыши на ст. E7.5-E8.5.
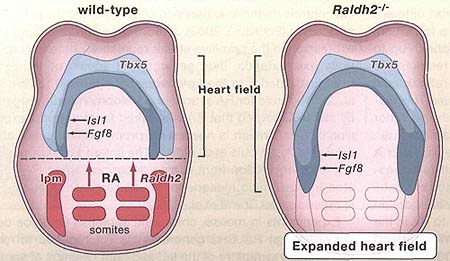 Figure 3. Retinoic Acid Signaling during Early Heart Organogenesis
Retinoic acid (RA) generated by retinaldehyde dehydrogenase 2 (Raldh2) in the somites and lateral plate mesoderm (Ipm) travels anteriorly where it provides a signal that helps establish the posterior border of the heart field. The lateral domain of the heart field expresses Tbx5 whereas the medial domain expresses Isl1 as well as Fgf8, which is required for cardiac Isl1 expression. Embryos from Raldh2 knockout mice exhibit posterior expansion of Fgf8 and Isl1 into lateral plate mesoderm that normally is not part of the heart field. As the Fgf8 promoter has been reported to contain an RA response element, RA may function as a repressor of cardiac Fgf8.
Figure 3. Retinoic Acid Signaling during Early Heart Organogenesis
Retinoic acid (RA) generated by retinaldehyde dehydrogenase 2 (Raldh2) in the somites and lateral plate mesoderm (Ipm) travels anteriorly where it provides a signal that helps establish the posterior border of the heart field. The lateral domain of the heart field expresses Tbx5 whereas the medial domain expresses Isl1 as well as Fgf8, which is required for cardiac Isl1 expression. Embryos from Raldh2 knockout mice exhibit posterior expansion of Fgf8 and Isl1 into lateral plate mesoderm that normally is not part of the heart field. As the Fgf8 promoter has been reported to contain an RA response element, RA may function as a repressor of cardiac Fgf8.
Исследования на рыбках данио показали, что RA ограничивает размер пула кардиальных предшественников (Keegan et al., 2005), а исследования на курах продемонстрировали, что RA ограничивает местоположение вентрикулярных предшественников вдоль передне-задней оси (Hochgreb et al., 2003). Анализ кардиальных генов у эмбрионов мышей, лишенных RALDH2, подтвердил, что эффект RA на раннее развитие сердца не обеспечивается посредством индукции генов мишеней (Niederreither et al., 2001), а скорее репрессией экспрессии Fgf8 в задней области сердца (Ryckebusch et al., 2008; Sirbu et al., 2008).
Во время раннего органогенеза сердечной трубки исследования эмбрионов кур и мышей идентифицировали популяции клеток предшественников в спланхнической латеральной пластинке мезодермы кардиального серпа, который экспрессирует уникальные комбинации транскрипционных факторов, важных для развития сердца (Cai et al., 2003; Buckingham et al., 2005). Напр., Tbx5 экспрессируется более латерально (иногда обозначается как первое поле сердца), в то время как гены, кодирующие транскрипционный фактор Isl1 и фактор роста Fgf8, экспрессируются более медиально (иногда обозначается как второе поле сердца). У мышей потеря передачи сигналов RA ведет к потере экспрессии Tbx5 задней латеральной области кардиального серпа, но не в передней области (Niederreither et al., 2001; Sirbu et al., 2008). Этот эффект на Tbx5 является косвенным, т.к. передача сигналов RA необходима только в задне-медиальном домене, где экспрессируются Fgf8 и Isl1 (но не Tbx5) (Sirbu et al., 2008). Мышиные эмбрионы, лишенные RALDH2, обнаруживают увеличение кардиальной экспрессии Fgf8 и Isl1 сзади (Ryckebusch et al., 2008; Sirbu et al., 2008), так же как и увеличение передачи сигналов FGF8, маркируемое экспрессией Sprouty2 (Sirbu et al., 2008). Исследование эмбрионов со специфичной для сердца потерей Fgf8 показало, что Fgf8 необходим для экспрессии Isl1 в предшественниках спланхнической мезодермы (IIagan et al., 2006; Park et al., 2006). Из-за потребности в передаче сигналов FGF8 для индукции Isl1, подавление с помощью RA Fgf8 может т.о. обычно ограничивать степень распространение кзади Isl1 в кардиальной мезодерме (Figure 3). Напротив, промоторы для Fgf8, контролируемые с помощью уникального retinoic acid response элемента, который делает возможной экспрессию основной изоформы (Fgf8b), когда RAR оказыватся не связанным лигандом, но репрессирует Fgf8b, когда присутствует RA (Brondani et al., 2002). Т.о., RA, по-видимому, функционирует репрессивным скорее, чем индуктивным способом во время раннего кардиального органогенеза.
Forelimb Induction
Введение экзогенной RA изменяет формирование передне-заднего паттерна в зачатках конечностей кур (Tickle et al., 1982) или формирование проксимо-дистального паттерна регенерирующих конечностей аксолотля (Maden, 1982). Позднее было показано, что Shh контролирует формирование передне-заднего паттерна конечностей и что RA-кусочки, имплантированные эктопически, индуцируют Shh (Riddle et al., 1993). Генетические исследования на мышах и рыбках данио демонстрируют, что RA, синтезируемая вблизи зачатков конечностей, контролируется с помощью RALDH2, экспрессируемого фланкирующей мезодермой, расположенной рядом с зачатками конечностей (Niederreither et al., 1999; Mic et al., 2002; Gibert et al., 2006). Дальнейшие исследования на мышах продемонстрировали, что активность RA в ранних зачатках конечностей униформна вдоль передне-задней оси, но снижается от проксимальной к дистальной части (Mic et al., 2004). Было предположено, что противоположные сигналы RA, которые генерируются проксимально на фланге, и Fgf8, которые экспрессируются дистально в апикальном эктодермальном гребне, могут быть важными для контроля закладки проксимо-дистальной оси конечности (Mercader et al., 2000). В то время как получено генетическое подтверждение для Fgf8 как дистального сигнала, отсутствуют генетические доказательства, что проксимальный центр передачи сигналов RA необходим для установления проксимо-дистальной оси конечности (Tabin and Wolpert, 2007). Кроме того, исследования на мышиных эмбрионах, лишенных RA-деградирующего энзима CYP26B1, который у эмбрионов дикого типа экспрессируется в дистальном регионе передних и задних конечностей, показали, что деградация RA необходима для собственно роста зачатков конечностей (Yashiro et al., 2004). Хотя потеря CYP26B1 приводит к аномальной дистальной экспансии передачи сигналов RA в передних и задних конечностях, которая коррелирует с RA-индуцированным тератогенезом конечностей, эти находки не дают доказательств, что нормальный уровень эндогенной передачи сигналов RA необходим для формирования проксимо-дистального паттерна конечностей.
В отсутствие синтеза RA с помощью RALDH2, зачатки передних конечностей не развиваются и эмбриональный рост затухает до стадии, когда инициируются зачатки задних конечностей (Niederreither et al., 2002; Mic et al., 2004); У рыбок данио в отсутствие синтеза RA блокируется индукция зачатков грудных плавников (Gibert et al., 2006). Т.о., RA необходима для индукции развития передних конечностей, но выполняет ли в действительности RA также и более позднюю роль по формированию паттерна конечностей, остается дискуссионным. Восстановление
Raldh2 мутантных эмбрионов с помощью низких доз добавок в пищу матерям RA устраняет летальность и приводит к индукции зачатков конечностей, несмотря на отсутствие обнаружимой активности RA в передних или задних конечностях; в этой модели зачатки передних конечностей меньших размеров, тогда как зачатки задних конечностей выглядят нормально (Niederreither et al., 2002; Mic et al., 2004), указывая тем самым, что RA может не играть роли в индукции формировании паттерна задних конечностей. Дальнейшим подтверждением этого заключения стало то, что
Rdh10 мутантные эмбрионы (лишенные энзима стоящего выше RALDH2 в синтезе RA), которые живут достаточно долго, чтобы обладать маленькими передними конечностями и нормальными задними конечностями, сходными с RA-нормализованными
Raldh2 мутантами (Sandell et al., 2007). Однако, зачатки задних конечностей могут затрагиваться передачей сигналов RA, которая проявляется в мезонефросах, которые экспрессируют
Raldh3 (Mic et al., 2002). Т.о., исследования, проверяющие, могут ли низкие дозы пищевой RA восстанавливать развитие конечностей у эмбрионов, лишенных как RALDH2, так и RALDH3, необходимы, чтобы понять, нуждаются ли задние конечности в RA для индукции или формирования паттерна вдоль или проксимо-дистальной или передне-задней оси.
Восстановление
Raldh2 нулевых мутантных эмбрионов низкими дозами добавляемой в пищу матерям RA обеспечивается меньшей RA, по сравнению с обычно синтезируемой с помощью RALDH2 (Mic et al., 2003), это приводит к состояниям, при которых активность RA отсутствует в передних конечностях, но присутствует по соседству в оси тела, особенно в нейроэктодерме (Niederreither et al., 2002; Mic et al., 2004); нейроэктодерма экспрессирует очень высокие уровни CRABP2 и RARβ и может по преимуществу отвечать на более низкие уровни RA, чем соматическая и конечностей мезодерма. Это наблюдение указывает на то, что хотя передача сигналов RA излишняя в мезодерме передних конечностей для образования зачатков передних конечностей, но RA может действовать в нейроэктодерме, чтобы разрешить индукцию конечностей. Принимая во внимание, что нейроэктодерма не нужна для индукции передних конечностей (Rong et al., 1992), активность RA в нейроэктодерме может вместо этого подавлять экспрессию диффундирующего фактора от оси тела, которая ингибирует индукцию передних конечностей. Три наблюдения подтверждают, что этим фактором, если он существует, д. быть FGF8. (1) RA репрессирует каудальную экспрессию Fgf8 во время вытягивания оси тела (Del Corral et al., 2003; Vermot et al., 2005); (2) эктопическая передача сигналов FGF от кусочков, имплантированных в поля крыльев у эмбрионов кур, нарушает развитие крыльев (Cohn et al., 1995; Mercader et al., 2000); (3) репрессия с помощью RA экспрессии Fgf8 во время удлинения оси тела мышей происходит в месте соединения нейроэктодерма/эпибласт во время сомитных стадий, когда происходит индукция передних конечностей (Sirbu and Duester, 2006). Т.о., вряд ли она играет инструктивную роль в закладке зачатков передних конечностей, недавние находки указывают на то, что RA, генерируемая в сомитах может играть пермиссивную роль в индукции передних конечностей благодаря своему действию в оси тела вблизи поля передних конечностей. На более поздних ступенях, когда происходит формирование паттерна конечностей, сомнительно, что RA выполняет роль.
Organs Derived from Endoderm Pancreas Induction
Многие исследования развития поджелудочной железы сфокусированы на гомеобоксном транскрипционном факторе Pdx1, который необходим для панкреатической спецификации в задней части передней кишки. Pdx1 экспрессируется на высоком уровне в дорсальном и вентральном энтодермальных зачатках, которые дают зрелую поджелудочную железу. Доказательства указывают на то, что RA может быть мезодермальным сигналом, необходимым для инициации экспрессии
Pdx1 (Stafford and Prince, 2002). Эмбрионы рыбок данио, дефицитные по RA лишены экспрессии
Pdx1 и , следовательно, неспособны индуцировать развитие поджелудочной железы. Сходные результаты были получены у эмбрионов мышей (Martin et al., 2005; Molotkov et al., 2005) и лягушек (Chen et al., 2004). Исследование эмбрионов птиц выявило, что сигналы от латеральной пластинки мезодермы могут управлять энтодермальными клетками, чтобы экспрессировать
Pdx1 и тем самым генерировать панкреатическую судьбу (Kumar et al., 2003). Изучение мышиных эмбрионов, несущих RA-репортер трансген, показало, что поджелудочная железа, обычно экспозируемая RA, генерируется в окружающей спланхнической латеральной пластинке мезодермы (Molotkov et al., 2005).
У RALDH2-дефицитных эмбрионов мышей (Molotkov et al., 2005) и у RAR антагонистом-обработанных эмбрионов
Xenopus (Chen et al., 2004), дорсальная энтодермальная панкреатическая ткань специфицируется неправильно. Напротив, вентральная энтодермальная панкреатическая ткань и печень всё ещё специфицируются, демонстрируя, что только дорсальная энтодерма нуждается в активности RA для развития панкреас. Спецификация дорсальной панкреатической ткани может быть восстановлена у RALDH2-дефицитных эмбрионов с помощью материнских низких доз RA, воздействия, которое преимущественно восстанавливает активность RA в дорсальной энтодерме, но не в окружающей дорсальной мезодерме (Molotkov et al., 2005). Это указывает на то. что RA действует непосредственно в дорсальной энтодерме для спецификации поджелудочной железы скорее, чем в латеральной пластинке мезодермы, где RA синтезируется. У рыбок данио исследования по трансплантации показали, что RAR необходимы только в энтодерме для индукции поджелудочной железы и что RA происходит из окружающей мезодермы (Stafford et al., 2006).
Lung Induction-
Легкие также происходят из энтодермы задней части передней кишки и также нуждаются в сигналах RA для органогенеза. RA из спланхнической мезодермы, окружающей энтодерму, как было установлено, важна для стимуляции энтодермы задней части передней кишки по приобретению судьбы легких на E9.5 у мышей (Malpel et al., 2000). RALDH2-дефицитные эмбрионы избавляются от ранней летальности с помощью добавления матерям в пищу RA между E7.5 и E8.5, но неспособны формировать легкие и лишены передачи сигналов RA в передней кишке (Wang et al., 2006). У RA-дефицитных эмбрионов первичные зачатки легких специфицируются, но не экспрессируют индуцируемого с помощью RA гена
Hoxa5 и они неспособны расти и ветвиться из-за потери экспрессии как Fgf10 , так и передачи сигналов FGF10 в легочном эпителии; обработка RA-дефицитных эмбрионов
in vitro FGF10 может восстанавливать формирование зачатков и ветвление легких (Wang et al., 2006). Дальнейшие исследования продемонстрировали, что потеря передачи сигналов RA в передней кишке ведет к активации TGF-β1 and TGF-β генов мишеней, а воздействие на эмбрионов дикого типа экзогенным TGF-β1 мможет воспроизводить дефекты зачатков легких, обнаруживаемые у RA-дефицитных эмбрионов (Chen et al., 2007). Поэтому очевидно, что RA действует во время отпочкования легких как индуктор
Hoxa5 и ингибитор передачи сигналов TGF-β1, это затем делает возможной локальную экспрессию
Fgf10, необходимую для экспансии зачатков легких и их ветвления.
Morphogenetic Movements during Eye Formation
Т.к. все три мышиных Raldh экспрессируются в развивающихся глазах, то интересно бы обсудить детально их паттерны экспрессии и что говорит нокаут этих генов о механизме передачи сигналов RA во время развития глаз. Дефицит витамина А и снижение функции рецепторов RA у RAR нулевых мышей (Lohnes et al., 1994) приводят к неполному закрытию сосудистой щели (ocular coloboma) а также к микрофталмии (small eyes) и к аномалиям роговицы, век и конъюнктивы, наблюдаемых на поздних стадиях плодного развития. Однако благодаря остаточной активности RA эти исследования не смогли установить на каких ст. развития RA необходима для развития глаз.
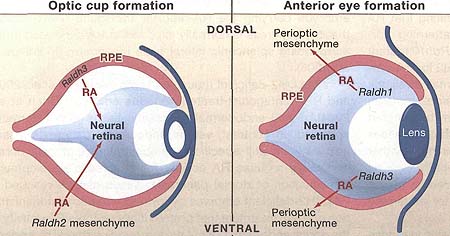 Figure 4. Retinoic Acid Regulates Eye Development
Paracrine retinoic acid (RA) signaling controls two distinct phases of eye morphogenetic movements and involves all three retinaldehyde dehydrogenase (Raldh) genes. During invagination of the optic vesicle to form an optic cup (E9.5-E10.5 in mouse), RA generated by Raldh2 in the perioptic mesenchyme as well as Raldh3 in tissue fated to become the dorsal retinal pigment epithelium (RPE) travels to the neural retina where it is required for ventral invagination during optic cup formation. After optic cup formation (E10.5-birth), Raldh2 is no longer expressed in the perioptic mesenchyme and Raldh3 expression ends in the RPE, but Raldhl and Raldh3 are now expressed in the dorsal and ventral neural retina, respectively. RA generated by Raldhl and Raldh3 is not required for patterning the neural retina, but this RA travels outside the retina where it limits invasion of perioptic mesenchyme during anterior eye development (cornea and eyelid formation).
Figure 4. Retinoic Acid Regulates Eye Development
Paracrine retinoic acid (RA) signaling controls two distinct phases of eye morphogenetic movements and involves all three retinaldehyde dehydrogenase (Raldh) genes. During invagination of the optic vesicle to form an optic cup (E9.5-E10.5 in mouse), RA generated by Raldh2 in the perioptic mesenchyme as well as Raldh3 in tissue fated to become the dorsal retinal pigment epithelium (RPE) travels to the neural retina where it is required for ventral invagination during optic cup formation. After optic cup formation (E10.5-birth), Raldh2 is no longer expressed in the perioptic mesenchyme and Raldh3 expression ends in the RPE, but Raldhl and Raldh3 are now expressed in the dorsal and ventral neural retina, respectively. RA generated by Raldhl and Raldh3 is not required for patterning the neural retina, but this RA travels outside the retina where it limits invasion of perioptic mesenchyme during anterior eye development (cornea and eyelid formation).
Три RALDHs экспрессируются в разных тканях во время развития глаз у мышей и в каждом случае сигнальная активность RA обнаруживалась в соседней ткани и оказывалась необходимой для развития глаз (Molotkov et al., 2006). Инвагинация эпителия оптического пузырька с E9.5-E10.5 ведет к образованию оптического бокала, в котором эпителий образует складку, чтобы сформировать отдельные слои для нейральной сетчатки и пигментного эпителия сетчатки, оба сворачиваются вокруг хрусталикового пузырька, который развивается путем инвагинации поверхностной эктодермы (Figure 4). RALDH2 генерирует RA на ст. E9.0 в периоптической мезенхиме, соседствующей с височной (temporal) стороной оптического пузырька, тогда как RALDH3 генерирует RA в дорсальной части пигментного эпителия сетчатки, начиная с E9.5 непосредственно перед инвагинацией; отсутствие RALDH2 и RALDH3 ведет к неспособности к инвагинации вентральной части оптического бокала (Molotkov et al., 2006). Во время образования оптического бокала вследствие изменения функции Raldh происходит: (1) прекращается экспрессия Raldh2 вблизи оптического бокала на E10.0; (2) прекращается экспрессия Raldh3 в дорсальной части пигментного эпителия сетчатки и инициируется в вентральной части нейральной сетчатки на ст. E10.5; (3) RALDH1 начинает генерировать RA в дорсальной части нейральной сетчатки на ст. E10.5. На ст. E11.5 , когда вентральная часть оптического бокала формирует сосудистую щель (choroid fissure), экспрессия Raldh1 и Raldh3 продолжается в в дорсальной и вентральной частях нейральной сетчатки, соотв. и продолжается даже после закрытия оптической щели на ст. E13.5. Однако, RALDH1 и RALDH3 не генерируют RA для формирования дорсо-вентрального паттерна сетчатки, а вместо этого они обладают полностью перекрывающимися функциями при генерировании RA, которая направляется от сетчатки к периоптической мезенхиме, где она стимулирует апоптоз; отсутствие и RALDH1 и RALDH3 приводит к мезенхимным выростам в роговице и веках (Matt et al., 2005; Molotkov et al., 2006). Pitx2 является потенциальной мишенью для окулярной передачи сигналов RA, т.к. его экспрессия сильно подавляется в периоптической мезенхиме мутантных эмбрионов, лишенных RALDH1 и RALDH3 (Matt et al., 2005).
Эти находки указывают на существование двух самостоятельных фаз передачи сигналов RA, необходимых для развития глаз: на ранней фазе оптического бокала и на поздней фазе при формировании передней части глаз (Figure 4). В обоих случаях клетки, экспрессирующие Raldh гены, продуцируют сигналы RA, которые действуют, чтобы контролировать морфогенетические движения в соседних клетках. Также в обоих случаях оба Raldh гена действуют как источники RA, обеспечивающие функциональное перекрывание. Мишень для действия RA изменяется во время морфогенеза глаз. Первоначальной мишенью является инвагинирующая нейральная сетчатка на ст. оптического пузырька с источником RA, обеспечиваемым экспрессией Raldh2 в мезенхиме, локализуемым временно в оптическом пузырьке и и экспрессией Raldh3 в пигментном эпителии сетчатки. После образования оптического бокала происходит переключение мишени на периоптическую мезенхиму с источником, обеспечиваемым Raldh1, экспрессируемым в дорсальной части сетчатки и Raldh3, экспрессируемым в вентральной части сетчатки. Эти мишени являются отличающимися от, но соседними с местами синтеза RA, тем самым демонстрируется, что RA действует паракринным образом, чтобы контролировать морфогенетические движения соседних клеток.
Development of the Genitourinary Tract
RA контролирует некоторые аспекты развития мочеполового тракта, т.к. Raldh2 экспрессируется в мезенхимных клетках мезонефросов и стромальных клетках развивающихся почек, а Raldh3 экспрессируется в уретрическом зачатке (Batourina et al., 2001; Mic et al., 2002). Посредством анализа RA рецепторов нокаутных мышей, было установлено, что передача сигналов RA играет ключевую роль в контроле эпителиально/мезенхимных взаимодействий во время развития почек посредством индукции экспрессии Ret (Batourina et al., 2001). Кроме того, RA, генерируемая в урогенитальном синусе стимулирует апоптоз в общем нефрическом протоке, необходимом для установления соединений между мочеточниками и мочевым пузырем(Batourina et al., 2005).
RA, как недавно было показано, стимулирует пол-специфическое начало мейоза в зародышевых клетках мышей. Начало мейоза происходит раньше в овариях (E13.5), чем в семенниках (после рождения) (Bowles et al., 2006; Koubova et al., 2006). RA (скорее всего из мезонефросов) индуцирует экспрессию
Stra8 в зародышевых клетках, которая необходима для перехода к мейозу как в овариях, так и тестисах. В семенниках RA-деградирующий энзим CYP26B1 экспрессируется и предупреждает индукцию экспрессии
Stra8. Преждевременное начало мейоза в тестисах происходит у мышей, лишенных CYP26B1 (Bowles et al., 2006) и в органной культуре, обработанной ингибитором CYP26 inhibitor (Koubova et al., 2006).
Paracrine Signaling by Retinoic Acid
Итак, имеется множество примеров паракринной передачи сигналов RA (Table 3). Существование аутокринной передачи сигналов RA не исключено, но необходимы дальнейшие исследования, чтобы понять происходит ли это в действительности. Это сделает более полным понимание
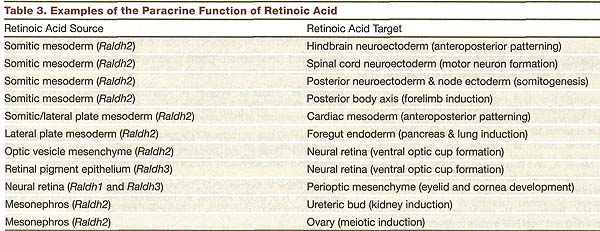
когда и где генерируется у эмбрионов RA , как далеко она может перемещаться от места синтеза, какие ткани являются мишенями, какие затрагиваются онтогенетические процессы и какие гены она регулирует. Это важно для понимания органогенеза у млекопитающих и облегчит разработку стратегий по оптимальному использованию RA с др. реагентами, чтобы в действительности дифференцировать стволовые клетки в специфические типы клеток, которые могут быть использованы для разработки клеточной терапии болезней.
Сайт создан в системе
uCoz Figure 1. Retinoic Acid Synthesis and Signaling
Depicted is the paracrine mechanism of retinoic acid (RA) signaling. Retinol is carried in the serum by retinol-binding protein (RBP4) secreted from the liver. Retinol enters cells via a specific receptor STRA6, and cellular retinol-binding protein (CRBP) facilitates conversion of retinol to retinyl esters for storage. In an RA-generating tissue, retinol is oxidized to retinaldehyde by either alcohol dehydrogenase (ADH) or retinol dehydrogenase (RDH), and retinaldehyde is oxidized to RA by retinaldehyde dehydrogenase (RALDH). RA is then released and taken up by surrounding cells. Cells that express cytochrome P450 (CYP26) initiate the further oxidation of RA for degradation and excretion and are not RA target cells. Some RA target cells express cellular RA-binding protein (CRABP) that facilitates uptake of RA and transport to the nucleus where RA binds the RA receptor (RAR). The ternary complex of ligand-bound RAR with RXR and a retinoic acid response element (RARE) regulates transcription of RA target genes by altering the binding of corepressors and coactivators.
Figure 1. Retinoic Acid Synthesis and Signaling
Depicted is the paracrine mechanism of retinoic acid (RA) signaling. Retinol is carried in the serum by retinol-binding protein (RBP4) secreted from the liver. Retinol enters cells via a specific receptor STRA6, and cellular retinol-binding protein (CRBP) facilitates conversion of retinol to retinyl esters for storage. In an RA-generating tissue, retinol is oxidized to retinaldehyde by either alcohol dehydrogenase (ADH) or retinol dehydrogenase (RDH), and retinaldehyde is oxidized to RA by retinaldehyde dehydrogenase (RALDH). RA is then released and taken up by surrounding cells. Cells that express cytochrome P450 (CYP26) initiate the further oxidation of RA for degradation and excretion and are not RA target cells. Some RA target cells express cellular RA-binding protein (CRABP) that facilitates uptake of RA and transport to the nucleus where RA binds the RA receptor (RAR). The ternary complex of ligand-bound RAR with RXR and a retinoic acid response element (RARE) regulates transcription of RA target genes by altering the binding of corepressors and coactivators. 
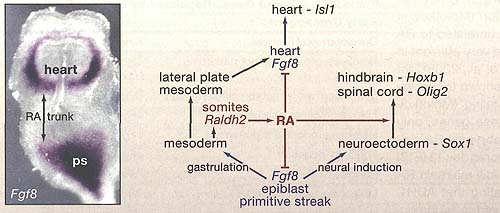 Figure 2. Retinoic Acid Organizes the Trunk by Repressing Fgf8
Shown on the left is an E8.0 mouse embryo stained for fibroblast growth factor 8 (Fgf8) mRNA by in situ hybridization. At this stage Fgf8 mRNA is expressed in an anterior cardiac domain where it induces Isll, plus a posterior domain encompassing the epiblast and primitive streak (ps) where FGF8 is needed during gastrulation and neural induction; retinaldehyde dehydrogenase 2 (Raldh2) is expressed in between these two domains in the somitic mesoderm where the future trunk will form. The diagram depicts the function of retinoic acid (RA) as a repressor of both Fgf8 domains and as an inducer of neural posterior-ization in the trunk to allow hindbrain and spinal cord differentiation.
Figure 2. Retinoic Acid Organizes the Trunk by Repressing Fgf8
Shown on the left is an E8.0 mouse embryo stained for fibroblast growth factor 8 (Fgf8) mRNA by in situ hybridization. At this stage Fgf8 mRNA is expressed in an anterior cardiac domain where it induces Isll, plus a posterior domain encompassing the epiblast and primitive streak (ps) where FGF8 is needed during gastrulation and neural induction; retinaldehyde dehydrogenase 2 (Raldh2) is expressed in between these two domains in the somitic mesoderm where the future trunk will form. The diagram depicts the function of retinoic acid (RA) as a repressor of both Fgf8 domains and as an inducer of neural posterior-ization in the trunk to allow hindbrain and spinal cord differentiation.  Figure 3. Retinoic Acid Signaling during Early Heart Organogenesis
Retinoic acid (RA) generated by retinaldehyde dehydrogenase 2 (Raldh2) in the somites and lateral plate mesoderm (Ipm) travels anteriorly where it provides a signal that helps establish the posterior border of the heart field. The lateral domain of the heart field expresses Tbx5 whereas the medial domain expresses Isl1 as well as Fgf8, which is required for cardiac Isl1 expression. Embryos from Raldh2 knockout mice exhibit posterior expansion of Fgf8 and Isl1 into lateral plate mesoderm that normally is not part of the heart field. As the Fgf8 promoter has been reported to contain an RA response element, RA may function as a repressor of cardiac Fgf8.
Figure 3. Retinoic Acid Signaling during Early Heart Organogenesis
Retinoic acid (RA) generated by retinaldehyde dehydrogenase 2 (Raldh2) in the somites and lateral plate mesoderm (Ipm) travels anteriorly where it provides a signal that helps establish the posterior border of the heart field. The lateral domain of the heart field expresses Tbx5 whereas the medial domain expresses Isl1 as well as Fgf8, which is required for cardiac Isl1 expression. Embryos from Raldh2 knockout mice exhibit posterior expansion of Fgf8 and Isl1 into lateral plate mesoderm that normally is not part of the heart field. As the Fgf8 promoter has been reported to contain an RA response element, RA may function as a repressor of cardiac Fgf8.  Figure 4. Retinoic Acid Regulates Eye Development
Paracrine retinoic acid (RA) signaling controls two distinct phases of eye morphogenetic movements and involves all three retinaldehyde dehydrogenase (Raldh) genes. During invagination of the optic vesicle to form an optic cup (E9.5-E10.5 in mouse), RA generated by Raldh2 in the perioptic mesenchyme as well as Raldh3 in tissue fated to become the dorsal retinal pigment epithelium (RPE) travels to the neural retina where it is required for ventral invagination during optic cup formation. After optic cup formation (E10.5-birth), Raldh2 is no longer expressed in the perioptic mesenchyme and Raldh3 expression ends in the RPE, but Raldhl and Raldh3 are now expressed in the dorsal and ventral neural retina, respectively. RA generated by Raldhl and Raldh3 is not required for patterning the neural retina, but this RA travels outside the retina where it limits invasion of perioptic mesenchyme during anterior eye development (cornea and eyelid formation).
Figure 4. Retinoic Acid Regulates Eye Development
Paracrine retinoic acid (RA) signaling controls two distinct phases of eye morphogenetic movements and involves all three retinaldehyde dehydrogenase (Raldh) genes. During invagination of the optic vesicle to form an optic cup (E9.5-E10.5 in mouse), RA generated by Raldh2 in the perioptic mesenchyme as well as Raldh3 in tissue fated to become the dorsal retinal pigment epithelium (RPE) travels to the neural retina where it is required for ventral invagination during optic cup formation. After optic cup formation (E10.5-birth), Raldh2 is no longer expressed in the perioptic mesenchyme and Raldh3 expression ends in the RPE, but Raldhl and Raldh3 are now expressed in the dorsal and ventral neural retina, respectively. RA generated by Raldhl and Raldh3 is not required for patterning the neural retina, but this RA travels outside the retina where it limits invasion of perioptic mesenchyme during anterior eye development (cornea and eyelid formation). 