Морфогенез с разветвлением является процессом, при котором клетка или группа клеток увеличивают область своей поверхности путем образования клеточных или тканевых расширений во время развития. Это один из наиболее распространенных процессов при возникновении систем органов, когда многоклеточные начинали эксплуатировать и адаптироваться к ранее незанятым нишам в природе. Органы различных беспозвоночных и позвоночных (напр., трахеи у мух и у млекопитающих слюнные железы, легкие, почки и молочные железы) (Fig. 1) подвергаются морфогенезу ветвления как существенной части их онтогенеза (1-3). Ветвление может происходить в одиночной клетке, такой как нейрон, т.к. он формирует короткие веточки или дендриты, чтобы общаться с мириадами др. нейронов, и длинные веточки или аксоны, чтобы транслировать нервные импульсы на расстояние. Напротив, ветвление м. происходить с группой клеток в сосудистой системе, когда формируется сеть кровеносных сосудов, чтобы снабжать кислородом и питательными веществами и удалять метаболические отходы. Исторически механизмы ветвления и наведения нервов и кровеносных сосудов изучены наиболее хорошо. Благодаря их структурной простоте и генетической доступности система трахей у дрозофилы и воздушных мешков предоставляют информацию, как происходит эпителиальное ветвление в более сложных системах органов позвоночных (1, 4). Недавние технические успехи, включая современную генетику мышей, картирование клеточных судеб, мозаичный анализ, наблюдение за живыми органными культурами, улучшили наше понимание механизмов ветвления у позвоночных. Одним из сюрпризов этих исследований
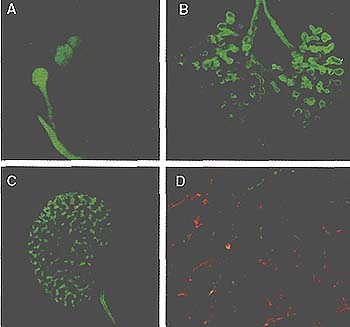 Fig. 1. Branching morphogenesis in mouse organs. (A to C) Immu-nofluorescent staining of E-cadherin in the branching epithelium of whole-mount salivary gland (A), lung (B) and kidney (C) from embryos at E13.5 to E15. (D) Branches of mammary epithelium derived from progenitors that were marked by expression of green and red fluorescent proteins as described previously (32).
Fig. 1. Branching morphogenesis in mouse organs. (A to C) Immu-nofluorescent staining of E-cadherin in the branching epithelium of whole-mount salivary gland (A), lung (B) and kidney (C) from embryos at E13.5 to E15. (D) Branches of mammary epithelium derived from progenitors that were marked by expression of green and red fluorescent proteins as described previously (32).
стало осуществление того, что молекулы, существенные для ветвления нейронов, также играют важную роль в ветвлении органов и сосудистой сети беспозвоночных и позвоночных (3). Здесь мы рассмотрим современное состояние клеточных и молекулярных механизмов морфогенеза ветвления. Сравнение событий, лежащих в основе ветвления разных типов клеток предоставляет информацию как о наличии общих тем, так и орган-специфических механизмов, которые делают каждый из этих типов клеток и типов тканей уникальным.
Mechanisms of Branching Morphogenesis
Разные клетки и ткани формируют веточки с характерным паттерном ветвления, определяемым длиной, диаметром, формой и пространственным расположением. Кроме того имеются общие моменты в том как генерируются и поддерживаются веточки. Очевидно, что существует "двигатель" ветвления, специализированная структура, состоящая или из одиночной клетки, части клетки, или группы клеток, на ведущем фронте ветвящегося кончика. Этот движок ветвления д. быть способен отвечать на индуктивный сигнал, который инициирует, направляет и поддерживает образование веточек. Индуктивный сигнал может быть предметом локальной и глобальной регуляции, чтобы обеспечить клеточно- и орган-специфичный паттерны ветвления во время процессов развития и ремоделирования.
Structure of the branching engine. Более ста лет тому назад, Ramon y Cajal описал ростовой конус, высоко специализированную структуру на кончике аксонов нейронов кур (3). Путем образования богатых актином пальце-подобных выпячиваний или филоподий и пластообразных проекций или ламеллоподий, ростовой конус может отвечать на различные сигналы наведения (Fig. 2A). Сходным образом во время ангиогенеза позвоночных миграция эндотелиальных клеток зависит от кончиковых клеток, которые прокладывает курс клеткам ствола, когда они колонизируют лишенную сосудов область эмбриона и формируют сосудистую сеть (Fig. 2B). Сходным образом, в эмбриональной трахее Drosophila кончиковые клетки ведут клетки ствола, когда они инвагинируют из эпителиального мешка и формируют инициальную или первичную веточку (Fig. 2C). Клетки кончика первичной веточки в дальнейшем усовершенствуются за счет клеточных расширений, наз. вторичными и терминальными веточками (5). В позднем личиночном возрасте веточки трахей, ассоциирующие с крыловыми дисками подвергаются дальнейшему морфогенезу и дают торакальные воздушные мешки (1) (Fig. 2D). И снова клетки кончика на мигрирующем фронте выбрасывают филоподии и ламеллопдии и играют важную роль в ведении клеток ствола в стереотипическом направлении (6). У позвоночных эпителиальное ветвление проявляется во всем блеске, являясь относительно простым процессом, использующим повторяющиеся события образования точки ветвления и элонгации протока (называемым также стволом или ножкой). Точки ветвления образуются посредством бифуркации [в редких случаях, trifurcation (6)] кончика (также наз. конечной почкой или ампулой) или отрастания боковой веточки, причем группа клеток отпочковывается от эпителия протока. Как эти два способа образования точек ветвления приводятся в действие, оставаясь орган-специфическими (6, 7) и оказываются генетически запрограммированными. На клеточном уровне ветвление эпителия позвоночных обнаруживает важные различия от др. систем ветвления. В отличие от кончиков веточек в сосудистой сети или трахеях мух, эти эпителии позвоночных содержат гетерогенные и иногда многослойные клеточные популяции, как это имеет место в молочных железах (Fig. 2E) (8). Обширная клеточная пролиферация необходима для ветвления, особенно на кончиках (2, 8).
Inductive signals for branch initiation. Центральным событием в морфогенезе ветвления является определение где инициировать новую веточку. Удивительно, нервы, кровеносные сосуды и эпителий используют лиганды, факторы роста для семейства receptor tyrosine kinase (RTK), в качестве индуктивных сигналов, чтобы сформировать новые веточки. Нейроны. напр., отвечают на RTK лиганд, nerve growth factor (NGF), который секретируется тканью-мишенью, напр., мышцами, лишенными иннервации (3) (Fig. 3). Сходным образом эндотелиальные клетки привлекаются в направлении гипоксичных тканей, которые секретируют RTK лиганд, vascular endothelial growth factor (VEGF) во время ангиогенеза (3).
В эпителии ветвящихся органов как беспозвоночных, так и позвоночных члены семейства fibroblast growth factor (FGF) играют доминирующую роль в инициации ветвления (2). В трахеях и воздушных мешках мух, напр., мезодермальные клетки экспрессируют Branchless (Bnl/Fgf), который вызывает миграцию и инициацию ветвления соседних эпителиальных клеток
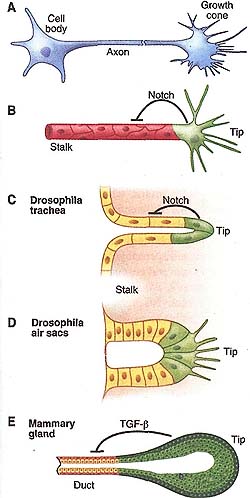 Fig. 2. Anatomy of the branching "engine." A schematic presentation of various branched tissues: neuron (A), vasculature (B), Drosophila trachea (C) and air sacs (D), and mammary gland (E). Note the finger-like projections of the neuronal growth cone (A) and those of tip cells (green) of endothelium during angiogenesis (B) and Drosophila air sacs during larval development (D). To become tip cells, cells inhibit each other to take the leading position. In endothelium (B) and Drosophila trachea (C), mutual inhibition depends on Notch signaling. In the mammary gland, mutual inhibition depends on TGF-fJ signaling (E).
Fig. 2. Anatomy of the branching "engine." A schematic presentation of various branched tissues: neuron (A), vasculature (B), Drosophila trachea (C) and air sacs (D), and mammary gland (E). Note the finger-like projections of the neuronal growth cone (A) and those of tip cells (green) of endothelium during angiogenesis (B) and Drosophila air sacs during larval development (D). To become tip cells, cells inhibit each other to take the leading position. In endothelium (B) and Drosophila trachea (C), mutual inhibition depends on Notch signaling. In the mammary gland, mutual inhibition depends on TGF-fJ signaling (E).
экспрессирующих рецептор Breathless (Btl/Fgfr) (4, 5). В дополнение к его роли в качестве хемоаттрактанта, Bnl/Fgf и его нижестоящие события предопределяют, станут ли клетки кончиковыми клетками или клетками ствола. Хотя все клетки эпителия трахей экспрессируют Btl/Fgfr и отвечают на Bnl/Fgf, они конкурируют за лиганд и клетки с наивысшей активностью передачи сигналов Bnl/Fgf становятся кончиковыми клетками (9). Как только кончиковые клетки предопределены, они становятся единственными клетками первичной веточки, которые зависят от передачи сигналов Bnl/Fgf; остальные клетки ствола следуют за кончиковыми клетками Bnl/Fgf-независимым способом (9). Сходным образом, в воздушных мешках мух и молочных железах, активность передачи сигналов FGF необходима для клеток, чтобы оставаться кончиковыми, но не клетками ствола или протока (1,10).
Основным препятствием пониманию ветвления эпителия у позвоночных является присутствие большого количества RTK лигандов из одного и того же или разных семейств. Эти различные RTK лиганды могут обнаруживать поведение сотрудничества, независимое или даже противодействия в зависимости от из специфических нижестоящих событий во время эпителиального ветвления. В почечном эпителии кусочки, смоченные или FGF (11) или glia-derived neural factor (GDNF) могут индуцировать эктопические веточки (12). К тому же передача сигналов GDNF необходима эпителиальным клеткам для поддержания в кончиках почечного эпителия (12). Эти результаты указывают на то, что пути передачи сигналов FGF и GDNF могут сотрудничать, действуя параллельно или последовательно, чтобы регулировать инициацию веточек и/или их рост в почках. С др. стороны, в воздушных мешках мух, FGF и epidermal growth factor (EGF) действуют независимо. Т.о., пока FGF облегчает миграцию клеток, EGF способствует пролиферации клеток воздушных мешков (1). Наконец, FGF7 и transforming growth factor α (TGF-α), член семейства EGF, противодействуют один др. во время эпителиального ветвления в молочных железах (13).
Local and global regulation of branching patterns. Образование, поддержание и последующий рост новой веточки находится под экстенсивной локальной и глобальной регуляцией. Разные ткани обладают врожденной способностью регулировать количество веточек, которые образуются. В трахеях мух количество браншей регулируется за счет взаимного ингибирования, причем эпителиальные клетки ингибируют др. др., чтобы занять лидирующую позицию, т.к. они конкурируют за факторы. индуцирующие ветвление. Как в трахеях мух, так и васкулатуре, такое взаимное ингибирование зависит от передачи сигналов Notch (1, 9,14) (Fig. 2, B and C).
Взаимное ингибирование происходит также при ветвлении эпителия у позвоночных. Уже давно распознано, что эпителиальные клетки молочных желез обладают свойством self-avoidance. Поэтому новая веточка часто возникает под острым углом и отклоняется или останавливает рост при приближении к др. веточке (15). Кроме того, если экзогенная эпителиальная клетка молочных желез вносится в строму молочной железы, то она может разрастаться и заполнять всю железу за исключением присутствующего эндогенного эпителия, который ингибирует её рост. В самом деле, в молочной железе эпителиальная геометрия предопределяет потенциальные места ветвления благодаря само-ингибированию (16). В этом случае, как полагают, само-ингибирование зависит, по крайней мере, частично от сигнальной активности TGF-β (Fig. 2E). Наконец, др. внешние факторы, включая WNTs, hedgehogs (HHs) и bone morphogenetic proteins (BMPs), супрессируются в мезенхиме и играют важную роль в регуляции инициации разветвлений (2).
Т.к. эмбриональная мезенхима и постнатальная строма гетерогенны, то не сюрприз, что специфические типы клеток участвуют в развитии органа. Напр., в молочных железах макрофаги, эозинофилы и мастоциты играют роль в нормальном ветвлении (17). Остается неясным, однако контролируют ли различные клеточные популяции уникальные аспекты эпителиального ветвления в органах позвоночных, напр., путем секреции одного или более внешних факторов.
Наконец, во многих системах, включая трахеи мух, легкие, крупные нервы и кровеносные сосуды у млекопитающих, паттерны ветвления сильно законсервированы и шаблонны, подтверждая тем самым, что они генетически запрограммированы. В самом деле, у мутантных мышей с обратной лево-правосторонней асимметрией, паттерн ветвления легочного эпителия имеет зеркальную картину по сравнению с нормальными легкими (7). Для др. ветвящихся органов, молочных желез и простаты, где ветвление не стереотипировано, паттерн ветвления всё ещё зависит от влияния глобального физиологического и/или гормонального статуса организма. В молочных железах эпителиальное ветвление регулируется гормоном роста и эстрогеном (17), тогда как в простате оно регулируется андрогеном (18).
Coordination of Branching Morphogenesis of Nerves, Blood Vessels, and the Epithelium
Морфогенез ветвления нервов. кровеносных сосудов и эпителия д. быть интегрирован, как это видно по их выравниванию относительно один др. (3, 7, 19). Но как ветвление в разных тканях координируется во время образования органа? Два эффективных способа, выполняющие эту цель, являются коммуникации между тканями и использование общих генов и путей, регулирующих ветвление.
Коммуникации между разными тканями. Хорошо известно, что эпителиальные ткани привлекают эндотелиальные клетки и аксоны нейронов путем секреции VEGF и NGF, соотв. (Fig. 3). Если Vegf удаляется из легочного эпителия, то васкулатура развивается аномально (3). Сходным образом нарушение функции NGF или его градиента предупреждает нейроны от иннервации своих тканей мишеней (3). Напротив, эндотелиальные клетки важны для спецификации и дифференцировки эпителия в легких, поджелудочной железе и печени (20); т.о., они могут играть роль также в эпителиальном ветвлении. Напр., легочный эндотелий секретирует hepatic growth factor (HGF), который существенен для морфогенеза эпителия дистальных частей легких (3). Кровеносные сосуды и нервы также помогают один др. следовать тому же самому пути. Эндотелиальные клетки продуцируют молекулы такие как artemin и neurotrophin-3 (21) чтобы привлечь аксоны к перемещению вдоль пионерских кровеносных сосудов, скорее всего ранние аксоны наводят более поздние аксоны. Сходным образом нервы могут продуцировать различные формы VEGF и привлекают кровеносные сосуды на свою сторону (Fig. 3).
Common genes and signaling pathways in branching tissues. Нейроны полагаются на небольшой хорошо известный набор молекул для ведения их к своим тканями мишеням. Большинство этих сигналов ведения относится к 4-м семействам Slits, Netrins, Ephrins и Semaphorins, которые могут привлекать или отталкивать аксоны (3). Основной сюрприз заключается в том, что члены всех этих 4-х семейств сигналов ведения аксонов играют роль в ветвлении и ведении васкулатуры и эпителия позвоночных и беспозвоночных. в
Robo4, рецептор для Slits, экспрессируется в сосудистой сети и его активация вызывает отталкивание эндотелиальных клеток in vitro (21). Сходным образом, в трахеях мух Slit и его рецепторы, Robo и Robo2, экспрессируются в мезодерме и соседнем эпителии, соотв. Интересно, что связывание Slit с помощью Robo и Robo2, экспрессирующихся в разных браншах, вызывают противоположные реакции; в то время как Slit привлекает Robo-экспрессирующие эпителиальные клетки, он отталкивает Robo2-экспрессирующие клетки (22). В почках, Slit2 экспрессируется в Вольфовых протоках, от которых индуцируется инициальная ветвь (т.e., уретрический зачаток) почечной эпителиальной сети. Robo2 экспрессируется в мезенхиме скорее, чем непосредственно управляет миграцией клеток как в нервах сосудах, так и трахеях мух, Slit2 регулирует экспрессию Gdnf и ограничивает количество уретрических зачатков, которые образуются. В отсуствие Slit2 или Robo2, домен экспрессии Gdnf расширяется и в результате формируются эктопические уретрические зачатки (12).
Др. сигнал ведения аксонов также функционирует в ветвящихся органах способом, сходным с тем или отличным от него, что в нервах. Подобно Robo4, Netrin рецептор Unc5b экспрессируется в эндотелиальных клетках кончиков. Его потеря у мышей вызывает аберрантное расширение филоподий кончиковых клеток и избыточное ветвление, это указывает на то, что Unc5b обычно репрессирует эндотелиальное ветвление in vivo (3). В соответствии с этими результатами, Netrin 1 вызывает ретракцию филоподий, если добавляется к культивируемым эндотелиальным клеткам (3). Напротив, в эпителии молочных желез Netrin 1 необходим для клеточной адгезии. Т.о., потеря или Netrin 1, который экспрессируется в теле клеток кончика или его рецептора Neol, который экспрессируется в клетках базальной шапочки кончика, двухслойный эпителий кончика не удерживается вместе, в результате кончик рушится (23). Netrins и их рецепторы экспрессируются также в легочном эпителии и могут ограничивать образование боковых веточек (23). Semaphorins передают сигнал посредством мультимерных рецепторных комплексов, в то время как связанные с мембранами semaphorins связывают plexins, секретируемые их формы связывают корецепторы neuropilins. В сосудистой сети, semaphorin-3a (Sema3a) репрессирует ветвление путем ингибирования образования ламмелоподий эндотелиальными клетками, которые экспрессируют различные plexins и neuropilins (21). Сходным образом, в легких и почках Sema3a ингибирует эпителиальное ветвление во время формирования органов (23,24). Однако в слюнных железах Sema3a способствует ветвлению путем регуляции образования расщелины (25). Т.о., точный способ действия Sema3a в органах позвоночных остается неясным.
Ephrins и их Eph рецепторы необычны тем, что соединение лиганд-рецептор ведет к передаче сигналов в двух направлениях: прямой сигнал в клетках, экспрессирующих Eph рецепторы и обратная передача сигнала в клетках, экспрессирующих лиганды. Как и в нервной системе EphrinB2 и его рецептор EphB4 действуют как репелленты в артериях и венах, соотв. и являются существенными для поддержания сосудов путем предупреждения от перемешивания артериальных и венозных эндотелиальных клеток(21).
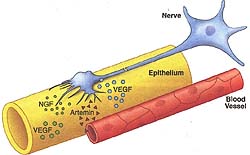 Fig. 3. Communication between epithelium, nerves, and blood vessels. Epithelium secretes NGF and VEGF (green) to attract nerves and vessels, respectively. Nerves also secrete VEGF (blue) to attract small arteries to track alongside nerve fibers. Blood vessels produce artemin and neurotrophin-3 (not shown), neurotrophic guidance signals, to guide neuronal axons.
Fig. 3. Communication between epithelium, nerves, and blood vessels. Epithelium secretes NGF and VEGF (green) to attract nerves and vessels, respectively. Nerves also secrete VEGF (blue) to attract small arteries to track alongside nerve fibers. Blood vessels produce artemin and neurotrophin-3 (not shown), neurotrophic guidance signals, to guide neuronal axons.
В молочных железах EphrinB2 экспрессируется в клетках просвета, тогда как EphB4 экспрессируется в базальных клетках (23); однако их функция остается неясной. Наконец, многие факторы, особенно WNTs, BMPs и HHs, которые, как известно, регулируют эпителиальный морфогенез, также играют роль в ветвлении и ведении нервов и кровеносных сосудов (26). Благодаря общности этих морфогенов и сигналов наведения, морфогенез ветвления в разных тканях может эффективно координироваться во время формирования органа.
Stromal Role in Development and Regeneration of Branched Organs
Во время образования ветвящихся органов происходят несколько важных событий, включая, спецификацию органов, контроль размера веточек и клеточная дифференцировка и гомеостаз, протекающих одновременно или последовательно с ветвлением эпителия. Чтобы понять развитие ветвящихся органов у позвоночных мы должны определить. как эти события включены с морфогенез ветвления. Т.к. основной источник регуляторов ветвления, мезенхима и строма, также существенно скоординированы в различных аспектах органогенеза позвоночных (Fig. 4).
Инструктивная функция мезенхимы во время образования некоторых разветвленных органов впервые была установлена с помощью классических экспериментов по трансплантации. Если скомбинировать с эмбриональной мезенхимой молочных желез кожный эпителий мышей, или даже кур и уток, то эмбрионы могут респецифицироваться, чтобы сформировать молочные веточки и молоко-продуцирующие альвеолы (17). Возраст и состояние дифференцировки эпителия предопределяет его пластичность к инструкциям от мезенхимы. Т.о., клетки эпителия кармана Ратке (будущего гипофиза) от эмбрионов 8.5 дня (E8.5) мышей могут быть респецифицированы к формированию слюнных желез , то клетки от эмбрионов E12 не могут этого (17). Более того, хотя мезенхима слюнных желез может инструктировать эмбриональный эпителий молочных желез к формированию веточек с паттерном, специфичным для слюнных желез, но трансплантаты всё ещё сохраняют способность формировать молоко-продуцирующие альвеолы (17). Эти результаты указывают на то, что дифференцировка клеток и паттерн ветвления по-разному контролируются внутренними и внешними факторами.
Строма, которая регулирует эпителиальную дифференцировку и ветвление, играет существенную роль в биологии стволовых клеток взрослых организмов и безразлична для органного гомеостаза и регенерации у позвоночных (27, 28). Молочные железы не являются жизненно важными органами, которые доступны для экспериментальных манипуляций и являются ценным инструментом для понимания биологии стволовых клеток взрослых у позвоночных. Когда эндогенный эпителий удаляется хирургически до полового созревания, то жировая строма молочных желез, которая остается в основном незанятой проникающим в неё эпителием, может быть использована в качестве хозяина для экзогенных клеток. Этот метод показал, что одиночная молочная стволовая клетка способна регенерировать целый орган (29, 30). Удивительно, когда тестикулярные или нейральные стволовые клетки вносили вместе эпителиальными молочными клетками в строму молочных желез, то они формировали эпителиальную ветвящуюся сеть и дифференцировались в молоко-продуцирующие клетки (31). Эти результаты указывают на присутствие "ниш" для стволовых клеток в постнатальных молочных железах, которые содержат важные сигналы, которые не только поддерживают стволовые молочные клетки, но и могут репрограммировать стволовые клетки из др. органов (Fig. 4). в
Без определенных маркеров трудно определить, где локализуются стволовые клетки в ветвящиеся органах и как они как они поддерживаются в ходе развития органов. В молочных железах мышей стволовые клетки распределены по всему органу и несущественно затрагиваются
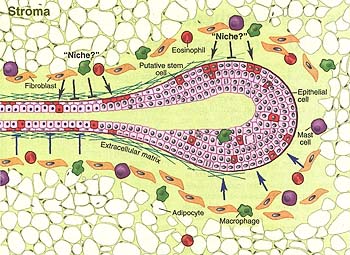 Fig. 4. Stroma role in development of vertebrate branched organs. A schematic presentation of the epithelium and stroma during mammary gland development. Stroma, which has a heterogeneous cell population, plays an important role in determining branching patterns (blue arrows and bars indicate stimulatory and inhibitory cues acting on the epithelium). Stroma also regulates biology of stem cells by contributing to a presumptive stem cell "niche."
Fig. 4. Stroma role in development of vertebrate branched organs. A schematic presentation of the epithelium and stroma during mammary gland development. Stroma, which has a heterogeneous cell population, plays an important role in determining branching patterns (blue arrows and bars indicate stimulatory and inhibitory cues acting on the epithelium). Stroma also regulates biology of stem cells by contributing to a presumptive stem cell "niche."
возрастом и репродуктивной историей мышей (31). Это распределение может иметь важное значение для того, где будут инициированы новые веточки, т.к. множественные стволовые клетки могут вносить вклад в одиночную ветвь (32). Они могут также сделать возможным образование максимального количества альвеол, которые будут подвержены повторяющимся циклам клеточной пролиферации и гибели во время каждой беременности. Кроме того, ''окончательно" дифференцированные клетки, напр., из молочных желез (31) или трахей мух (33), могут возобновлять онтогенетическую потенцию и формировать различные типы клеток при соотв. условиях. Эти результаты подчеркивают важность понимания молекулярных основ дифференцировки стволовых клеток и роль стромы в регуляции потенции стволовых клеток.
Conclusions and Future Directions
Despite their distinct origins and functions, different tissues and organs use common genes and signaling pathways for regulating branching during organ formation. One possible explanation for such molecular conservation is the existence of "branching modules," consisting of a defined set of genes that can be activated whenever branching is needed (34). Alternatively, and perhaps more likely, branching morphogenesis, irrespective of cell and tissue types, requires a common set of cell behaviors, for example, regulation of cytoskeletal machinery that is controlled by evolutionarily conserved genes and pathways. It is thus formally possible that the genes and signaling pathways involved in neural branching and guidance, which evolved first, were later "co-opted" by blood vessels and epithelia of various branched organs.
While continuing the quest for molecules that play conserved roles in various branched organs, we should also focus on molecules that promote organ-specific morphogenesis and functions to understand how different organs evolved. For instance, in the embryonic lung or kidney, branching of the epithelium accompanies enormous growth of the overall organ. In contrast, in the mammary gland, the epithelium primarily invades and forms branches in the stroma that have already been laid down and barely changes in size during pubertal development. Thus, in the mammary gland, unlike in most other branched organs, there is constant remodeling of the stromal compartment, extracellular matrix, and vasculature as mammary epithelium populates the fat pad. Indeed, the mammary gland may use different genes than do other organs for epithelial branching. Shh, which is indispensable for lung and kidney epithelial branching, is not required for mammary development (2).
Identifying stromal factors will be important for understanding essential aspects of development of vertebrate branched organs. To understand how organs are formed and maintained, and whether they can be regenerated, it will be important to determine whether a stem cell "niche" exists in vertebrates and, if so, how it regulates stem cell self-renewal and differentiation. In addition, what is the nature of adult stem cells? At least in the mammary gland, the frequency and property of adult stem cells remain puzzling and do not fit current models (31, 35). Thus, it will also be important to determine the intrinsic factors that respond to the "niche" and maintain stem cells and how they can be re-programmed upon experimental manipulations. With the emergence of the mammary gland as an amenable platform for functional testing, we can be optimistic about a better understanding of the intrinsic and extrinsic factors that regulate stem cell development in branched organs.
 Fig. 1. Branching morphogenesis in mouse organs. (A to C) Immu-nofluorescent staining of E-cadherin in the branching epithelium of whole-mount salivary gland (A), lung (B) and kidney (C) from embryos at E13.5 to E15. (D) Branches of mammary epithelium derived from progenitors that were marked by expression of green and red fluorescent proteins as described previously (32).
Fig. 1. Branching morphogenesis in mouse organs. (A to C) Immu-nofluorescent staining of E-cadherin in the branching epithelium of whole-mount salivary gland (A), lung (B) and kidney (C) from embryos at E13.5 to E15. (D) Branches of mammary epithelium derived from progenitors that were marked by expression of green and red fluorescent proteins as described previously (32). Fig. 2. Anatomy of the branching "engine." A schematic presentation of various branched tissues: neuron (A), vasculature (B), Drosophila trachea (C) and air sacs (D), and mammary gland (E). Note the finger-like projections of the neuronal growth cone (A) and those of tip cells (green) of endothelium during angiogenesis (B) and Drosophila air sacs during larval development (D). To become tip cells, cells inhibit each other to take the leading position. In endothelium (B) and Drosophila trachea (C), mutual inhibition depends on Notch signaling. In the mammary gland, mutual inhibition depends on TGF-fJ signaling (E).
Fig. 2. Anatomy of the branching "engine." A schematic presentation of various branched tissues: neuron (A), vasculature (B), Drosophila trachea (C) and air sacs (D), and mammary gland (E). Note the finger-like projections of the neuronal growth cone (A) and those of tip cells (green) of endothelium during angiogenesis (B) and Drosophila air sacs during larval development (D). To become tip cells, cells inhibit each other to take the leading position. In endothelium (B) and Drosophila trachea (C), mutual inhibition depends on Notch signaling. In the mammary gland, mutual inhibition depends on TGF-fJ signaling (E).  Fig. 3. Communication between epithelium, nerves, and blood vessels. Epithelium secretes NGF and VEGF (green) to attract nerves and vessels, respectively. Nerves also secrete VEGF (blue) to attract small arteries to track alongside nerve fibers. Blood vessels produce artemin and neurotrophin-3 (not shown), neurotrophic guidance signals, to guide neuronal axons.
Fig. 3. Communication between epithelium, nerves, and blood vessels. Epithelium secretes NGF and VEGF (green) to attract nerves and vessels, respectively. Nerves also secrete VEGF (blue) to attract small arteries to track alongside nerve fibers. Blood vessels produce artemin and neurotrophin-3 (not shown), neurotrophic guidance signals, to guide neuronal axons.  Fig. 4. Stroma role in development of vertebrate branched organs. A schematic presentation of the epithelium and stroma during mammary gland development. Stroma, which has a heterogeneous cell population, plays an important role in determining branching patterns (blue arrows and bars indicate stimulatory and inhibitory cues acting on the epithelium). Stroma also regulates biology of stem cells by contributing to a presumptive stem cell "niche."
Fig. 4. Stroma role in development of vertebrate branched organs. A schematic presentation of the epithelium and stroma during mammary gland development. Stroma, which has a heterogeneous cell population, plays an important role in determining branching patterns (blue arrows and bars indicate stimulatory and inhibitory cues acting on the epithelium). Stroma also regulates biology of stem cells by contributing to a presumptive stem cell "niche."