Cilia and Developmental Signaling | |
|
Rohatgi, R., L. Milenkovic, M. P. Scott
Patched1 regulates hedgehog signaling at the primary cilium. Science 317, 372–376 (2007)  SHH вызывает делокализацию PTC1 из первичной реснички. In control cells (left), PTC1 (green) induced to high levels colocalizes with primary cilia (red). PTC1 delocalizes from primary cilia after incubation with SHH (right). Nuclei are stained blue. |
Пути передачи сигналов, которые обеспечивают межклеточные коммуникации во время развития обнаруживают тенденцию к клеточной организации мультибелковых сигнальных комплексов. Эти комплексы включают активированные трансмембранные рецепторы, ассоциированные с адапторами и сигнальными эффекторами (Hoeller et al., 2005)с деструкцией β-catenin комплексов (Kimelman & Xu 2006) и комплексами, ассоциированными с эндосомами (Fischer et al., 2006). В каждом из этих случаев образование кластеров аппаратов сигнальной трансдукции в небольших, определенных субклеточных местах способствует эффективному и быстрому взаимодействию и модификации сигнальных белков в ответ на сигнал. THE NATURE OF CILIA Реснички и жгутики являются грациозными проекциями из клеток и имеют стереотипическую, базирующуюся на микротрубочках структуру, которая состоит из кольца 9 двойных микротрубочек (наружные дублеты). Каждая ресничка растет из базального тельца, модифицированной центросомы. Клетеки млекопитающих могут быть подвижными и неподвижными и иметь разнообразные специфичные для типа клеток структуры. Среди клеток с подвижными ресничками некоторые, подобно эмбриональному узелку, имеют одиночную ресничку, тоогда как эпендимные клетки взрослого головного мозга могут иметь множественные реснички, а клетки бронхиального эпителия могут иметь сотни ресничек (Afzelius 2004).
Физиологическое значение подвижных ресничек у людей стало очевидным с средины 1970s. Kartagener (1933) описал наследственный синдром у людей, который характеризуется необычной комбинацией бронхоэкстазов (типа хронических легочных закупорок), хронической инфекцией синусов и обратной лево-правосторонней асимметрией (situs inversus). Идентификация дополнительных аспектов синдрома, спермиев с неподвижными жгутиками, привело к распознаванию неподвижных ресничек, которые и оказались ответственными за дефекты легких и синусов и позволили предположить, что нормальная лево-правосторонняя асимметрия также зависит от ресничек (Camner et al. 1975, AfzeLius 1976). Последующие исследования на эмбрионах мышей выявили многие аспекты того, как подвижные реснички узелка мышей генерируют лево-правостороннюю асимметрию (rev. Shiratori & Hamada 2006).
Неподвижные реснички найдены как одиночные реснички на клетку. Неподвижные реснички могут быть специализированы к формированию структур, которые служат в качестве наружных сегментов фоторецепторов и сенсорного аппарата обонятельных нейронов, в которых усилены компоненты передачи сигналов. Кроме того, почти все интерфазные и неделящиеся клетки у позвоночных имеют одиночную, неподвижную, по-видимому, неспециализированную ресничку (наз. первичной ресничкой). Роль первичной реснички выяснена в начале 2000, когда стала очевидной связь между первичными ресничками polycystic kidney disease (PKD) . Сегодня известно, что почечные реснички действуют как механосенсоры тока внутри почечных канальцев, хотя пока неясно, как нарушение восприятия механических сигналов ведет к поликистозу почек (Nauli & Zhou 2004). BUILDING CILIA: INTRAFLAGELLAR TRANSPORT Наше современное понимание структуры, конструкции и функции ресничек в основном покоится на генетических и биохимических исследованиях одноклеточных водорослей Chlamydomonas, которые обладают двумя длинными жгутиками (которые имеют ту же самую структуру, что и реснички), они используются для плавания; жгутики также важны для распознавания и слияния двух типов спаривания, которые предшествуют мейозу. Выделение и характеристика мутантов с нарушенным плаванием выявило многие компоненты, необходимые для конструкции или подвижности жгутиков (Dutcher 1995).
Kozminski et al. (1993) наблюдали частицы, которые перемещались от основания к кончику жгутика Chlamydomonas и затем обратно с помощью differential interference contrast микроскопии; они назвали этот процесс intraflagcllar transport (IFT) (Figure 1). Они продолжили поиск корреляций частиц IFT с крупными плот-подобными структурами, видимыми в трансмиссионном electron microscopy (EM) между наружными микротрубочками дублетов и плазматической мембраной ресничек. Ген FLA10 оказался необходим для присутствия жгутиков, а анализ процесса транспорта внутри жгутиков при температурно-чувствительном аллеле fla1O показал, что ген необходим для перемещения частиц IFT (Kozminski et al. 1995). FLA10 кодирует субъединицу kinesin-II, направленного к плюс-концу мотора, базирующегося на микротрубочках (Walther et al. 1994) , который оказался ассоциированным с наружными дублетами (Kozminski et al. 1995).
Последующие исследования показали, что IFT зависит как от тримерного kinesin-II мотора (одна из субъединиц которого кодируется FLA10), который переносит белки к дистальному кончику реснички, где они могут быть собраны в аксонему реснички (или жгутика), так и от димерного цитоплазматического dynein, который обеспечивает ретроградный транспорт белков реснички обратно в тело клетки. По крайней мере, 17 белко из двух крупных комплексов (A и B) создают плот-подобные структуры, видимые при трансмиссионной EM. В отсутствие kinesin субъединиц или белков В IFT комплекса IFT отсутствует и не образуются жгутики.
Перемещение IFT частиц в ресничках видно в ресничках хемосенсорных нейронов у живых Caenorhabditis elegans благодаря использованию трансгенных червей, которые экспрессируют нагруженные GFP компонеты аппарата IFT (Orozco et al. 1999). Сходным образом. перемещения GFP-нагруженных IFT20 вдоль реснички были визуализировано в клетках млекопитающих (Follit et al. 2006). Генетические исследования подтвердили, что IFT белки существенны для конструкции ресничек у C. elegans (Cole et al. 1998), рыбок данио (Sun et al. 2004, Tsujikawa & Mahcki 2004) и мышей (Pazour et al. 2000, Huangfu est aL 2003). MOUSE INTRAFLAGELLAR TRANSPORT MUTANTS DEMONSTRATE THAT HEDGEHOG SIGNALING IS COUPLED TO CILIA Первым указанием на то, что белки внутрижгутикового транспорта играют роль в онтогенетических процессах помимо установления лево-правосторонней асимметрии, стал анализ мутаций у мышей гена IftSS (наз. также Tg737, orpk или polaris). Трансген инсерционного аллеля Tgl31 является мутацией с частичной потерей функции, которая вызывает как PKD так и четкие дефекты формирования паттерна конечностей, преаксиальную Polydactyly у гомозигот. Хотя животные, гомозиготные по мутации Tg731 доживают до рождения, индуцированные нулевые аллели мышей IftSS/polaris приводят к летальности в средине беременности (Murcia et al. 2000). Мутантные эмбрионы обнаруживают бессистемную лево-правостороннюю асимметрию с потерей ресничек в узелке. Эти эмбрионы обнаруживают также дефекты в др. структурах срединной линии, которые не могут быть объяснены дефектами нодальных ресничек. Сходным образом, целенаправленные мутации субъединиц 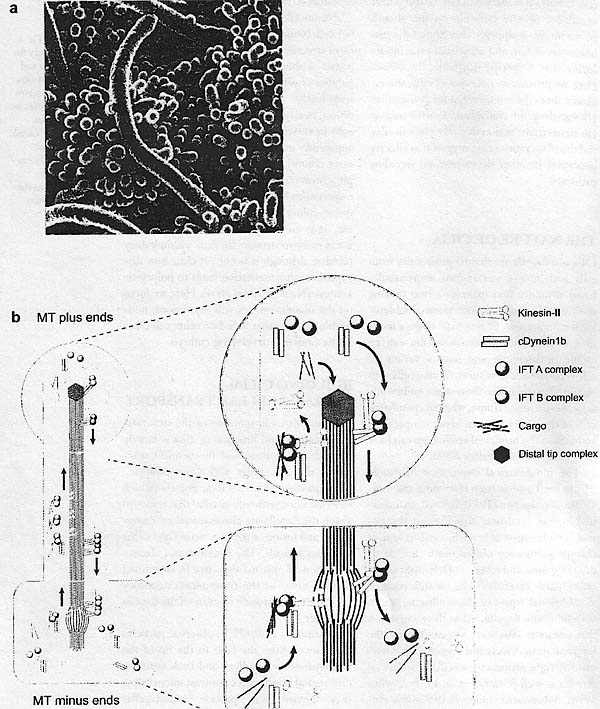 Fig. 1. Cilia and intraflagellar transport (IFT). (a) Cilia on the node of the e8.0 mouse embryo, as visualized by scanning electron microscopy. These cilia are 3-5 microns long, which is longer than typical primary cilia. Modified from Huangfu & Anderson (2005). (b) A schematic of the process of TFT. The construction and maintenance of cilia and flagella depend on a steady source of new components, which are assembled at the distal tip complex (DTC) (at the plus ends of the microtubules). Transport to the distal tip involves assembly of the anterograde TFT platform on transition fibers at the base of the cilium and anterograde movement powered by the kinesin-II motor. Although still mechanistically unclear, events at the DTC are thought to involve disassembly of the anterograde transport machinery, assembly of structural components into the growing axoneme, and assembly/engagement of the retrograde transport apparatus. IFT machinery and residual structural cargo are recycled by retrograde transport, powered by the cytoplasmic dynein motor, from the tip to the base of the cilium. At the base, the retrograde apparatus is disassembled, potentially allowing IFT components to be reused. Kif3a и Kif3b у мышей антероградного мотора kinesin-II IFT, которые обусловливают отсутствие ресничек и дефекты формирования лево-правостороннего паттерна, также вызывают гибель в средине беременности, которая не может быть объяснена дефектами лево-правосторонней асимметрии (Nonaka et al. 1998, Marszalek et al. 1999, Takeda et al. 1999). Table 1 Mutations that affect cilia structure and their effects on embryonic patterning1 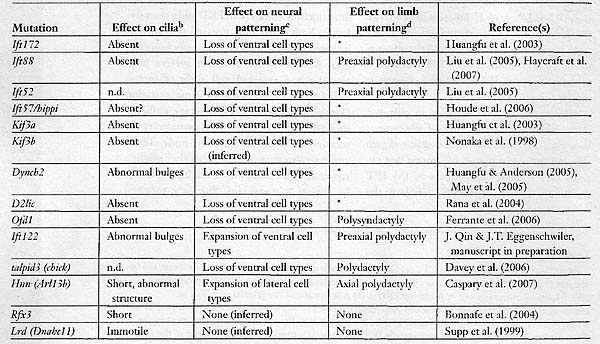 a All known mutations that prevent formation or cilia disrupt patterning of die neural tube and the limb. Patterning is not affected in mutants that have short or iinmotile cilia, bn.d. denotes not determined. cIt is mferred that mutations that arc homo7ygous viable do not affect neural patterning. d* indicates that an effect on limb patterning could not be determined owing to early lethality of mutants. ANALYSIS OF NEURAL TUBE PATTERNING SHOWS THAT INTRAFLAGELLAR TRANSPORT PROTEINS ARE REQUIRED AT THE CORE OF THE CYTOPLASMIC HEDGEHOG SIGNAL TRANSDUCTION MACHINERY Передача сигналов Hh эволюционно законсервирована, а обширные генетические исследования на Drosophila не выявили какой-либо роли белков IFT этом процессе, так что корреляция между потерей передачи сигналов Shh и потерей белков IFT у мышей оказалась сюрпризом. Передача сигналов с помощью трех Hh лигандов млекопитающих [Shh, Indian (Ihh), и Desert] осуществляется посредством двух мембранных белков, Patched 1 и Smo, чтобы регулировать активность трех транскрипицонных факторов семейства Gli: Gli1, Gli2 и Gli3 (rev. Ingham & McMahon 2001). Анализ формирования нейрального паттерна у двойных мутантных эмбрионов демонстрирует, что IFT мутации блокируют передачу сигналов Hh ниже Patched 1 и Smo. Patched 1, который связывает лиганды Hh, является необычным рецептором, т.к. его активность необходима для удержания пути закрытым в отсутствие лиганда. Как результат, нижестоящий путь активируется в Patched1-мутантных клетках: вентральные типы нервных клеток не специфицируются у Shh мутантов, тогда как все нервные клетки воспринимают вентральную судьбу у Patched 1-мутантных эмбрионов. У мутантов, которые лишены IFT complex В белков Ift88 или lftl72, вентральные типы нервных клеток отсутствуют, как и у мутантов Shh. Фенотип нейрального паттерна уf Patched1 Ift88 или Patched1 Jft172 двойных мутантов идентичен тому, что характерен для одиночных Ift мутантов: вентральные типы нервных клеток не специфицированы (Huangfu et al. 2003). Т.о., хотя удаление Patched 1 активирует нижестоящие ступени сигнального пути, этого не может произойти, когда отсутствуют IFT белки. Это указывает на то, что IFT белки затрагивают ступень сигнального пути Shh, которая находится ниже Patched 1. INTRAFLAGFLLAR TRANSPORT PROTEINS AND SONIC HEDGEHOG SIGNALING IN LIMB PATTERNING Shh необходим для формирования нормального паттерна конечностей, при этом он регулирует рост, количество пальцев и передне-заднюю полярность(rev. Tickle 2006). У мышей потеря Shh ведет к тяжелой гипоплазии и формированию одиночного пальца с передними характеристиками, тогда как потеря Gli3 ведет к образованию дополнительных пальцев в зачатках передних конечностей (преаксиальная полидактилия). Фенотип Shh Gli3 двойных мутантов очень сходен с таковым у одиночных мутантов Gli3? это демонстрирует то, что Gli3 опосредует эффекты Shh при формировании паттерна пальцев (Litingtung et al. 2002, te Welscher et al. 2002). Т.о., в противоположность нервной трубке, где Gli активаторы играют центральную роль в формировании паттерна, большинство эффектов Shh в конечностях возникает благодаря регуляции Gli3 репрессора. INTRAFLAGFLLAR TRANSPORT PROTEINS ARE REQUIRED FOR SIGNALING BY BOTH SONIC AND INDIAN HEDGEHOG Ihh необходим для нормального развития длинных костей конечностей, благодаря его эффектам на пролиферацию и дифференцировку клонов хондроцитов (St.-Jacques et al. 1999). Условные делеции Ift88 в мезенхиме конечностей вызывают укорочение проксимо-дистальной оси конечности, сходное с фенотипом Ihh мутантов. Gli1 и Ptch1 (Hh гены мишени) неспособны экспрессироваться в развивающихся костях Ift88 условных мутантов (Haycraft et al. 2007).Сходным образом, инициальная спецификация легких зависит как от Ihh, так и Shh, и зачатки легких не возникают у IFT мутантов (Huangfu & Anderson 2006). Не было экспериментов, посвященных вопросу, зависит ли также Desert Hh (необходимый для сперматогенеза) от IFT белков, но скорее всего, что все передачи сигналов Hh зависят от IFT белков. 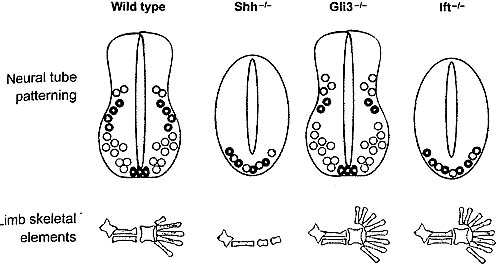 Distinct effects of loss of intraflagellar transport (IFT) proteins in the neural tube and limb. All Hedgehog signaling in the mouse embryo depends on IFT proteins, but tissue-specific effects of IFT mutants arise as a function of the relative importance of Gli activator and Gli repressor in the tissue. In the neural tube, Gli activators play a central role hi neural patterning, and thus loss of IFT in that tissue has a phenotype similar to that of Sonic hedgehog (Shh) mutants (upper row). The /FT-mutant neural tube phenotype is not identical to that of Shh mutants because GU3 repressor (which is present and active in Shh mutants) is absent in IFT mutants. Therefore, there is a low level of pathway activation in the neural tube. In the limb, Gli3 repressor plays a central role in digit patterning, and the phenotype caused by loss of IFT is similar to that caused by loss of Gli3 (lower row). HEDGEHOG PATHWAY COMPONENTS ARE ENRICHED IN CILIA Фенотипы IFT мутантов. описанные выше, демонстрируют. что имеется тесная корреляция между присутствием ресничек и способностью клеток передавать сигналы Hh. Эти результаты открывают интересную возможность, что реснички создают среду, которая является критической для передачи сигналов interesting possibilities that cilia provide a milieu that is critical for Hh и что некоторые компоненты аппарата передачи сигналов Hh могут локализоваться в ресничках. ARE CILIA MORE THAN A SITE FOR ENRICHMENT OF THE HEDGEHOG SIGNAL TRANSDUCTION MACHINERY? Приведенные результаты демонстрируют, что IFT белки необходимы для передачи сигналов Hh и что некоторые сигнальные Hh белки обогащены в ресничках. Эти находки
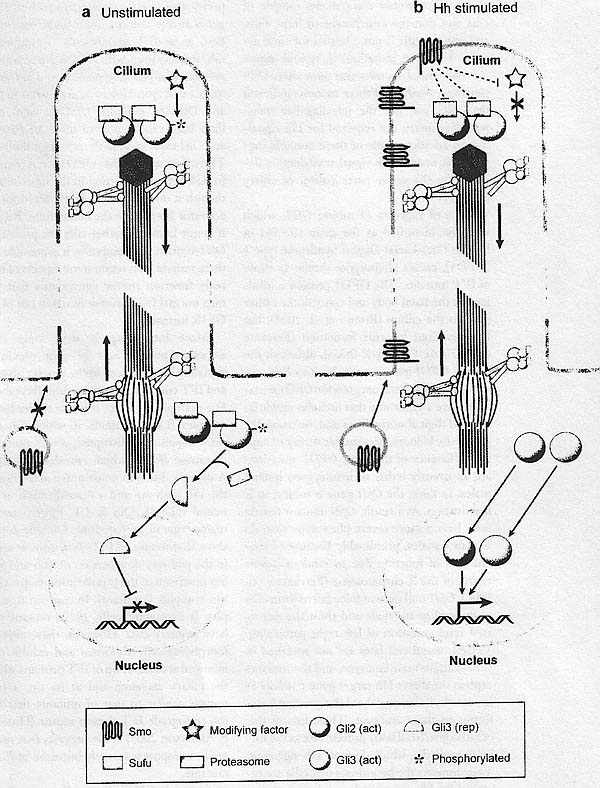 A model for Hh signal transduction within the cilium. Cilia mediate complex steps in the Hh signaling pathway both in the absence and presence of Hh ligand. (a) In the absence of stimulation, Smoothened (Smo) does not localize to the cib'um, and Gii3 repressor is generated. In this state, Gli3 is localized to the rip of the cilium, and the formation of Gli3 repressor [Gli3 (rep)j depends on a modification that occurs within the cilium (possibly phosphorylation). This modification ultimately targets GH3 for proteolytic processing by the proteasome once the transcription factor returns to the base of the cilium. Processed Gli3 repressor then enters the nucleus and represses Hh target gene expression. At the same time, Gli2 is present widiin the cilium but is maintained in an inactive state by Sum and other negative regulators, (b) Upon stimulation by Hh, several events occur in the cilium. Smo becomes activated and accumulates within the cilium, allowing it to interact with downstream components. Once in the cilium, Smo prevents or reverses the modification of Gli3 (so that it can no longer be processed), and it relieves the inhibition of both Gli2 and full-length Gli3 by Sum and other factors, possibly by preventing the interaction between the inhibitors and the Gli proteins. Activated Gli2 and Gli3 [GH2 (act) and Gli3 (act), respectively], now released from inhibition, enter the nucleus upon their transport back to the cell body. Once in the nucleus, Gli2 and GH3 activators stimulate the transcription of Hh target genes. не исключают возможности, что IFT белки транспортируют компоненты Hh пути вне ресничек и что накопление Smo, Glis и Sufu в ресничках не существенно для их активности. Однако, мутации в некоторых белках, ассоциированных ресничками мышей, также обнаруживают изменения в передаче сигналов Hh. Анализ этих мутантов показал, что реснички, не сам аппарат внутрижгутикового транспорта, необходимы для передачи сигналов Hh. Кроме того, некоторые из этих мутантов указывают на то, что нормальная передача сигналов Hh зависит от активного участия белков ресничек. Несмотря на это фенотип формирования нервного паттерна lft122 мутантов оказался неожиданным, благодаря своему сходству с мутантами комплекса В, мутантные эмбрионы, дефицитные Dync2h1, субъединице мотора для ретроградного IFT motor, не способны активировать гены мишени Hh, который дает оппозитный фенотип таковому мутантов Ift122. Недавно подтверждено, что комплекс A и В может участвовать в нескольких аспектах процесса транспорта. Напр., комплекса A IFT белки могут ассоциировать с kinesin-II независимым от комплекса В способом (Ou et al. 2005, Pederson et al. 2006). Т.о., комплекс В и комплекс А могут оба играть роль в антероградном транспорте и иметь разную специфичность к грузу. Комплекс В может быть в целом необходимым для антероградного транспорта груза, используемого для сборки реснички (напр., tubulin димеров, радиальных spoke белков и др. структурных компонентов ресничек), тогда как комплекса A IFT белки могут быть важными для аппарата транспорта, используемого для оборота на дистальном кончике или для ретроградного транспорта. Как результат потеря IFT122 может вести к постоянной активации пути из-за дефекта антероградного транспорта специфического фактора, который противодействует функции Gli внутри реснички.
Arl13b (первоначально наз. Arl211), гомолог гена scorpion рыбок данио (Sun et al. 2004), является малой GTPase из подгруппы Arl/Arf сверхсемейства Ras и играет уникальные роли в формировании ресничек и передачи сигналов Hh. Белок Arl13b располагается на стержне реснички, а мутантные мыши, которые лишены Arl13b, имеют короткие реснички аномальной структуры, в которых В канальцы наружных дублетов открыты (Caspary et al. 2007). В соответствии с данным дефектом в структуре ресничек мутантные эмбрионы обнаруживают новый дефект в формировании нейрального паттерна, в котором как наиболее дорсальные, так и наиболее вентральные клеточные типы не специфицированы и домен моторный нейронов, который возникает в промежуточном положении, существенно расширен. Анализ двойных мутантов по стрежневым компонентам Hh пути показал, что в то время как Gli3 репрессорная активность нормальная у Arl13b мутантных эмбрионов, Gli активаторы постоянно активны на низких уровнях. Т.о., в то время как обычные реснички нуждаются как в активационной, так и репрессорной активности белков Gli , эти события разделены в ресничках Arl13b , которые могут регулировать Gli репрессор, но ни Gli активатор.
Фенотипы мутантов Ift122 и Arl13b указывают на то, что реснички более чем сенсорная антенна, в которой сконцентрированы компоненты пути Hh. Вместо этого, структура и динамика реснички, по-видимому, выполняет более интегральную роль в передаче сигналов Hh. Это мнение напоминает исследования у Chlamydomoiias, которые показали, что компоненты IFT играют активную роль в передаче внутриклеточных сигналов в ответ на спаривание (Wang et al. 2006). Необходимы дополнительные исследования, чтобы понять, как белки в ресничке взаимодействуют с и регулируют компоненты передачи сигналов Hh и как пространственно регулируют экспрессию генов, кодирующих белки IFT и др. компоненты ресничек (e.g., Huangra & Anderson 2005), модулируя передачу сигналов Hh. Был идентифицирован ряд др. генных продуктов. специфичных для позвоночных, которые затрагивают предачу сигналов Hh на той же самой ступени. что и белки IFT: ниже Smo и выше Gli белков. Сюда входят позитивные и негативные регуляторы пути [мышиные Rab23, Fkbp8 и Sil; Iguana рыбок данио; и Talpid3 у кур (Eggenschwiler et al. 2001, Izraeli et al. 2001, Bulgakov et al. 2004, Sekimizu et al. 2004, Wolff et al. 2004, Davey etal. 2006)] и также могут затрагивать реснички. Исследования структуры ресничек у таких мутантов и субклеточная локализация этих белков необходимы, чтобы понять, влияют ли эти белки также на передачу сигналов Hh через реснички. ARE CILIA REQUIRED FOR HEDGEHOG SIGNALING IN ALL VERTEBRATES? Исследования, описанные выше, показали, что реснички необходимы для всех реакций на Hh лиганды у эмбрионов мышей. У Drosophila мутации, которые блокируют образование ресничек не оказывают эффекта на передачу сигналов Hh, а реснички ограничены однодендритными сенсорными нейронами и спермиями (Han etal. 2003, Avidor-Reiss etal. 2004). Является ли этот эволюционно законсервированный сигнальный путь сопряженным с ресничками на определенной стадии ветви позвоночных или напротив связь с ресничками была потеряна в ветви, которая ведет к двукрылым.
Пока неясно, все ли позвоночные нуждаются в ресничках для передачи сигналов Hh. Xenopus эмбрионы с разрушенными ресничками обнаруживают потерю передачи сигналов Hh (Park et al. 2006). Однако, более полные генетические данные на др. позвоночном рыбках данио, указывают на отсутствие связи между IFT мутантами и передачей сигналов Hh. Мутации у рыбок данио Ift88, Ift172, Ift81, и lft57 также как и morpholino нокдаун Ift52 все они ведут к кистозным почкам и дефектам в структуре ресничек в почках и др. тканях (Sun et al. 2004, Tsujikawa & Malicki 2004). Однако, мутанты не обнаруживают дефектов паттерна сомитов, характерных для мутантов Hh пути у рыбок данио, хотя они обнаруживают вентрально искривленный хвост, наблюдаемый у некоторых мутантов пути Hh. Отсутствие характерного Hh фенотипа может быть обусловлено perdurance материнских генных продуктов, т.к. реснички всё ещё обнаруживаются, даже у Ift мутантов. Последовательность мотива в Smo, которая необходима для его локализации в ресничках в клетках MDCK, также необходима для активности Smo у рыбок данио (Corbit et al. 2005), это указывает на то. что реснички могут быть важными для передачи сигналов Hh и у рыбок данио. Трансплантации Ift-мутантных зародышевых клеток рыбок в хозяев, которые лишены примордиальных зародышевых клеток (Ciruna et al. 2002) позволили создать животных, которые лишены как материнского, так и зиготического источников белков IFT, и затем были протестированы, необходим ли IFT для передачи сигналов Hh. ARE THERE OTHER DEVELOPMENTAL SIGNALS THAT DEPEND ON CILIA? Замечательный эффект IFT-мутантных эмбрионов мыши заключается в том, что все ясно видимые фенотипы могут быть объяснены как результат отсутствия передачи сигналов Hh. Открытая нервная трубка, изменения в формировании нейрального паттерна, полидактилия и неспособность инициировать развитие легких могут быть отслежены непосредственно до нарушений в предаче сигналов Hh. Создается впечатление, что во время развития, первичные реснички являются органеллами, которые посвящены передаче сигналов Hh. В самом длее, в настоящее время нет определенных доказательств, что какие-либо др. онтогенетические сигнальные пути зависят от ресничек. Однако, летальность мутантов IFT в середине беременности и явные дефекты, вызываемые нарушением передачи сигналов Hh могут маскировать др. роли ресничек. Platelet-Derived Growth Factor Receptor л Signaling Сигнальный путь platelet-derived growth factor (PDGF) используется для разнообразных клеточных процессов во время развития, включая пролиферацию, жизнеспособность и миграцию многих типов клеток (rev.Heldin & Westermark 1999). Как и в случае пути передачи сигналов Hh несоотв. активация пути PDGF интимно связана с разнообразными пагубами у людей (Pietras et al. 2003). Имеются две основные формы как PDGFлигандов. так и их рецепторов, и те и др. действуют или как гомо- или гетеродимеры. PDGF-AA лиганд может соединяться с передавать сигнал только через PDGFRαα гомодимеры. Двумя важными реакциями, стоящими ниже активированных PDGF рецепторов, являются пути активации PIK3-AKT and MEK1/2-FRK1/2, которые обеспечивают некоторые клеточные функции этого пути.
Недавно эксперименты на NIH3T3 фибробластах выявили взаимоотношения между ресничками и передачей сигналов с помощью PDGF рецептора αa (PDGFRα) (Schneider et al. 2005). Эти эксперименты показали, что PDGFRα позитивно регулируются и локализуются в ресничках в клетках с арестованным ростом, присутствие PDGFRα в ресничках коррелирует со способностью клеток отвечать на его лиганд (PDGF-AA), PDGFRα в ресничках становится фосфорилированным в ответ на действие лиганда и нижестоящая мишень MEK1/2 также фосфорилируется внутри ресничек в ответ на стимуляцию лигандом. В противоположность PDGFRα, PDGFRβ локализуется преимущественно в кластерах на клеточной поверхности, хотя , по-видимому, часть локализуется и на ресничках. В соответствии с тем, что реснички представляют собой первичный сайт для функции PDGFRα но не для функции PDGFRβ эмбриональные фибробласты мышей Tg737orpk' (которые гомозиготны по аллелю с частичной потерей функции Polaris/Ift88) имеют короткие реснички и неспособны к нормальной реакции на PDGF-AA без существенного снижения чувствительности к PDGF-BB .
Позитивная регуляция и локализация в ресничках PDGFRα в GO клетках вряд ли случайно совпадение. Реснички, присутствующие на культивируемых фибробластах, если они находятся в GO фазе (Tucker & Pardee 1979a), и предпочтительная роль передачи сигналов PDGF способствуют вступлению клетки в клеточный цикл из GO-арестованного состояния путем активации непосредственно ранних генов. таких как c-fos (Stiles et al. 1979, Pledger et al. 1981, Greenberg & Ziff 1984). Доставка PDGFRα в реснички может таким образом ограничивать способность клеток отвечать на PDGF-AA в GO фазе клеточного цикла. Согласие с этой возможностью обнаруживается в реакции на PDGF, NIH3T3 фибробластов. котоные начинают вступать в клеточный цикл, а их центриоли быстро лишаются ресничек (Tucker et al. 1979b). Потеря реснички может в свою очередь супрессировать дальнейшие реакции на PDGF стимуляцию.
Др. потенциальное взаимоотношение между первичной ресничкой и путем передачи PDGF лежит в их ассоциации с миграцией клеток. NIH3T3 фибробласты обнаруживают направленную миграцию (хемотаксис) в направлении источника PDGF-AA (Uren et al. 1994). Миграция предшественников олигодендроцитов (02A) зависит от PDGFRα in vivo и in vitro (Forsberg-Nilsson et al. 1998, Khnghoffer et al. 2002). Играют ли реснички какую-либо роль в миграции клеток? В культивируемых мигрирующих NIH3T3 фибробластах неподвижные реснички ориентируются параллельно направлению миграции (Albrecht-BuehJer 1977), указывая тем самым, что они играют клеточно-автономную, инструктивную роль в клеточной миграции. Это, в свою очередь, открывает возможность, что если аппарат, используемый для восприятия и реакции на PDGF-AA, специфически локализуется в первичной ресничке, то ориентация этой структуры вдоль градиента PDGF-AA может иметь целью восприятие и реакцию на этот градиент.
Важным открытым вопросом является, могут ли быть необходимыми реснички для нормальных реакций на PDGF-A in vivo. Если это так, то некоторые аспекты фенотипов, обнаруживаемые у мышей , дефицитных по IFT функции, могут быть обусловлены нарушениями передачи сигналов PDGF-AА. Мыши, лишенные PDGF-A и PDGFRα имеют разные эмбриональные фенотипы, включая тяжелую задержку роста, апоптоз в производных нервного гребня, дефектную пролиферацию олигодендроцитов, аномальный паттерн сомитов, закрытя нервной трубки и скелетные аномалии (Bostrom ct al. 1996, Soriano 1997). IFТ-мутантные эмбрионы обнаруживают дефекты в тканях, которые нуждаются в передаче сигналов PDGF. Однако, эти фенотипы могут быть вызваны нарушениями передачи сигналов Hh, т.к. собственно регуляция передачи сигналов Hh также важна для эмбрионального роста, жизнеспособности нервного гребня, закрытия нервной трубки, развития сомитов и спецификации олигодендроцитов (Hui & Joyner 1993, Chiang et al. 1996, Orentas et al. 1999, Buttitta et al. 2003, Brito et al. 2006). Т.о., подтверждение потребности в ресничках передачи сигналов PDGF in vivo д. в конечном счете зависеть от условного разрушения IFT в контексте развития, в которых дефекты передачи сигналов Hh д. оказывать незначительный эффект. Canonical Wnt Signaling Пути Hh и канонической передачи сигналов Wnt имеют ряд удивительных сходств (Nusse 2003, Lum & Beachy 2004). Оба связаны с serpentine рецепторами (Smo и Frizzleds) для пути активации и оба зависят от протеосом в отношении передачи сигналов (процессинг Gli3 и регулируемая деградация β-catenin). Поэтому стоит ли удивляться, если передача сигналов Wnt также окажется зависимой от ресничек (Ross et al. 2005, Simons et al. 2005). Если реснички играют роль в передаче сигналов Wnt, то ресничка может служить местом для интеграции путей Hh и Wnt в клетках, которые одновременно подвергаются действию обоих сигналов, напр., клетки в вентральной части нервной трубки (Lei et al. 2006).
Результаты некоторых экспериментов подтверждают, что потеря ресничек может вести к повышению передачи канонических Wnt сигналов. Хотя возникновение кистозных почек, обусловленное потерей белков IFT, является спорным, было предположено, что увеличение кальция, вызываемое потерей polycystins, может активировать передачу сигналов Wnt, а значит и пролиферацию. Экспрессия активированной формы β-catenin в почках вызывает избыточную пролиферацию и почечные кисты (Saadi-Kheddouci et al. 2001), a повышенные уровни цитоплазматического и ядерного β-catenin были описаны в постнатальных кистозных почках, вызванные условной делецией Kif3a в почках (Lin et al. 2003). Сходное увеличение β-catenin наблюдалось в постнатальной поджелудочной железе у животных с дефектами IFT (Cano et al. 2004). Однако, уровни β-catenin у условных Kif3a мутантов были исследованы после рождения, тогда как кистозные органы обнаруживались вскоре после ст. e14.5-15.5. Следовательно, необходимо проанализировать сигнальные пути на ранних стадиях развития или использовать conditional инактивацию у взрослых (as in Piontek et al. 2004), чтобы посмотреть является ли повышение ядерного β-catenin причиной или следствием кистоза почек, вызываемого потерей IFТ.
Несмотря на потенциальную связь между IFT и передачей сигналов Wnt в почках и поджелудочной железе, фенотипы IFT-мутантных эмбрионов демонстрируют, что реснички не являются существенными для передачи канонических сигналов Wnt. Мутантные мыши, у которых отсутствует каноническая передача сигналов Wnt, д. арестовываться очень рано в развитии и обнаруживать фенотип, характерный для потери канонической передачи сигналов Wnt. Напр., Wnt мутанты погибают во время гаструляции, а Lef1 Tсf1 двойные мутанты (которые лишены двух транскрипционных факторов, которые обеспечивают большую чать передачи сигналов Wnt) погибают на ст. e10.5, с характерным накоплением клеток в хвостовой почке (Galceran et al. 1999, Liu et al. 1999). Ни один из этих фенотипов не обнаруживался ни у нулевых, ни у с частичной потерей функции IFT мутантов. Усиление передачи сигналов Wnt также вызывает тяжелые нарушения в раннем развитии, как это наблюдается у мутантов, которые лишены негативных регуляторов Axin или APC (Zeng et al. 1997, Chazaud & Rossant 2006). Эти мутанты погибают очень рано в развитии и обладают характерным фенотипом, который, опять же, не перекрывается с дефектами, обнаруживаемыми у IFT-мутантных эмбрионов.
Экспрессия трансгенных репортеров канонической передачи сигналов Wnt нормальная у Ift172-мутантных эмбрионов (Figure 4), это непосредственно демонстрирует, что каноническая передача сигналов Wnt у эмбрионов в середине беременности ни снижается, ни повышается в отсутствие ресничек. Однако, т.к. один сигнальный путь в развитии может запускать изменения, которые в конечном итоге будут затрагивать др. сигнальные пути, потеря IFT в развивающихся почках м. прерывать передачу сигналов Hh и это, в свою очередь, может приводить к несоотв. активации передачи сигналов Wnt. Потеря Shh ведет к неспособности к развитию одной или обеих почек, но те мутантные почки, которые развиваются, обнаруживают расширенные канальцы (Hu et al. 2006). Т.о., фенотип кистозных почек IFT мутантов может быть обусловлен дефектами передачи сигналов Hh
на определенной стадии развития почек. Чтобы оценить эту возможность необходимо иметь в виду, что потеря IFT может оказывать специфичные для клеточных типов эффекты на активность генов мишеней для Hh, в зависимости от относительной важности Gli активатора и Gli репрессора в соотв. клетках (Figure 2). Эффект потери IFT на передачу сигналов Hh в развивающихся почках может , следовательно, отличаться от такового у Shh или Gli3 мутантов.
Если рассматривать роль ресничек в почках и поджелудочной железе, то важно помнить, что существуют скорее всего разные белки, ассоциированные с ресничками в специализированных типах клеток. Существуют очевидные морфологические различия между подвижными и неподвижными ресничками; между специализированными подвижными ресничками на клетках узелка, желудочков мозга и бронхиальных клеток; и между неподвижными ресничками фоторецепторов и обонятельных клеток (rev. Rosenbaum & Witman 2002). Кроме того, существуют молекулярные различия среди сходных классов ресничек. Напр., лево-правосторонний dynein (lrd) необходим для подвижности клеток узелка, но, по-видимому, не существенен для подвижности бронхиальных и эпендимных клеток (Supp et at. 1999). Polycystin-1 экспрессируется в механосенсорных ресничках почек, но не эмбрионального узелка (Karcher et al. 2005). Т.о., существует зависимая от клеточных типов регуляция, благодаря которой белки поставляются в реснички. Поэтому важно протестировать, могут ли компоненты сигнального Wnt пути локализоваться в ресничках специфических развивающихся тканей. Напр., белок Inversin, который необходим для лево-правосторонней асимметрии и нормального развития почек, ассоциирует с ресничками и центросомами (Watanabe et al. 2003). Inversin может связывать Disheveled 1 (Dvl1) (Simons et al. 2005), компонент как канонического, так и не канонического Wnt пути. Было бы интересно проверить, ассоциирует ли Dvl1 с ресничками в специфических типах клеток, таких как в развивающихся почках. Noncanonical Wnt Signaling Было предположено, что реснички связаны с неканонической передачей сигналов Wnt [планарная клеточная полярность
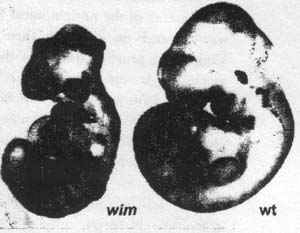 Figure 4 Canonical Wnt signaling in the mouse embryo is normal in Iftl 72-mutant embryos (M. Tuson & КЛ7. Anderson, unpublished). The Topgal transgene contains multimerized Lef/Tcf binding sites driving the expression of (3-galactosidase and acts as a faithful reporter for sites of endogenous Wnt signaling (DasGupta & Fuchs 1999). (Right) A wild-type (wt) el0.5 embryo that carries a copy of the Topgal repoiter. (3-galactosidase is expressed in many distinct sites at which canonical Wnt signaling is active at this stage of development. (Left) Homozygous Iftl 72 (wi?n) embryos that earn' a copy of the Topgal reporter show the characteristic morphology of Ift mutants. The most obvious phenotype is an open neural tube that lacks the normal ventral groove of the neural tissue. The Topgal reporter is expressed in the same set of cell types in the mutant as in the wild type and at indistinguishable levels. (PCP)] . Передача сигналов PCPу Drosophila обеспечивает проксимо-дистальную ориентацию клеток внутри эпителия (Adler 2002) и обнаруживает сходные функции в ориентации волосков на коже мышей (Guo et al. 2004) и в клетках внутреннего уха (Montcouquiol et al. 2006). Кроме того, наиболее удивительный эффект потери PCP у эмбрионов мышей заключается в полной неспособности к закрытию спинномозговой трубки, это может представлять собой отсутствие определенного типа перестройки клеток (convergent extension), которое зависит от поляризации клеток (rev. Wang & Nathans 2007). Предполагается два разных типа связей между ресничкакми и передачей сигналов PCP. Некоторые исследования позволили предположить, что реснички необходимы для передачи сигналов PCP или могут участвовать в переключении между канонической и не канонической передачей сигналов Wnt (напр., Rossetal. 2005, Simons et al. 2005). Напротив, в др. исследовании было предположено, что PCP эффекторные белки могут быть необходимы для конструкции нормальных ресничек (Park et al. 2006). DO HUMAN GENETIC DISEASES ASSOCIATED WITH CILIA REFLECT DISRUPTION OF SIGNALING PATHWAYS? В последние 10 лет стало ясно. что дефекты ресничек и функции базальных тел интимно связаны в болезнями людей. Помимо нарушений, возникающих в результате дискинезии первичной реснички, обсужденные выше (напр., синдром Kartageners), несколько десятков врожденных болезней людей ассоциируют с дефектами в ресничках и/или базальных телец. Связь между ресничками, базальными тельцами и болезнями людей облегчает идентификацию ряда эволюционно законсервированных генов, которые ассоциированы специфически с ресничками и базальными тельцами. Сравнение последовательностей всего генома привело к распознаванию того, что реснички присутствуют у родоначальников эукариот как растений, так и животных, но они теряются независимо в ветвях некоторых современных организмов. Напр., Cblamydomonas имеют жгутики (структурный эквивалент реснички), но Arabidopsis (др. растение) не имеет. Эти сравнения последовательностей целого генома, исследования экспрессии и протеомный анализ очищенных жгутиков в десятках разных лаб. привел к определению протеома ресничек из ~ 1200 различных белков, которые найдены в ресничках и/или базальных тельцах (http://www.ciliaproteome.org/). Эти части списка предоставляют ценный ресурс для идентификации генов, ответственных за фенотипы, связанные с ресничками. Дефекты белков ресничек лежат в основе нескольких синдромов у людей, таких как Bardet-Biedl, Alstrom, Meekel-Gruber и OFD синдромы, которые характеризуются поликистозной болезнью почек, дегенерацией сетчатки, аносомией, полидактилией или situs reversal. Некоторые из этих синдромов обнаруживают признаки неявно связанные с ресничками, включая ожирение и умственную отсталость. В отношении этих ciliopathies (rev. Badano et al. 2006), мы рассмотрим здесь, происходят ли эти нарушения в результате онтогенетических нарушений сигнальных процессов.
Возникновение др. признаков этого синдрома, таких как тучность, остается неясным. Интересно также, что мыши, мутантные по гену tubby обладают признаками, общими с таковыми у пациентов с Bardet-Biedl, такие как ожирение, дегенерация сетчатки и потеря слуха (Ohlemiller et al. 1995). Др. члены семейства белков Tubby также обладают активностью, связанной с ресничками. Напр., у Bbs2 и Tubby-like protein1 (Tulp1) мутантных мышей родопсин не эффективно транспортируется посредством соединяющей реснички ы наружный сегмент фоторецепторных клеток сетчатки, что, по-видимому, приводит к гибели фоторецепторов (Hagstrom еt al. 1998. 2001; Xishimura et al. 2004). Мышиный Tubby-like protein 3 (Tulp3) локализуется в базальном тельце и кончике реснички и действует как антагонист передачи сигналов Shh в нервной системе и конечностях (R. Norman, A. Tkeda & J.T. Eggenschwiler, manuscript in preparation). Подобно пациентам с синдромом Bardet-Biedl, Tulp3 мутантные мыши полидактиличны. С elegans имеют единственный tubby-related homolog, Tub-1, который обнаруживает очень высокое сходство с Tulp3 и Tubby мышей. Tub-1 и BBS1 экспрессируются в нейронах с ресничками и участвуют в контроле хранения жира. С elegans bbs;tub1 двойные мутанты обнаруживают идентичный фенотип, наблюдаемому у bbs-1 и tub-1 одиночных мутантов, указывая тем самым, что два фактора действуют на одном и том же пути (Мак et al. 2006). Tubby участвует в нескольких сигнальных процессах. Белок транслоцируется из мембран, где он ассоциирован с PIP2, в ядро, где он может соединяться ДНК в ответ на активацию специфических G protein-coupled рецепторов, таких как рецепторы serotonin (5-HT) (Santagata et al. 2001). Учитывая, что передача сигналов 5-HT интимно участвует в контроле веса, поведения питания и отложении жира (rev. .Meguid et al. 2000) и что 5-HT(6) рецепторы локализуются в ресничках некоторых нейронов (Brailov et al. 2000), можно предположить, что BBS и Tubbv белки контролируют ожирение, делая возможной передачу serotonergic сигналов внутри ресничек.
Механические исследования на C. elegans показали, что белки BBS обладают специфической функцией в специализированных ресничках, которые обладают singlet микротрубочками, распространяющимися от дистального конца к стандартным наружным дублетам. C. elegans BBS7 и BBSS необходимы для сборки дистального сегмента реснички и могут координировать активность двух антероградных моторов,kinesin-II и Osm-3 (Ou et al. 2005, X. Pan et al. 2006). Это открывает возможность того, что BBS белки млекопитающих не играют роль во всех ресничках, а скорее участвуют в специализированных функциях ресничек определенного типа, таких как конструкция и поддержание дистального сегмента фоторецепторных клеток.
Meckel-Gruber syndrome type 3 и синдром Joubert type 6 также обнаруживают кистозную дисплазию почек и уродства ЦНС и оба ассоциируют с мутациями в гене MKS3 (Smith et al. 2006, Baala et al. 2007). MKS3 кодирует Meckelin, новый 7 раз пронизывающий трансмембранный белок, родственный Frizzleds, компонентами Wnt рецепторов. Подобно некоторым др. белкам сходной структуры, таким как Smo и 5-HT рецепторы, Meckelin локализуется в первичных ресничках и в плазматической мембране и ко-иммунопреципитируется с MKS1, фактором, ассоциирующим с базальным тельцем, мутантным при Meckel-Gruber syndrome type 1 (Dawe et al. 2007). Эти находки подтверждают, что Meckelin и MKS1 действуют в специализированных ресничках, участвуя в путях передачи неидентифцировнных сигналов, которые важны для развития почек и ЦНС. ARE PRIMARY СILIА SIGNAL TRANSDUCTION MACHINES? Ранее было показано, что реснички действуют как "biological nanomachines" для подвижности (Satir 1999). Сложность событий, которые имееют место в ресничках во время передачи сигналов, указывает на то, что это может быть пригодным для рассматривания ресничек как органелл, которые действуют как поступательные машины для передачи сигналов. Как показано на Figure 3, современные данные подтверждают модель передачи сигналов Hh у млекопитающих, которая зависит от упорядоченной серии событий, которые происходят внутри реснички. В отсутствие лиганда ресничка обеспечивает основную линию регуляции Gli транскрипционных факторов, которые д. быть локализованы в этой структуре, чтобы подвергнуться процессингу. Активация пути с помощью Hh лиганда способствует перемещению трансмембранного белка Smo к основанию реснички так , что этот белок сможет транспортироваться дистально на кончик. Здесь активированный Smo, как полагают, подвергается упорядоченному набору взаимодействий с нижестоящими компонентами, которые, в свою очередь, заставляют белки Gli избегать подавления с помощью Sufu и становятся активированными. Когда эти реакции завершаются, то соотв. образом модифицированные Glis д. транспортироваться обратно к основанию реснички, возможно с помощью ретроградного IFT, а отсюда они д. осуществлять свой путь в ядро клетки. Если дополнительные сигнальные пути зависят от ресничек in vivo, то сложная организация ресничек может также действовать как платформа для специфических взаимодействий между разными сигнальными путями.
Было также предположено, что реснички, которые выпячиваются во внеклеточное пространство, действуют как антенны для получения внеклеточных сигналов (Singla & Reiter 2006). Если Hh лиганды соединяются с Patched рецепторами в ресничке, то ресничка в самом деле может действовать как антенна, но как та, что купирована с клеточной машиной для перерабитки и интеграции сигналов.
|