Формирование эмбриона осуществляется за счет комбинации коллективных клеточных перемещений, которые приводят к диверсификации клеток и образованию тканей (1-4). Большинство этих морфогенетических событий динамичны и характеризуются одновременные выполнением разных движений, при этом большие популяции клеток движутся в трехмерном пространстве (3D) глубоко внутри эмбриона (4, 5). Гаструляция является самым ранним морфогенетическим событием с участием массивных клеточных перемещений зародышевых слоёв (6). Т.к. технически трудно наблюдать движения отдельных клеток внутри эмбриона не повреждая их жизнеспособности, поэтому изучение миграции мезодермальных клеток во время гаструляции
Drosophila было использовано для экстраполяции динамических событий с наблюдений фиксированных эмбрионов (Fig. 1, A and B) или из описаний
in vivo небольших количеств клеток (7-9).
Использовали оптимизированную two-photon excited fluorescence (2PEF) (10,11), чтобы получить картины крупных доменов эмбрионов
Drosophila повсеместно экспрессирующих ядерный green fluorescent protein (GFP) (Fig. 1, C and D) (12) с достаточным пространственным и временным разрешением, чтобы исследовать неинвазивно распределение мезодермы свыше 2-х час (Fig. IE and movie SI) (13). Экстрагировали комплекс клеточных движений мезодермальных и эктодермальных клеток с каждых крупных изобразительных данных (~3 billion voxels), используя 3D сегментацию клеточных позиций и 3D слежение во времени (Fig. 1, F to H, и movie S2). Для этого было проанализировано более 100,000 позиций клеток на эмбрион (movie S3) (13). Был использован компьютерный анализ, чтобы отследить три основных морфогенетические события мезодермы (Fig. IF) и подтвердили, что слой эктодермальных клеток, по которому мигрируют мезодермальные клетки, подвергается элонгации зародышевого диска посредством конвергентных вытягивающихся движений (Fig. 1,1 and J) (14,15).
Мы разработали инструменты для экстракции количественной информации о траекториях клеток и для описания динамического поведения в деталях (movie S3) (13). Сначала мы переопределили позиции клеток в соответствии с цилиндрической системой координат [radial (r), angular (Θ) и longitudinal (L)] путем подгонки к цилиндру средних позиций эктодермальных клеток. Эта система координат в отличие от страндартной системы Декартовых координат (x, y и z), более подходит к плану тела эмбрионов дрозофилы и геометрии их морфогенетических событий (Fig. 2, A to E, fig. S1, и movie S4) (14, 15). в
Было установлено влияние движений эктодермальных клеток на миграторный путь лежащей поверх мезодермы путем исследования согласия между движениями этих двух клеточных популяций. Эктодерма находится в тесном физическом контакте с мезодермой: мезодерма инвагинирует из эктодермы и эктодерма служит в качестве субстрата, на котором мезодермальные клетки распространяются во время элонгации зародышевого диска (15,16). Предыдущие количественные исследования показали связь их движений; у мутантов, которые неспособны формировать эктодерму, мезодермальные клетки специфицируются, но неспособны к перемещению (14). Статистический анализ данных показал, что траектории мезодермальных и эктодермальных клеток сильно скоррелированы в передне-заднем направлении (AP) (ось L) (Fig. 2H). Однако в др. направлениях ( r и Θ оси), корреляции мало или она отсутствует (Fig. 2, F and G). Вычленение осевых перемещений локальных эктодермальных клеток от перемещения каждой мезодермальной клетки не выявило остаточных перемещений мезодермы в L направлении (Fig. 2I and movies S5 и S6), это указывает на то, что мезодермальные клетки захватываются сильным движением эктодермы в этом направлении во время элонгации зародышевого диска. Отсутствие корреляции в радиальном и ангулярном направлении указывает на то, что мезодермальные клетки подвергаются активному движению, отличному от такового эктодермы.
В ангулярном направлении (Θ), движение мезодермальных клеток было симметричным в отношении срединной вентральной линии эмбриона, ка было продемонстрировано с помощью средних значений а из а (Fig. 2D). Использовали цветные коды для идентификации каждого клеточного трека с помощью его оригинальной позиции в борозде (Fig. 3A), в результате был выявлен стабильный цветной паттерн траекторий в а направлении, это подчеркивает тот факт, что пространственная организация клеток в этом направлении сохраняется (консервируется) с течением времени. Прямизна траекторий и ограниченное перемешивание клеток подтверждают мнение, что движения клеток направлены. Клеточные траектории показывают, что группы клеток, возникшие
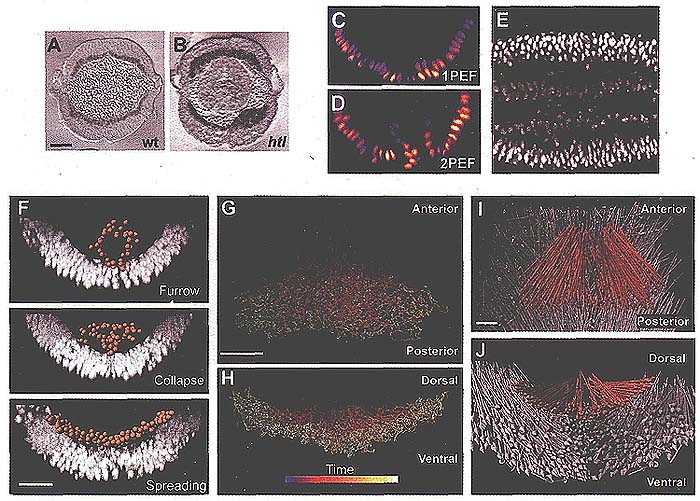 Fig. 1. Two-photon microscopy and analysis of histone2A (H2A)-GFP expressing embryos captures key events in gastrulation. (A and B) Cross-sections of wild-type (A) and htl mutant (B) embryos stained with antibody to Twist. (C and D) Confocal 1PEF (0 fails to image internalized mesoderm cells, whereas 2PEF (D) captures the positions of the internalized cells. (E) A 50-um-deep and 10-um-thick lateral slice through an H2A-GFP embryo demonstrates the signal-to-noise ratio (anterior, left). (F) Segmentation of mesoderm nuclei (orange spheres) by the use of Imaris software (Bitplane AG, Zurich, Switzerland). Each sphere was defined by the fluorescent intensity of H2A-GFP. Furrow formation, furrow collapse as a result of an EMT, and spreading of the mesoderm to form a monolayer are illustrated from top to bottom, respectively. (G to J) Tracking cell positions in three dimensions over time. Shown are dorsal (G) and posterior (H) views of mesoderm tracks (blue and yellow indicate early and late time points, respectively) and dorsal (I) and posterior (]) views of mesoderm (orange) and ectoderm (gray) net displacement vectors. Scale bars, 20 µm.
Fig. 1. Two-photon microscopy and analysis of histone2A (H2A)-GFP expressing embryos captures key events in gastrulation. (A and B) Cross-sections of wild-type (A) and htl mutant (B) embryos stained with antibody to Twist. (C and D) Confocal 1PEF (0 fails to image internalized mesoderm cells, whereas 2PEF (D) captures the positions of the internalized cells. (E) A 50-um-deep and 10-um-thick lateral slice through an H2A-GFP embryo demonstrates the signal-to-noise ratio (anterior, left). (F) Segmentation of mesoderm nuclei (orange spheres) by the use of Imaris software (Bitplane AG, Zurich, Switzerland). Each sphere was defined by the fluorescent intensity of H2A-GFP. Furrow formation, furrow collapse as a result of an EMT, and spreading of the mesoderm to form a monolayer are illustrated from top to bottom, respectively. (G to J) Tracking cell positions in three dimensions over time. Shown are dorsal (G) and posterior (H) views of mesoderm tracks (blue and yellow indicate early and late time points, respectively) and dorsal (I) and posterior (]) views of mesoderm (orange) and ectoderm (gray) net displacement vectors. Scale bars, 20 µm.
из верхних латеральных частей борозды (Fig. 3 A) оказываются расположенными на каждом из ведущих краев популяции мезодермальных клеток, и это сохраняется в течение всего хода их миграции (movie S7). Эти ведущие клетки не были не первыми, ни последними из инвагинировавших; их локализация внутри борозды позиционирует их в ведущее положение, когда борозда спадается после epithelial-to-mesenchymal transition (EMT).
Мы исследовали и др. морфогенетические события, которые могут вносить вклад в распределение мезодермы, такие как паттерн клеточных делений и клеточные интеркаляции, базируясь на наших данных по трекам клеток. Каждая мезодермальная клетка делится дважды (7, 8, 17, 18) и эти деления упорядочены в пространстве и во времени (Fig. 3B). Клетки, ближайшие к эктодерме, делятся первыми, затем следуют клетки ближайшие к вершине вентральной борозды. Эта последовательность сохраняется и во время второго клеточного цикла. Анализ клеточных делений мутантов не выявляет каких-либо характерных дефектов миграции мезодермы, наблюдаемых на фиксированных срезах (fig. S6) (18). Данные по трекам показывают, что ориентация клеточных делений в мезодерме случайна и что изменение организации клеточных делений не оказывает эффекта на распространение мезодермы или жизнеспособность эмбрионов (fig. S7, A to C). Т.о., маловероятно, что эти организованные клеточные деления играют роль в распределении мезодермы. События радиальной клеточной интеркаляции (19) оказывались синхронными со второй волной клеточных делений (Fig. 3, C and D), но ориентация клеточных делений, по-видимому, не играет роли в интеркаляционных движениях. Интеркаляция мезодермальных клеток вносит вклад в формирования и распределение монослоя (Fig. 3, C and D).
Чтобы облегчить сравнения между эмбрионами, мы разработали статистический анализ, характеризующий поведение распределения мезодермальных клеток. Как предполагалось в соответствии с пространственной организацией распределения (Fig. 3 A), ангулярные позиции каждой из клеток в начале (Θstart) и в конце (Θend) процесса были высоко скоррелированы. Построение кривых стартовых и конечных позиций выявило линейные взаимоотношения (fig. S4, A to C). Учитывая это, были использованы линейные регрессии, которые были приложены к Θend(Θstart) значениям, которые позволили измерить как силу распространения (как наклон линии, A) (fig. S4, D and E) , так и количественно измерить коллективное поведение (степень корреляции, R) (13). Клетки дикого типа обнаруживали упорядоченное поведение распространения [Θend a 2(Θstart)], которое было общим для большинства клеток (R > 0.9) (fig. S5). Сравнение регрессионного анализа от 5 эмбрионов дикого типа показало постоянство клеточного поведения (n = 5 эмбрионов и n = 596 клеток) (fig. S5).
Предыдущие исследования фиксированных эмбрионов (8, 9,20,21) подтвердили, что передача сигналов fibroblast growth factor (FGF) участвует в регуляции миграции мезодермальных клеток, но его точная функция осталась неизвестной. Мы использовали нашу методологию для изучения функции сигнального пути FGF на регуляцию гаструляции путем анализа эмбрионов, мутантных по FGF рецептору heartless (htl) точно также как у эмбрионов дикого типа (figs. S2 and S3 and movie S9). Мы продемонстрировали, что клеточные перемещения у
htl мутантных эмбрионов в отношении r, Θ и L (fig. S3, A to C), делают возможным прямое сравнение с эмбрионами дикого типа (Fig. 2, C to E). Связанные с эктодермой перемещения мезодермальных клеток в L направлении оставались неизменными у
htl мутантов (fig. S3F), и мы не получили доказательств
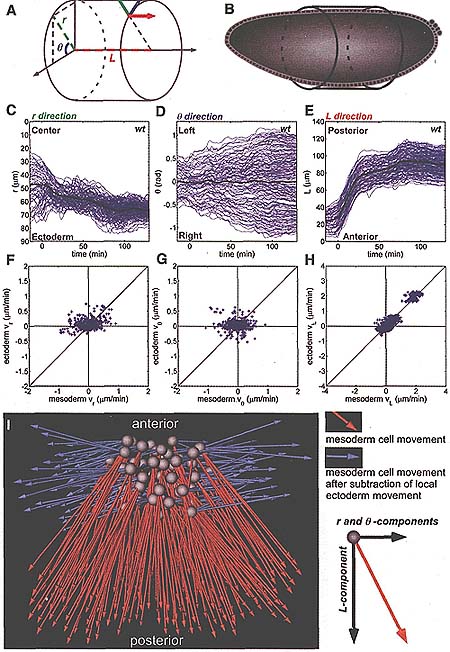 Fig. 2. Decomposition and correlative analysis of cell movements with the use of cylindrical coordinates. (A and B) The use of cylindrical coordinates allows the positioning of cells according to the body plan of the embryo at stage 6. (C to E) Cell trajectories (blue lines) reveal that each axis corresponds to a morphogenetic movement. (C) r is the radial position over time (for example, furrow collapse and intercalation; 0 indicates the center of the embryo). (D) 6 is the angular movement (for example, mesoderm spreading and ectoderm convergence; 0 indicates the position of the ventral midline). (E) L corresponds to the movement of cells along the length of the embryo (for example, germ-band elongation). In (C) to (E), time (f) = 0 is set as the point when AP movement begins. (F to H) Correlation of the velocity (v) of each mesoderm cell with its six nearest ectodermal neighbors along the (F) radial, (G) angular, and (H) AP axes, with correlation values of 0.21 ± 0.43, 0.08 ± 0.18, and 0.90 ± 0.06, respectively (n = 3 embryos). (I) Dorsal view of mesoderm cell displacement before (orange) and after (blue) subtraction of local ectoderm cell movements.
Fig. 2. Decomposition and correlative analysis of cell movements with the use of cylindrical coordinates. (A and B) The use of cylindrical coordinates allows the positioning of cells according to the body plan of the embryo at stage 6. (C to E) Cell trajectories (blue lines) reveal that each axis corresponds to a morphogenetic movement. (C) r is the radial position over time (for example, furrow collapse and intercalation; 0 indicates the center of the embryo). (D) 6 is the angular movement (for example, mesoderm spreading and ectoderm convergence; 0 indicates the position of the ventral midline). (E) L corresponds to the movement of cells along the length of the embryo (for example, germ-band elongation). In (C) to (E), time (f) = 0 is set as the point when AP movement begins. (F to H) Correlation of the velocity (v) of each mesoderm cell with its six nearest ectodermal neighbors along the (F) radial, (G) angular, and (H) AP axes, with correlation values of 0.21 ± 0.43, 0.08 ± 0.18, and 0.90 ± 0.06, respectively (n = 3 embryos). (I) Dorsal view of mesoderm cell displacement before (orange) and after (blue) subtraction of local ectoderm cell movements.
дефектов событий клеточных делений (fig. S7D). Однако,
htl мутантные эмбрионы обнаруживали дефекты мезодермальных клеток, которые касались как коллапса борозды (r ось) так и распределения в angular направлении (Θ ось) (fig. S3, A and B). Статистический анализ клеточных перемещений для данных треков
htl мутантов показал значение разрозненного распределения Θend(Θstart) (figs. S41 and S5), приводящее к низким значениям распространения и корреляции (A < 1 and R < 0.5 to 0.7, соотв.) (fig. S5C). Значения, полученные при анализе индивидуальных
htl эмбрионов или путем объединения по клеткам от множественных
htl эмбрионов (n = 3 эмбриона и n = 284 клеток) (fig. S5, B and C) количественно продемонстрировали, что сходное нарушение распределения присутствует у всех
htl эмбрионов в
Анализ клеточных треков выявил, что потеря передачи сигналов FGF затрагивает мезодермальные клетки не-гомогенно (movie S10). В радиальном направлении
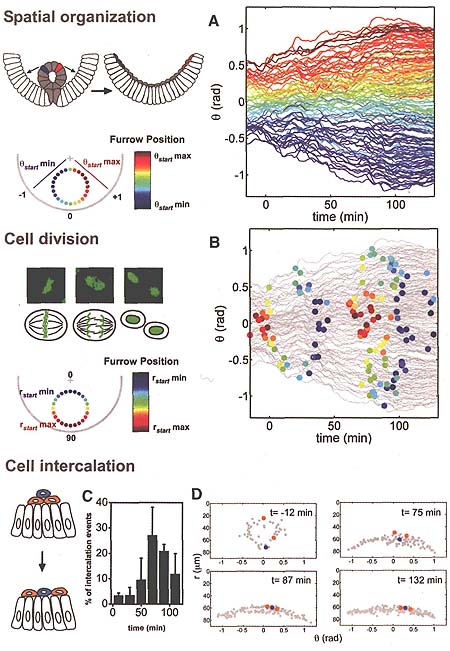 Fig. 3. Quantitative analysis of morphogenetic events reveals a high level of organization in wild-type embryos. (A) A color code marks the angular position of cells in the furrow at stage 7 and shows the spatial organization as cells move over time, rad, radians. Each line represents the trajectory of one cell. (B) Position and timing of each cell division (colored circle). The color code represents the radial position in the furrow at stage 7. DNA morphology during cell division in H2A-GFP embryos is shown (top left). (C) Analysis of intercalation events within the mesoderm over time shown as a percentage of mesoderm cells intercalating (n = 3 embryos). (D) The position of mesoderm cells before and after intercalation events.
Fig. 3. Quantitative analysis of morphogenetic events reveals a high level of organization in wild-type embryos. (A) A color code marks the angular position of cells in the furrow at stage 7 and shows the spatial organization as cells move over time, rad, radians. Each line represents the trajectory of one cell. (B) Position and timing of each cell division (colored circle). The color code represents the radial position in the furrow at stage 7. DNA morphology during cell division in H2A-GFP embryos is shown (top left). (C) Analysis of intercalation events within the mesoderm over time shown as a percentage of mesoderm cells intercalating (n = 3 embryos). (D) The position of mesoderm cells before and after intercalation events.
клетки, возникшие из верхней половины борозды ("upper-furrow" cells) в целом не подвергаются коллапсу, оставаясь удаленными от эктодермы во время всего исследования (Fig. 4A, fig. 3SA, and movies S11 and S8). Ангулярные перемещения клеток upper-furrow сильно нарушались у
htl мутантов (Fig. 4, B to G). Напротив, последние клетки, чтобы инвагинировать у
htl мутантов, которые давали нижнюю часть борозды, вели себя точно также как и мезодермальные клетки дикого типа и могут достигать той же самой дорсальной позиции, что и клетки дикого типа (Fig. 4G). Статистический анализ клеточных перемещений клеток из верхней и нижней части брозды подтвердил присутствие двух разных поведенческих типов клеток у
htl эмбрионов (fig. S5, D and E). Др подходы по мечению клеток, такие как photoactivatable GFP, могут быть использованы для характеристики мутантных фенотипов, но они отслуживают ограниченные количества клеток (7) это затрудняет интерпретацию, особенно, когда имеются разные типы поведений клеток, такие как у
htl мутантных эмбрионов.
Некоторые клетки из верхней часть борозды у htl мутантов обнаруживают нормальные позиции в Θend(Θstart) graph, сходные с таковыми у эмбрионов дикого типа. Эти клетки были расположены вблизи эктодермы в конце распространения (Fig. 4,1 and J, and fig. S4J). Это указывает на то. что расстояние от эктодермы может оказывать существенное влияние на поведение распространения. В самом деле, различие между двумя миграторными поведениями, наблюдалось яснее, когда анализировали клетки, которые были ближе или дальше к эктодерме (Fig. S5, D and E). Мы подтвердили, что такое объединение Θend(Θstart) graph с использованием цветового кода для радиального положения клеток в конце процесса распределения (Fig. 4, H and I): htl клетки, которые следуют поведению дикого типа [Θend ~ 2(Θstart) так что A = 2] оказываются вблизи к эктодерме (Fig. 4I, green), тогда как клетки, которые остаются вдали от эктодермы (Fig. 4I, red) обнаруживают четкое нарушение поведения, так что некоторые клетки пересекают срединную линию и миририруют в неправлильно направлении (A < 0). Все клетки дикого типа поведения оказываются вблизи к эктодерме (Fig. 4H).
Наш анализ предоставляет некоторую информацию о htl мутантном фенотипе. Во-первых, первичной функцией передачи сигналов FGF д. быть помощь всем клеткам в борозде, которые подвергаются коллапсу, направляющая их в направлении эктодермы (Fig. 4K). Во-вторых, др. пока не идентифицированный сигнал д. наводить миграцию клеток в ангулярном направлении в направлении дорсальной эктодермы, т.к. эти перемещения наблюдаются и в отсутствие сигналов FGF. В-третьих, контакт с эктодермой является ключевым для мезодермального ответа на этот сигнал наведения, т.к. расстояние мезодермальных клеток от эктодермы предопределяет их компетентность к миграции. Любая клетка, которая соприкасается с эктодермой становится способной к направленному движению в ангулярном направлении в ответ на сигнал, который не может зависеть исключительно от FGF. Перемещение мезодермальных клеток может нуждаться в контакте с эктодермой, чтобы они стали компетентными отвечать на направляющий сигнал, как это продемонстрировано на др. системах (22-24).
Данное исследование демонстрирует, что стереотипические морфогенетические события во время развития эмбриона могут быть оценены количественно, проанализированы и сравнены у эмбрионов дикого типа и мутантных
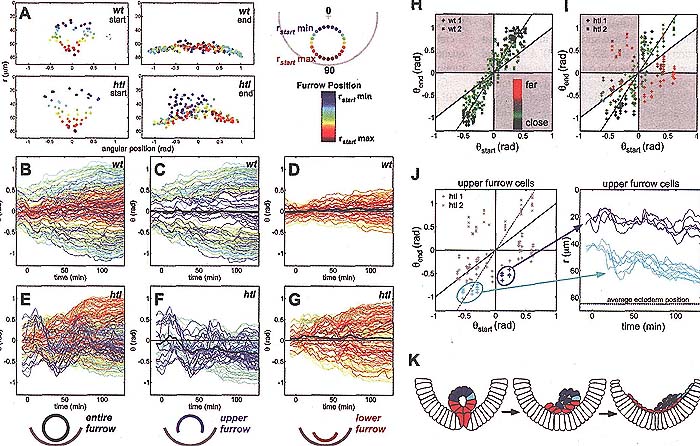 Fig. 4. Furrow collapse and spreading of mesoderm cells are disrupted in htl mutants. (A) Position of mesoderm cells (circles) at stage 7 and stage 10 in wild-type and htl embryos shown with a radial color code. (B to G) Angular movement of cells over time analyzed in wild-type [(B) to (D)] and htl mutant [(E) to (G)] embryos within the entire [(B) and (E)], upper [(C) and if)], and lower [(D) and (G)] furrow (black line indicates the average mesoderm displacement with respect to the midline). (H and I) Spreading profile of wild-type (H) and htl (I) embryos. The color code represents the distance from the ectoderm at the end of spreading (red indicates far from ectoderm and green indicates close to ectoderm). The gray line represents a spreading coefficient of A = 2, where Θend = A(Θstart) + B [B,
constant (13)]. Cells that do not spread within the collective are represented within gray regions of the graph (13). In general, cells located close to the ectoderm fall along the gray line. (J) The radial position (r) of two particular groups of mesoderm cells from the upper furrow of htl mutants is depicted over time. One group exhibits normal spreading behavior (light blue), and the other group exhibits aberrant spreading (dark blue). (K) The furrow collapse in htl mutants is disrupted, resulting in cells falling randomly to one side of the embryo. Upper-furrow cells that reach the ectoderm (light blue) undergo normal spreading, whereas cells that remain far from the ectoderm spread abnormally (dark blue). Red cells are Red indicates lower-furrow cells.
Fig. 4. Furrow collapse and spreading of mesoderm cells are disrupted in htl mutants. (A) Position of mesoderm cells (circles) at stage 7 and stage 10 in wild-type and htl embryos shown with a radial color code. (B to G) Angular movement of cells over time analyzed in wild-type [(B) to (D)] and htl mutant [(E) to (G)] embryos within the entire [(B) and (E)], upper [(C) and if)], and lower [(D) and (G)] furrow (black line indicates the average mesoderm displacement with respect to the midline). (H and I) Spreading profile of wild-type (H) and htl (I) embryos. The color code represents the distance from the ectoderm at the end of spreading (red indicates far from ectoderm and green indicates close to ectoderm). The gray line represents a spreading coefficient of A = 2, where Θend = A(Θstart) + B [B,
constant (13)]. Cells that do not spread within the collective are represented within gray regions of the graph (13). In general, cells located close to the ectoderm fall along the gray line. (J) The radial position (r) of two particular groups of mesoderm cells from the upper furrow of htl mutants is depicted over time. One group exhibits normal spreading behavior (light blue), and the other group exhibits aberrant spreading (dark blue). (K) The furrow collapse in htl mutants is disrupted, resulting in cells falling randomly to one side of the embryo. Upper-furrow cells that reach the ectoderm (light blue) undergo normal spreading, whereas cells that remain far from the ectoderm spread abnormally (dark blue). Red cells are Red indicates lower-furrow cells.
эмбрионов на больших группах живых клеток. Сложные клеточные перемещения могут быть разбиты на определенные типы клеточного поведения, это указывает на высокий уровень организации и позволяет интерпретировать умеренные мутантные фенотипы у
Drosophila и позволит понять коллективную миграцию клеток и эмбриональное развитие с молекулярного уровня до целого организма (25).
Supporting Online Material
www.sciencemag.org/cgi/content/full/322/5907/fpagel/DCl
Сайт создан в системе
uCoz 
 Fig. 2. Decomposition and correlative analysis of cell movements with the use of cylindrical coordinates. (A and B) The use of cylindrical coordinates allows the positioning of cells according to the body plan of the embryo at stage 6. (C to E) Cell trajectories (blue lines) reveal that each axis corresponds to a morphogenetic movement. (C) r is the radial position over time (for example, furrow collapse and intercalation; 0 indicates the center of the embryo). (D) 6 is the angular movement (for example, mesoderm spreading and ectoderm convergence; 0 indicates the position of the ventral midline). (E) L corresponds to the movement of cells along the length of the embryo (for example, germ-band elongation). In (C) to (E), time (f) = 0 is set as the point when AP movement begins. (F to H) Correlation of the velocity (v) of each mesoderm cell with its six nearest ectodermal neighbors along the (F) radial, (G) angular, and (H) AP axes, with correlation values of 0.21 ± 0.43, 0.08 ± 0.18, and 0.90 ± 0.06, respectively (n = 3 embryos). (I) Dorsal view of mesoderm cell displacement before (orange) and after (blue) subtraction of local ectoderm cell movements.
Fig. 2. Decomposition and correlative analysis of cell movements with the use of cylindrical coordinates. (A and B) The use of cylindrical coordinates allows the positioning of cells according to the body plan of the embryo at stage 6. (C to E) Cell trajectories (blue lines) reveal that each axis corresponds to a morphogenetic movement. (C) r is the radial position over time (for example, furrow collapse and intercalation; 0 indicates the center of the embryo). (D) 6 is the angular movement (for example, mesoderm spreading and ectoderm convergence; 0 indicates the position of the ventral midline). (E) L corresponds to the movement of cells along the length of the embryo (for example, germ-band elongation). In (C) to (E), time (f) = 0 is set as the point when AP movement begins. (F to H) Correlation of the velocity (v) of each mesoderm cell with its six nearest ectodermal neighbors along the (F) radial, (G) angular, and (H) AP axes, with correlation values of 0.21 ± 0.43, 0.08 ± 0.18, and 0.90 ± 0.06, respectively (n = 3 embryos). (I) Dorsal view of mesoderm cell displacement before (orange) and after (blue) subtraction of local ectoderm cell movements.  Fig. 3. Quantitative analysis of morphogenetic events reveals a high level of organization in wild-type embryos. (A) A color code marks the angular position of cells in the furrow at stage 7 and shows the spatial organization as cells move over time, rad, radians. Each line represents the trajectory of one cell. (B) Position and timing of each cell division (colored circle). The color code represents the radial position in the furrow at stage 7. DNA morphology during cell division in H2A-GFP embryos is shown (top left). (C) Analysis of intercalation events within the mesoderm over time shown as a percentage of mesoderm cells intercalating (n = 3 embryos). (D) The position of mesoderm cells before and after intercalation events.
Fig. 3. Quantitative analysis of morphogenetic events reveals a high level of organization in wild-type embryos. (A) A color code marks the angular position of cells in the furrow at stage 7 and shows the spatial organization as cells move over time, rad, radians. Each line represents the trajectory of one cell. (B) Position and timing of each cell division (colored circle). The color code represents the radial position in the furrow at stage 7. DNA morphology during cell division in H2A-GFP embryos is shown (top left). (C) Analysis of intercalation events within the mesoderm over time shown as a percentage of mesoderm cells intercalating (n = 3 embryos). (D) The position of mesoderm cells before and after intercalation events. 