Convergent extension (CE) (Keller, 2002) является одним из наиболее важных клеточных перемещений во время гаструляции, вносящим вклад в формирование трех зародышевых листков и становление удлиненного плана тела с характерной передне-задней осью тела, начиная с бластулы. Это является процессом сужения ткани вдоль одной из осей (mediolateral оси) и одновременным удлинением вдоль перпендикулярной оси (anterior-to-posterior или A-P оси). Во время гаструляции мезодермальные клетки подвергаются CE, чтобы установить передне-заднюю ось тела и удлинить его вдоль этой оси (Keller, 2002). CE играет также важную роль во время нейруляции. На ст. нейрулы клетки нейральной эктодермы испытывают CE, чтобы растянуться вдоль А-Р оси и закрыть нервную трубку (Keller, 2002). Во время гаструляции у
, было показано, используя Keller's экспланты, что мезодермальные клетки сначала подвергаются радиальной интеркаляции, чтобы сформировать более тонкую ткань и затем интеркалируют медиолатерально (Keller et al., 1985). Медиолатеральная интеркаляция клетое ведет к конвергенции (сужению) ткани вдоль той же самой (mediolateral) оси и вытягиванию вдоль перпендикулярной А-Р оси. Т.к. клеточное поведение и движущие силы радиальной интеркаляции неизвестны, но известно, что при медиолатеральной интеркаляции клетки поляризуются или удлиняются вдоль медиолатеральной оси и проецируют медиолатерально ориентированные ламеллаподии (Wilson and Keller, 1991, Keller, 2002). Компьютерные модели указывают на то, что силы, генерируемые с помощью protrusive активности клеток вдоль медиолатеральной оси достаточны, чтобы осуществлять интеркаляцию клеток вдоль той же самой оси (Zajac et al., 2003, Brodland, 2006, Brodland and Veldhuis, 2006). Эта гипотеза согласуется с наблюдением, что компоненты актино-миозинового цитоскелета необходимы для интеркаляции клеток (Zallen and Wieschaus, 2004). У млекопитающих морфогенетические изменения указывают на то, что сходные CE перемещения клеток происходят и при гаструляции и нейруляции. Однако, процесс CE у млекопитающих пока не задокументирован непосредственно.
Во время терминальной дифференцировки на ст. E14.5-E18.5, постмитотический кортиев орган истончается с эпителия толщиной в 4-5 клеток в финальную двухслойную структуру и удлиняется значительно вдоль продольной оси (Chen et al., 2002, McKenzie et al., 2004). Удлинение и истончение не зависят от пролиферации и гибели клеток внутри развивающегося кортиевого органа, соотв., указывая на то, что клеточная перестройка внутри короткого и толстого сенсорного зачатка ведет к формированию боле длинного и тонкого зрелого органа (Chen et al., 2002). Такого типа клеточные перемещения довольно сходны с процессом CE, который происходит во время гаструляции и нейруляции у
. Морфологические и функциональные исследования ещё больше подтверждают. что радиальные и медиолатеральные интеркаляции клеток, характерные для CE скорее всего участвуют в удлинении
улитки и формировании паттерна волосковых клеток (Fig. 3) (Montcouquiol et al., 2003, McKenzie et al., 2004, Wang et al., 2005, Jones and Chen, 2007).
Терминальная дифференцировка и удлинение кортиевого органа происходит в реснитчатом эпителии между E14.5-E18.5 мышей. ЭМ и иммуноокрашивание показывают, что клетки в развивающейся улитке имеют по одной ресничке, содержит базирующийся на микротрубочках первичную ресничку (Davis et al., 2006), известную как kinocilium
(Figs. 1 and 2). Kinocilium впервые обнаруживается в центре верхушки возникающей волосковой клетки и окружен микроворсинками, состоящими из актиновых филамент униформных размеров (Sobkowicz et al., 1995). Затем эти микроворсинки начинают увеличиваться и становятся стереоцилиями. Киноцилий смещается в боковую сторону верхушки клетки, а стереоцилии растут в виде характерного "V"-образного паттерна с точкой соединения "V" расположенной вблизи kinocilium (Frolenkov et al., 2004). Полярность киноцилий, по-видимому, вызывает поляризацию стереоцилий, развитие стереоцилий и их полярность следуют градиенты дифференциации от основания к верхушке вдоль продольной оси и от внутренних к внешним волосковым клеткам вдоль медиолатеральной оси улитки. На ст. E18.5 у мышей полярность стереоцилий и киноцилий устанавливается вдоль всей длины канала улитки и поперек толщины кортиева органа. Установившись однажды, стереоцилии продолжают расти, созревать и обновляться. У млекопитающих киноцилии в улитке регрессируют постнатально. Временное присутствие и полярность киноцилий в улитке выполняют онтогенетическую роль. Однако, функция киноцилий в развитии улитки ещё не описана.
Planar cell polarity pathway in shaping the cochlea and
its sensory organ
PCP pathway
Интересно, что CE (Fig. 3B), как известно, участвующий в терминальной морфогенезе органа Корти (Chen et al., 2002), как было установлено регулируется у позвоночных за счет консервативного пути, пути planar cell polarity (PCP)(Wallingford et al., 2000, Keller, 2002, Mlodzik, 2002, Wallingford et al., 2002).
Путь PCP впервые был идентифицирован и охарактеризован относительно своей роли в регуляции различных форм PCP в тканях Drosophila (Gubb and Garcia-Bellido, 1982, Klein and Mlodzik, 2005, Strutt and Strutt, 2005). В тканях. которые обладают PCP, имеется хорошо определяемая плоскостная полярность как в от природы поляризованных структурах каждой индивидуальной клетки, так и в расположении разных клеток относительно одна др. внутри группы (Fig. 1). В кортиевом органе пучки стереоцилий каждой волосковой клетки расположены асимметрично в форме "V". Асимметричная природа "V"-образно расположенных стереоцилий представляет собой внутренне присущую поляризованную структуру внутри каждой волосковой клетки. Более того, все стереоцилии униформно ориентированы вдоль медиолатеральной оси улитки, обнаруживая точную координацию в расположении клеток относительно др. др. внутри группы. Плоскостная поляризация клеток как в отношении прирожденных структур, так и расположения клеток относительно др. др. во всей группе нуждается в трехярусной регуляции (Tree et al., 2002) согласно двум альтернативным моделям (Fig. 4). Обе модели нуждаются: в глобальных наводящих сигналах, передающих информацию о направлении (вышестоящих PCP генах), и в клеточных факторах для интерпретации направляющих сигналов путем приобретения поляризованной асимметричной локализации вдоль оси для поляризации (стержневые PCP гены) (Fig. 4). После формирования поляризованных стержневых PCP комплексов, третья и финальная ступень передачи сигналов PCP планарной поляризации поперек всей ткани может быть достигнута с помощью клеточно-специфических эффекторов, стоящих иерархически ниже стержневых PCP генов (нижестоящие PCP гены эффекторы), которые управляют формированием асимметричных структур внутри каждой клетки и координируют поляризацию всех клеток поперек всей ткани. Альтернативно, аппарат, который строит асимметричные структуры внутри каждой клетки независим от передачи сигналов PCP. Для достижения третьей ступени в передаче сигналов PCP планарной поляризации поперек ткани в этой второй модели, клеточные медиаторы (нижестоящие PCP гены медиаторы) связывают поляризованные стрежневые комплексы PCP с клеточной кухней, которая и создает асимметричные структуры внутри индивидуальных клеток скоординировано с планарной поляризацией во всех клетках во всей ткани (Fig. 4). В первой модели, нарушение передачи сигналов PCP д. приводить к дефектам как образования асимметричных структур внутри индивидуальных клеток, так и координации всех клеток поперек ткани. Во второй модели, однако, нарушение передачи сигналов PCP д. затрагивать только координацию планарной поляризации поперек ткани, но не продукцию асимметричных структур внутри индивидуальных клеток.
Генетические исследования на Drosophila идентифицировали ряд стержневых PCP генов, которые затрагивают все известные структуры с PCP признаками (Tree et al., 2002, Klein and Mlodzik, 2005, Strutt et al., 2006). Во время установления PCP, стрежневые PCP белки сортируются асимметрично вдоль оси поляризации и эта поляризованная ассоциация стержневых PCP белков необходима для планарной поляризации на ширину ткани (Axelrod et al., 1998, Axelrod, 2001, Tree et al., 2002, Klein and Mlodzik, 2005, Strutt and Strutt, 2005). Исследования на Xenopus и рыбках данио выявили законсервированный PCP путь у позвоночных, который состоит из сходной кассеты генов, включая Frizzled (Fz)(Djiane et al., 2000), Dishevelled (Dvl) (Sokol, 1996, Wallingford et al., 2000), Ltap/Vangl2 (Goto and Keller, 2002, Jessen et al., 2002, Park and Moon, 2002) and homologs of Diego (Schwarz-Romond et al., 2002, Moeller et al., 2006) и Prickle (Veeman et al., 2003), которые необходимы для CE во время гаструляции и нейруляции (Fig. 4). Стержневые PCP белки обнаруживают поляризованную субклеточную локализацию вдоль передне-задней оси (Jiang et al., 2005, Ciruna et al., 2006). Вместе с медиолатерально поляризованными сортирующими Par комплексами (Hyodo-Miura et al., 2006, Mlodzik, 2006), стрежневые PCP белки скорее всего выполняют инструктивные роли для направления медиолатеральной интеркаляции клеток во время CE (Mlodzik,2006).
Стержневой PCP компонент Fz может служить в качестве рецептора для сигнальных молекул Wnt (Moon, 2005). Соединение Wnt с Fz может активировать канонический путь Wnt, в котором β-catenin стабилизируется для транскрипционной активации нижестоящих генов мишеней. Передача сигналов PCP
не использует β-catenin обусловленную транскрипционную активацию, а вместо этого использует цитоскелетные мишени (т. известный как неканонический Wnt путь). Т.к. поляризация клеток во всем поле нуждается в информации о направлении, а Wnts в качестве морфогенов могут выполнять такую направляющую роль, поэтому Wnts активно проверялись в отношении их потенциального участия в PCP. Однако, Wnts, по-видимому, безразличны для PCP в некоторых тканях
Drosophila (Ma et al., 2003, Klein and Moldzik, 2005, Strutt and Strutt, 2005). Математическая модель (Amonlirdviman et al., 2005),
чьи предсказания были протестированы экспериментально, ещё сильнее подтвердили регуляцию с помощью морфоген-независимой петли обратной связи поляризации на длинные расстояния. Напротив, два недавних исследования показали на инструктивную роль Wnt и Hh в ориентации denticles (актиновых выпячиваний) на эпидермисе эмбрионов
Drosophila (Colosimo and Tolwinski, 2006, Price et al., 2006). Следовательно, возможно, что плоскостная поляризация эпителия на ширину ткани может использовать независимый от морфогена механизм для поляризации на большую дальность, инструктивный сигнал-зависимый механизм поляризации на короткие расстоянния или комбинацию обоих. В противоположность разнообразным ролям их в установлении эпителиальной PCP у
Drosophila, вышестоящие морфогены всё же участвуют в передаче сигналов PCP для CE у позвоночных (Heisenberg et al., 2000, Smith et al., 2000, Tada and Smith, 2000, Kilian et al., 2003, Ohkawara et al., 2003). У
Xenopus и рыбок данио, Wnt5 и Wnt11 необходимы для CE (Heisenberg et al., 2000, Smith et al., 2000, Tada and Smith, 2000, Kilian et al., 2003, Ohkawara et al., 2003) и их роль в
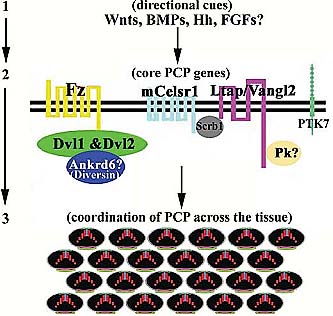 Fig. 4. A model of planar cell polarity (PCP) regulation in the cochlea.
The establishment of PCP across the organ of Corti requires a threetiered
regulation: (1) upstream factors for directional information along
the mediolateral axis of the cochlea; (2) core PCP proteins form polarized
complexes along the mediolateral axis of the cochlea; (3) unknown
cellular mediators link polarized core PCP complexes to the machinery
that builds the "V"-shaped stereocilia in individual hair cells and orient the
vertices of the "V"-shaped stereocilia toward the periphery of the
spiraling cochlea, establishing uniformly oriented stereocilia across the
organ of Corti. The identity and the role of the upstream factors were
hypothesized; and the role of Pk and Ankrd6/Diversin in inner ear was
hypothesized based on their role in PCP signaling in Drosophila and in CE
in zebrafish. Several core PCP proteins are observed at the boundaries
between supporting cells and between hair cells and supporting cells in
a polarized manner along the mediolateral axis of the cochlea. Their
localization to one or both cells at the boundaries has not been determined
unequivocally
Fig. 4. A model of planar cell polarity (PCP) regulation in the cochlea.
The establishment of PCP across the organ of Corti requires a threetiered
regulation: (1) upstream factors for directional information along
the mediolateral axis of the cochlea; (2) core PCP proteins form polarized
complexes along the mediolateral axis of the cochlea; (3) unknown
cellular mediators link polarized core PCP complexes to the machinery
that builds the "V"-shaped stereocilia in individual hair cells and orient the
vertices of the "V"-shaped stereocilia toward the periphery of the
spiraling cochlea, establishing uniformly oriented stereocilia across the
organ of Corti. The identity and the role of the upstream factors were
hypothesized; and the role of Pk and Ankrd6/Diversin in inner ear was
hypothesized based on their role in PCP signaling in Drosophila and in CE
in zebrafish. Several core PCP proteins are observed at the boundaries
between supporting cells and between hair cells and supporting cells in
a polarized manner along the mediolateral axis of the cochlea. Their
localization to one or both cells at the boundaries has not been determined
unequivocally
CE, по-видимому, скорее пермиссивна, чем инструктивна. Кроме того, градированные передне-задние сигналы, такие как activin и BMPs, необходимы для CE у
Xenopus (Myers et al., 2002, Ninomiya et al., 2004). Точный механизм, лежащий в основе участия градированных передне-задних сигналов в CE неясен.
После формирования стержневых PCP белков на противоположных сторонах клетки вдоль оси планарной полярности, плоскостная поляризация в пределах ткани достигается посредством скоординированной морфологической поляризации. У Drosophila, три связанных с цитоскелетом белка, Inturned, Fuzzy и Fritz, функционируют ниже стержневых PCP генов (Park et al., 1996, Turner and Adler, 1998, Yun et al., 1999, Adler et al., 2004, Collier et al., 2005). Мутации в Inturned, Fuzzy и Fritz вызывают образование множественных волосков в аномальных местах в крыловых клетках (Adler et al., 2004, Collier et al., 2005), указывая тем самым, что эти гены могут функционировать как нижестоящие PCP медиаторы и связывать поляризованные стержневые PCP комплексы с аппаратом, который создает волоски в крыловых клетках, для скоординированной планарной поляризации во всех клетках в пределах крыла. Образование множественных волосков у этих мутантов указывает также на то, что эти нижестоящие медиаторы непосредственно регулируют образование волосков путем ограничения активности аппарата, который строит волоски в крыловых клетках.
Два члена семейства Rho GTPase, которые способны модифицировать компоненты цитоскелета, RhoA и Rac, участвуют у позвоночных в передаче сигналов PCP ниже из стрежневого PCP гена
Dvl во время CE у
Xenopus (Habas et al., 2001, Marlow et al., 2002, Habas et al., 2003, Phillips et al., 2005). Кроме того, Inturned, Fuzzy и др. связанный с цитоскелетом белок Dub необходимы для CE у
Xenopus и рыбок данио (Oishi et al., 2006, Park et al., 2006). Так, передача сигналов PCP и Par комплексы, по-видимому, необходимы только для медиолатеральной поляризации lamellapodia выпячиваний (Wallingford et al., 2000, Hyodo-Miura et al., 2006). Нарушения передачи сигналов PCP или комплексов Par не предупреждают активности lamellapodia выпячиваний, а скорее вызывают образование случайных и нестабильных lamellapodia выпячиваний (Wallingford et al., 2000, Hyodo-Miura et al., 2006). Следовательно, передача сигналов PCP может приводить только к скоординированной поляризации клеток в пределах ткани, но не к образованию асимметричных структур внутри индивидуальных клеток во время плоскостной поляризации эпителия, но не при образовании ламеллоподий во время CE.
PCP pathway and morphogenesis of the organ of Corti
Установление PCP в кортиевом органе происходит конкурентно с удлинением улитки с привлечением клеточных перестроек, характерных для CE, открывая тем самым возможность, что путь PCP у млекопитающих может регулировать оба процесса во время терминальной дифференцировки кортиевого органа (Chen et al., 2002).
В самом деле, мыши, дефектные по стрежневым PCP генам, включая, Ltap/Vangl2, Dvl1/2, Fz3/6 и Celsr1, обнаруживают различные степени неправильной ориентации стереоцилий (Fig. 5) (Curtin et al., 2003, Montcouquiol et al., 2003, Wang et al., 2005, Montcouquiol et al., 2006, Wang et
al., 2006a, Wang et al., 2006b). Расширенный и укороченный орган Корти описан также у некоторых из этих PCP мутантов (Fig. 5) (Montcouquiol et al., 2003, Wang et al., 2005, Wang et al., 2006a). Далее было продемонстрировано, что неправильная ориентация стереоцилий и появление дефектов CE являются характерными для дефектной передачи сигналов PCP внутри улитки, а не являются опосредованными результатами дефектов нервной трубки у мутантных животных (Wang et al., 2005). Эти данные подтверждают, что установление униформной ориентации стереоцилий и CE улитки регулируются и связаны с PCP путем млекопитающих.
Однако, процесс CE и клеточное поведение во время терминальной дифференцировки органа Корти не были продемонстрированы непосредственно. И неизвестно, является ли перестройка клеток активным процессом внутри развивающегося кортиевого органа или пассивным процессом, обусловленным клеточной интеркаляцией в окружении из эпителиальных и/или мезенхимных клеток и является ли необходим actin/myosin компонент цитоскелета. Ничего не значит, что Math1-/- животные не обнаруживали дифференцировки волосковых клеток и до не которой степени поддерживающих клеток (Bermingham et al., 1999, Chen et al., 2002, Woods et al., 2004, Matei et al., 2005), улитка, по-видимому, имеет нормальную длину (unpublished observation). Эти данные указывают на то, что дифференцировка полного набора волосковых клеток и поддерживающих клеток не существенна для удлинения улитки и её сенсорного органа. Окружающие эпителиальные и мезенхимные клетки могут быть достаточны для предоставления движущих сил для CE улитки.
Интригующий вопрос, как PCP путь млекопитающих конкурентно регулирует установление PCP, проявляющуюся в униформной ориентации стереоцилий волосковых клеток, и CE в улитке во время терминальной дифференцировки. Два процесса происходят конкурентно и дефекты обоих процессов взаимосвязаны у PCP мутантов. Однако, установление PCP в кортиевом органе и CE не являются взаимозависимыми. У Math1-/- животных, не обнаруживается явной PCP, морфологически поляризованных волосковых клеток и поддерживающих клеток, в эпителии улитки, тогда как удлинение улитки происходит нормально. Два процесса могут использовать перекрывающиеся сигнальные пути, но содержат отличающиеся молекулярные и клеточные компоненты. В согласии с этим мнением то, что некоторые стержневые PCP гены экспрессируются во всем эпителии улитки с более высокими уровнями в области медиальнее развивающегося кортиева органа. Внутри же развивающегося органа Корти Ltap/Vangl2, Dvl2 и Fz3/6 обнаруживают поляризованную субклеточную локализацию вдоль медиолатеральной оси улитки (Wang et al., 2005, Montcouquiol et al., 2006, Wang et al., 2006a, Wang et al., 2006b). В области медиальнее органа Корти субклеточная локализация этих стержневых PCP белков также поляризована, но по-видимому, вдоль оси основани-верхушка улитки, т.е. перпендикулярно медиолатеральной оси, наблюдаемой для PCP (data not published). Кроме того, вклад, вносимый клетками подлежащей мезенхимы улитки, в униформную ориентацию стереоцилий и клеточные перестройки внутри развивающегося кортиева органа, не был исследован.
Чтобы ориентировать униформно стереоцилии вдоль медиолатеральной оси улитки, д. присутствовать информация для медиального-латерального направлений во время развития. Подобно исследованиям
Drosophila PCP, были исследованы Wnts в отношении их потенциальной роли в передаче сигналов PCP в улитке. Wnt7a экспрессируется в столбчатых клетках, а добавление Wnt антагонистов и Wnt7a в культуру кортиевого органа приводило к неправильной ориентации стереоцилий
in vitro (Dabdoub et al., 2003). Однако,
Wnt7a-/- животные не имели очевидных дефектов в передаче сигналов PCP (Dabdoub et al., 2003), указывая тем самым, что пути компенсаторные или независимые от Wnts предоставляют информацию о направлениях для органа Корти во время развития. В самом деле. экспрессия др. Wnt молекулы, Wnt5a, ограничена областью медиальнее развивающегося органа Корти (Qian et al., 2007). Генетическая инактивация Wnt5a ведет к ~35% пенетрантности характерных CE дефектов в улитке (Qian et al., 2007). Более того, Wnt5a генетически взаимодействует с известным PCP геном
Ltap/Vangl2 в регуляции ориентации стереоцилий, удлинения улитки и нейруляции (Qian et al., 2007). Вместе эти данные указывают на роль Wnt5a в передаче сигналов PCP у мышей. Интригует, что Wnt антагонист, секретируемый Frizzled-related protein 3 (Sfrp3 или Frzb), экспрессируется в виде реципрокного паттерна по отношению к Wnt5a в развивающемся органе Корти (Qian et al., 2007). Однако, неясно, может ли реципрокная экспрессия Wnt5a и Wnt антагониста участвовать в генерации градированного сигнала Wnt для выполнения инструктивной роли в передаче сигналов PCP.
Cell adhesion and PCP signaling in the organ of Corti
В конечном итоге сродство между составляющими клетками и сродство между клетками и их внеклеточным матриксом детерминируют клеточное расположение и соотв. морфологию определенной ткани или органа (Townes and Holtfreter, 1955, Nose et al., 1988, Steinberg and Takeichi, 1994, McNeill, 2000, Zajac et
al., 2003).
In vitro, дифференциальное клеточное сродство может управлять клеточной агрегацией и клеточной перестройкой (Townes and Holtfreter, 1955, Nose et al., 1988, Steinberg and Takeichi, 1994, McNeill, 2000, Zajac et al., 2003, Strutt et al., 2004, Saburi and McNeill, 2005). У
Drosophila, атипические cadherins, Fat и Dachsous и protocadherin Flamingo играют существенные роли в инициации и распространении сигналов PCP (Fanto et al., 2003, Matakatsu and Blair, 2004, Simon, 2004, Strutt et al., 2004). У млекопитающих гомолог Flamingo, Celsr1, необходим для передачи сигналов PCP в улитке (Curtin et al., 2003). Однако, экспрессия и функция атипических cadherins в передаче сигналов PCP в улитке не исследовалась. Более того, изменения клеточной упаковочной геометрии значительны во время терминальной дифференцировки органа Корти (Fig. 3A). Клеточные соединения д. быть ремоделированы во время морфогенеза кортиевого органа на ст. терминальной дифференцировки. Очень возможно, что молекулы, обеспечивающие генеральную межклеточную адгезию играют существенную роль в передаче сигналов PCP и морфогенеза органа Корти. Исследование клеточных адгезивных активностей и свойств внеклеточного матрикса в улитке может предоставит ценную информацию по вычленению клеточных компонентов передачи сигналов PCP в улитке.
PCP signaling and ciliogenesis in morphogenesis of the
organ of Corti
Ресничка состоит из базирующейся на микротрубочках аксонеме, прикрепленной к клетке базальным тель цем и обычно выпячивается из апикальной поверхности клетки (Davis et al., 2006). Базальное тельце состоит из пары центриолей и является организационным центром как для цитоскелетных микротрубочек, так и для микротрубочек реснички. Аксонема в цилиарной части состоит из дублетов микротрубочек или с (9+2) или без (9+0) центрально расположенной пары (Davis et al., 2006). Белковый синтез не происходит в ресничках. Реснички собираются и поддерживаются за счет intraflagellar transport (IFT), в котором мультимерные белковые комплексы наз. IFT частицами и перемещаются в двух направлениях вдоль аксонемы за счет координации IFT моторов, антероградно (в направлении плюс концов микротрубочек или кончика реснички) молекулярным мотором kinesin и ретроградно (в направлении минус концов микротрубочек) молекулярным мотором dynein вдоль микротрубочек. Потеря IFT генов ведет к дефектам ресничек.
Поляризация стереоцилий в волосковых клетках обеспечивается за счёт полярности kinocilium, первичной реснички (Figs. 1 and 2). Киноцилии регрессируют постнатально в улитке млекопитающих (Sobkowicz et al., 1995, Leibovici et al., 2005), указывая на свое участие в развитии. Недавние исследования показали провоцирующую связь между ресничками и передачей сигналов PCP (Ross et al., 2005, Park et al., 2006, Jones and Chen, 2007) и открыли возможность того, что передача сигналов PCP необходима для цилиогенеза и возможно, что реснички участвуют в передаче сигналов PCP. Эти находки предоставляют первое экспериментальное доказательство того, что kinocilia могут и в самом деле выполнять онтогенетическую роль в улитке.
После тщательной проверки, однако, возникли вопросы относительно связи между передачей сигналов PCP и цилиогенезом. Нокдаун генов эффекторов, нижестоящих PCP,
Inturned и Fuzzy, у рыбок данио вызывает дефекты цилиогенеза (Park et al., 2006), указывая тем самым, что передача сигналов PCP м.б. необходима для цилиогенеза. Однако, PCP гены, которые необходимы для цилиогенеза ограничены этими нижестоящими цитоскелетными эффекторами. Kinocilia и др. первичные реснички, по-видимому, нормальны у мутантов по стержневым PCP (Jones and Chen, 2007). Эти данные аргументируют против необходимости передачи сигналов PCP в цилиогенезе, а скорее выполняют двойную роль цитоскелетных эффекторов, таких как Inturned и Fuzzy, как в цилиогенезе, так и в PCP.
Рецепторы и медиаторы для сигнальных путей hedgehog (Hh) и plateletderived growth factor receptor (PDGFR) были локализованы в ресничках для передачи сигналов по обоим путям (Corbit et al.,
2005, Haycraft et al., 2005, Liu et al., 2005, Schneider et al.,
2005). Эта вновь установленная роль ресничек как специализированного субклеточного компартмента для локализации и концентрации связанных с мембранами сигнальных рецепторов и комплексов, чтобы передавать сигналы от реснички во внутрь клетки, привела к предположению, что реснички выполняют сходную функцию и трансдуцируют Wnt сигналы (Ross et al., 2005, Simons et al., 2005). Однако, первое исследование роли ресничек в передаче сигналов PCP вызвало некоторые вопросы (Ross et al., 2005). Компонент PCP, Ltap/Vangl2, был локализован в базальном тельце и ресничке в реснитчатых клетках респираторного носового эпителия человека (Ross et al., 2005). Некоторые Bardet-Biedl Syndrome (BBS) гены кодируют белки базальных телец, а мутации этих BBS генов вызывают дефекты ресничек и минорные дефекты в формировании паттерна стереоцилий (Ross et al., 2005). Однако, дефекты стереоцилий у BBS мутантов проявляются низким процентом неправильной формы стереоцилий, в противоположность неправильно ориентированным стереоцилиям, наблюдаемым у PCP мутантов. Ltap/Vangl2 или любые др. PCP белки, такие как Fz (Wnt рецепторы) были локализованы в базальных тельцах или ресничках в тканях. которые обладают PCP подобны органом Корти. Хотя точная роль ресничек и цилиарных генов в передаче сигналов PCP и морфогенезе кортиева органа остаётся неясной, возможность участия ресничек в передаче сигналов PCP является захватывающей и будет энергично исследоваться.
Coalescing multiple signaling pathways in shaping the
organ of Corti during terminal differentiation
Укороченный и расширенный канал улитки и неправильная ориентация пучков стереоцилий не ограничены мутантами, дефектными по PCP генам, В частности, гены для передачи сигналов Notch экспрессируются в развивающейся улитке во время терминальной дифференцировки, а мутации некоторых из этих генов вызывают определенно характерные PCP дефекты в улитке и её сенсорном органе (Kiernan et al., 2005a, Brooker et al., 2006). Роль пути Notch
в обеспечении сенсорной компетентности и в детерминации судьбы волосковых клеток в противовес поддерживающим клеткам установлена
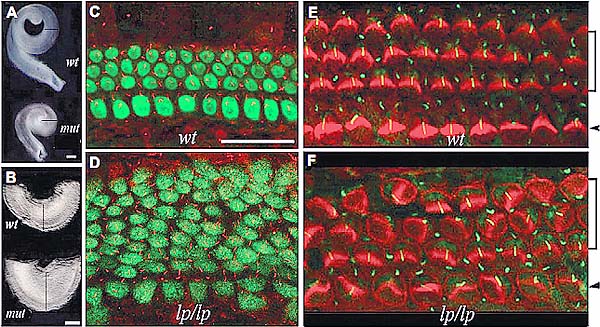 Fig. 5. Typical PCP phenotypes in the cochlea. Defective PCP signaling leads to formation of a shorter (A) and wider (B) cochlea in mutant (mut) mice, in comparison to wild-type (wt) animals. The widening of the cochlea and its sensory organ is most prominent toward the apical region (compare C and D) by staining for a hair cell marker (C, D). In addition, wild-type cochleae show a distinctive PCP, manifested with uniformly oriented stereocilia (E) while PCP mutant cochleae display misorientation of stereocilia (F). A single primary cilium, the kinocilium (C-F), is seen on the apical surface of each hair cell. lp: the loop tail alleles, a loss-of-function allele for core PCP gene Vangl2 (Ltap). Brackets and arrowheads (E, F) indicate the outer and inner hair cells, respectively. This image is modified from Wang et al. (2005), Nature Genetics. Authors' Copyright.
Fig. 5. Typical PCP phenotypes in the cochlea. Defective PCP signaling leads to formation of a shorter (A) and wider (B) cochlea in mutant (mut) mice, in comparison to wild-type (wt) animals. The widening of the cochlea and its sensory organ is most prominent toward the apical region (compare C and D) by staining for a hair cell marker (C, D). In addition, wild-type cochleae show a distinctive PCP, manifested with uniformly oriented stereocilia (E) while PCP mutant cochleae display misorientation of stereocilia (F). A single primary cilium, the kinocilium (C-F), is seen on the apical surface of each hair cell. lp: the loop tail alleles, a loss-of-function allele for core PCP gene Vangl2 (Ltap). Brackets and arrowheads (E, F) indicate the outer and inner hair cells, respectively. This image is modified from Wang et al. (2005), Nature Genetics. Authors' Copyright.
(Daudet and Lewis, 2005, Kiernan et al., 2005a, Brooker et al., 2006, Kiernan et al., 2006). У мышей, несущих мутации в двух из Notch лигандов Jag2 и Dll1, однако, неправильная ориентация стереоцилий также очевидна (Kiernan et al., 2005a). Укороченный канал улитки с увеличением рядов волосковых клеток наблюдается в направлении апикальной области улитки у мышей, мутантных по
Dll1 (Kiernan et al., 2005a, Brooker et al., 2006). Было предположено, что неправильная ориентация пучков стереоцилий у Jag2 и Dll1 мутантов может быть непрямым результатом дефектов в формировании паттерна волосковых клеток и подтверждается клеточным мозаицизмом (Kiernan et al., 2005a). Было также предположено, что укорочение и расширение канала улитки у мутантов Dll1 может быть связано с преждевременной дифференцировкой, которая укорачивает период роста и предупреждает обычное удлинение и сужение сенсорного примордия (Brooker et al., 2006). Т.к. молекулярные механизмы, лежащие в основе PCP-подобных дефектов в пути Notch мутантов, не определены, то эти данные указывают на тесную взаимосвязь клеточной дифференцировки и формирования паттерна за счет передачи сигналов PCP. Возможно, что спецификация и дифференцировка волосковых клеток и/или поддерживающих клеток продуцирует специфические поверхностные или мембранные компоненты, которые необходимы для межклеточных общений во время передачи сигналов PCP для установления униформной ориентации стереоцилий в рамках кортиевого органа и/или для медиолатерально поляризованной клеточной protrusive активности, чтобы управлять CE улитки.
Развитие нейронов спирального ганглия также. по-видимому, влияет на морфогенез кортиева органа. В исследованиях роли neurogenin1 в создании афферентных соединений с внутренними волосковыми клетками, было установлено, что он не только осуществляет афферентные соединения, и оказывает сильное влияние на собственно соединения и автономную иннервацию. но и также, по-видимому, выполняет непосредственную роль в развитии сенсорного эпителия (Ma et al., 2000). Хотя волосковые клетки, по-видимому, дифференцируются нормально в отсутствие афферентной иннервации у
Ngn1 нулевых животных, но др. аспекты фенотипа сильно напоминают PCP дефекты (Ma et al., 2000), строго подтверждая роль влияния со стороны нейронов на морфогенез кортиева органа. Орган Корти укорочен и расширен вдоль медиолатеральной оси в апикальной области (Ma et al., 2000). Неправильная ориентация стереоцилий также наблюдается в апикальной области улитки (Ma et al., 2000).
Помимо пути Notch и нейрального влияния передача сигналов Hh, transforming growth factor-β (TGF-β) и FGF также может вносить вклад в PCP процесс в улитке. У эмбрионов
Drosophila Hh и Wnt молекулы действуют совместно, чтобы ориентировать denticles, базирующиеся на актине проекции на сегментно повторяющихся субнаборах вентральных эпидермальных клеток (Colosimo and Tolwinski, 2006, Price et al., 2006). Роль Hh в терминальной дифференцировке кортиева органа активно исследовалась (Riccomagno et al., 2002, Riccomagno et al., 2005) и это помогло иллюстрировать комплекс вышестоящих сигнальных молекул в передаче сигналов PCP. Во время гаструляции у
Xenopus, передне-задние сигналы (вдоль оси удлинения), такие как activin, член семейства TGF-β, необходим для СЕ (Ninomiya et al., 2004). Интересно, что BMP4, один из членов семейства TGF-β, экспрессируется асимметрично в эпителии улитки вдоль продольной (оси удлинения) и медиолатеральной оси улитки (Morsli et al., 1998). Множественные FGF лиганды и рецепторы/медиаторы также экспрессируются в улитке во время терминальной дифференцировки (Pirvola et al., 2000, Mueller et al., 2002, Shim et al., 2005, Fritzsch et al., 2006). Роль передачи сигналов Hh, BMP и FGF в формировании раннего паттерна и дифференцировки хорошо охарактеризована. Однако, могут ли они также непосредственно регулировать процесс PCP, униформную ориентацию стереоцилий и презумптивное CE в улитке, остаётся неясным.
A working model of PCP regulation in the cochlea and
perspectives
Кортиев орган проявляет вообще-то наиболее характерную форму РСР у позвоночных. Он используется в качестве модельной системы, чтобы проиллюстрировать лежащие в основе механизмы пути PCP, которые существенны для развития и функционирования многоклеточных организмов.
Базируясь на современном понимании передачи сигналов PCP и мутациях, которые затрагивают униформную ориентацию стереоцилий и удлинение улитки, мы предлагаем рабочую модель, в которой сливаются многие сигнальные пути для регуляции PCP в улитке (Fig. 4). В ответ на вышестоящие направляющие сигналы, которые могут состоять как из морфогенов, так и белков, которые обеспечивают межклеточную адгезию, стержневые PCP комплексы рассортировываются асимметрично вдоль медиолатеральной оси улитки. Межклеточные общения усиливают сортировку стержневых PCP белков и подгонку соседних клеток. Отметим. что все известные мыши, дефектные по стержневым PCP генам, сохраняют "V"-образное расположение стереоцилий. Хотя возможно, что имеется остаточная передача сигналов PCP у всех этих известных PCP мутантов, достаточная для формирования "V"-образно расположенных стереоцилий, эти наблюдения подчеркивают механизм, с помощью которого образование "V"-образных стереоцилий не зависит от передачи сигналов PCP. Поэтому мы предполагаем, что клеточные медиаторы связывают поляризованные стержневые PCP комплексы с аппаратом, который управляет формированием "V"-образно расположенных стереоцилий в индивидуальных волосковых клетках и и располагает униформно верхушки "V"-образных стереоцилий всех волосковых клеток вдоль медиолатеральной оси улитки, распространяя PCP на весь кортиев орган.
Остается множество вопросов относительно передачи сигналов PCP в улитке. Природа вышестоящий направляющих сигналов остается смутной. Wnt, Hh, BMPs, FGFs, Fat-Dachsous взаимодействия, также как и нейральное влияние могут закладывать инициальную полярность стержневых PCP комплексов. Одинаково с PCP регуляцией у
Drosophila, стержневые PCP комплексы также поляризуются вдоль оси для PCP в улитке млекопитающих. Однако, детальные молекулярные взаимодействия среди стержневых PCP белков могут отклоняться от тех. которые хорошо охарактеризованы для
Drosophila стержневых PCP белков. Идентификация предполагаемых клеточных медиаторов, которые связывают поляризованные стержневые PCP комплексы с аппаратом формирования "V"-образно организованных стереоцилий и то, как эти предполагаемые клеточные медиаторы общаются со стержневыми PCP белками и компонентами стереоцилий, неизвестны. Кажущееся участие ресничек и/или базальных телец в передаче сигналов PCP открывает новые направления для поисков механизмов, лежащих в основе морфогенеза улитки. Можно предположить, что реснички могут функционировать как специализированные аппараты для направляющих сигналов в процессе PCP в улитке и что базальные тельца в качестве организационного центра микротрубочек могут участвовать в сортировке стержневых PCP комплексов и/или связывать поляризованные стрежневые комплексы PCP со стереоцилиями чтобы координировать их униформную ориентацию во всем органе Корти. Адгезивные свойства клеток в улитке также могут быть критическими для понимания клеточных и молекулярных компонентов управления перестройки клеток, которые ответственны за формообразование удлиняющейся улитки и её сенсорного органа.
Сайт создан в системе
uCoz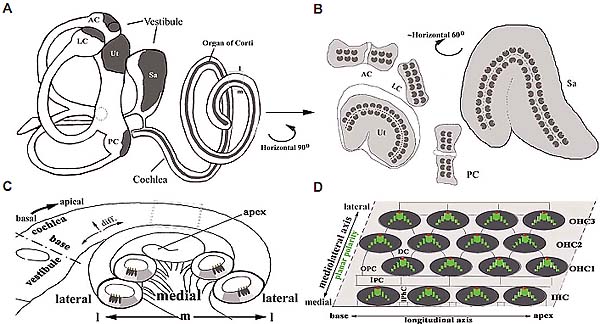
 Fig. 2. Stereotyped cellular patterning, polarity and neural connection in the organ of Corti stretch the entire length of the snail-shaped mammalian cochlea. (A) A dissected mouse cochlea with YFP expressed in the spiral ganglion neurons to visualize the general morphology of the cochlea and innervation of its sensory organ along the length of the cochlea from the base to apex. The highest YFP signal is under the row of inner hair cells (IHC). (B) Schematic diagram showing the arrangement of auditory hair cells (blue) and their stereocilia bundles (red), with kinoclium (magenta)at the vertex, along the PCP axis. Supporting cells are not shown, but also exhibit distinct polarity. An example is the Dieter's cells, each of which cup the base of an outer hair cells and form a phalangeal process that forms the separation between the more lateral row of outer hair cells at
a distance along the longitudinal axis of the cochlea. (C) Hair cell polarity occurs in both the apicalbasolateral axis and in a perpendicular axis within the plane of the epithelium, the PCP axis. Cell nuclei of myosinVI-labelled auditory hair cells (blue) are towards the basal regions of hair cells, whereas the phalloidin-labelled stereocilia bundles (red) are apical towards the lumen. On the apical surface, the stereocilia bundles are oriented uniformly along the mediolateral PCP axis. (D) Coordinately polarized orientation of the stereocilia bundles (red) on the apical surface of the auditory hair cells (blue) with kinocilium (magenta) seen at the vertices of the bundles. All four rows of the hair cells, with one row of inner hair cells and three rows of outer hair cells can be seen here. (E) YFP-expressing spiral ganglion neurons (green) show precise connections to auditory hair cells (blue). The spiral ganglion neurons and the sensory cells are derived from the same region within the otocyst and the development of spiral ganglion neurons influences the shape of the cochlea and its sensory organ. m, medial; l, lateral.
Fig. 2. Stereotyped cellular patterning, polarity and neural connection in the organ of Corti stretch the entire length of the snail-shaped mammalian cochlea. (A) A dissected mouse cochlea with YFP expressed in the spiral ganglion neurons to visualize the general morphology of the cochlea and innervation of its sensory organ along the length of the cochlea from the base to apex. The highest YFP signal is under the row of inner hair cells (IHC). (B) Schematic diagram showing the arrangement of auditory hair cells (blue) and their stereocilia bundles (red), with kinoclium (magenta)at the vertex, along the PCP axis. Supporting cells are not shown, but also exhibit distinct polarity. An example is the Dieter's cells, each of which cup the base of an outer hair cells and form a phalangeal process that forms the separation between the more lateral row of outer hair cells at
a distance along the longitudinal axis of the cochlea. (C) Hair cell polarity occurs in both the apicalbasolateral axis and in a perpendicular axis within the plane of the epithelium, the PCP axis. Cell nuclei of myosinVI-labelled auditory hair cells (blue) are towards the basal regions of hair cells, whereas the phalloidin-labelled stereocilia bundles (red) are apical towards the lumen. On the apical surface, the stereocilia bundles are oriented uniformly along the mediolateral PCP axis. (D) Coordinately polarized orientation of the stereocilia bundles (red) on the apical surface of the auditory hair cells (blue) with kinocilium (magenta) seen at the vertices of the bundles. All four rows of the hair cells, with one row of inner hair cells and three rows of outer hair cells can be seen here. (E) YFP-expressing spiral ganglion neurons (green) show precise connections to auditory hair cells (blue). The spiral ganglion neurons and the sensory cells are derived from the same region within the otocyst and the development of spiral ganglion neurons influences the shape of the cochlea and its sensory organ. m, medial; l, lateral. 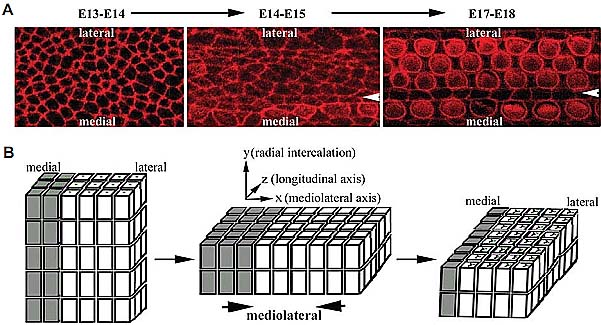
 Fig. 4. A model of planar cell polarity (PCP) regulation in the cochlea.
The establishment of PCP across the organ of Corti requires a threetiered
regulation: (1) upstream factors for directional information along
the mediolateral axis of the cochlea; (2) core PCP proteins form polarized
complexes along the mediolateral axis of the cochlea; (3) unknown
cellular mediators link polarized core PCP complexes to the machinery
that builds the "V"-shaped stereocilia in individual hair cells and orient the
vertices of the "V"-shaped stereocilia toward the periphery of the
spiraling cochlea, establishing uniformly oriented stereocilia across the
organ of Corti. The identity and the role of the upstream factors were
hypothesized; and the role of Pk and Ankrd6/Diversin in inner ear was
hypothesized based on their role in PCP signaling in Drosophila and in CE
in zebrafish. Several core PCP proteins are observed at the boundaries
between supporting cells and between hair cells and supporting cells in
a polarized manner along the mediolateral axis of the cochlea. Their
localization to one or both cells at the boundaries has not been determined
unequivocally
Fig. 4. A model of planar cell polarity (PCP) regulation in the cochlea.
The establishment of PCP across the organ of Corti requires a threetiered
regulation: (1) upstream factors for directional information along
the mediolateral axis of the cochlea; (2) core PCP proteins form polarized
complexes along the mediolateral axis of the cochlea; (3) unknown
cellular mediators link polarized core PCP complexes to the machinery
that builds the "V"-shaped stereocilia in individual hair cells and orient the
vertices of the "V"-shaped stereocilia toward the periphery of the
spiraling cochlea, establishing uniformly oriented stereocilia across the
organ of Corti. The identity and the role of the upstream factors were
hypothesized; and the role of Pk and Ankrd6/Diversin in inner ear was
hypothesized based on their role in PCP signaling in Drosophila and in CE
in zebrafish. Several core PCP proteins are observed at the boundaries
between supporting cells and between hair cells and supporting cells in
a polarized manner along the mediolateral axis of the cochlea. Their
localization to one or both cells at the boundaries has not been determined
unequivocally 