Как ранние эмбрионы мышей побуждаются к переключению от импринтированного к случайному способу регуляции? До недавнего времени полагали, что в обоих случаях инициация Х инактивации связана с клеточной дифференцировкой (Monk and Harper 1979). Так, считалось, что клоны трофэктодермы и первичной энтодермы инактивируют Xp в ответ на родительские импринты на Xist, когда они впервые дифференцируются на стадии бластоциста, тогда как клетки ICM, которые дают собственно эмбрион, считалось первыми стирают Xist импринт и затем подвергаются случайной Х инактивации, когда они дифференцируются в три зародышевых листка на ст. гаструляции.
Более недавние данные, однако, продемонстрировали, что инактивация Xp происходит до начала клеточной дифференцировки у эмбрионов ст. дробления и что это происходит во врех клетках, включая предшественников ICM (Mak et ai. 2004; Okamoto et al. 2004). Т.о., импринтированная инактивация X в трофэктодерме и первичной энтодерме является реликтовым паттерном Х инактивации, устанавливаемым у ранних дробящихся эмбрионов. ICM клетки тем самым побуждают программу ревертации этой инициальной волны импринтированной инактивации Xp, тем самым закладывается сцена для последующей случайной инактивации Х (see Fig. 4). База для реверсии инактивации Xp неизвестна, но она может использовать ICM-специфическую программу, которая репрессирует Xp Xist экспрессию (see Section 5).
Важно отметить, что ассоциация Xist РНК с Xi избирательна. Она не обнаруживается вдоль PAR, которая остается активной и эухроматиновой, или на конституитивном (центрическом) гетерохроматине. Более того, анализ метафазных хромосом демонстрирует полосо-образную локализацию, которая, по-видимому, коррелирует с богатыми генами G-light дисками (see Fig. 3) (Duthie et al 1999). Эти наблюдения показывают, что Xist РНК покрывает только определенные области хроматина.
Механизм(ы), с помощью которых Xist РНК осуществляет изменения в структуре хроматина, и ассоциированное с этим молчание генов, всё ещё не понятны в деталях. Известно, что разные области Xist РНК молекулы ответственны за генное молчание и распределение вдоль Х хромосомы. Эксперименты с индуцибельной системой экспрессии Xist в ES клетках мышей, в которых функции Xist молекул, несущих определенные делеции, могут быть тестированы, показали, что молчание может быть приписано законсервированным повторяющимся последовательностям на 5' конце молекулы, тогда как покрываение Х обеспечивается за счет последовательностей разбросанных по остальной части молекулы (Wutz et al. 2002).
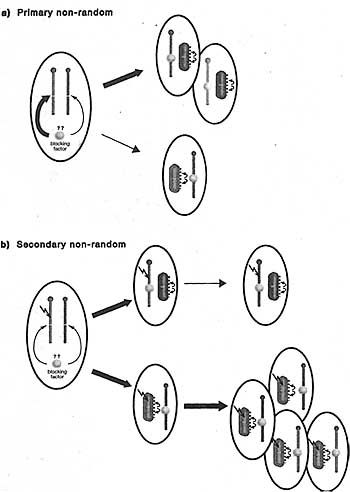 Figure 7. Models for Nonrandom X Inactivation
Primary nonrandom X inactivation refers to skewing of the initial choice of which X chromosome is inactivated. Theoretically, this could occur in heterozygous females where there is a bias in the probability of the two alleles binding the blocking factor. In secondary nonrandom X inactivation, the choice of which X is inactivated is random, but cell selection events result in progressive loss of cells inactivating one of the two X chromosomes. For example, where there is a deleterious mutation on one X chromosome, cells that inactivate the other, wild-type X chromosome will be preferentially lost.
Figure 7. Models for Nonrandom X Inactivation
Primary nonrandom X inactivation refers to skewing of the initial choice of which X chromosome is inactivated. Theoretically, this could occur in heterozygous females where there is a bias in the probability of the two alleles binding the blocking factor. In secondary nonrandom X inactivation, the choice of which X is inactivated is random, but cell selection events result in progressive loss of cells inactivating one of the two X chromosomes. For example, where there is a deleterious mutation on one X chromosome, cells that inactivate the other, wild-type X chromosome will be preferentially lost.
4.2 The Heterochromatic Structure of the Inactive X
С момента самых ранних исследований в световом микроскопе стало понятным, что Xi обладает признаками гетерохроматина. Подобно конституитивному гетерохроматину, найденному в и около центромер, Xi остается видимой и кажущейся конденсироанной в течение всей интерфазы (в виде телец Барра), а её ДНК обычно реплицируется позднее в S фазе. Xi скажем состоит из факультативного гетерохроматина. Однако, важно помнить, что ДНК конституитивного гетерохроматина обычно обогащена специфическими, повторяющимися сателлитными последовательностями, которые ответственны, по крайней мере частично, за её характерные свойства. ДНК Х хромосомы не обнаруживает такого обогащения, хотя она обнаруживает более легкие отличия в специфических повторяющихся элементах, которые могут играть роль в процессе инактивации (see Section 4.5). Кроме того, хотя Xi хроматин часто описывается как "конденсированный", но тщательный микроскопический анализ и трехмерная реконструкция Xa и Xi хромосом, меченных X-специфическими ДНК зондами, подтверждает, что различия между ними больше вопрос формы, чем количества хроматина на единицу объема (Eils et al. 1996).
Дальнейшие параллели между Xi и конституитивным гетерохроматином получены в результате использования непрямой иммунофлюоресцентной микроскопии для изучения распределения гистоновых модификаций и вариантов как вдоль метафазных хромосом, так и в интерфазных ядрах. Факультативный гетерохроматин неактивной X хромосомы в клетках мышей и человека истощается по ацетилированному гистону H4 (Jeppesen and Turner 1993), и тем самым напоминает конституитивный, центрический гетерохроматин. Это стало первой демонстрацией того, что неактивная Х хромосома маркируется специфического типа гистоновой модификацией. Последующие эксперименты в нескольких лаб. подтвердили эти наблюдения и показали, что ацетилированные изоформы всех 4-х стержневых гистонов (H2A, H2B, H3 и H4) истощены как в конституитивном. так и факультативном гетерохроматине интерфазных и метафазных клеток (O'Neill et al. 2003 and references therein). В частности, как центрический гетерохроматин, так и Xi истощены по ди- и три-метилированным H3 в K4 (H3K4me2 и H3K4me3). Общепринято, что подобно ацетилированию, существуют маркеры транскрипционно активного или потенциально активного хроматина.
Ситуация становится более сложной, если рассматривать появление маркеров. ассоциированных с транскрипционным молчанием скорее, чем с исчезновением тех, что ассоциированы с транскрипционной активностью. Напр., ди- и три-метилированные H3 по K9 (H3K9me2/3) соответствуют меткам транскрипционно молчащих генов и часто обнаруживаются концентрирующимися в центрическом гетерохроматине с помощью иммунофлюоресцентной микроскопии (Lachner et al. 2003). Однако, из-за комбинации технических и биологических причин, их обогащение на Xi неопределенно. По этой причине, важность специфичности антител, обеспечивающих реальную иммунофлюоресценцию, необходимо подчеркнуть. Напр., лизины 9 и 27 из H3 являются как частью тетрапептида ARKS, так и антителами, созданными против одного, но могущего перекрестно реагировать с др. Такая перекрестная реакция д. быть строго исключена прежде чем интерпретировать результаты с уверенностью. Кроме того, используемая процедура иммунизации и используемый immunogen, влияют на детальные специфичности антисывороток. Напр., антисыворотка к H3K9me3, полученная к перекрестно связываемому пептиду, соединяется более сильно с модифицированным гистоном, когда он находится внутри гетерохроматиновой области, чем когда он внутри эухроматина (Maison et al. 2002). Антисыворотки, приготовленные таким образом являются ценными реагентами для изучения гетерохроматина, но не идеальны для количественных сравнений гетерохроматина и эухроматина. Наконец, отмечено, что усиленное иммунофлюоресцентное окрашивание в интерфазе может быть результатом просто более высокой плотности нуклеосом внутри гетерохроматина (Perche et al. 2000).
Тщательный анализ распределений гистоновых модификаций вдоль Xi в культивируемых клетках человека предоставяет дальнейшую информацию о сложности системы (Chadwick and Willard 2004). H3K9me3 и H3K27me3 оба обогащены в определенных, не перекрывающихся областях вдоль Xi. Т.о., в отличие от потери ацетилирования гистона, обогащение такими модификациями является региональным, а не всеобщим, свойством Xi. Интересно, что такие области, обогащенные H3K27me3, обнаруживаются также обогащенными по Xist РНК и варианту гистона macroH2A1.2 (Costanzi and Pehrson 1998). Как macroH2A1.2 может ассоциировать с Xi, и его возможная роль в процессе инактивации обсуждается в Section 4.4. Напротив, такие области Xi, которые обогащены H3K9me3, также обнаруживают увеличенные уровни гетерохроматинового белка HP1 (как известно. соединяющегося с метилированнными H3K9) и H4K20me3 (метки, также ассоциированной с конституитивным, центрическим гетерохроматином). Важно, что иммуноокрашивание телец Барра в интерфазных клетках обнаруживает те же самые паттерны ко-окрашивания, это указывает на то, что разные домены сохраняются в ходе клеточного цикла.
Возникает картина из комбинаций гистоновых модификаций, гистоновых вариантов, негистоновых белков и Xist РНК, взаимодействующих, чтобы сформировать хроматин с определенными свойствами транскрипционного молчания, репликации в поздней S фазе, возникновению конденсации и (возможно) ядерной локализации, которые характерны для Xi. Однако, точное функциональное значение определенных хроматиновых доменов Xi ещё предстоит установить. Важным и дей1ствующим наблюдением является то, что частота наблюдаемых доменов широко варьирует от одной клеточной линии человека к др. (Chadwick and Willard 2004). Это может быть не более чем подтверждением известной перекрываемости (redundancy) в системе инактивации Х (напр., как отмечалось ранее, молчание поддерживается в зрелых клетках даже когда Xist РНК утеряна), но это также предупреждает о том, что культивируемые клеточные линии, в частности иммортализованные, не всегда в точности и аккуратно указывают на то, что происходит в первичных тканях и определенно не на ранних стадиях развития.
Гистоновые модификации, ассоциированные с эухроматином и факультативном и конституитивным гетерохромтаином суммированы в Табл. 1. Итак, лишь метилирование H3K27 и убиквитилирование гистона H2A по лизину 119 (H2AK119ub) обнаруживаются в большом количестве на Xi, но не в конституитисном гетерохроматине (Plath et al. 2003; Silva et al. 2003; deNapofes et al. 2004; Smith et al. 2004).
Все модификации, приведенные в Table 1, ассоциируют с общей, гетерохроматиновой конформацией неактивной Х хромосомы и были идентифицированы с помощью иммунофлюолрресцентного анализа или метафазных хромосом или телец Барра в интерфазных клетках. Однако, локальные изменения гистоновых модификаций могут также играть важные роли на разных стадиях процесса инактивации Х. Такие изменения могут быть идентифицированы с помощью высоко-разрешающей микроскопии или с помощью chromatin immunoprecipitatkm (ChIP), чтобы картировать модификации, рассмотренные в Chapter 10? внутри или по соседству с критической
Table 1. Histone modifications characteristic of constitutive and facultative heterochromatin
 Histone modifications that are enriched (+) or depleted (-) in constitutive and facultative heterochromatin, relative to euchromatin, are indicated. The = symbol indicates that the level of the modification is not detectably different from that in euchromatin. (me) methylation.
Histone modifications that are enriched (+) or depleted (-) in constitutive and facultative heterochromatin, relative to euchromatin, are indicated. The = symbol indicates that the level of the modification is not detectably different from that in euchromatin. (me) methylation.
aApplies to all acetylatable lysines.
bEnriched in local "hot spots" but not overall.
cEnrichment is transient in some cell types. областью Xic. Напр., крупный домен, распространяющийся на более чем 340 kb 5' гена
Xist характеризуется гиперметилированием H3K9 в недифференцированных ES клетках. Гиперметилирование снижается по мере дифференцировки клеток и и происходит Х инактивация (Heard et al. 2001). Та же самая общая область хроматина обогащена метилированными H3K27 в ES клетках самок (Rougeulle et al. 2004), a сайты внутри неё обогащены ацетилированными H3 и H4 (O'Neffl et aL 1999). С начала исследований установлено до какой степени эти локальные модификации гистонов а области Xic являются ранними каузальными событиями, управляющими процессом Х инактивации или нижестоящих событий, которые (возможно существенные) компоненты инициации процесса ремоделировани я хроматина.
Конституитивный центромерный гетерохроматин обогащен метилированной ДНК, преимущественно 5'-methylcytosine в CpG димерах (see Chapter 18). Это согласуется с его низким уровнем транскрипционной активности. Довольно неожиданно уровень метилирования CpG на Xi в целом не достоверно выше, чем в остальной части генома. Однако, специфические CpG островки, ассоциированные с молчащими генами высоко метилированы, а экспреиментальные доказательства подтверждают, что метилирование ДНК играет важную роль в стабилизации неактивного состояния. Т.о., мыши, лишенные энзимов, которые или метилируют ранее немодифицированные CpGs (
de novo DNA methyltransferases, Dnmta и Dnmtb) или поддерживают модификации ранее модифицированных остатков (поддерживающий энзим, Dnmtl), инициируют и устанавливают случайную инактивацию Х нормальным способом (Sado et al. 2000,2004). Однако, гены на гипометилированных Xi у таких мутантных мышей более легко реактивируются, чем на Xi у животных дикого типа с нормальными уровнями метилирования (Sado et al. 2000).
4.3 The Enzymology of Histone Modifications on Xi
Энзимы, ответственные за деацетилирование стержневых гистонов (HDACs) во время Х инактивации или за деметилирование H3K4, пока неизвестны. Т.к. ингибитор деацетилазы trichostatin A (TSA) может предупреждать или, по крайней мере, задерживать, появление деацетилированных Х в дифференцирующихся ES клетках самок, то разумно предположить, что HDACs участвуют (O'Neill et al. 1999). Однако, мы не знаем, какой из 11 классов I и II HDACs скорее всего ответственен (энзимы класса III не ингибируются с помощью TSA). Мы также не знаем механизм. ответственный за удаление метилирования H3K4. Энзимы. способные к удалению метильных групп с H3K4 при mono- или di-methylated состояниях идентифицированы лишь недавно, а энзимы, способные деметилировать H3K4 tri-methylated состояние ещё предстоит открыть. На данной стадии мы не можем исключить, что метилирование H3K4 и/или деацетилирование гистонов исчезают из Xi за счет замещения гистонов или пассивно за счет репликации ДНК.
Сегодня мы знаем больше об энзимах, ответственных за пуск гистоновых модификаций в соотв. местах. Метилирование H3K27 осуществляется с помощью Ezh2/Enxl, гомолога Drosophila polycomb-group (PcG) белка, энхансера zeste (E(Z)) (Silva et al. 2003). E(Z) является гистоновой methyl-transferase (HKMT), которая функционирует в PRC2 PcG комплекса (see Chapter 11). PRC2 рекрутируется на Xi во время дифференцировки ES клеток с той же самой кинетикой, что и метилирование H3K27. Интересно, что PcG белки также участвуют в ubiquitylation H2A по лизину 119 на Xi. В особенности RinglA/RinglB белок, стержневой компонент PRC1 PcG комплекса, функционирует как E3 лигаза для H2A ubiquitylation. Делеция RinglA и RinglB ведет к потере H2A ubiquitylation как на Xi, так и по всему геному (de Napoles et al. 2004).
4.4 The Order of Events That Leads to X Inactivation;
ES Cells as a Model System
ES клетки мышей представляют собой неоценимую модельную систему для изучения динамики инактивации Х хромосомы. Повышенные уровни Xist РНК и ею покрытие одной Х хромосомы являются первыми обнаружимыми в высокой пропорции клеток спустя 1-2 дня после дифференцировки. Имеются доказательства, что играют роль как транскрипционные, так и посттранскрипционные механизмы в усилении активности Xist (Panning et al. 1997; Sheardown et al. 1997; Rougeulle et aL 2004). Xist однако, транскрибируется с обеих Х хромосом в недифференцированных ES клетках самок и с одиночной Х в ES клетках самцов, но РНК продукт быстро деградирует и лишь небольшие количества обнаруживаются по соседству с Xist локусом. Получены доказательства, что по мере осуществления дифференцировки происходит стабилизация Xist РНК на одной из двух Х хромосом в клетках самок (Panning et al. 1997; Sheardown et al. 1997). Механизм, который лежит в основе этой ступени избирательной стабилизации РНК остается неясным, также как и его вклад в общее увеличение Xist РНК и покрытие хромосомы в цис-положении.
Ряд ступеней Х инактивации, как было установлено, происходит одновременно с началом накопления Xist РНК в дифференцирующихся XX ES клетках. Сюда входят рекрутирование PcG белков и ассоциированное метилирование H3K27, H2A monoubiquitylation, деацетилирование H3K9 и потеря метилирования H3K4 (Heard et al. 2001; Silva et al. 2003; de Napoles et al. 2004; Rougeulle et al. 2004). Глобальное деацетилирование гистонов относительно позднее событие, происходящее на 3-5 день в большинстве клеток и следовательно, скорее всего участвует в поддержании и/или стабилизации неактивного состояния скорее, чем в его инициации (Keohane et al. 1996). Такая интерпретация предполагает, что паттерны ацетилирования в промоторах индивидуальных генов, подвергающихся инактивации, отражает паттерн, определеяемый с помощью иммунофлюоресцентного анализа целых хромосом или крупных доменов. Инициальные исследования с помощью ChIP подтвердили, что это происходит в самом деле, но необходимы дальнейшие эксперименты для большого количества генов (O'Neill et al. 2003).
Накопление варианта гистона macroH2A1.2 на Xi происходит значительно позднее во время дифференцировки XX ES клеток (Mermoud et al. 1999). Этот вариант гистона имеет свяше 200 дополнительных аминокислот на своем С-теминальном хвосте и несколько аминокислотных замен по всей молекуле. Интересно, что экспрессия Xist РНК необходима для поддержания macroH2A на Xi в соматических клетках (Csankovszki et aL 1999), но недостаточна для рекрутирования macroH2A на ранних стадиях дифференцировки (Mermoud et al. 1999; Wutz et al. 2002).
Избирательное метилирование ДНК на Xi является даже более поздним событием в ES клетках. CpGs, которые, как известно, высоко метилированы на Xi в клетках взрослых, не становятся метилированными в ES клетках самок вплоть до момента более поздней дифференцировки, 14-21 день (Keohane et al. 1996). Это согласуется с результатами в собственно развивающемся эмбрионе (Lock et al. 1987)и с идеей, что метилирование ДНК ответственно за стабилизацию или запирания, неактивного состояния скорее, чем инициацию и распространение.
Т.о., возникает картина скоординированной и тщательно регулируемой последовательности событий, с помощью которых изменения хроматина на Xi возникают по ходу развития (summarized in Fig. 8). Удивительно, что некоторые из этих изменений, напр., деацетилирование гистонов и метилирование ДНК, происходят после того, как клетки начинают прогрессировать по разным отличающимся путям дифференцировки. очевидно, что программа, ответственная за завершение X инактивации осуществляется независимо от др. программ клеточной дифференцировки. Однако, важно отметить, что некоторые аспекты случайной инактивации Х могут происходить только после начала дифференцировки. Напр., переключение на экспрессию
Xist трансгенов в
недифференцированных ES клетках запускает различные модификации гистонов, ассоциированные с гетерохроматинизацией, а также переход к репликации в поздней S фазе (Wutz and Jaenisch 2000),
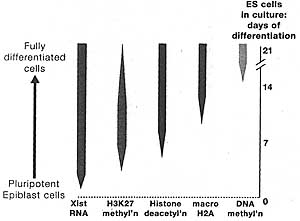 Figure 8. Layers of Epigenetic Silencing Accumulate on Xi
through Differentiation
The diagram shows how five different epigenetic changes associated with transcriptional silencing are put in place on the inactive X chromosome at different stages of development and differentiation in both the developing embryo and ES cells in culture. In some cell types, methylation of H3K27 is transient, being seen only at early stages of differentiation and not in mature cells.
Figure 8. Layers of Epigenetic Silencing Accumulate on Xi
through Differentiation
The diagram shows how five different epigenetic changes associated with transcriptional silencing are put in place on the inactive X chromosome at different stages of development and differentiation in both the developing embryo and ES cells in culture. In some cell types, methylation of H3K27 is transient, being seen only at early stages of differentiation and not in mature cells.
но отсутствует обнаружимое включение macroH2A; только после того, как клетки оказываются индуцированными к дифференцировке macroH2A колокализуется с
Xist РНК на хромосоме, содержащей
Xist трансген (Rasmussen et aL 2001). Ассоциация macroH2A с Xist-покрытым хроматином зависит от продолжающегося присутствия
Xist РНК (Csankovszki et aL 1999), но не нуждается в транскрипционном молчании, т.к. она наблюдается также и когда хромосомы покрыты мутантной
Xist РНК, лишенной регионов, необходимых для молчания (Wutz et aL 2002). Т.о., X инактивация может рассматриваться как конечный результат серии параллельных процессов, только некоторые из которых независимы.
Важно подчеркнуть, что определенные ферментативные комплексы или гистоновые модификации могут выполнять критические роли на определенных стадиях процесса инактивации Х, но могут становиться менее важными или избыточными позднее, вообще-то после более долговременных механизмов молчания, базирующихся на метилировании ДНК. Напр., метилирование H3K27, катализируемое с помощью PRC2, важно для успешной инактивации Х в раннем онтогенезе, но, по-видимому, бесполезно позднее.
Необходимо также отметить, что др. порядок событий может возникать во время установления импринтируемой Х инактивации у преимплантационных эмбрионов. Отметим, что обогащение H3K27me3 не выявляется сплоть до 16-клеточной стадии, значительно позднее, чем начало экспрессии
Xist (2- до 4-клеточной стадии) (Mak et aL 2004; Okamoto et aL 2004). Это может указывать на потребность в специфических онтогенетически регулируемых кофакторах, чтобы рекрутировать PRC2 PcG комплекс на Xi.
4.5 Spreading of Silent Chromatin
XIC является существенным для инактивации Х и предполагается, что молчание распространяется от XIC, с проксимальными генами, становящимися молчащими раньше, чем более дистальные. Единственное объяснение этому, что Xist РНК распространяется прогрессивно вдоль хромосомы от места её синтеза. Это д. согласовываться с результатами экспериментов, в которых Xist трансгены вставляются в аутосомы и где покрытие аутосом Xist РНК ведет к молчанию генов и изменениям хроматина (see above). Распространение неактивного состояния от XIC интенсивно исследовалось на естественно возникших транслокациях X:аутосома. В самом деле, такие транслокации были критическими для демонстрации существования XIC (Rastan 1983). Хроматин, несущий характерные маркеры факультативного гетерохроматина (напр., потеря ацетилирования гистонов, поздняя репликация и транскрипционное молчание), как было показано, распространяется с Xi на аутосомную часть гибридной хромосомы (White et al. 1998; Duthie et aL 1999; Sharp et al. 2002). Это выявило важный принцип, что факультативный гетерохроматин не является исключительны для Х хромосом, это согласуется и с результатами Xist трансгенов, экспрессируемых на аутосомах. Однако, распространение молчащего хроматина вдоль аутосомных хромосомных плеч варьирует у разных транслокаций и ограничено по степени.
Имеются две модели для объяснения ограниченного распространения молчания в цис-сцепленные аутосомы. Во-первых, аутосомы могут быть резистентны к инициальному распространению Xist РНК и к ассоциированному генному молчанию в начале инактивации Х. Альтернативно, инициальное распространение на аутосомы может быть эффективным, но молчание может слабо поддерживаться в процессе онтогенеза, что обозначается как "spread and retreat". Доказательства в пользу spread and retreat, но две модели не являются взаимно исключающими и необходимы дальнейшие исследования. Необходимо заметить, что те клетки, в которых происходит экстенсивное молчание аутосом, могут отбираться во время раннего развития, из-за потеря экспрессии критических аутосомных генов. При некоторых X:аутосома транслокациях распределение является прерывистым, кажется, что пропускаются определенные регионы и транскрипционно активные, эухроматиновые области окружены молчащими гетерохроматиновыми областями (Sharp et al. 2002). Распространение конституитивного гетерохроматина в соседние эухроматиновые области, что ведет к мозаичному (variegation) эффекту положения у Drosophila (see Chapter 5), может обнаруживать сходное поведение. Такие наблюдения легче примирить с ранним механизмом клеточной селекции, базирующимся на spread и retreat молчания, чем с непрерывным распространением стабильного молчания.
Считается, что существуют элементы, распределяющиеся вдоль Х хромосомы, называемые "way stations," которые служат в качестве точек сбора гетерохроматина и тем самым повышают шансы распространения и/или поддержания Х инактивации (описано у Gartler and Riggs 1983). Эти элементы д. быть менее распространены или распределены менее регулярно на аутосомах. Предполагается, что обычное семейство разбросанных повторов, long interspersed repeats (LINES), является прекрасным кандидатом на роль элементов путевых станций (Lyon 1998, 2003). Эти повторяющиеся последовательности обычны для геномов человека и мыши, но особенно часты вдоль Х хромосомы. Более того, LINE элементы наиболее распространены среди наиболее конденсированных, бедных генами, G-banded регионов геномов человека и мыши, это подтверждает, что они edebv-то образом способствуют конформации хроматина, ассоциированной с транскрипционным молчанием. Недавнее завершение расшифровки ДНК последовательностей Х хромосомы человека выявили распределение LINE элементов, что хорошо согласуется с возможной ролью в качестве путевых станций, но идея остается недоказанной.
4.6 Escape from X-Chromosome Inactivation
Как было рассмотрено выше, ряд генов избегает инактивации. В механистических терминах избегание Х инактивации приписывается редкости путевых станций по соседству с этими генами или присутствием пограничных элементов, которые блокируют распространение
Xist РНК и/или др. silencing компонентов. Имеются некоторые доказательства, что гены, которые изегают инактивации являются молчащими, по крайней мере, до некоторой степени, в раннем развитии. Напр., в случае мышиного гена
Smcx, избегание инактивации варьирует в зависимости от стадии развития и типа ткани (Sheardown et al. 1996). Это, следовательно, наиболее согласуется с идеей spread and retreat, рассмотренной выше в контексте молчания аутосомных генов при X;A транслокациях.
4.7 X Inactivation hi Marsupial Mammals
Дивергенция плацентарных и сумчатых млекопитающих произошла около 130 миллионов лет назад. Сумчатые, подобно плацентарным, используют XY (male):XX (female) систему предопределения пола и механизм дозовой компенсации, в котором одна из ld[ { хромосом самок инактивируется. Как упоминалось выше, неактивная Х у сумчатых всегда является отцовского происхождения гомологом (Xp). Дальнейшие различия относительно плацентарных млекопитающих заключаются в степени генного молчания индивидуальных локусов, часто варьирующее в разных тканях. Имеются также некоторые доказательства, что нестабильность молчания увеличивается в ходе развития и онтогенеза. Это снова напоминает модель spread and retreat для замалчивания аутосомных локусов у плацентарных. Интересно, что обогащение LINE элементами X хромосомы происходит после дивергенции плацентарных и сумчатых, так что возможно, что нестабильность молчания на Х сумчатых также связана с идеей путевых станций. Более того, отсутствие метилирования в CpG островках, ассоциируемое с Х-сцепленными генами у сумчатых, может вносить вклад дополнительно в нестабильность Xi.
Относительно мало известно о молекулярном механизме Х инактивации у сумчатых и к тому же не идентифицирован у сумчатых гомолог XIST. Отсутствие XIST гомолога не отвергает, конечно, существование негомологичных РНК, которые выполняют ту же самую функцию, что и инициатор Х инактивации, но они пока не найдены. Лишь два свойства, которые недвухсмысленно общи неативным Х у плацентарных и сумчатых, что обе реплицируются поздно в S фазе и что обе маркированы низкими уровнями ацетилирования гистона H4 (Wakefield et al. 1997).
Учитывая летальность самцов для мутаций, которые разрушают дозовую компенсацию у др. организмов, включая др. млекопитающих, довольно неожиданно, что такое нарушение дозовой компенсации допустимо у сумчатых. Одно из возможных объяснений вытекает из того факта, что Х сумчатых несет меньше генов, чем её аналог у плацентарных (Graves 1996; Marshall Graves and Shetty 2001). Лишь гены длинного плеча Х плацентарных присутствуют на X сумчатых. Гены на коротком плече распределены среди аутосом у сумчатых. Большая часть Х сумчатых бедна генами и конституитивно гетерохроматиновая. Вообще-то такое уменьшение количества генов делает возможным для некоторых типов клеток переносить ослабление дозовой компенсации, пока не станет достаточно большой, чтобы позволить организму обходиться без дозовой компенсации в целом. Кроме того, сумчатые могут заставлять молчать Xi более эффективно в раннем онтогенезе, когда различия в дозе скорее всего наиболее критические, также как и в случае импринтированных локусов. Возможны два объяснения.
5 X-Chromosome Reactivation and Reprogramming
<
5.1 Stability of X Inactivation m Somatic Cells
Множественные слои эпигенетических модификаций вносят вклад в молчание инактивированной Х и как результат репрессированное состояние довольно стабильно. Иллюстрацией этого послужили ранние эксперименты, в которых наблюдали за способностью 5-azacytidine (5azaC), ингибитора метилириования ДНК, ревертировать молчание Х хромосомы в линиях ХХ клеток (Mohandas et al. 1981). Спорадическая реактивация индивидуальных генов происходит с низкой частотой. Однако, анализ клеточных линий, в которых данный ген реактивируется, выявил, что др. гены в целом остаются неактивными, как это делает и вся хромосома на цитогенетическом уровне. Сходные данные были получены с использованием TSA, чтобы ингибировать type I histone deacetylases (Csankovszki et al. 2001).
Спорадическая реактивация индивидуальных Х-сцепленных генов наблюдается во время старения у мышей. Это происходит даже чаще у сумчатых, у которых инактивация Х не столь стабильна и прогрессиваня реактивация происходит во время онтогенеза.
Какова же роль Xist РНК? Данные, полученные с использованием клеточных линий человека, показали, что потеря области Х хромосомы, соответствующей XIST, не приводит к обнаружимой реактивации Х (Brown and Willard 1994). Эти результаты были подтверждены на линиях мышиных фибробластов с использованием нокаута аллелей Xist (Csankovszki et al. 1999). Было установлено, что потеря Xist приводит к делокализации варианта гистона macroH2A из Xi. Более недавние исследования продемонстрировали, что гистоновые модификации, катализируемые PcG комплексами, триметилированием H3 lysine 27 и H2A ubiquitylation также теряются в линиях клеток фибробластов с условным нокаутом Xist (Plath et al. 2004). Редкая спорадическая реактивация индивидуальных генов была выявлена и которая ещё больше усиливалась воздействием SazaC или TSA. Однако, снова не наблюдалось драматической по всей хромосоме реактивации. Т.о., удаление множественных эпигенетических маркеров молчания всё ещё недостаточно для устранения молчания во всей хромосоме.
Избыточность механизмов молчания Xi в соматических клетках часто обозначается как "belts and braces" (пояса и подтяжки). Это указывает на то, что индивидуальные уровни эпигенетического молчания само-поддерживаются и делаются устойчивыми посредством взаимосвязанных механизмов позитивной петли обратной связи. Сходные механизмы наблюдаются в др. эпигенетических системах; напр., связанное поддержание метилирования гистонов и метилирования ДНК в перицентрическом гетерохроматине (see Chapters 9 and 18).
5.2 X Reactivation in Normal Development
В то время как инактивация Х в соматических клеток очень стабильна, имеются условия в ходе нормального развития, при которых вся Х хромосома реактивируется. Наиболее изученным примером является реверсия инактивированной Х в развивающихся primordial germ cells (PGCs). У мышей PGCs специфицируются приблизительно на 7-8 день развития, вскоре после гаструляции. В это время клетки эмбриона уже подверглись случайной Х инактивации. Затем развивающиеся PGCs мигрируют вдоль области задней кишки эмбриона и достигают генитального гребня, структуры, которая дает взрослые гонады. Это является моментом. когда XX PGCs реактивируют свою Xi (Monk and McLaren 1981). Это событие происходит одновременно с более общим эпигенетическим репрограммированием, которое включает стирание родительских импринтов и деметилирование ДНК всего генома (for more detail, see Chapter 20).
X реактивация в PGCs может указывать на специализированный механизм реверсии мультислойной гетерохроматиновой структуры. Исчезновение экспрессии Xist РНК коррелирует с реактивацией Х, но учитывая, что молчание является Xist-независимым в XX соматических клетках, вряд ли это является причиной. Возможно, что PGCs неспособны устанавливать все метки, ассоциированные с молчанием и являются поэтому более чувствительными к реактивации. Согласуется с этим доказательство, что метилирование CpG островков не происходит на Xi в развивающихся PGCs у мышей (Grant et al. 1992).
Вьлоым примером реактивации Х является возвращение импринтированной Xp инактивации во время распределения ICM клона у эмбрионов ст. бластоциста (Section 3.5), которая снова ассоциирована с событиями широкого геномного репрограмирования. Эта реактивация также коррелирует с угасанием Xist РНК и с потерей многих эпигенетических меток, ассоциированных с молчанием.
S3 X Reactivation during Experimental Reprogramming
Реактивация Х также наблюдается при определенных экспериментальных условиях. Она происходит во время переноса ядер соматических клеток в неоплодотворенные ооциты (Eggan et al. 2000) и после слияния соматических клеток с тотипотентными типами клеток, такими как ES, embryonic germ (EG), или embryonal carcinoma (EC) клетками (Tada et al. 2001).
Эксперименты на мышах продемонстрировали (Eggan et al. 2000) быструю реактивацию генных маркеров на Xi при переносе ядер стадии дробления. Несмотря на это ядро сохраняло некоторую память, о том, что Х была инактивирована, т.к. у клонируемых эмбрионов на плодной стадии Xi донорских клеток также была Xi в трофэктодермальных клетках плаценты. Напротив, клетки собственно эмбриона обнаруживали случайную инактивацию Х (see Fig. 9). По-видимому, X реактивация и репрограммирование, которые происходят в развивающейся ICM дают эмбриону воторой шанс перестроить эпигенетическую информацию с донорского ядра.
X реактивация при слиянии между XX соматическими клетками и плюрипотентными эмбриональными клетками изучена плохо. Предположительно она также происходит как результат воздщей2ствия соматического генома на факторы, присутствующие в EC, ES или EG клетках. Реактивация, как было продемонстрировано, происходит довольно быстро, в течение приблизительно 5 дней после слияния, высокий уровень экспрессии
Xist затухает в слитых клетках после долговременного культивирования. Причинная связь этих событий не установлена.
S.4 Lessons from Inducible Xist Transgenes
Ряд экспериментов с использованием индуцибельных
Xist трансгенов в ES клетках существенно увеличил наше понимание стабильности в противовес обратимости инактивации Х. Во-первых, было продемонстрировано, что
Xist РНК может устанавливать инактивацию Х в недифференцированных ES клетках и во время каждой очень ранней стадии дифференцировки, но не позже (Wutz and Jaenisch 2000). Это обозначается как "window of opportunity." Эта способность клеток отвечать на
Xist РНК широко коррелирует с обратимостью инактивации Х. Т.о., молчание обратимо, когда трансген выключался в ES клетках или во время ранней дифференцировки, но не во время поздней дифференцировки или в соматических клетках. Возвращение к реактивации Х и репрограммированию, данные по индуцибельному трансгену предполагают, что при определенных клеточных условиях, а именно, в недифференцированных ES клетках, X
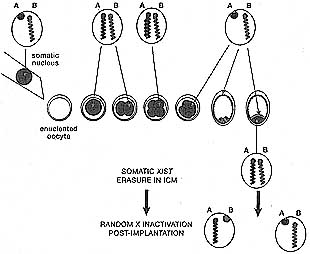 Figure 9. Regulation of X Inactivation in Cloned Mouse Embryos
The figure illustrates an XX donor cell with the inactive X chromosome (A) coated with Xist RNA (green line). In this model, transcription from the donor nucleus, including Xist RNA, is repressed by oocyte factors until the 2-cell stage, resulting in X reactivation. Recommencement of Xist expression then occurs at the 2-cell stage. Xist is then reexpressed, again from the inactive X allele from the donor cell. This would be attributable to retention of a mark such as DNA methylation at the Xist promoter. This pattern is maintained in cells allocated to the TE and PE lineages but not in pluripotent epiblast where Xist expression is again extinguished, leading to a second reactivation event. In the ICM, erasure of the epigenetic marks governing donor Xist expression allows subsequent random X inactivation hi the embryo proper.
Figure 9. Regulation of X Inactivation in Cloned Mouse Embryos
The figure illustrates an XX donor cell with the inactive X chromosome (A) coated with Xist RNA (green line). In this model, transcription from the donor nucleus, including Xist RNA, is repressed by oocyte factors until the 2-cell stage, resulting in X reactivation. Recommencement of Xist expression then occurs at the 2-cell stage. Xist is then reexpressed, again from the inactive X allele from the donor cell. This would be attributable to retention of a mark such as DNA methylation at the Xist promoter. This pattern is maintained in cells allocated to the TE and PE lineages but not in pluripotent epiblast where Xist expression is again extinguished, leading to a second reactivation event. In the ICM, erasure of the epigenetic marks governing donor Xist expression allows subsequent random X inactivation hi the embryo proper.
реактивация д. происходить, когда экспрессия
Xist РНК затухает. Если мы учтем, что такие клетки, в которых реактивация Х безусловно происходит (напр., PGCs, ICM клетки, EG и EC клетки), все они сходны с ES клетками в терминах плюрипотентности и пластичности, тогда затухание экспрессии
Xist может лежать в основе Х реактивации во всех случаях.
6 Summary and Future Directions
In recent years, there has been significant progress in our understanding of the molecular mechanism of X inactivation. To date, this progress has been fed by advances in related fields of epigenetic research and has, in turn, stimulated advances in other fields. An example of the latter is the growing evidence that some clusters of imprinted genes are regulated by ris-acting noncoding RNAs in much the same way that Xist regulates the X chromosome (see Chapter 19). There is every reason to think that this complementary progress will continue.
Many unanswered questions remain, however, and it is remarkable that despite over 40 years of research, we still do not understand, even in outline, the mechanisms involved in "counting" and "choice." The blocking factor hypothesis, now over 20 years old, provides an attractive conceptual guide, but the nature of the blocking factor itself, if it exists, remains elusive. Progress has been made in defining the c/s-acting sequences and trans-acting factors that regulate counting, and their further elucidation provides an exciting challenge. Similarly, although we now know some of the chromatin-modifying complexes involved in maintaining X inactivation, for example, the Polycomb-group complexes, the signal for establishing chromosome-wide silencing, triggered by Xist RNA, remains unknown. Possibly linked to this, we need to understand the mechanism of histone deacetylation and demethylation on the inactive X. Other key questions are to understand how silencing spreads across the chromosome and what role, if any, way stations (perhaps LINE elements) play in this process and in the stabilization/maintenance of the silent state. This may relate to the intriguing question of how X inactivation is reversed in some cell types and stages of development, but is essentially irreversible in others. This latter question relates to the wider and crucially important issue of understanding genome plasticity and reprogramming through development.
Сайт создан в системе
uCoz
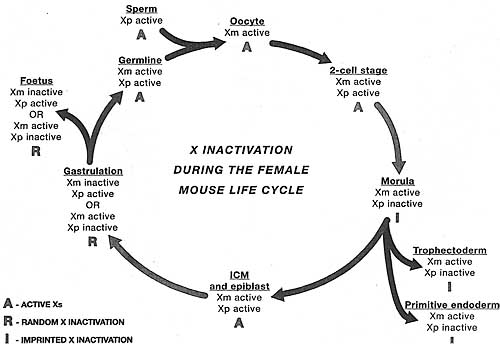
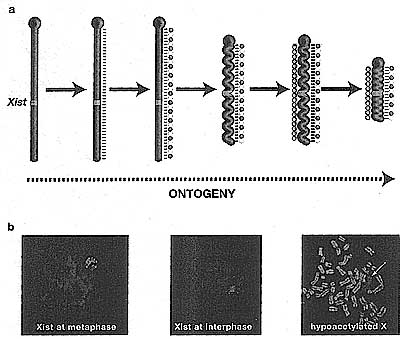
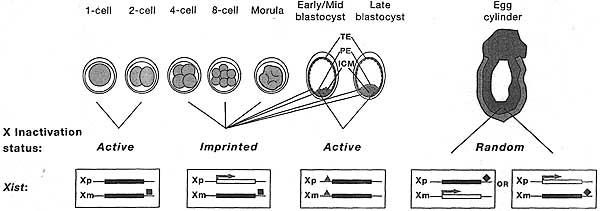
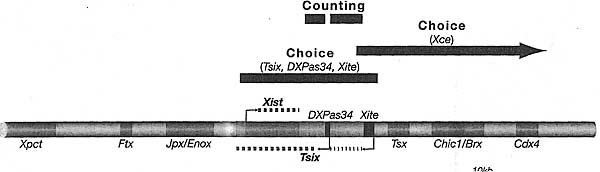
 Figure 7. Models for Nonrandom X Inactivation
Primary nonrandom X inactivation refers to skewing of the initial choice of which X chromosome is inactivated. Theoretically, this could occur in heterozygous females where there is a bias in the probability of the two alleles binding the blocking factor. In secondary nonrandom X inactivation, the choice of which X is inactivated is random, but cell selection events result in progressive loss of cells inactivating one of the two X chromosomes. For example, where there is a deleterious mutation on one X chromosome, cells that inactivate the other, wild-type X chromosome will be preferentially lost.
Figure 7. Models for Nonrandom X Inactivation
Primary nonrandom X inactivation refers to skewing of the initial choice of which X chromosome is inactivated. Theoretically, this could occur in heterozygous females where there is a bias in the probability of the two alleles binding the blocking factor. In secondary nonrandom X inactivation, the choice of which X is inactivated is random, but cell selection events result in progressive loss of cells inactivating one of the two X chromosomes. For example, where there is a deleterious mutation on one X chromosome, cells that inactivate the other, wild-type X chromosome will be preferentially lost. 

