В случае клеточного старения увеличение репрессивных гистоновых меток также является показателем дисфункции клеток. Это вместе с пониженным показателем ацетилирования гистонов, может усилить и даже повысить уровни молчащего хроматина, блокировать клеточную пластичность и перевести клетки в антипролиферативное состояние (Scaffidi et al. 2005). Это в основном возраст-зависимый эффект, хотя болезненное состояние, progeria, может способствовать преждевременному старению. Напротив, когда репрессивные перицентромерные метильные метки снижаются у мутантов, лишенных трансдуцирующего энзима (Suv39h), то клетки обнаруживают повышенные доли иммортализации, более не стареют и обнаруживают более высокие степени геномной нестабильности (Braig et al. 2005). Эти примеры иллюстрируют, что дерегуляция хроматина, демонстрируемая по уровням характерных гистоновых меток, часто трансдуцируется с помощью PcG и trxG энзимов, a ядерная морфология является важным индикатором прогрессирования болезни.
PcG-обусловленное молчание генов и инактивация Х хромосом являются первостепенными примерами онтогенетически регулируемых переходов между активным и неактивным состоянием хроматина (see Fig. 17), часто обозначаемых как факультативный гетерохроматин. Он находится в контрасте с конституитивным гетерохроматином (напр., в перицентромерных доменах), который может быть default индуцирован в некодирующих или высоко повторяющихся регионах. Факультативный гетерохроматин появляется в кодирующих регионах генома, где генное молчание зависит от, а иногда обратимо в зависимости от онтогенетических решений, специфицирующих различные клеточные судьбы.
Инактивация X использует крупную (~17 kb) некодирующую РНК, Xisty, которая, по-видимому, действует как первичный триггер ремоделирования хроматина Xi. Хотя существует потенциал образования dsRNA между Xist и антисмысловым транскриптом Tsix (экспрессируемым только перед началом инактивации Х), но нет неопровержимых доказательств для RNAi-зависимых механизмов, участвующих в инициации инактивации Х. X-inactivation center (XIC) и возможно ДНК "entry" или "docking" сайты (предположительно являющиеся специализированными повторяющимися ДНК элементами, которыми обогащена одна из Х хромосом) играют роль для Xist РНК, чтобы ассоциировать и функционировать в качестве каркасной молекулы, декорирующей Xi в цис-положении. Xist способствует рекрутированию и действию как PRC1 (polycomb respressive complex), так и PRC2 комплексов, участвующих в установлении стабильной неактивной Х хромосомы. Компоненты PRC2 включают, напр., HKMT хроматин-модифицирующий энзим, EZH2, который катализирует H3K27me3. Свяывание PRC1 комплекса может обеспечиваться как H3K27me3, так и независимым от гистоновых модификаций способом, тогда как др. компоненты комплекса, такие как Ring1 белки, ubiquitinate H2A. Такой же является и гетерогенность PcG комплексов, разные компоненты которых могут действовать независимо от др. компонентов комплекса. Модификации хроматина, связывание PcG комплекса, последующее включение варианта гистона macroH2A вдоль Xi и сильное метилирование ДНК, всё это вносит вклад в генерацию факультативных гетерохроматиновых структур вдоль всей Xi хромосомы. После образования стабильной гетерохроматиновой структуры Xist РНК становится не нужной для её поддержания (Avner and Heard 2001; Heard 2005). Сходной формой моноаллельного молчания является геномный импринтинг, который также использует некодирующие или антисмысловые РНК, чтобы заставить молчать одну из аллельных копий специфичным для родительского происхождения способом (Chapter 19). Пока неясно, могут ли и как у Dicer-мутантных мышей ES клетки подвергаться процессу Х инактивации или геномного импринтинга.
Итак, данный раздел и разделы 10 и 11 описывают механизмы РНК-управляемых модификаций хроматина, т.к. они касаются конституитивного гетерохроматина, Xi хромосомы и возможно PcG-обусловленного молчания генов. На основании интригующих параллелей можно постулировать, что РНК половинка(и) или неспаренная ДНК д. представлять привлекательный пример пускового устройства для стабилизации PcG комплексов на PREs или поставленной под угрозу функции промотора, где они могут "ощущать" качество транскрипционного процессинга. Аберрантная или остановившаяся элонгация и/ или ошибки сплайсинга д. побуждать к взаимодействию между PRE-bound PcG и промотором, приводя в результате к его выключению. Т.о., инициация молчания PcG д. индуцироваться с помощью перехода от продуктивной к непродуктивной транскрипции. Степень, с которой trxG комплексы могут использовать контроль качества РНК и/или процессинга первичных транскриптов РНК, как части поддерживающего транскрипционного "ВКЛ" состояния, только начинает раскрываться (Sanchez-Eisner et al. 2006).
14 Reprogramming of Cell Fates
Вопрос, как клеточные судьбы могут быть изменены или обращены, давно интересует исследователей. Зародышевые клетки и ранние эмбриональные клетки отличаются от др. клеточных компартментов как коренные ("ultimate") стволовые клетки по своей прирожденной тотипотентности. Хотя спецификация клеточных судеб у млекопитающих делает возможным образование около 200 различных типов клеток, имеются в принципе два основных дифференцирующих перехода: от стволовых (плюрипотентных) клеток к полностью дифференцированным клеткам и между покоящимися (молчащими или G0) и пролиферирующими клетками. Они представляют собой крайние конечные точки среди множества промежуточных в соответствии с совокупностью из различных заготовок (makeups) эпигенома в развитии млекопитающих. Во время эмбриогенеза выявляется динамическое увеличение эпигенетических модификаций, выявляемых при переходе от оплодотворенного ооцита к стадии бластоцист а и затем к имплантации, гаструляции, развитию органов и росту плода. Большинство из этих модификаций или отпечатков могут быть стерты путем переноса дифференцированного клеточного ядра в цитоплазму энуклеированного ооцита. Однако, некоторые маркеры могут сохраняться и тем самым ограничивать нормальное развитие клонируемых эмбрионов, а немногие могут даже наследоваться как germ-line modifications (g-mod) (see Fig. 18), которые у млекопитающих скорее всего включают метилирование ДНК.
Регенерация печени и репарации мышечных клеток являются исключениями из тканей млекопитающих, которые могут регенерировать в ответ на повреждения или ранения, хотя большинство др. тканей неспособны репрограммироваться. У др. организмов, таких как растения и Axolotl, определенные соматические клетки могут действительно репрограммировать свой эпигеном и повторно вступать в клеточный цикл, чтобы регенерировать потерянную или поврежденную ткань (Tanaka 2003). В целом, однако, репрограммирование соматических клеток невозможно, за исключением того, когда они искусственно перестраиваются, чтобы рекапитулировать раннее развитие после ядерного переноса (NT) в энуклеированные ооциты. Это впервые было продемонстрировано на клонируемых лягушках (Xenopus), и сравнительно недавно получением овцы Dolly, первого клонированного млекопитающего (Campbell et al. 1996; see Chapter 22).
Выявлены три основных препятствия к эффективному соматическому репрограммированию у млекопитающих. Во-первых, определенные соматические эпигенетические маркеры (напр., репрессивные H3K9me3) стабильно передаются посредством делений соматических клеток и сопротивляются репрограммированию в ооците. Во-вторых, ядро соматической клетки неспособно воспроизводить асимметрию репрограммирования, которая происходит у оплодотворенного эмбриона как следствие дифференциальных эпигенетических маркеров, наследуемых с помощью гаплоидных геномов самца и самки (see Mayer et al. 2000; van der Heijden et al. 2005; Chapter 20). В-третьих, передача импринтированных локусов, которые особенно важны для плодного и плацентарного развития, сохраняются не полностью после NT (Morgan et al. 2005). Большинство клонируемых эмбрионов абортируют, указывая тем самым, что нарушенные эпигенетические импринты представляют собой узкое горлышко для нормального развития и могут быть причиной низкой эффективности assisted reproductive technologies (AST) и снижают жизненную силу (vigor) клонируемых животных.
Использование эмбриональных стволовых клеток по сравнению с соматическими обнаруживает более значительный потенциал репрограммирования. Демонстрация, что молчащие клетки (частая характеристика стволовых клеток) характеризуются глобальным снижением H3K9me3 и H4K20me3 состояний, это может быть фактором, указывающим на повышенную пластичность эпигенома (Baxter et al. 2004). Это также согласуется с фактом, что "бессмертные" одноклеточные организмы (напр., дрожжи) в основном с отрытым и активнм геномом лишены некоторых репрессивных эпигенетических механизмов.
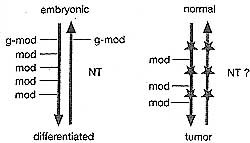 Figure 18. Reprogramming by Nuclear Transfer
During the lifetime of an individual, epigenetic modifications (mod) are acquired in different cell lineages (left). Nuclear transfer (NT) of a somatic cell reverses the process of terminal differentiation, eradicating the majority of epigenetic marks (mod); however, some modification that would also be present in the germ line (g-mod) cannot be removed. During neoplastic transformation (from a normal to tumor cell), caused by a series of genetic mutations (red stars), epige-netic lesions accumulate. The epigenetic lesions (mod), but not the mutations, can be erased through reprogramming upon NT This approach evaluates the interplay between genetic and epigenetic contributions to tumorigenesis. (Figure adapted from R. Jaenisch.)
Figure 18. Reprogramming by Nuclear Transfer
During the lifetime of an individual, epigenetic modifications (mod) are acquired in different cell lineages (left). Nuclear transfer (NT) of a somatic cell reverses the process of terminal differentiation, eradicating the majority of epigenetic marks (mod); however, some modification that would also be present in the germ line (g-mod) cannot be removed. During neoplastic transformation (from a normal to tumor cell), caused by a series of genetic mutations (red stars), epige-netic lesions accumulate. The epigenetic lesions (mod), but not the mutations, can be erased through reprogramming upon NT This approach evaluates the interplay between genetic and epigenetic contributions to tumorigenesis. (Figure adapted from R. Jaenisch.) Др. признаком нормального эпигенетического репрограммирования у млекопитающих после оплодотворения является его четкая асимметрия. Это можно в первую очередь приписать разным программам эпигенетической спецификации зародышевых клеток самцов и самок (Chapters 19 and 20). Геном спермиев в основном строится из protamines, хотя имеются остаточный, хотя и достоверный уровень CENP-A (варианта гистона H3) и др. предположительно эпигенетических импринтов (Kimmins and Sas-sone-Corsi 2005), в то время как ооцит строит регулярный содержащий нуклеосомы хроматин. После оплодотворения гаплоидные геномы спермия и яйцеклетки подвергаются циклу репрограммирования, с участием деметилирования ДНК и замены гистоновых вариантов. Модификации могут или усиливать или балансировать эпигенетические отличия двух родительских геномов перед слиянием ядер в первом клеточном цикле. Во время дифференцировки эмбриональных (т.e., inner cell mass [ICM) и внеэмбриональных (т.e., trophectoderm [TE] и плаценты) тканей устанавливаются различные профили метилирования ДНК и гистоновых модификаций между клонами (Morgan et al. 2005). Соматическое клонирование не могут в точности воспроизвести эти паттерны репрограммирования, обнаруживая быструю, но немее экстенсивное деметиирование в первом клеточном цикле и нарушения метилирования ДНК и метилирование лизинов гистонов между ICM и TE клетками.
Близко родственные процессы при соматическом репрограммировании предопределяют судьбу импринтированных генетических локусов. При нормальном эмбриональном развитии корректная аллельная экспрессия импринтируемых локусов необходима (Chapter 19). Это было продемонстрировано с помощью плодотворных экспериментов, которые генерировали однородительских эмбрионов (Barton et al. 1984; McGrath and Solter 1984; Surani et al. 1984). Андрогенетические эмбрионы (оба генома отцовского происхождения) обнаруживают задержку эмбрионального развития, но гиперпролиферацию внеэмбриональных тканей (напр., плаценты). У гино- или партеногенетических эмбрионов (оба генома женского происхождения), плацента оказывается недоразвитой. Специфический для родителей инпринтинг д. устанавливаться в зародышевых клетках вследствие стирания предсуществующих меток (Chapter 20). Считается, что это происходит примерно в 100 или более импринтированных генах, в основном участвующих в системах снабжения ресурсами эмбрионального и плацентарного развития (напр., Igf2 фактор роста).Интересно, что имеются доказательства, что импринтинг может быть нарушен во время культивирования
in vitro эмбрионов, полученных с помощью ART или переноса ядер (Maher 2005).
15 Cancer
Имеется деликатный баланс между самообновлением и дифференцировкой. Неопластическая трансформация (tumorigenesis) рассматривается как процесс, при котором клетки подвергаются изменениям, приводящим к неконтролируемой клеточной пролиферации, потере checkpoint контроля, позволяющим избегать накопления хромосомных аберраций и геномных анеуплоидий, и неправильно контролируемой дифференцировке (Lengauer et al. 1998). Общепринято, что трансформация обусловливается, по-видимому, крайней мере, одним генетическим повреждением, таким как точковая мутация, делеция или транслокация, нарушающими или ген супрессор опухолей или онкоген (Hanahan and Weinberg 2000). Гены супрессии опухолей оказываются молчащими в опухолевых клетках. Онкогены активируются посредством доминантных мутаций или избыточной эксрессии нормальных генов (proto-oncogene). Важно, что накопление аберрантных эпигенетических модификаций также связано с опухолевыми клетками (see Chapter 24). Эпигенетические изменения вызывают изменения паттернов метилирования ДНК, модификации гистонов и структуры хроматина (see Fig. 19). Т.о., неопластическая трансформация является ложным многоступенчатым процессом, связанным со случайной активацие1 онкогенов и/или замалчивания генов, супрессирующих опухоли, считается, что посредством генетических или эпигенетических событий, и это обозначается как "Knudson two-hit" теория (Feinberg 2004; Feinberg and Tyko 2004). Чтобы проиллюстрировать молчание гена retinoblastoma (Rb), опухолевого супрессора, вызывающего потерю checkpoint контроля, что не только создает пролиферативные преимущества, но и также способствует "второму удару" путем нарушения нижестоящих функций, связанных со структурой хроматина, которая поддерживает геномную целостность (Gonzalo and Blasco 2005). Несоответствующая активация онкогенного продукта, такого как гена myc может оказывать сходный эффект (Knoepfler et al 2006).
Возникает вопрос, до какой степени аберрантные эпигенетические изменения вносят вклад в показатели и вообще в в поведение опухолей? Это исследовали с помощью NT экспериментов, используя клетки меланомы nudeus в качестве донорских (Hochedlinger et al. 2004). Любое генетическое повреждение донорской клетки остается; однако, NT стирает эпигенетические надстройки. Показатель опухолей у клонируемых мышиных эмбрионов показал, что спектр опухолей, которые возникают de novo варьирует существенно, что согласуется с разным вкладом эпигенетических модификаций в разные ткани, которые запускают неопластический рост.
Гипометилирование ДНК (в противоположность гиперметилированию) может происходить в дискретных локусах или на широких регионах хромосом. Гипометилирование ДНК было. фактически, первым типом эпигенетического перехода, ассоциированного с раком (Feinberg and Vogelstein 1983). Это в свою очередь ведет к широким фенотипическим проявлением раковых клеток. На уроне индивидуальных генов гипометилирование ДНК может быть неопластическим из-за активации прото-онкогенов, депрессии генов, которые вызывают аберрантные клеточные функции, или из-за биаллельной экспрессии импринтируемых генов (называется также потерей импринтинга loss of imprinting или LOI) (see Chapters 23 and 24). На более глобальной геномной шкале широкое гипометилирование ДНК, особенно в областях конституитивного гетерохроматина, предрасполагает клетки к хромосомным транслокациям и анеуплоидиям, которые вносят вклад в прогрессирование опухолей. Этот эффект воспроизводится у мутантов Dnmtl (Chen et al. 1998). Геномная нестабильность, которая возникает, когда имеет место гипометилирование ДНК, скорее всего обусловлена мутагенным эффектом реактивации транспозонов. С привлечением внимания к существенной роли, которую играют гистоновые модификации для поддержания гетерохроматина в центромерах и теломерах, появились доказательства, что эти метки теряются, геномная нестабильность кроме того обеспечивает вклад в прогрессирование раковых опухолей (Gonzalo and Btasco 2005).
Напротив, гиперметилирование ДНК концентрируется в промоторных регионах CpG островков в большинстве раковых опухолей. Молчание генов, супрессирующих опухоли, в результате подобного гиперметилирования ДНК является критическим для прогрессирования раковых опухолей. Недавние исследования показали, что имеется серьезное взаимодействие между модификациями хроматина и метилированием ДНК, демонстрирующее, что более одного эпигенетического механизма участвует в молчании генов опухолевых супрессоров. В качестве иллюстрации известно, что гены супрессоров опухолей, pl6 и hMLHl, принуждаются к молчанию как метилированием ДНК, так и репрессивным метилированием гистоновых лизинов при раке (McGar-veyetal. 2006).
Дерегуляция модификаторов хроматина участвует во многих формах рака. Определенные гистон-модифицирующие энзимы становятся онкогенными, такие как PcG белок EZH2 и trxG белок MLL, и осуществляют свои эффекты посредством пертурбации клеточных эпигенетических характерных особенностей, которая затем или транскрипционно замалчивает или активирует несоотв. гены (Schneider et al. 2002; Valk-Lingbeek et al. 2004). Очевидно, что эпигенетические характеристики являются критическими клеточными функциями. Фактически, паттерн глобальных acetyl и methyl гистоновых меток составляет отличительные признаки для прогрессиорования определенных опухолей, как показывают исследования прогрессирования опухоли простаты (Sdigson et aL 2005).
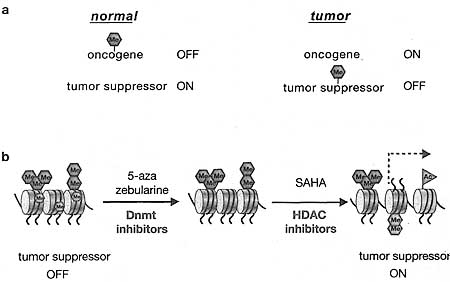 Figure 19. Epigenetic Cancer
(a) Aberrant epigenetic marks at cancer-causing ioci typically involve the derepression of oncogenes or silencing of tumor suppressor genes. Epigenetic marks known to alter a normal cell include DNA methylation, repressive histone methylation, and histone deacetylation. (d) The use of epigenetic therapeutic agents for the treatment of cancer has consequences on the chromatin template, illustrated for a tumor suppressor locus. Exposure o to Dnmt inhibitors results in a loss of DNA methylation, and exposure to HDAC inhibitors results in the acquisition of histone acetyl marks and subsequent downstream modifications, including active histone methyl marks and the incorporation of histone variants. The cumulative chromatin changes lead to gene re-expression.
Figure 19. Epigenetic Cancer
(a) Aberrant epigenetic marks at cancer-causing ioci typically involve the derepression of oncogenes or silencing of tumor suppressor genes. Epigenetic marks known to alter a normal cell include DNA methylation, repressive histone methylation, and histone deacetylation. (d) The use of epigenetic therapeutic agents for the treatment of cancer has consequences on the chromatin template, illustrated for a tumor suppressor locus. Exposure o to Dnmt inhibitors results in a loss of DNA methylation, and exposure to HDAC inhibitors results in the acquisition of histone acetyl marks and subsequent downstream modifications, including active histone methyl marks and the incorporation of histone variants. The cumulative chromatin changes lead to gene re-expression.
Разработка лекарственных мишеней, ингибирующих функцию хроматин-модифицирующих эффекторных энзимов, открывает новые горизонты в противоопухолевой терапии (see Fig. 19). Использование DNMT и HDAC ингибиторов наиболее продвинуто на стадии клинических испытаний. Zebularine и SAHA являются, соотв., двумя такими ингибиторами. Они особенно целительны для раковых клеток, в которых репрессированы гены опухолевых супрессоров (J.C. Cheng et al. 2004; Garcia-Manero and Issa 2005; Marks and Jiang 2005), т.к. обработка ведет стимуляции транскрипции. Основная пропорция репрессивного метилирования гистоновых лизинов теряется во время лечения в основном в результате связанных с транскрипцией замен гистонов и замещения нуклеосом; однако, эти ингибиторы не меняют существенно H3K9me3 в регионах промоторов мишеней (McGarvey et al. 2006). Остается разрешить вопрос, могут ли индуцировать репрессивные метки, которые персистируют, последующее повторное молчание генов опухолевых супрессоров, если в лечении наступает пауза, что могло бы противодействовать успешности "эпигенетической терапии". Возможно, что стратегия двойной эпигенетической терапии с использование ингибиторов DNMT и HDAC м. обещать лучший прогноз в клинических испытаниях.
Идентификация ингибиторов др. классов гистоновых модификаторов, а именно HKMTs и PRMTs, сегодня в фазе развития. Имеется приблизительно около 50 SET доменовых HKMTs в геноме млекопитающих. Большинство из хорошо охарактеризованных энзимов, таких как SUV39H, EZH2, MIX и RIZ участвуют в развитии опухолей (Schneider et al. 2002). Т.о., высокопроизводительный скрининг (high-throughput screens (HTS)) д. использоваться для успешной идентификации низкомолекулярных ингибиторов, которые может быть использованы в поисковых исследованиях и в конечном счете для противоопухолевой терапии. Все классы гистон-модифицирующих энзимов пригодны для подобных подходов, т.к. их специфические субстрат-связывающие сайты (т.e., к гистоновым пептидам), в противоположность связывающим сайтам к общему кофактору (напр., acetyl-CoA и SAM), д. позволять разработку более избирательных лоекарств. HTS оказался успешным для HDACs (Su et al. 2000), PRMTs (D. Cheng et al. 2004) и HKMTs (Greiner et aL 2005).
Необходимы как hypothesis-driven, так и эмпирические подходы для окончательного определения эффективности и пригодности любого из гистон-модифицирующих ингибиторов. Напр., избирательные HKMT ингибиторы против MLL или EZH2 могут быть ценными терапевтическими агентами против лейкемии и рака простаты. Альтернативно, использование SUV39H HKMT ингибитора, который кажется контринтуитивным, из-за потребности в этом энзиме для поддержания конституитивного гетерохроматина и стабильности генома, всё ещё может преимущественно сенсибилизировать опухолевые клетки. Кроме того, анализ HDAC ингибитора SAHA показал, что он может оперировать посредством дополнительных путей, которые отличны от реактивации транскрипции (Marls and Jiang 2005). Напр., HDAC ингибиторы могут также сенсибилизировать повреждения хромат ина, ингибируя эффективную репарацию ДНК и обеспечивая геномную нестабильность, которая может запускать апоптоз опухолевых клеток. Эти наблюдения обязательно д. отслеживаться, при оценке эффективности двойной комбинационной терапии. Исходя из результатов, однако, вполне возможно, что комбинационная терапия с использованием HDAC и HKMT ингибиторов может быть более избирательной в убивании про-неопластических клеток путем вовлечения их в информационный переизбыток и хроматиновую катастрофу. Следует надеяться, что продолжающиеся исследования позволят идентифицировать жизнеспособные кандидаты для эффективной эпигенетической терапии рака.
16 What Does Epigenetic Control Actually Do?
Приблизительно 10% белкового пула, кодируемого с помощью генома млекопитающих, играет роль в транскрипции или регуляции хроматина (Swiss-Prot database). Учитывая, что геном млекопитающих состоит из 3 X 109 bp, то он может быть приспособлен к примерно 1 X 107 нуклеосомам. Это порождает несметное количество возможных регуляторных посланий, включая ДНК-связывающие взаимодействия, гистоновые модификации, гистоновые варианты, ремоделирование нуклеосом, метилирование ДНК и некодирующие РНК. Всё же этот процесс транскрипционной регуляции сам по себе является совершенно запутанным, часто нуждается в сборке крупных мультибелковых комплексов (MOO белки), чтобы гарантировать инициацию, элонгацию и корректный процессинг мРНК с одиночного избранного промотора. Если ДНК сиквенс-специфическая регуляция столь сложна, то следует ожидать, ассоциаций низкого сродства вдоль динамичного полимера ДНК-гистоны и даже более того. На основании этих рассуждений редко может быть так, что одна модификация коррелирует с одним эпигенетическим состоянием. Скорее всего и как подтверждают экспериментальные доказательства существует комбинация или кумулятивный эффект нескольких (возможно многих) сигналов поверх расширенной области хроматина, которые стабилизируют и распространяют эпигенетические состояния (Fischle et al. 2003b; Lachner et al. 2003; Henikoff, 2005).
По большей части, связывание транскрипционного фактора является временным и теряется в последующих клеточных делениях. Для сохранения паттернов генной экспрессии, необходимы транскрипционные фактории в каждом последующем клеточном делении. Как таковой эпигенетический контроль может усиливать первичный сигнал (напр., стимуляция промотора, молчание генов, определение центромеры) чтобы обеспечить последовательные (но не бесконечные) клеточные генерации с помощью наследственной передачи информации посредством хроматиновых матриц (Fig. 20). Интересно, что у S. pombe, Swi6-зависимая эпигенетическая variegation может быть супрессирована на многие клеточные деления во время как митозов, так и мейоза (Grewal and Klar 1996) с помощью гистоновых модификаций (наиболее вероятно H3K9me2). Аналогичные исследования были осуществлены на Drosophila, используя пульсовой активирующий транскрипционный фактор, чтобы передавать клеточную память для экспрессии Hox генов в зародышевой линии самок (Cavalli and Paro 1999). В обоих этих примерах эпигенетическая память обеспечивается изменениями хроматина, которые представлены разными гистоновыми модификациями и, скореее всего, также включением вариантов гистонов.
Если гистоновые модификации функционируют совместно, то может накладываться отпечаток (imprint) на хроматиновую матрицу, что д. помочь пометить нуклеосомы, особенно, если сигнал восстанавливается после репликации ДНК (Fig. 20). Для даже более стабильного наследования сотрудничество между гистоновыми модификациями, включением вариантов гистонов и ремоделированием хроматина д. превращать протяженные области хроматина в персистирующие структурные альтерации, которые затем могут распространяться в течение многих клеточных делений. Несмотря на объяснение наследуемых транскрипционных "ВКЛ" состояний, сходная синергичность между репрессивными эпигенетическими механизмами д. быть более стабильно заперта регионами молчащего хроматина, что в дальнейшем д. усиливаться за счет дополнительного метилирования ДНК.
Двойная спираль ДНК может быть рассмотрена затем как самох-организующийся полимер, который, благодаря своему упорядочиванию в хроматин, может отвечать на эпигенетический контроль и амплифицировать первичный сигнал в более долговременную "память". Кроме того, многие гистоновые модификации возможно участвуют в реакции на внутренние и внешние стимулы. Учитывая это, хроматин-модифицирующие энзимы д. нуждаться в кофакторах, таких как ATP (kinases), acetyl-CoA (HATs) и SAM (HKMTs), чьи уровни диктуются внешнесредовыми изменениями (напр., диетой). Т.о., измененные условия могут транслироваться в более динамичный или стабильный полимер ДНК-гистоны. Прекрасным примером является NAD-зависимая HDAC, Sir2, которая действует в качестве "сенсора" питательных веществ и life span/aged клеток (Guarente and Picard 2005; Rine 2005). Понимание того, как эти внешние сигналы превращаются в биологически важные эпигенетические сигнатуры и как они считываются, транслируются и наследуются, является сутью современных эпигенетических исследований. Однако, важно подчеркнуть, что эпигенетический контроль нуждается в сложном балансе многих факторов и что функциональное взаимодействие не всегда полностью восстанавливается после каждого клеточного деления. Это является функциональным контрастом по отношению к генетике, где используются альтерации последовательностей ДНК, которые всегда стабильно передаются через митозы и мейоз, если мутация возникает в зародышевой линии.
Возникает важный вопрос из представленных выше рассуждений, как информация, содержащаяся в хроматине, передается от материнской дочерним клеткам. Если клетка теряет свои качественные особенности из-за болезни, неправильной регуляции или репрограммирования, то сопровождается ли потеря качественных характеристик изменениями в структуре хроматина? Массовый синтез большинства стержневых гистонов высоко регулируется во время клеточного цикла. Транскрипция стержневых гистоновых генов происходит во время S фазы, стадии, когда ДНК реплицируется (replication coupled). Такая "координация" подтверждает, что т.к. количество ДНК удваивается в клетке, то имеется достаточно стержневых гистонов для откладывания их на новую реплицированную ДНК и тем самым для упаковки ДНК, происходящей одновременно с репликацией ДНК. Как показано выше разные регионы хроматина могут обладать самостоятельными отличиями по гистоновым модификациям, которые программируют область или к транскрипции или наоборот. Как домены вновь синтезированного дочернего хроматина сохраняют эту критическую информацию для соотв. экспрессии генов? Как программа полностью передается в виде матрицы из одной клеточной генерации следующей во время митозов или формирования зародышевых клеток (спермиев и яиц)? Эти центральные вопросы ждут дальнейшего исследования.
Хотя первоначальные исследования показали полуконсервативный процесс, при котором новый H3/H4 тетрамер откладывается, сопровождаемый включением двух новых H2A/H2B димеров, но недавние данные поставили под вопрос эту гипотезу. В этой недавней модели "новые" H3 и H4 полипептиды, которые уже могут нести некоторые посттрансляционные модификации, инкорпорируются во вновь синтезируемые H3/H4 гистоновые димеры вместе со "старыми" H3/H4 димерами, сегрегирующими между материнской и дочерней ДНК. Если это так, тогда модифицированные родительские H3/H4 димеры теперь также д. присутствовать вместе с вновь синтезированными димерами на той же самой ДНК. Их совместное присутствие может затем диктовать как соотв. модификации будут помещаться на вновь добавленных димерах (Tagami et aL 2004). Эта модель привлекательна и может помочь объяснить наследование гистоновых модификаций и тем самым распространение эпигенетической информации во время репликации ДНК и делений клеток. Однако, необходимо больше доказательств, подтверждающих действенность данной или др. интригующих моделей, объясняющих передачу хроматиновых меток при клеточных делениях.
В завершение этой части зададимся вопросом, отличается ли эпигенетический контроль фундаментально от базовых генетических принципов? Хотя мы можем пожелать рассмотреть эпигенетические ландшафты Уоддингтона в качестве демаркирующих участков активирующих или репрессивных гистоновых модификаций вдоль континуума хроматинового полимера, это мнение может быть
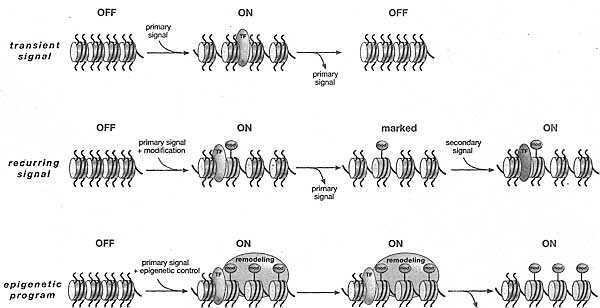
Figure 20. Epigenetic Potentiation of a Primary Signal (Memory/Inheritance)
Classic genetics predicts that gene expression is dependent on the availability and binding of the appropriate panel of transcription factors (TF). Removal of such factors (i.e., a primary signal) results in the loss of gene expression, and thus constitutes a transient activating signal (top). Chromatin structure contributes to gene expression, where some conformations are repressive and others active. The activation of a locus may therefore occur through a primary signal and result in the downstream change in chromatin structure, involving active covalent histone marks (mod) and the replacement of core histones with variants (e.g., H3.3). Through cell division, this chromatin structure may only be reestablished in the presence of an activating signal (denoted "recurring signal"). Epigenetic memory results in the maintenance of a chromatin state through cell division, even in the absence of the primary activating signal. Such a memory system is not absolute, but involves multiple levels of epigenetic regulation for remodeling chromatin structure. The dynamic nature of chromatin means that although a chromatin state may be mitotically stable, it is nonetheless prone to change, hence affecting the longevity of epigenetic memory..
легко интерпретировано по другому. Только в последнее время, когда мы узнали о крупных ферментативных системах, посредством которых могут распространяться гистоновые модификации. Это повлияло на наше современное понимание стабильности, а следовательно, и наследование определенных гистоновых маркеров. Кроме того, даже заниженные оценки недавних открытий показывают, что мутации хроматин-модифицирующих активностей, таких как ремодельеры нуклеосом (Cho et al. 2004; Mohrmann and Verrijzer 2005), DNMTs (Robertson 2005), HDACs или HMKTs (Schneider et al. 2002), т.к. они часто обнаруживаются при аномальном развитии и неоплазии, являются наглядным примером предельной мощности генетического контроля. Как таковой показатель опухолей у таких мутантных мышей в целом рассматривается как генетическое заболевание. Напротив, альтерации в структуре нуклеосом, метилировании ДНК и профилей гистоновых модификаций - не вызываются мутантными генами - д. классифицироваться как "настоящие" эпигенетические аберрации. Прекрасным примером такой наиболее пластичной системы являются стохастические решения во время раннего эмбрионального развития, репрограммирование с помощью перенося ядер, транскрипционная память, геномный импринтинг, мозаичная инактивация Х, качественные характеристики центромер и прогрессирование опухолей. Генетика и эпигенетика являются тесно связанными феноменами и наследование обоих является их распространением посредством клеточных делений, которые, для генетического контроля, заключают в себя зародышевую линию, если мутации происходят в зародышевых клетках. В случае др., часто слишком легко категоризированных, эпигенетических модификаций, мы не знаем отражают ли они лишь минорные и временные реакции на изменения во внешней среде или вносят существенный вклад в фенотипические различия, которые могут быть затем поддержаны в течение многих, но не бесконечных делений соматических клеток и иногда затрагивают зародышевую линию. С нашим сегодняшним знанием эпигенетических механизмов имеется мало, если вообще новые подтверждения Ламаркизма.
17 Big Questions in Epigenetic Research
This book discusses the fundamental concepts and general principles that explain how epigenetic phenomena occur, as puzzling as they may seem. Our ultimate goal is to expose the reader to the current understanding of mechanisms that guide and shape these concepts, drawing upon the rich biology from which they emerge. In just a few years, epigenetic research has prompted exciting and remarkable insights and breakthrough discoveries, yet many long-standing questions remain unanswered (see Fig. 21). Although it is tempting to draw broad-brush conclusions and to propound general rules from this progress, we caution against this tendency, suspecting that there will be many exceptions that break the rules. For example, it is dear that striking organismal differences occur. Notably, from unicellular to multicellular organisms, the extent and type of histone modifications, histone variants, DNA methylation, and use of the RNAi machinery does vary.
There are, however, plenty of reasons for renewed energy in research programs designed to gain molecular insights into epigenetic phenomena. Elegant biochemical and genetic studies have already successfully dissected many of the functional aspects of these pathways, in an unprecedented manner. It could therefore be predicted that careful analysis of epigenetic transitions in different cell types (e.g., stem versus differentiated; resting versus proliferating) will uncover hallmarks of pluripotency (Bernstein et al. 2006; Boyer et al. 2006; Lee et al. 2006). This wiD most likely be valuable in diagnosing which chromatin alterations are significant during normal differentiation as compared with disease states and tumorigenesis. For example, using large-scale mapping approaches with normal, tumor, or ES cells-"epigenetic landscaping" along entire chromosomes (Brachen et al. 2006b; Squazzo et al. 2006; Epigenomics AG, ENCODE, GEN-AU, EPIGENOME NoE)-it is anticipated that the knowledge generated could be harnessed for novel therapeutic intervention approaches and work toward promoting a worldwide consortium to map the entire human epigenome (Jones and Martienssen 2005). It is conceivable that differences in the relative abundance between distinct histone modifications, such as the apparent underrepresentation of repressive histone lysine tri-methylation in S. pombe and A. thaliana, may reflect the greater proliferative and regenerative potential in these organisms as compared to the more restricted developmental programs of metazoan systems. In addition, the functional links between the RNAi machinery, histone lysine methylation, and DNA methylation will continue to provide exciting surprises into the complex mechanisms required for cell-fate determination during development. Similarly, an enhanced understanding of the dynamics and specificity of nucleosome-remod-eling machines will contribute to this end. We predict that more "exotic" enzymatic activities will be uncovered, catalyzing epigenetic transitions through modifications of histone and non-histone substrates. It would appear that chromatin alterations, as induced by the above mechanisms, act largely as a response filter to the environment. Thus, it is hoped that this knowledge can ultimately be applied to enhanced therapeutic strategies for resetting
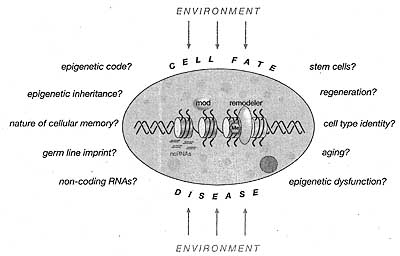 Figure 21. Big Questions in Epigenetic Research
The many experimental systems used in epigenetic research have unveiled numerous pathways and novel insights into the mechanisms of epigenetic control. Many questions, as shown in the figure, still remain and require further elucidation or substantiation in new and existing model systems and methods.
Figure 21. Big Questions in Epigenetic Research
The many experimental systems used in epigenetic research have unveiled numerous pathways and novel insights into the mechanisms of epigenetic control. Many questions, as shown in the figure, still remain and require further elucidation or substantiation in new and existing model systems and methods.
some of an individual's epigenetic response that contribute to aging, disease, and cancer. This includes tissue regeneration, therapeutic cloning (using ES cells and their derivatives), and adult stem cell therapy strategies. It is believed such strategies will extend cellular life span, modulate stress responses to external stimuli, reverse disease progression, and improve assisted reproductive technologies. We predict that understanding the "chromatin basis" of pluripotency and totipotency will Ik at the heart of understanding stem cell biology and its potential for therapeutic intervention.
Many fundamental epigenetic questions remain. For example, What distinguishes one chromatin strand from the other allele when both contain the same DNA sequence in the same nuclear environment? What defines the mechanisms conferring inheritance and propagation of epigenetic information? What is the molecular nature of cellular memory? Are there epigenetic imprints in the germ line that serve to keep this genome in a totipotent state? If so, how are these marks erased during development? Alternatively, or in addition, are new imprints added during development that serve to "lock in" differentiated states? We look forward to the next generation of studies (and students) bold enough to tackle these questions with the heart and passion of previous generations of genetic and epigenetic researchers.
In summary, the genetic principles described by Mendel likely govern the vast majority of our development and our outward phenotypes. However, exceptions to the rule can sometimes reveal new principles and new mechanisms leading to inheritance that have been underestimated, and in some cases, poorly understood previously. This book hopes to expose its readers to the newly appreciated basis of phenotypic variation-one that lies outside of DNA alteration. It is our hope that the systems and concepts described in this book will provide a useful foundation for future generations of students and researchers alike who become intrigued by the curiosities of epigenetic phenomena.
Сайт создан в системе
uCoz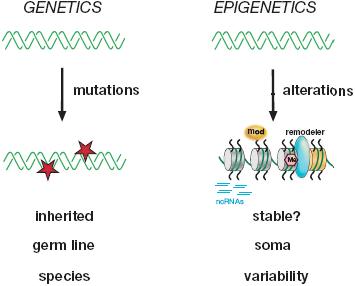
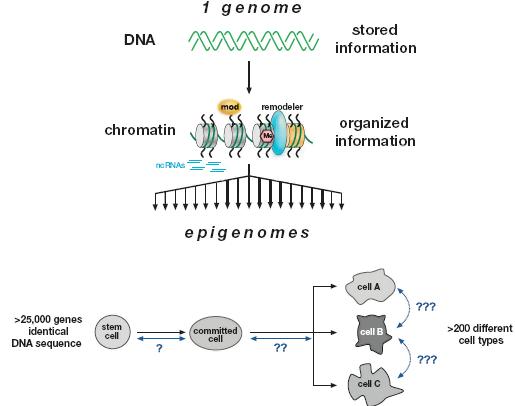
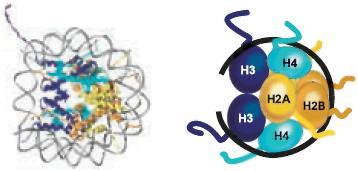

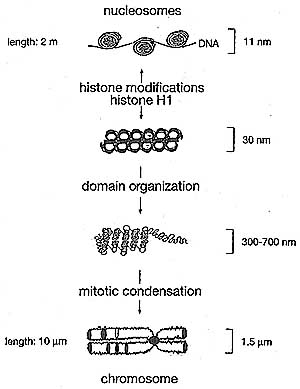 Figure 7. Higher-Order Structuring of Chromatin
The 11 -nm fiber represents DNA wrapped around nucleosomes. The 30-nm fiber is further compacted into an as-yet-unconfirmed structure (illustrated as solenoid conformation here), involving linker histone HI. The 300-700-nm fiber represents dynamic higher-order looping that occurs in both interphase and metaphase chromatin. The 1.5-jam condensed chromosome represents the most compacted form of chromatin that occurs only during nuclear division (mitosis or meiosis). It is not yet clear how mitotic chromosome-banding patterns (i.e., G- or R-banding) correlate with particular chromatin structures.
Figure 7. Higher-Order Structuring of Chromatin
The 11 -nm fiber represents DNA wrapped around nucleosomes. The 30-nm fiber is further compacted into an as-yet-unconfirmed structure (illustrated as solenoid conformation here), involving linker histone HI. The 300-700-nm fiber represents dynamic higher-order looping that occurs in both interphase and metaphase chromatin. The 1.5-jam condensed chromosome represents the most compacted form of chromatin that occurs only during nuclear division (mitosis or meiosis). It is not yet clear how mitotic chromosome-banding patterns (i.e., G- or R-banding) correlate with particular chromatin structures. 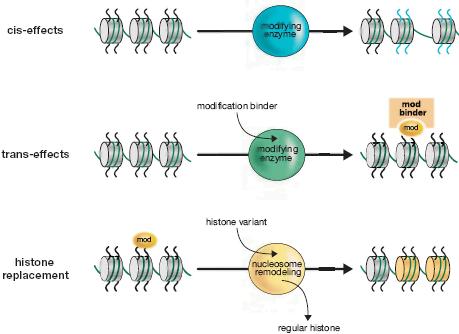
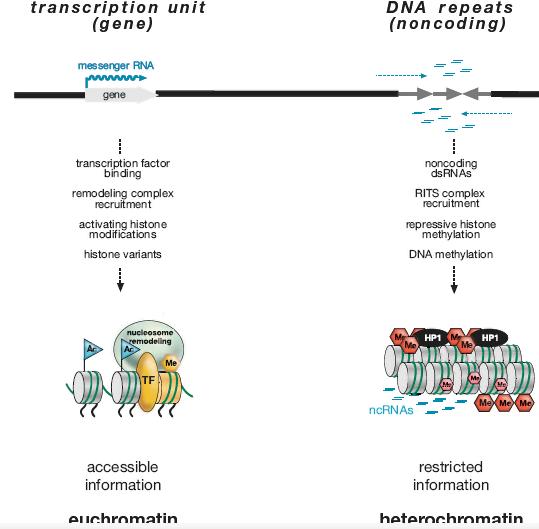
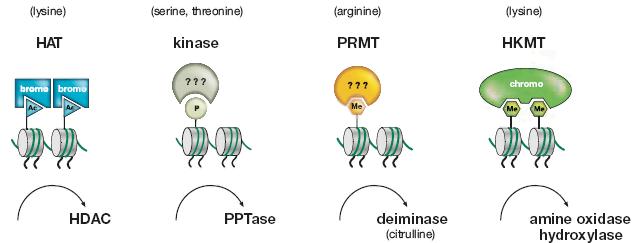
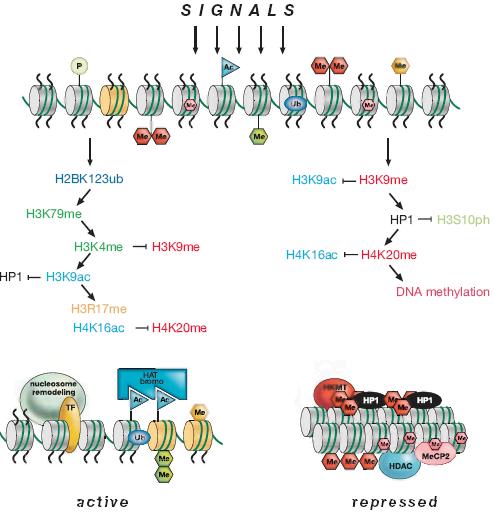
 Figure 12. Histone Variants
Protein domain structure for the core histones (H3, H4, H2A, H2B), linker histone HI, and variants of histones H3 and H2A. The histone fold domain (HFD) where histone dimerization occurs, and regions of the protein that differ in histone variants (shown in red) are indicated.
Figure 12. Histone Variants
Protein domain structure for the core histones (H3, H4, H2A, H2B), linker histone HI, and variants of histones H3 and H2A. The histone fold domain (HFD) where histone dimerization occurs, and regions of the protein that differ in histone variants (shown in red) are indicated. 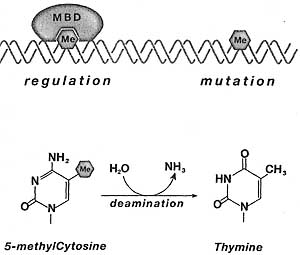 Figure 13. DNA Methylation and Deamination
Cytosine nucleotides that are methylated (Me) may be bound by
methyl DNA-binding proteins (MBD). Unbound 5-methylcytosine is prone to spontaneous mutation through deamination (reaction shown in the lower panel), resulting in a 5-methyt CpG to TpA transition in the DNA sequence.
Figure 13. DNA Methylation and Deamination
Cytosine nucleotides that are methylated (Me) may be bound by
methyl DNA-binding proteins (MBD). Unbound 5-methylcytosine is prone to spontaneous mutation through deamination (reaction shown in the lower panel), resulting in a 5-methyt CpG to TpA transition in the DNA sequence. 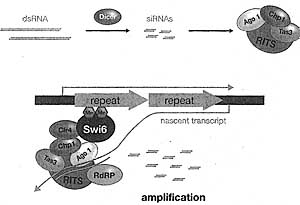 Figure 14. RNA-dfrected Heterochromatin Formation
Complementary dsRNA transcripts, produced by transcription of
both strands or the folding back of inverted repeat transcripts, result in the generation of siRNAs through the action of Dicer (top). Incorporation of the siRNAs into the RITS complex through binding with the Argonaute protein (Ago) activates the complex for targeting to complementary DNA or nascent RNA. The complex attracts Ck4, which transduces histone H3K9me2. The modification-specific binder, Swi6, binds to these modified histories, facilitating the spread of a repressive chromatin domain. The action of RdRP amplifies the levels of siRNAs by using existing siRNAs as primers, reinforcing the targeting capacity of the RTTS complex to specific regions of DNA.
Figure 14. RNA-dfrected Heterochromatin Formation
Complementary dsRNA transcripts, produced by transcription of
both strands or the folding back of inverted repeat transcripts, result in the generation of siRNAs through the action of Dicer (top). Incorporation of the siRNAs into the RITS complex through binding with the Argonaute protein (Ago) activates the complex for targeting to complementary DNA or nascent RNA. The complex attracts Ck4, which transduces histone H3K9me2. The modification-specific binder, Swi6, binds to these modified histories, facilitating the spread of a repressive chromatin domain. The action of RdRP amplifies the levels of siRNAs by using existing siRNAs as primers, reinforcing the targeting capacity of the RTTS complex to specific regions of DNA.  Figure 15. Pie Charts of Organismal Genome Organization
Genome sizes are indicated for the major model organisms used in epigenetic research at the top of each pie chart. The increase in genome size correlates with the vast expansion of noncoding (i.e., intronic, intergenic, and interspersed repeat sequences) and repeat DNA (e.g., satellite, LINE, SINE DNA) sequences in more complex multicellular organisms. This expansion is accompanied by an increase in the number of epigenetic mechanisms (particularly repressive) that regulate the genome. Expansion of the genome also correlates with an increase in size and complexity of transcription units, with the exception of plants; they have evolved mechanisms that are intolerant to insertions or duplications within the transcription unit. P = Promoter DNA element.
Figure 15. Pie Charts of Organismal Genome Organization
Genome sizes are indicated for the major model organisms used in epigenetic research at the top of each pie chart. The increase in genome size correlates with the vast expansion of noncoding (i.e., intronic, intergenic, and interspersed repeat sequences) and repeat DNA (e.g., satellite, LINE, SINE DNA) sequences in more complex multicellular organisms. This expansion is accompanied by an increase in the number of epigenetic mechanisms (particularly repressive) that regulate the genome. Expansion of the genome also correlates with an increase in size and complexity of transcription units, with the exception of plants; they have evolved mechanisms that are intolerant to insertions or duplications within the transcription unit. P = Promoter DNA element. 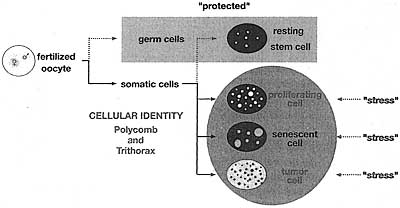 Figure 16.Cellular Identity by PcG and trxG Proteins
Two cell compartments are established during embryogenesis, distinguished by their differentiation potency: They are germ cells (totipotent) and somatic cells (including stem cells) with restricted differentiation potentials. The plasticity of a germ or stem cell's genome expression potential is reflected in reduced levels of repressive histone marks which are no longer visible at pericentromeric foci. Normal proliferating cells typically have a nuclear morphology showing 15-20 het-erochromatic foci. Polycomb- and Trithorax-containing complexes operate in specifying the epigenetic and, hence, cellular identity of different lineages. They also function in response to external "stress" stimuli, promoting cellular proliferation and appropriate gene expression. Loss of genome plasticity and proliferation potential occurs in senescent (aging) cells, reflected by abnormally large heterochromatic foci and an overall increased level of repressive histone marks. Highly proliferating tumor cells, however, exhibit changes in the balance of repressive and activating histone marks through the deregulation of PcG and trxG histone-modifying enzymes. This is accompanied by perturbed nuclear morphology.
Figure 16.Cellular Identity by PcG and trxG Proteins
Two cell compartments are established during embryogenesis, distinguished by their differentiation potency: They are germ cells (totipotent) and somatic cells (including stem cells) with restricted differentiation potentials. The plasticity of a germ or stem cell's genome expression potential is reflected in reduced levels of repressive histone marks which are no longer visible at pericentromeric foci. Normal proliferating cells typically have a nuclear morphology showing 15-20 het-erochromatic foci. Polycomb- and Trithorax-containing complexes operate in specifying the epigenetic and, hence, cellular identity of different lineages. They also function in response to external "stress" stimuli, promoting cellular proliferation and appropriate gene expression. Loss of genome plasticity and proliferation potential occurs in senescent (aging) cells, reflected by abnormally large heterochromatic foci and an overall increased level of repressive histone marks. Highly proliferating tumor cells, however, exhibit changes in the balance of repressive and activating histone marks through the deregulation of PcG and trxG histone-modifying enzymes. This is accompanied by perturbed nuclear morphology.  Figure 17. RNA Directed Induction of Repressed Chromatin States
Different forms of silent chromatin have different primary signals, but many are likely to be RNA transcript-related (from aberrant transcripts, to Xist RNA, to dsRNAs), depending on the nature of the underlying DNA sequence. This triggers the establishment of a collection of chromatin changes, including a combination of histone modifications (H3K9, H3K27, and H4K20 methylation), the binding of repressive proteins or complexes (e.g., PC or HP1) to the chromatin, DNA methylation, and the presence of histone variants (e.g., macroH2A on the inactive X chromosome). Facultative or constitutive heterochromatin shows visible clustering in the nucleus. Euchromatic repression cannot be determined by nuclear morphology patterns.
Figure 17. RNA Directed Induction of Repressed Chromatin States
Different forms of silent chromatin have different primary signals, but many are likely to be RNA transcript-related (from aberrant transcripts, to Xist RNA, to dsRNAs), depending on the nature of the underlying DNA sequence. This triggers the establishment of a collection of chromatin changes, including a combination of histone modifications (H3K9, H3K27, and H4K20 methylation), the binding of repressive proteins or complexes (e.g., PC or HP1) to the chromatin, DNA methylation, and the presence of histone variants (e.g., macroH2A on the inactive X chromosome). Facultative or constitutive heterochromatin shows visible clustering in the nucleus. Euchromatic repression cannot be determined by nuclear morphology patterns.  Figure 18. Reprogramming by Nuclear Transfer
During the lifetime of an individual, epigenetic modifications (mod) are acquired in different cell lineages (left). Nuclear transfer (NT) of a somatic cell reverses the process of terminal differentiation, eradicating the majority of epigenetic marks (mod); however, some modification that would also be present in the germ line (g-mod) cannot be removed. During neoplastic transformation (from a normal to tumor cell), caused by a series of genetic mutations (red stars), epige-netic lesions accumulate. The epigenetic lesions (mod), but not the mutations, can be erased through reprogramming upon NT This approach evaluates the interplay between genetic and epigenetic contributions to tumorigenesis. (Figure adapted from R. Jaenisch.)
Figure 18. Reprogramming by Nuclear Transfer
During the lifetime of an individual, epigenetic modifications (mod) are acquired in different cell lineages (left). Nuclear transfer (NT) of a somatic cell reverses the process of terminal differentiation, eradicating the majority of epigenetic marks (mod); however, some modification that would also be present in the germ line (g-mod) cannot be removed. During neoplastic transformation (from a normal to tumor cell), caused by a series of genetic mutations (red stars), epige-netic lesions accumulate. The epigenetic lesions (mod), but not the mutations, can be erased through reprogramming upon NT This approach evaluates the interplay between genetic and epigenetic contributions to tumorigenesis. (Figure adapted from R. Jaenisch.)  Figure 19. Epigenetic Cancer
(a) Aberrant epigenetic marks at cancer-causing ioci typically involve the derepression of oncogenes or silencing of tumor suppressor genes. Epigenetic marks known to alter a normal cell include DNA methylation, repressive histone methylation, and histone deacetylation. (d) The use of epigenetic therapeutic agents for the treatment of cancer has consequences on the chromatin template, illustrated for a tumor suppressor locus. Exposure o to Dnmt inhibitors results in a loss of DNA methylation, and exposure to HDAC inhibitors results in the acquisition of histone acetyl marks and subsequent downstream modifications, including active histone methyl marks and the incorporation of histone variants. The cumulative chromatin changes lead to gene re-expression.
Figure 19. Epigenetic Cancer
(a) Aberrant epigenetic marks at cancer-causing ioci typically involve the derepression of oncogenes or silencing of tumor suppressor genes. Epigenetic marks known to alter a normal cell include DNA methylation, repressive histone methylation, and histone deacetylation. (d) The use of epigenetic therapeutic agents for the treatment of cancer has consequences on the chromatin template, illustrated for a tumor suppressor locus. Exposure o to Dnmt inhibitors results in a loss of DNA methylation, and exposure to HDAC inhibitors results in the acquisition of histone acetyl marks and subsequent downstream modifications, including active histone methyl marks and the incorporation of histone variants. The cumulative chromatin changes lead to gene re-expression. 
 Figure 21. Big Questions in Epigenetic Research
The many experimental systems used in epigenetic research have unveiled numerous pathways and novel insights into the mechanisms of epigenetic control. Many questions, as shown in the figure, still remain and require further elucidation or substantiation in new and existing model systems and methods.
Figure 21. Big Questions in Epigenetic Research
The many experimental systems used in epigenetic research have unveiled numerous pathways and novel insights into the mechanisms of epigenetic control. Many questions, as shown in the figure, still remain and require further elucidation or substantiation in new and existing model systems and methods.