Присутствие геномного импринтинга у млекопитающих имеет важное медицинское, социальное и интеллектуальное значение в терминах (1) клинического использования генетических признаков и болезней (2) способности контролировать выращивания людей и животных с помощью соотв. репродуктивных технологий (3) прогресса биотехнологии и пост-геномных медицинских исследований. Любая современная дискуссия генетических проблем в области исследований или медицины обязательно д. учитывать обнаруживает ли ген двуродительский (т.е. диплоидный) способ экспрессии или является объектом геномного импринтинга и обнаруживает специфичную для родителей (т.e., гаплоидную) экспрессию. Несмотря на важность геномного импринтинга для здоровья людей и самочувствия неожиданно широкое принятие его существования и значения произошло только в начале 1990s, после того как было показано, что три гена недвусмысленно обнаруживают специфичную для родителей экспрессию у мышей.
Родитель-специфичное поведение целых хромосом уже наблюдалось при цитогенетических исследованиях хромосом у артропод с 1930s (Chandra and Nanjundiah 1990). Интересно, что термин "chromosome imprinting" был впервые предложен для описания диминуции специфичных отцовских хромосом, что играет роль в детерминации пола у некоторых видов артропод (Grouse et aL 1971). Хромосомный импринтинг Х хромосомы млекопитающих также был замечен, он приводил к специфичной для отцов инактивации одной из двух Х хромосом во всех клетках самок сумчатых и во внеэмбриональных тканях мышей (Cooper et aL 1971). Во время того же самого периода классические генетики создали мутантных мышей, несущих хромосомные транслокации, которые заложили основы для наблюдения экспрессии импринтируемых генов. Некоторые из таких "транслокационных" мышей первоначально использовались для картирования позиций генов на хромосомах, демонстрировали специфичный для родителей фенотип, когда определенные регионы хромосом наследовались как дупликации одной родительской хромосомы с отсутствием др. родительской хромосомы (известны как uniparental disomy или UPD Рис. 1). Эти результаты показали возможность, "что гаплоидная экспрессия определенных материнских или отцовских генов важна для нормального развития мышей" (Searle and Beechey 1978). В то же самое время др. генетики, используя необычных мутантных мышей, известных как "Hairpin-tail" мыши, которые несли крупную делецию хромосомы 17, недвусмысленно объявили незаконным основной принцип генетики "что организмы, гетерозиготные по данному локусу фенотипически идентичны независимо от того, какие гаметы и какие аллели вносят вклад в генотип" (Johnson 1974). Вместо этого потомство, которое получает делецию Hairpin-tail от матери бяло увеличенным в размере
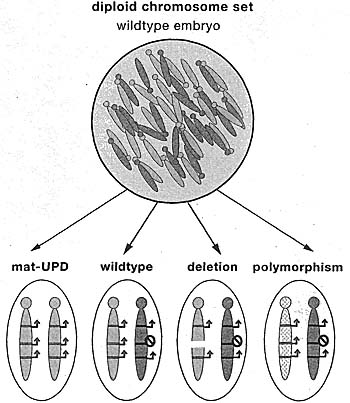 Figure 1. Mouse Models to Study Genomic Imprinting That Allow the Maternal and Paternal Chromosome to Be Distinguished
Mammals are diploid and inherit a compete chromosome set from the maternal and paternal parents. However, mice can be generated that 0) inherit two copies of a chromosome pair from one parent and no copy from the other parent (known as uniparental disomy or UPD); (2) Inherit a partial chromosomal deletion from one parent and a wild-type chromosome from the other parent; (3) inherit chromosomes carrying stogte-nudeotide polymorphisms (known as SNPs) from one parent and a wild-type chromosome from the other parent Offspring with UPDs or deletions are likely to display lethal phenotypes, whereas SNPs will allow the production of viable offspring, (mat) Maternal, (stop sign) the imprint
Figure 1. Mouse Models to Study Genomic Imprinting That Allow the Maternal and Paternal Chromosome to Be Distinguished
Mammals are diploid and inherit a compete chromosome set from the maternal and paternal parents. However, mice can be generated that 0) inherit two copies of a chromosome pair from one parent and no copy from the other parent (known as uniparental disomy or UPD); (2) Inherit a partial chromosomal deletion from one parent and a wild-type chromosome from the other parent; (3) inherit chromosomes carrying stogte-nudeotide polymorphisms (known as SNPs) from one parent and a wild-type chromosome from the other parent Offspring with UPDs or deletions are likely to display lethal phenotypes, whereas SNPs will allow the production of viable offspring, (mat) Maternal, (stop sign) the imprint
и погибало в середине эмбрионального развития, тогда как передача от отцов генетически идентичной хромосомы продуцирует жизнеспособных и плодовитых мышей (Fig. 1). Достойно внимания, оглядываясь назад, что несмотря на существование инактивации импринтируемой Х хромосомы у млекопитающих предпочтительной интерпретацией этих экспериментов с генетическими транслокациями и делециями была та, что гены на этих аутосомах преимущественно действуют в гаплоидном яйце или спермии, чтобы модифицировать белки, используемые позднее в эмбриональном развитии. Несмотря на это концепция дифференциального функционирования материнского и отцовского генома пробила себе дорогу и было сделано предположение, что "материнский геном может быть обычно активным по хромосомной области Hairpin-tail, тогда как её отцовский аналог преимущественно инактивирован" (McLaren 1979). Важной ступенью в направлении установления существования геномного импринтинга у млекопитающих стало спустя несколько лет разработка улучшенной технологии переноса ядер, используемой для тестирования возможности возникновения диплоидных однородительских эмбрионов только из ядра яйцеклетки мыши. Техника ядерного переноса брала донорские самцовые или самковые пронуклеусы из только что оплодотвренных яиц и использовала тончайшие микропипетки, чтобы поместить внутрь оплодотворенной яйцеклетки, из которой удалялся материнский или отцовский пронуклеус. Возникали диплоидные эмбрионы с одним отличием, они имели два материнских или два отцовских генома (gynogenetic и androgenetic эмбрионы) (Fig. 2). Технология впервые была использована, чтобы показать, что ядра от оплодотворенных Hairpin-tail мутантных эмбрионов не могут восстанавливаться, если переносятся в хозяйскую яйцеклетку дикого типа. Это предоставило доказательство, что эмбриональный геном, а не цитоплазма ооцита, переносит Hairpin-tail дефект. Было также подтверждено предположение, что гены на материнской и отцовской копии хромосомы 17 функционируют по-разному во время эмбрионального развития (McGrath and Solter 1984b).
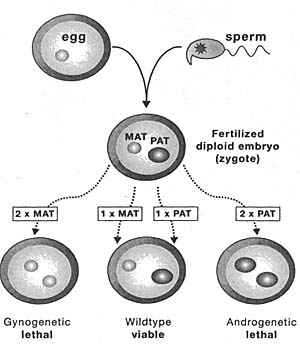 Figure 2. A Maternal Genome and a Paternal Genome are Needed for Mammalian Reproduction.
The nuclear transfer technique used micropipettes and high-powered microscopes to remove the male or female nuclei from a newly fertilized egg and place them in various combinations into a second host* fertilized egg that had already been enucleated, thereby gen-rating anew, diploid embryos with two maternal (Gynogenetic) or tw paternal (Androgenetic) genomes or a btparental genome MM type). Gynogenetic and androgenetic embryos were lethal at any embryonic stages. Only reconstituted embryos that received oth a maternal and paternal nucleus (WWdtype) survived to pro-uce living young. These experiments show the necessity for both le maternal and paternal genome in mammalian reproduction and indicate that the two parental genomes express different sets of genes needed for complete embryonic development
Figure 2. A Maternal Genome and a Paternal Genome are Needed for Mammalian Reproduction.
The nuclear transfer technique used micropipettes and high-powered microscopes to remove the male or female nuclei from a newly fertilized egg and place them in various combinations into a second host* fertilized egg that had already been enucleated, thereby gen-rating anew, diploid embryos with two maternal (Gynogenetic) or tw paternal (Androgenetic) genomes or a btparental genome MM type). Gynogenetic and androgenetic embryos were lethal at any embryonic stages. Only reconstituted embryos that received oth a maternal and paternal nucleus (WWdtype) survived to pro-uce living young. These experiments show the necessity for both le maternal and paternal genome in mammalian reproduction and indicate that the two parental genomes express different sets of genes needed for complete embryonic development
Затем перенос ядер использовали для демонстрации, что эмбрионы, реконструированные из двух материнских пронуклеусов (гиногенетические эмбрионы) или из двух отцовских пронуклеусов (андрогенетические эмбрионы) не способны выживать; только эмбрионы, реконструированные из одного материнского и одного отцовского пронуклеусов дают жизнеспособное и плодовитое потомство (McGrath and Solter 1984a; Surani et al. 1984). Эта работа опрокинула предыдущие утверждения, что однородительские мыши могут развиваться во взрослых особей (Hoppe and Illmensee 1982). Гиногенетические эмбрионы к моменту гибели были дефектными по внеэмбриональным тканям, которые вносят вклад в плаценту, а андрогенетические эмбрионы были дефектны по эмбриональной ткани. Это привело к гипотезе, что эмбриональное развитие нуждается в импринтируемых генах, экспрессируемых с материнского генома, тогда как отцовским геномом экспрессируемые импринтируемые гены необходимы для внеэмбрионального развития (Barton et al. 1984). Последующая идентификация импринтируемых генов у мышей не подтвердила предпочтений в функционировании импринтируемых генов, показав, что наблюдаемые различия между гиногенетическими и андрогенетическими эмбрионами могут быть объяснены доминантным эффектом одного или нескольких импринтируемых генов.
Эксперименты с переносом ядер в комбинации с подтверждающими данными из мышиной генетики, предоставили убедительные доказательства, что оба родительских генома необходиы для эмбриогенеза мышей и привели к строгому обоснованию существования геномного импринтинга у млекопитающих (Fig. 2). Обширные исследования вклада родительских хромосом в эмбриональное развитие с использованием "translocation" мышей для создания UPD хромосом (Fig. 1), идентифицировали два региона на мышиных хромосомах 2 и 11, которые обнаруживали оппозитные фенотипы, если присутствовали две материнские или две отцовские копии. Это ещё больше подкрепило аргумент в пользу родитель-специфичной генной экспрессии у млекопитающих (Cattanach and Kirk 1985). Кроме того, были собраны данные клинической генетики, которые строго показывали, что некоторые генетические заболевания, наиболее заметен синдром Prader-Willi, который возникает исключительно в результате отцовской передачи, могут быть лучше всего объяснены родитель-специфичной экспрессией генов (Reik 1989). Дальнейший ключ к разгадке пришёл в результате использования вновь разработанной технологии получения трансгенных мышей путем микроинъецирования генных последовательностей в оплодотворенное яйцо мыши. Это часто осложнялось проблемой метилирования ДНК, неожиданно индуцирующей молчание трансгенов в соматических тканях. Эта "проблема", однако, добавила веса аргументу, что родительские хромосомы ведут себя по-разному, когда было продемонстрировано. что некоторые трансгены обнаруживают специфичные для родителей отличия в своей способности приобретать метилирование ДНК. Это обычно распространенный паттерн, что матерью передаваемые трансгены метилируются, тогда как отцом передаваемые трансгены нет. Однако, лишь в немногих случаях возникающие различия в метилировании ДНК коррелируют с родитель-специфической экспрессией. Хотя множество сходств поздней было найдено между импринтингом метилированных "трансгенов" и геномным импрингингом эндогенных генов мышей, несколько признаков отличает их (Reik et al. 1990). Сюда входит высокая чувствительность к фоновым эффектам, которая в большинстве случаев нуждается в смешанном генетическом фоне, чтобы выявить импринтируемое поведение, неспособность поддерживать импринтированную экспрессию различных хромосомных сайтов интеграции и потребность в чужеродных последовательностях ДНК для продукции импринтированных эффектов (Chaillet et al. 1995).
Несмотря на изобилие подтверждающих данных окончательное доказательство существования геномного импринтинга у млекопитающих зависит от идентификации генов, обнаруживающих импринтированную родитель-специфическую экспрессию. Это произошло в 1991, когда были описаны три импринтированных гена мыши. Первым из них стал, Igf2r (Insulin-like growth factor type 2 рецептор, который является "scavenger" рецептором для гормона роста Igf2), он был идентифицирован как матерински экспрессируемый импринтируемый ген. Этот ген позднее позволил объяснить фенотип избыточного роста Hairpin-tail мутантных мышей (Barlow et al. 1991). Спустя несколько мес. Igf2 ген (Insulin-like growth factor type 2), который был известен функцией в качестве гормона роста, был идентифицирован как отцовски экспрессируемый импринтируемый ген (DeChiara et al. 1991; Fer-
;uson-Smith et al. 1991). Наконец, ген H19 (cDNA сlone No. 19 , выделенный из библиотеки печени плода), необычайная noncoding RNA (ncRNA), в последствии было показано, что это матерински экспрессирвуемый импринтируемый ген (Bartolomei et al. 1991). Разные стратегии были использованы для идентификации этих генов, каждая из которых зависела от возникающих технологий в мышиной генетике. Для Igf2r было использовано позиционное клонирование, чтобы идентифицировать гены, которые картируются Hairpin-tail делецией на хромосоме 17, и мыши, наследующие делецию от одного из родителей использовались для идентификации этих генов, обнаруживающих специфическую материнскую экспрессию (Fig. 1). Для Igf2 физиологическая роль этого ростового фактора в эмбриональном развитии тестировалась с помощью инсерционного мутагенезе. Неожиданно мыши, несущие мутантный нефункциональный аллель, обнаруживали фенотип, соответствующий отцовской передаче, но не фенотип, характерный для материнской передачи. В свете предыдущих находок, что чужеродные последовательности ДНК могут индуцировать импринтированную экспрессию мышиных генов, специфичная отцовская экспрессия Igf2 с дикого типа немодифицированных хромосом, подтверждается также использованием мышей, несущих реципрокные родительские дупликации и нехватки по хромосоме 7 (Fig. 1). Была идентифицирована HI9 ncRNA в качестве импринтируемого гена путем проверки гипотезы, что импринтированные гены д. быть собраны в кластер, после чего ген был картирован вблизи локуса Igf2 на хромосоме 7. Хотя все эти стратегии подтвердили свою пригодность в последующих попытках идентифицировать импринтированные гены, демонстрация, что импринтируемые гены собраны в тесные кластеры, подтвердила важность этого открытия для понимания механизмов, контролирующих геномный импринтинг.
2 Genomic Imprinting-An Epigenetic Gene Regulatory System
Определяющей характеристикой геномного импринтинга является его цис-действие. Т.о., механизм импринтинга действует только на одной хромосоме. Это контрастирует с транс-действующими регуляторными механизмами, которые свободны действовать на любой из хромосом в ядре. Две родительские хромосомы обычно содержат множество различий по одиночным парам оснований (известно как single-nucleotide polymorphisms, SNPs), если популяция аутбредная, но они могут быть генетически идентичными, если используются инбредные линии мышей. Т.к. геномный импринтинг обнаруживается у инбредных мышей, которые имеют генетически идентичные родительские хромосомы, то этот процесс д.
|
KEY FEATURES OF GENOMIC IMPRINTING IN MAMMALS
cis-Acting mechanism
A consequence of inheritance, not sex
Imprints are epigenetic modifications acquired by one parental gemete
Imprinted genes are mostly clustered together with a noncoding RNA
Imprints can modify long-range regulatory elements that act on multiple genes
Imprinted genes play a role in mammalian development
|
использовать эпигенетический механизм для модификации информации, переносимой последовательностями ДНК, и создавать различия в экспрессии между двумя родительскими копиями генов. Эти наблюдения показывают также, что цис-действующий механизм молчания оперирует в пределах одной хромосомы, так что факторы молчания не могут свободно диффундировать по ядру, чтобы достигать активной копии гена. Хотя импринтируемые гены репрессированы на одной из родительских хромосом и активны на др., мы не знаем
a priori, что геномный импринтинг базируется только на механизме молчания. Необходимо учитывать, что это может быть наоборот активирующий механизм, направленный на ген, который молчащий изначально в геноме млекопитающих.
Стартовая точка геномного импринтинга д. прежде всего зависеть от эпигенетической системы, которая модифицирует или "imprints" одну из двух родительских хромосом (Fig. 3). Можно аргументировать тем, что данный импринт используется затем для привлечения или отталкивания транскрипционных факторов и также меняет экспрессию импринтированного гена на одной из родительских хромосом. Т.к. мы знаем, что инбредные мыши с генетически идентичными хромосомами также обнаруживают геномный импринтинг, то мы можем полагать, что родительские импринты не могут возникать после того, как эмбрион становится диплоидным, т.к. не существует способа для клеточного эпигенетического аппарата делать различия между идентичными родительскими копиями генов, т.о., родительские импринты д. приобретаться, когда два набора родительских хромосом разделение и это происходит только во время формирования гамет и приблизительно в течение 12 ч после оплодотворения (Fig. 3). Наиболее вероятный сценарий, что гаметные импринты помещаются на отцовски импринтируемые гены во время продукции спермиев, а метерински импринтируемые гены во время формирования яиц. Ключевым признаком "imprinted" последовательностей ДНК является то, что они д. быть модифицированы на одной из двух родительских гамет; т.к. необходимы двух типов системы распознавания, одна спермий-специфическая и др. ооцит-специфическая, каждая направленная на разные последовательности ДНК. Несколько и др. признаков приобретают импринты. Во-первых, возникнув он остается на той же самой родительской хромосоме после оплодотворения, когда эмбрион становится диплоидным. Во-вторых, импринт д. наследоваться с той же самой родительской хромосомой в ходе каждого клеточного деления эмбриона и взрослого животного. Наконец, он может стираться. Последнее необходимо, т.к. эмбрион д. следовать или по пути развития самца или самки и его гонады д. продуцировать только один тип импринтированных гаплоидных родительских гамет. Т.к. зародышевые клетки возникают из эмбриональных диплоидных клеток (Fig. 3),они д. прежде всего терять свои унаследованные материнские и отцовские импринты прежде, чем они будут продуцировать соотв. гаметы.
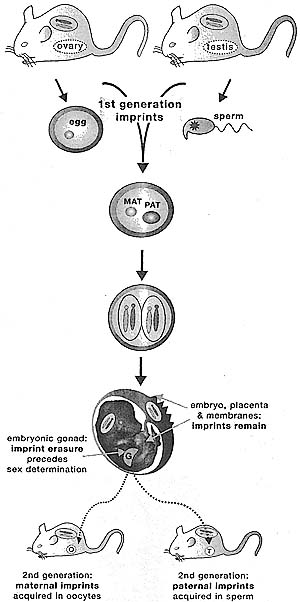 Figure 3. Imprint Acquisition and Erasure in Mammalian Development
Imprints are acquired by the gametes; thus, oocytes and sperm already carry imprinted chromosomes (1st generation Imprints). After fertilization when the embryo is diploid, the imprint is maintained on the same parental chromosome after each cell division in cells of the embryo, membranes, placenta, and also in the adult The germ cells are formed in the embryonic gonad, and the imprints are erased only in these cells prior to sex determination. As the embryo develops into a male, the gonads differentiate to testes that produce haploid sperm which acquire a paternal imprint on their chromosomes. Similarly in developing females, chromosomes in the ovaries acquire maternal imprints (2nd generation imprints).
Figure 3. Imprint Acquisition and Erasure in Mammalian Development
Imprints are acquired by the gametes; thus, oocytes and sperm already carry imprinted chromosomes (1st generation Imprints). After fertilization when the embryo is diploid, the imprint is maintained on the same parental chromosome after each cell division in cells of the embryo, membranes, placenta, and also in the adult The germ cells are formed in the embryonic gonad, and the imprints are erased only in these cells prior to sex determination. As the embryo develops into a male, the gonads differentiate to testes that produce haploid sperm which acquire a paternal imprint on their chromosomes. Similarly in developing females, chromosomes in the ovaries acquire maternal imprints (2nd generation imprints). Как гаметные импринты идентифицируются? Импринт может быть определен как эпигенетическая модификация, которая делает отличной материнскую копию гена от отцовской копии. Импринт, возникнув, д. также позволять транскрипционному аппарату, по-разному воздействовать на материнскую и отцовскую копию гена внутри одного и того же ядра. Гаметический импринт, как ожидается, д. постоянно присутствовать на всех стадиях развития (Fig. 3); поэтому импринты могут обнаруживаться при сравнении эпигенетических модификаций на материнской и отцовской хромосомах эмбриональных или взрослых тканей (используя стратегии, представленные на Fig. 1) и отслеживаться в обратном порядке развития одной из двух гамет. Гаметические импринты д. быть модификациями ДНК или гистоновых белков, которые упаковывают ДНК в хромосомы. Хотя имеется только один тип эпигенетических модификаций ДНК у млекопитающих, который является метилированием ДНК (see Chapter 18), гистоны могут приобретать множественные типы модификаций, включая метилирование, ацетилирование, фосфорилирование, сумоилирование и убиквитилирование (see Chapter 10 for more detail). Они могут также замещаться вариантами гистонов со специфическими функциями (see Chapters 3 and 13). Любая из этих эпигенетических модификаций д. теоретически квалифицироваться как импринт. Мы полагаем, что энзимы, ответственные за эти эпигенетические модификации д. экспрессироваться исключительно в одной из двух гамет и специфически ассоциировать с одной родительской хромосомой, чтобы копировать модификацию, когда клетка делится. Однако, как описывается в Section 3, только метилирование ДНК четко демонстрирует функцию в качестве гаметного импринта для импринтируемых генов у млекопитающих, кстати, это единственная известная наследуемая модификация.
Как гаметный импринт оперирует, контролируя импринтированную экспрессию? Необходимо "держать в уме", ведет ли импринт к активации или репрессии одной из родительских копий импринтируемого гена. Чтобы понять, как оперирует импринт, необходимы три куска информации: какая родительская хромосома несет импринт, какая родительская хромосома несет экспрессируемый аллель импринтируемого гена и позицию импринтированной последовательности относительно экспрессируемого или молчащего аллеля импринтируемого гена. Используя подобного типа подход, сегодня известно, что гаметические импринты могут действовать на целые кластеры генов сразу. Эти импринтируемые кластеры содержат от 3 до 10 генов и занимают от 100 kb до 3000 kb геномной ДНК (см. http://www.mgu.har.mrc.ac.uk/research/imprinting/). Большинство генов в каждом из кластеров являются импринтированными генами белок-кодирующих РНК; однако, по крайней мере, один всегда является импринтированной ncRNA (noncoding RNA).
Т.к. расположение импринтируемых генов в кластере с некоторыми генами экспрессируемыми с одной родительской хромосомы и с некоторыми с другой; то не всегда просто определить, как оперирует импринт. Возможно изучение эффекта одиночных импринтированных генов в кластере, но могут оказаться более информативными исследования эффектов импринтов всего кластера. Ясно одно, что природа выбрала не простейшую из моделей, каким образом импринт управляет промотором, чтобы избирательно делать молчащим импринтированный ген одной из гамет. Вместо этого, импринты, по-видимому, в целом направлены на дально-дейстующие цис-действующе репрессоры, которые влияют на экспрессию множественных генов, расположены на значительном расстоянии на одной и той же хромосоме.
3 Key Discoveries in Genomic Imprinting
3.1 Imprinted Genes Control Embryonic and Neonatal Growth
Какова функция геномного импринтинга у млекопитающих? Чтобы ответить на этот вопрос необходимо установить функцию известных импринтируемых генов
in vivo. Сегодня современные технологии делают возможным определение функции мышиных генов путем мутирования генных последовательностей, чтобы обнаружить эту функцию. Используя технику "гомологичной рекомбинации" установлена функция 26 из 78 известных импринтируемых генов (ref., see http://www.mgu.har.mrc.ac.uk/research/imprinting/function.html). Table 1 представляет список этих генов в соответствии с их функцией в развитии мышей и их экспрессией в материнского или отцовского аллеля. Самая крупная категория, кстати, представляет собой импринтированные гены, которые затрагивают рост эмбрионов или плаценты или новорожденные полностью зависят от молока своих матерей. В этой категории приблизительно половина отцовски экспрессируемых импринтируемых генов, которые функционируют как ростовые промоторы (что демонстрируется по задержке роста у эмбрионов, дефицитных по гену). Др. половина матерински экспрессируемые импринтированные гены, которые функционируют как репрессоры роста (что демонстрируется усилением роста у эмбрионов по этим генам). Следующая по величине категория включает гены с отсутствием очевидных дефектов на эмбриональное развитие, за ней следуют категории с поведенческими и нейрологическими дефектами. Оставши еся 3 тестированных гена имеют разные, по-видимому, несвязанные дефекты. Эти результаты с одной стороны неутешительны, т.к. они не идентифицировали одну функцию для всех импринтируемых генов. Однако, они могут быть светом в конце туннеля, т.к. эти результаты говорят нам, что более 50% импринтируемых генов действуют как регуляторы эмбрионального и неонатального роста. Более интересна способность регулировать рост, связанная с матерински экспрессируемыми регулирующими рост генами, репрессирующими рост потомства, в то время как отцовски экспрессируемые
Table 1. The function of imprinted genes as determined by gene Inactivation
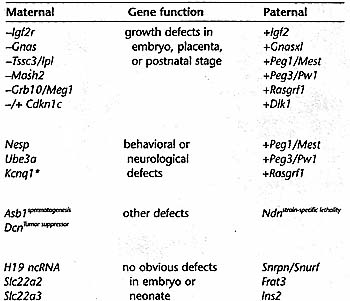 (Maternal) Maternally expressed Imprinted gene. (Paternal) paternally expressed imprinted genes, (+) growth suppressing effect, (-/+) defect in daferentiation but growth regulatory status unclear, (o) additional dirfertntietfon defect (Reference http//www.mgu.har.mrc.ac.uk/research/imprinting/function.html)
(Maternal) Maternally expressed Imprinted gene. (Paternal) paternally expressed imprinted genes, (+) growth suppressing effect, (-/+) defect in daferentiation but growth regulatory status unclear, (o) additional dirfertntietfon defect (Reference http//www.mgu.har.mrc.ac.uk/research/imprinting/function.html)
гены в этой категории действуют, усиливая рост. 20% протестированных импринтированных генов активны в нейрологических процессах, некоторые из которых затрагивают скорость роста новорожденных, путем изменения материнского поведения. Наиболее неожиданной категорией, в смысле попытки идентифицировать избирательные силы, управляющие приобретением экспрессии импринтируемых генов у всех сохранившихся на сегодня млекопитающих, стала та, в которой импринтированные гены не обнаруживают биологической функции в эмбриональном развитии, их 25% от протестированных импринтируемых генов.
3.2 The Function of Genomic Imprinting In Mammals
Может ли анализ функции генов помочь понять, почему гены импринтируются у млекопитающих? Взгляд на геномный импринтинг у разных типов млекопитающих проливает некоторый свет. Плацентарные млекопитающие, такие как мыши и человек и сумчатые, такие как опоссум и кенгуру, обнаруживают геномный импринтинг. Яйцекладущие млекопитающие, такие как утконос и ехидна, по-видимому, лишены импринтируемых генов, хотя не проводилось ещё обширных исследований. Плацентарные млекопитающие и сумчатые отличаются репродуктивной стратегией, которая позволяет эмбрионам непосредственно влиять на количество материнских рессурсов, используемых для их собственного роста. Напротив, эмбрионы, которые развиваются из яиц неспособны непосредственно влиять на материнские ресурсы. Большинство беспозвоночных и позвоночных используют яйцекладущую репродуктивную стратегию. Отметим также, что они могут также подвергаться партеногенезу, создавая воспроизведение, при котором женские гаметы развиваются в новые диплоидные индивиды без оплодотворения гаметами самцов (отметим, что партеногенетические эмбрионы возникают за счет удвоения того же самого материнского генома, тогда как гиногенетические эмбрионы, представленные на Fig. 3 возникают из двух разных материнских геномов). Способность организмов подвергаться партеногенезу скорее всего указывает на полное отсутствие геномного импринтинга, т.к. было показано, что отцовский геном безразличен. У млекопитающих, однако, прямым следствием экспрессии импринтируемых генов является контроль роста плодов, так что партеногенез невозможен. И материнский и отцовский геномы необходимы для продукции жизнеспособного потомства, что делает млекопитающих полностью зависимыми от полового воспроизведения, чтобы создавать жизнеспособное потомство (Fig. 4). Партеногенез не наблюдается у млекопитающих несмотря на утверждения обратного, хотя некоторые редкие мыши с диплоидным материнским геномом были недавно созданы путем манипуляции с экспрессией Igf2 импринтированного кластера (Kono et al 2004).
Почему геномный импринтинг используется только некоторые млекопитающими, не не позвоночными в целом? Три признака геномного импринтинга - функция регуляции роста
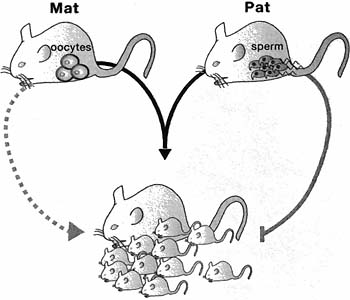 Figure 4. Imprinted Genes Play a Role In Mammalian Reproduction
Mammals are diploid and reproduction requires fertilization of a haploid female egg by a haploid male sperm to recreate a diploid embryo. Only females are anatomically equipped for reproduction, but they cannot use parthenogenesis to reproduce because essential imprinted genes needed for fetal growth are imprinted and silenced on maternal chromosomes. These genes are expressed only from paternal chromosomes; thus, both parental genomes are needed for reproduction in mammals; Parthenogenesis is the production of diploid offspring from two copies of the same maternal genome.
Figure 4. Imprinted Genes Play a Role In Mammalian Reproduction
Mammals are diploid and reproduction requires fertilization of a haploid female egg by a haploid male sperm to recreate a diploid embryo. Only females are anatomically equipped for reproduction, but they cannot use parthenogenesis to reproduce because essential imprinted genes needed for fetal growth are imprinted and silenced on maternal chromosomes. These genes are expressed only from paternal chromosomes; thus, both parental genomes are needed for reproduction in mammals; Parthenogenesis is the production of diploid offspring from two copies of the same maternal genome.
у многих импринтированных генов, ограничение импринтируемых генов плацентарными и сумчатыми млекопитающими, и, наконец, необходимость отцовского генома для плодного развития - предоставляют доказательства, согласующиеся с двумя одинаково привлекательными гипотезами.
Первая гипотеза предполагает, что геномный импринтинг участвует в ответе на ситуацию "родительского конфликта" (Moore and Haig 1991). Это возникает из-за противоположных интересов материнского и отцовского геномов: эмбриональный рост зависит от одного родителя, но испытывает влияние со стороны эмбриона, чей геном происходит от двух родителей. Отцовски экспрессируемые импринтируемые гены, как предполагается, усиливают эмбриональный рост, за счет чего максимализируется конкурентоспособность индивидуального потомка, несущего определенный отцовский геном. Матерински экспрессируемые импринтируемые гены, как полагают, супрессируют плодный рост. Это д. приводить к более равномерному распределению материнских ресурсов для всего потомства и увеличить передачу материнского генома многим потомкам, которые могут иметь разные отцовские геномы.
Вторая гипотеза, названа "trophoblast defense" (Varmuza and Mann 1994). Она предполагает, что материнский геном подвержен риску, будучи анатомически оснащенным для внутренней репродукции, и спонтанная активации ооцита д. приводить к полноценному эмбриональному развитию. Т.к. самцы лишены необходимой анатомической экипировки для внутренней репродукции, то они не обладают таким же риском спонтанной активации сперматозоидов. Импринтинг т.о. предлагает или молчание генов на материнской хромосоме, которые способствуют развитию плаценты, или активируют гены, которые ограничивают этот процесс. Гены, необходимые для образования плаценты д. следовательно, экспрессироваться только с отцовского генома после оплодотворения.
Какая из этих гипотез верно объясняет эволюцию геномного импринтинга? Обе гипотезы демонстрируют роль импринтируемых генов в регуляции развития и функции плаценты; однако, ни модель родительского конфликта, ни модель защиты трофобласта не могут полностью объяснить все данные(Wilkins and Haig 2003). Интерсно отметить, что импринтируемые гены были также идентифицированы в эндосперме растений, ткани. которая сравнима с плацентой для эмбрионов млекопитающих, т.к. он переносит питательные ресурсы от родительского растения эмбриону (см. Chapter 11). Эта находка строго подтверждает аргументы, что геномный импринтинг используется как средство для регуляции переноса питательных веществ между родителем и потомством, но это ничего не говорит нам почему. Более полное или альтернативное объяснение функции геномного импринтинга у млекопитающих возможно из двух источников. Во-первых, необходимо исследовать функцию "imprinting" вдоль всего кластера генов
per se, в противовес исследованию фенотипа мышей с отсутствием одного продукта импринтированного гена. Для этого необходимо приобрести способность к реверсии импринта и генерации двуродительской экспрессии генов вдоль всего импринтированного кластера. Во-вторых, необходимо понять в точности, как гены импринтируются. Возможно, что не все гены кластера являются предумышленными мишенями механизма импринтинга и что некоторые могут быть лишь "невинными свидетелями" процесса, так что их функция не будет информативной относительно роли геномного импринтинга. Существование генов невинных свидетелей, затрагиваемых механизмом импринтинга, может удовлетворительно объяснить курьёзное обилие импринтированных генов без очевидной биологической функции в развитии (Table 1).
3.3. Imprinted Genes Are Clustered and Controlled by Imprint Control Elements
Кстати, примерно 80 импринтированных генов было картировано в 10 хромосомах мыши, большинство из которых обнаруживается в кластерах (Verona et al. 2003). 11 кластеров импринтированных генов распределены по 8 хромосомам (№ 2, 6, 7, 9, 11, 12, 15 и 17), в то время как единичные импринтированные гены были идентифицированы только в трех хромосомах (№ 2, 14 и 18). Существование кластеров импринтированных генов является строгим указанием, что общий ДНК элемент может регулировать импринтированную экспрессию множественных генов в cis-положении. Кстати, только 6 из импринтируемых кластеров хорошо охарактеризованы и они представлены в Table 2 по имени принципиального импринтированного мРНК гена (напр., Igf2r, Igf2, Kcnql, GnaS, Dlk1 кластеры импринтированных генов) или по ассоциированной болезни (the Pws cluster, Prader-Willi syndrome, см. Chapter 23). Эти 6 кластеров содержат от 3-х до 10 импринтированных генов и занимают свыше 100-3000 kb ДНК.
Figure 5 показывает родитель-специфический паттерн экспрессии в типичном кластере импринтированных генов. Общим признаком этих 6 кластеров является присутствие последовательности ДНК, несущей импринт гаметического метилирования, который известен как гаметический DMR (Differentially DNA-Methylated Region). Импринт гаметического метилирования определяется как импринт метилирования, установленный в одной гамете и поддерживаемый только на одной родительской хромосоме в диплоидных клетках эмбриона. В 4-х кластерах (Igf2r, Kcnq1, Gnas и Pws) гаметический DMR имеет материнское метилирование
Table 2. Features of imprinted gene clusters in the mouse genome
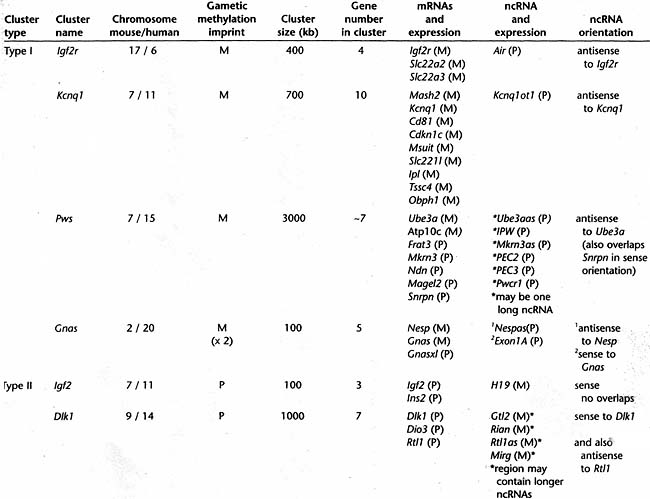 (M) Maternal, (P) paternal, (DMR) differentially methylated region. Details are given in the text. (Modified from Beechey et al. 2005)
(M) Maternal, (P) paternal, (DMR) differentially methylated region. Details are given in the text. (Modified from Beechey et al. 2005)
импринта, приобретенное в оогенезе, тогда как два кластера acquired in oogenesis, whereas in two clusters
Igf2 и Dlk1) имеют отцовское метилирование импринта, приобретенное во время сперматогенеза. Во всех 6 примерах гаметический DMR, как было установлено, контролирует импринтированную репрессию всего или части кластера и поэтому обозначается как imprint control element (ICE) для кластера (Spahn and Barlow 2003).
Table 2 показывает, что каждый кластер импринтированных генов содержит множественные мРНК и, по крайней мере, одну ncRNA. 4 кластера (Igf2r, Kcnql, Igf2 и Dlk1) обнаруживают простой паттерн, в котором хромосома, несущая метилированный гаметический DMR, экспрессирует множественные мРНК, но не экспрессирует ncRNA (как показано на Fig. 5 материнского гаметического DMR). Хромосома, несущая не метилированный гаметический DMR, обнаруживает реципрокный паттерн экспрессии: репрессию множественных мРНК и экспрессию ncRNA. Остальные два кластера (
Gnas и Pws) имеют сложный паттерн, где импринтированные мРНК экспрессируются обеими хромосомами, тогда как импринтированная ncRNA экспрессируется только с хромосомы, несущей не метилированный гаметический DMR. Table 2 показывает, что в трех кластерах {
Igf2r, Kcnq1 и Gnas) промотор ncRNA располагается в интроне одной из импринтируемых мРНК, тогда как в остальных кластерах промотор ncRNA отделен, но лежит вблизи импринтированных мРНК генов. Это тесное перемешивание активных и молчащих генов в импринтированном кластере указывает на то, что механизмы молчания и активации, затрагивающие импринтируемые гены, не распространяются, а ограничиваются затрагиваемым геном. В частности тот факт, что промотор молчащей ncRNA может располагаться в интроне активно транскрибируемого гена указывает, что механизмы молчания
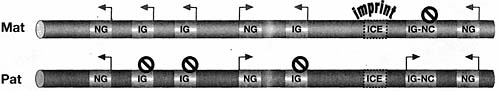 Figure 5. Imprinted Genes Are Expressed from One Parental Allele and Often Clustered
Most imprinted genes are found in clusters that include multiple protein-coding mRNAs and at least one noncoding RNA (ncRNA). Non-imprinted genes can also be present. The imprinting mechanism is c/s-acting, and imprinted expression is controlled by an imprint control element that carries an epigenetic imprint inherited from one parental gamete. One pair of diploid chromosomes is shown pink (maternally expressed imprinted gene) and blue (paternally expressed imprinted gene). (IG) Imprinted mRNA gene, (IG-nc) imprinted ncRNA gene, (NG) non-imprinted gene, (ICE) imprint control element, (arrow) expressed gene, (filled circle) repressed gene.
Figure 5. Imprinted Genes Are Expressed from One Parental Allele and Often Clustered
Most imprinted genes are found in clusters that include multiple protein-coding mRNAs and at least one noncoding RNA (ncRNA). Non-imprinted genes can also be present. The imprinting mechanism is c/s-acting, and imprinted expression is controlled by an imprint control element that carries an epigenetic imprint inherited from one parental gamete. One pair of diploid chromosomes is shown pink (maternally expressed imprinted gene) and blue (paternally expressed imprinted gene). (IG) Imprinted mRNA gene, (IG-nc) imprinted ncRNA gene, (NG) non-imprinted gene, (ICE) imprint control element, (arrow) expressed gene, (filled circle) repressed gene.
могут даже не распространяться на всю длину гена, а могут ограничиваться непосредственно регуляторными элементами.
Какова роль гаметического DMR? Несмотря на тот факт, что гаметические DMRs мб. метилированы матерински и отцовски, эксперименты по делеции этих элементов дают в целом сходные результаты, хотя с некоторыми интересными исключениями (Fig. 6). Для трех кластеров (Igf2r, Kcnql, Dlkl) экспериментальные делеции метилированного гаметического DMR не вызывали эффектов. Однако, делеция не метилированного гаметического DMR полностью ревертировала паттерн родитель-специфической экспрессии, так что экспрессия ncRNA терялась, а появлялась биаллельня экспрессия мРНК (Lin et al. 1995; Zwart et al. 2001; Fitzpatrick et al. 2002). Два кластера {Gnas и Pws), по-видимому, содержат более чем один гаметический DMR и обнаруживают более сложное поведение, которое всё ещё обладает некоторыми общими сходствами с этим паттерном (Williamson et al. 2006). Кластер Igf2, однако, ведет себя по другому: делеция как метилированного, так и не метилированиe гаметического DMR вызывает изменения экспрессии мРНК и ncRNA в cis-положении (Thorvaldsen et al. 1998).
Хотя данные всё ещё на ранней стадии, уже предпринимались попытки определить два типа импринтируемых кластеров (Table 2). Типа I и типа II кластеры обнаруживают одно и то же общее поведение реципрокной родитель-специфической экспрессии между ncRNA и множественными мРНК генами, но могут отличаться тремя способами. Во-первых, типа I кластеры несут материнский импринт метилированной (Igf2r, Kcnq1, Pws и Gnas), в то время как типа II кластеры несут отцовский импринт метилированной ДНК (Igf2 и Dlkl). Во-вторых, типа I кластеры экспрессируют ncRNA с отцовской хромосомы, тогда как типа II экспрессируют ncRNA с материнской хромосомы. В-третьих, в типа I кластерах промотор ncRNA располагается в интроне и генерирует транскрипт в антисмысловой ориентации по отношению к множественным импринтируемым мРНК генам, тогда как в типа II кластерах промотор располагается ниже и имеет смысловую ориентацию в отношении, по крайней мере, одного импринтируемого мРНК гена (Regha et aL 2006).
3.4 Imprinted Gene Clusters Contain at Least One neRNA
Из 12 известных кластеров импринтируемых генов, 8 ассоциированы с ncRNA (O'Neill 2005). ncRNAs, за исключением тех, что участвуют в процессинге и трансляции РНК, таких как сплайсинг, перенос, и рибосомальных РНК, как считалось ранее редки в геноме млекопитающих. Теперь, благодаря доступности геномных последовательностей мышей и людей, стал возможен анализ транскриптомов, который выявляет весь список транскриптов РНК в данной клеточной популяции. Уже установлено, что большая часть транскриптома млекопитающих (не считая те ncRNAs, которые ассоциированы с процессингом и трансляцией) неожиданно оказалась в основном из ncRNAs вместо белок-кодирующих мРНК. Значительное изобилие транскрипции ncRNA в геноме млекопитающих и тот факт, что огромное количество ncRNAs перекрывают известные белок-кодирующие гены, указывают на то, что это нельзя оценить как "транскрипционный шум", он скорее всего составляет новую, пока неизвестную, систему генной регуляции (Mattick 2005). Web сайт, названный NONCODE сформировал данные по всем организмам о функциональных ncRNAs (http://noncode.bioinfo.org.cn/). Существует несколько типов ncRNAs у млекопитающих, которые как было установлено, обладают функции регуляции генов, включая "short" ncRNAs из 21 bp до 30 bp, которые участвуют в путях RNA interference (Chapter 8), "intergenic" неподвергающиеся процессингу транскрипты, которые регулируют активность локального хроматина (Haussecker and Proudfoot 2005), и "длинные" подвергающиеся процессингу ncRNAs, такие как Xist, которые участвуют в инактивации Х хромосомы (Chapter 17).
Какого же типа ncRNAs ассоциированы с кластерами импринтируемых генов? Анализ ncRNAs, ассоциированных с 6 хорошо охарактеризованными импринтируемыми кластерами, показанных в Table 2, всё ещё неполон, выявляется некоторое сходство, но также и отличия. Три импринтируемых ncRNAs необычайно длинные зрелые РНК: Air в 108 kb (Lyle et aL 2000), Kcnqlotl по крайней мере в 60 kb, но окончательный размер пока не установлен (Mitsuya et al. 1999), и Ube3aas может превышать 1000 kb (Landers et al. 2004). H19 ncRNA, напротив всего в 2.3 kb (Brannan et al. 1990). Gtl2 ncRNA содержит множественные альтернативно сплайсированные транскрипты; однако, нижестоящая межгенная транскрипция также отмечается, указывая, что более длинные транскрипционные единицы вполне возможны (Tierling et al. 2005). Nespas ncRNA является крупнее, чем могут установить RNA blots, и полный размер её неизвестен (Wroe et al. 2000). Все эти импринтируемые ncRNAs, по-видимому, бедны интронами с низким соотношением intron-exon или являются не сплайсированными как зрелые транскрипты. Ранее было предположено, что все импринтируемые гены бедны интронами; однако, это может быть верным только для импринтируемых ncRNAs (Hurst et al. 1996). Одним из дальнейших свойств является то, что две импринтируемые ncRNAs (Ube3aas и Gtl2 downstream transcripts) действуют как транскрипты хозяева для snoRNAs (small nucleolar RNAs, которые управляют модификациями rRNA, snRNAs и возможно mRNAs, действуя при этом как пост-транскрипционные регуляторы) и miRNAs (microRNAs, участвующих в транскрипционной и посттранскрипционной регуляции мРНК). snoRNAs не направляются в направлении импринтируемых мРНК генов в кластере и скорее всего они не играют роли в самом механизме импринтинга (Seitz et al. 2004). Сходным образом miRNAs в Dlkl кластере участвуют в пост-транскрипционной репрессии одного из мРНК генов в кластере, но их роль в регуляции импринтируемой экспрессии кластера ещё не изучена (Davis et al. 2005).
Два свойства импринтируемых ncRNAs показывают, что они могут играть роль в замалчивании импринтируемых мРНК (т.e., protein-coding) генов в кластере. Первое это то, что ncRNA обычно обнаруживают реципрокную родитель-специфическую экспрессию по сравнению импринтируемыми мРНК генами (Table 2). Второе, DMR, который несет импринт гаметического метилирования, и который контролирует импринтируемую экспрессию всего кластера, перекрывает промотор ncRNA в трех случаях (Air, Kcnq1ot1, Gnas Exon1a). Это д. указывать на то, что импринты участвуют в регуляции ncRNA в каждом импринтируемом кластере. Эта интерпретация подтверждается экспериментами, в которых делетировали не метилированные последовательности, несущие гаметический DMR, в результате происходила потеря экспрессии ncRNA вместе с избытком экспрессии импринтируемых мРНК генов (Fig. 6), как это обнаруживалось в Igf2r, Kcnql, Gnas, Pws и Dlkl кластерах(Wutz et aL 1997; Bielinska et al. 2000; Fitzpatrick et aL 2002; Lin et al. 2003; Williamson et al. 2006). Кластер Igf2 составляет исключение, т.к. не метилированные гаметический DMR, по-видимому, не является непосредственным регулятором H19 ncRNA (Thorvaldsen et al. 1998).
Эксперименты, в которых непосредственно тестировали роль самой ncRNA, сегодня проделаны для двух ncRNAs из type I импринтированного кластера генов (
Air и Kcnq1ot1) и одной ncRNA (H19) из типа II кластера. Укорочение 108-kb Air ncRNA до 3 kb показало, что ncRNA сама по себе необходима для молчания всех трех мРНК генов в кластере
Igf2r, указывая на четкую регуляторную роль этой ncRNA (Sleutefe et aL 2002). Кроме того, укорочение 60-kb
Kcnq1ot1 ncRNA до 15 также показало, что эта ncRNA непосредственно нужна для молчания всех 10 мРНК генов в самом крупном
Kcnq1 кластере (Mantini-DiNardo 2006). Напротив точная делеция H19 ncRNA и промотора не оказывает эффекта на импринтинг
Igf2 кластера в ткани энтодермы, хотя некоторые потери импринтинга обнаруживаются в мезодермальной ткани (Schmidt et aL 1999). Т.о., два type I матерински импринтируемые кластеры обладают общим ncRNA-зависимым механизмом молчания, в то время как единственный из type II отцовски импринтируемых кластеров, исследованных точно также отличается, согласуясь с insulator-зависимой моделью. Результаты др. импринтированных кластеров очень ожидаемы, чтобы посмотреть, действительно ли это указывает на то, что имеются только два типа базовых механизмов импринтинга у млекопитающих, один для отцовски импринтируемых кластеров и др для матерински импринтируемых кластеров.
3.5 The Rok of DNA Methytathn In Genomic Imprinting
Идентификация первых трех эндогенных импринтируемых генов в 1991 позволило исследователям изучить, как клеточный эпигенетический аппарат маркирует импринтируемые гены в отношении родительской принадлежности. Первым и наиболее легко тестируемым кандидатом стало метилирование ДНК, модификация у млекопитающих, которая ковалентно добавляет метильную группу к остаткам цитозина в любом CpG динуклеотиде. Метилирование ДНК приобретается за счет действия de novo метилтрансфераз и поддерживается in situ во время каждого клеточного деления посредством действия поддержания матилтрансфераз (described in Chapter 18). Следовательно, эта модификация удовлетворяет критериям, представленным на Figure 3, приобретения идентифицирующей родителя метки или "imprint" т.к.
(1) она может быть установлена или в спермии или ооците с помощью de novo метилтрансфераз, которые действуют только в одной из гамет,
(2) она может стабильно распространяться с каждым эмбриональным клеточным делением путем поддержания метилтрансфераз и (3) она может стираться в зародышевой линии, чтобы восстановить импринт в следующей генерации или путем пассивного деметилирования или возможно посредством действия деметилазы.
Метилирование ДНК может потенциально выполнять две разные функции в геномном импринтинге. Оно может действовать как метка импринтинга путем приобретения de novo только с помощью хромосом одной гаметы. Оно возможно также служит молчанию одного из родительских аллелей, т.к. метилирование ДНК ассоциирует с генной репрессией. Чтобы определить, какой функцией оно обладает, сначала необходимо показать, что метилирование ДНК присутствует только на одной родительской хромосоме (т.e., что оно является DMR). Во-вторых, необходимо идентифицировать, какой импринтируемый ген в кластере и какая часть генного регуляторного аппарата маркируются с помощью метилирования ДНК. Локализация меток метилирования на промоторе или на удаленном позитивном или негативном регуляторном элементе, д. иметь разные последствия для генной экспрессии. Наконец, необходимо идентифицировать, когда формируется DMR во время развития. Если он формируется во время гаметогенеза и поддерживается на месте в соматических клетках (известен как гаметический DMR), то он может служить как метка импринтинга. Если, однако, он помещается на ген после того, как эмбрион становится диплоидным, когда обе родительские хромосомы находятся в одной и той же клетке (известен как соматический DMR), то он вряд ли служит в качестве идентифицирующей метки, но может служить для поддержания родитель-специфического молчания.
Родительское аллель-специфическое метилирование ДНК было обнаружено в большинстве импринтируемых кластеров, некоторые были изучены. Напр., Igf2 кластер имеет гаметический DMR, расположенный 2 kb выше H19 ncRNA промотора, который метилируется только в отцовской гамете и сохраняется после этого во всех соматических тканях (Bartolomei et al. 1993; Ferguson-Smith et al. 1993). Сходный гаметический DMR идентифицирован, как покрывающий промотор Air ncRNA, присутствует только на молчащей материнской копии гена и приобретается ещё материнскими гаметами (Stoger et al. 1993). Неожиданно гаметические DMRs не были идентифицированы на промоторах принципиальных импринтируемых белок-кодирующих генов в этих кластерах (соотв., Igf2 и Igf2r). Вместо этого молчащий Igf2 промотор оказался свободным от метилирования ДНК, тогда как молчащий Igf2r промотор располагался внутри соматического DMR (Sasaki et al. 1992; Stoger et al. 1993). Сходные находки гаметических DMRs, метилированных на хромосоме, несущей молчащую копию импринтированной ncRNA, были сделаны для 4-х др. хорошо изученных генных кластеров Pws, Kcnql, Gnas и Dlk1 (Shemer et al. 1997; Liu et al. 2000; Takada et al. 2002; Yatsuki et al. 2002).
Соматические DMRs появляются более редко и были описаны только для немногих импринтируемых белок-кодирующих генов в каждом кластере, указывая тем самым, что метилирование ДНК может играть только ограниченную роль в поддержании экспрессии импринтируемых генов (Stoger et al 1993; Moore et al. 1997; Yatsuki et al. 2002). Делеции гаметических DMRs у мышей приводят к полной потере импринтинга для множественных генов, указывая тем самым, что этот класс DMRs также служит в качестве крупного ICE для целого кластера (Fig. 6) (Wutz et al. 1997; Thorvaldsen et al. 1998; Bielinska et al. 2000; Fitzpatrick et aL 2002; Lin et al. 2003; Williamson et aL 2006). Напротив, делеция соматических DMRs затрагивает экспрессию ассоциированных импринтируемых белок-кодирующих генов, но импринтируемая экспрессия поддерживается за счет др. генов в кластере (Constancia et al. 2000; Sleutels et al. 2003).
Недостаточность метилирования ДНК во всем геноме, вызываемая мутациями в семействе гнеов Dnmt, подчеркивает важность его роли в регуляции экспрессии импринтируемых генов. Мутации в de novo метилазе Dnmt3a, метилазу стимулирующем факторе Dmnt3L или Dnmt1 поддерживающей метилазу, генерирует эмбрионов. дефицитных по метилированию ДНК, все они обладают изменениями в экспрессии импринтируемых генов (see Chapter 18). Тип пертурбаций показан для 4-х импринтируемых кластеров (Igf2, Igf2r, Kcnql и Dlk1) , он характеризуется тем, что метилирование ДНК в целом действует, супрессируя действие гаметического DMR на той же самой родительской хромосоме, которая экспрессирует кластер мРНК генов. Т.о., в отсутствие метилирования ДНК гаметический DMR не может функционировать соответственно. Как следствие, некоторые импринтируемые белок-кодирующие гены, включая Igf2, Igf2r, Kcnql и Dlk1, оказываются репрессированными на обеих родительски х хромосомах. Это указывает на то, что эти мРНК гены обычно являются молчащими в геноме млекопитающих и нуждаются в эпигенетической активации, чтобы экспрессироваться. Особенно HI 9 ncRNA, которая обычно экспрессируется только на хромосоме, несущей не метилированный гаметический DMR, начинает экспрессироваться с обеих родительских хромосом (Chapter 18). Некоторые ожидания такого генерального паттерна были описаны для генов. которые обнаруживают импринтируемую экспрессию только в плаценте (Lewis et al. 2004).
Существуют ли др. типы эпигенетических модификаций, используемые в качестве гаметических импринтов? Учитывая явное обилие эпигенетических механизмов, действующих, чтобы модифицировать генетическую информацию в геноме млекопитающих (Chapter 3), метилирование ДНК является уникальным только для механизма импринтинга. Гистоновые модификации, которые затрагивают состояние активности хроматина являются скорее всего кандидатами на роль родительских импринтов, т.к. они могут выполнять многие из необходимых условий. показанных на Figure 3. Кстати, только компонент Polycomb Group, белок известный как Eed (который облегчает метилирование гистона H3 по lysine 27) , как было установлено, влияет на немногие отцовски репрессированные гены. Эффекты Eed на геномный импринтинг, однако, относительно малы по сравнению с метилированием ДНК и оно может служить только для функции поддержания (Mager et aL 2003).
Как DMRs отбираются с помощью аппарата гаметического метилирования? Сравнение последовательностей известных гаметических DMRs не выявило серьезной консервации последовательностей, хотя некоторые, как сообщалось, содержат серии прямых повторов, которые могут формировать вторичную структуру, которая привлекает метилирование ДНК (Neumann et al. 1995). Последовательности DMRs заметно богаты CpG по сравнению с остальной частью генома и напоминают, что CpG островки ассоциируют с промоторами более половины генов в геноме млекопитающих (Chapter 18). Удивительно, что ключевым признаком CpG островков промоторов является то, что они обычно лишены метилирования ДНК и что существуют механизмы в ранних эмбриональных клетках, чтобы удерживать промоторные CpG островки свободными от метилирования (Antequera 2003). Однако, CpG островки могут становиться метилированными в опухолях и во время старения.
Два наблюдения проливают свет на то как метилирование ДНК может находить последовательности мишени DMR. Первое наблюдение заключается в том, что отцовская специфичность метилирования в H19 гаметическом DMR зависит от предупреждения метилирования по умолчанию этой области в материнской гамете с помощью белка CTCF (Fedoriw et al. 2004, см. Section 3.6). Это может указывать на отсутствие специфических последовательностей из системы метилирования ДНК. Второе наблюдение состоит в том, что дополнительный белок метилирования Dnmt3L играет разные роли в гаметах самцов и самок. В гаметах самцов Dnmt3L играет главную роль в метилировании и молчании ретротранспозонов и минимальную роль в метилировании DMR. Напротив, в ооцитах Dnmt3L играет основную роль в метилировании DMR и не играет роли в метилировании ретротранспозонов (Bourc'his and Bestor 2006). Ретротранспозоны являются мобильными генетическими элементами, которые присутствуют в очень больших количествах в геноме млекопитающих и могут быть копированы посредством промежуточных РНК образований и вставляться в новые сайты генома (Kazazian 2004). Находка, что тот же самый белок, который управляет метилированием, чтобы заставить молчать ретротранспозоны, может также управлять метилированием DMR, указывает на то, что необходимые механизмы для защиты генома от вторжения ДНК, были приспособлены, чтобы продуцировать импринты в материнской зародышевой линии (Barlow 1993).
3.6 Two Types of as-Acting Silencing Identified in Imprinted Gene Clusters
Сегодня два класса цис-действующих механизмов молчания, как полагают, управляют импринтингом различных кластеров: модель insulator приложима к
Igf2 кластеру, а модель ncRNA-обусловленного молчания приложима к
Igf2r и Kcnql кластерам. Пока еще полностью не установлено, но большинство кластеров в Table 2 включают аспекты одной из двух моделей. Открытие, которое привело к формулированию модели insulator в Igf2 локусе, заключалось в делеции гаметического DMR, который расположен на 2 kb выше стартовой точки транскрипции H19 и на 80 kb ниже Igf2 (Fig. 7) (Thorvaldsen et al. 1998). При его делеции, H19 и Igf2 обнаруживают потерю импринтинга независимо от того, наследуется ли делеция
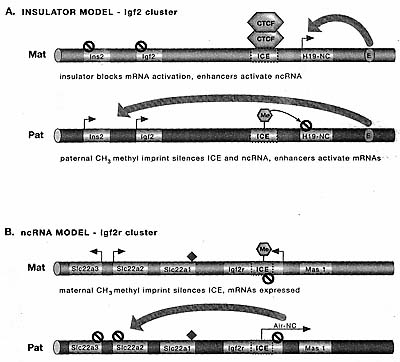 Figure 7. Two cis-Acting Silencing Mechanisms at Imprinted Gene Clusters
(a) Insulator model for the Igf2 cluster. The expression pattern for endoderm is shown. On the maternal chromosome the unmethylated ICE binds the CTCF protein and forms an insulator that prevents the common endoderm enhancers (E) from activating Igf2 and Ins2. Instead, the enhancers activate the nearby HI 9 ncRNA promoter. On the paternal chromosome, the methylated ICE cannot bind CTCF and an insulator does not form, hence the Igf2 and Ins2 mRNA genes are expressed only on this chromosome. The HI 9 ncRNA is methylated most likely because of spreading from the 2-kb distant methylated ICE, and silenced, (b) ncRNA model for the Igf2r cluster. The expression pattern for placenta is shown. On the maternal chromosome, the methylated ICE contains the Air ncRNA promoter that is directly silenced by the DNA methylation imprint. The Igf2r, Slc22a2, and Slc22o3 mRNA genes are expressed only on this chromosome. Mas 7 and Slc22al are not expressed in placenta. On the paternal chromosome, the Air ncRNA promoter lying in the unmethylated ICE is expressed, and silences Igf2r, Slc22a2, and Slc22a3 in cis. Note that in both models, the DNA methylation imprint silences the ncRNA and permits mRNA expression. (ICE) Imprint control element, (gray box) imprinted mRNA gene, (gene-NC) imprinted ncRNA gene, (arrow) expressed allele of an imprinted gene, (black stop sign) repressed allele of an imprinted gene, (filled diamond) tissue-specific gene silenced on both parental chromosomes, {gray arrows) long-distance effect in cis.
Figure 7. Two cis-Acting Silencing Mechanisms at Imprinted Gene Clusters
(a) Insulator model for the Igf2 cluster. The expression pattern for endoderm is shown. On the maternal chromosome the unmethylated ICE binds the CTCF protein and forms an insulator that prevents the common endoderm enhancers (E) from activating Igf2 and Ins2. Instead, the enhancers activate the nearby HI 9 ncRNA promoter. On the paternal chromosome, the methylated ICE cannot bind CTCF and an insulator does not form, hence the Igf2 and Ins2 mRNA genes are expressed only on this chromosome. The HI 9 ncRNA is methylated most likely because of spreading from the 2-kb distant methylated ICE, and silenced, (b) ncRNA model for the Igf2r cluster. The expression pattern for placenta is shown. On the maternal chromosome, the methylated ICE contains the Air ncRNA promoter that is directly silenced by the DNA methylation imprint. The Igf2r, Slc22a2, and Slc22o3 mRNA genes are expressed only on this chromosome. Mas 7 and Slc22al are not expressed in placenta. On the paternal chromosome, the Air ncRNA promoter lying in the unmethylated ICE is expressed, and silences Igf2r, Slc22a2, and Slc22a3 in cis. Note that in both models, the DNA methylation imprint silences the ncRNA and permits mRNA expression. (ICE) Imprint control element, (gray box) imprinted mRNA gene, (gene-NC) imprinted ncRNA gene, (arrow) expressed allele of an imprinted gene, (black stop sign) repressed allele of an imprinted gene, (filled diamond) tissue-specific gene silenced on both parental chromosomes, {gray arrows) long-distance effect in cis.
от матери или отца, указывая тем самым, что этот DMR является ICE. Впоследствии было показано, что этот ICE связан с ITCF, белком, обеспечивающим insulator активность в beta-globin локусе и что сам по себе ICE функционирует как insulator (Bell and Felsenfeld 2000; Hark et al. 2000). В этом контексте инсулятор определяется как элемент, который блокирует взаимодействия энхансера и промотора, если помещается между ними. Т.о., модель экспрессии импринтируемого гена в данном локусе следующая: на материнском аллеле CTCF соединяется с ICE и блокирует доступ
Igf2 и Ins2 к энхансерам, общими с H19 ncRNA, которые расположены ниже этих трех генов. Т.о. это делает возможным H19 эксклюзивный доступ к энхансерам (Fig. 7). На отцовском аллеле ICE приобретает метилирование ДНК в зародышевой линии самцов, предупреждая CTCF от связывания с ним. Т.о., на отцовской хромосоме
Igf2 и Ins2 взаимодействуют с энхансерами и экспрессируются с этой хромосомы. Присутствие метилирования ДНК на отцовском ICE ведет ко вторичному метилированию H19 промотора с помощью неизвестного механизма и он становится молчащим на отцовской хромосоме. Вовлечение CTCF в модели isulator привело к идентификации CTCF-связывающих сайтов в др. импринтируемых генах, таких как
Rasgrf1, GbrlO и Kcnq1ot1, указывая тем самым, что модель инсулятора может оперировать и в др. импринтируемых кластерах.
Класс ncRNA модели импринтинга может оказаться более распространенным. Открытие, которое привело к идентификации функциональных ncRNAs в импринтируемых кластерах, было подтверждено в экспериментах, в которых укорочена 108-kb Air ncRNA до 3 kb (Sleutels et al. 2002). Это укорочение ncRNA сохраняло импринтируемую экспрессию, а Air промотор сохранял метилирование импринтированной ДНК - кроме того, молчание всех трех мРНК генов в Igf2r кластере теряется (Fig. 7). ncRNA-обусловленное молчание, как было установлено, оперирует также в кластере Kcnql (Mancini-DiNardo 2006). На сегодня неизвестно, как Air или Kcnq1ot1 ncRNAs заставляют молчать гены в своих соотв. импринтируемых кластерах. Возможны многие модели, которые могут быть приложимы к обеим кластерам. Возникают две возможности из смыслового-антисмыслового перекрывания между мРНК и ncRNA, которое происходит в каждом кластере. Первая возможность заключается в том, что двунитчатая РНК может формироваться между мРНК и ncRNA и индуцировать RNA interference (RNAi) (see Chapter 8). Вторая возможность в том, что это смысловое-антисмысловое перекрывание вызывает образование транскрипционной interference между двумя промоторами, которая затрагивает только транскрипцию с мРНК промотора. В обоих случаях первым событием д. быть пост-транскрипционное молчание перекрываемых мРНК, сопровождаемое накоплением репрессивного хроматина, который может распространяться и индуцировать транскрипционное молчание генов по всему кластеру.
Также возможно, что импринтируемые ncRNAs действуют путем покрытия оболочкой локальной хромосомной области и непосредственно рекрутируют белки репрессивного хроматина на импринтируемый кластер по способу, сходному с тем. что описан для действия Xist ncRNA при инактивации Х хромосомы (Chapter 17). Имеются множественные сходства между молчанием. обусловленным с помощью Xist ncRNA. Наиболее существенным является то, что оба являются механизмами эпигенетического молчания и оба обнаруживают позитивную корреляцию между экспрессией ncRNA и молчанием множественных мРНК генов. Было также предположено, что геномный импринтинг и инактивация Х используют общий эпигенетический механизм (Reik and Lewis 2005). Если это действительно так, то можно предположить, что импринтируемые ncRNAs д. заставлять молчать гены посредством таргетинга репрессивного хроматина на импринтируемый кластер генов. Однако, пока нет четкой информации о том, как импринтируемые ncRNAs осуществляют свою функцию обеспечения молчания. Пока также неизвестно, сколько др. импринтируемых ncRNAs играют функциональную роль в генном молчании.
4 Genomic Imprinting-A Model for Mammalian Epigenetic Regulation
Геномный импринтинг имеет преимущества перед др. моделями эпигенетической регуляции генов млекопитающих, поскольку как активный, так и неактивный родительские аллели находятся в одном и том же ядре и подвержены действию одной и той же транскрипционной среды. Как результат любое эпигенетическое отличие меэжду двумя родительскими аллелями скорее всего коррелирует с их транскрипционным состоянием в противоположность эпигенетическим системам "before and after", где эпигенетические изменения могут также отражать измененное состояние дифференцировки клеток. Присутствие как активного, так и молчащего родительских аллелей в одном и том же ядре делает геномный импринтинг идеальной системой для изучения эпигенетической регуляции генов, но также накладывает определенные трудности, т.к. в первую очередь необходимо различить один и родительских аллелей, чтобы идентифицировать специфические свойства, ассоциированные с активностью и молчанием гена. Эта трудность была в основном преодолена у мышей путем разработки модельных систем, которые позволяют отличать материнские и отцовские хромосомы (Fig. 1).
Несмотря на тот факт, что пути эпигенетической регуляции генов сильно законсервированы в эволюции, существуют безусловно отличия, которые связаны с типом геномной организации для каждого организма. Геном млекопитающих обнаруживает необычную организацию, при которой перемешаны с повторами из большого количества копий (известных также как мобильные элементы). Это существенно увеличивает длину большинства генов, а также расстояния между соседними генами (Kazazian 2004). Это контрастирует с др. модельными организмами, такими как дрожжи, реснитчатые, грибы, нематоды, растения и Drosophila, чьи геномы обнаруживают тенденцию оставаться свободными от повторов или, по крайней мере, отделяют повторы от генов (Rabinowicz et al. 2003).
Было отмечено, что повторы с высоким количеством копий привлекают метилирование ДНК и репрессивные гистоновые модификации у многих организмов. Это, как полагают, в основном защитная адаптация против инвазии чужеродных последовательностей ДНК (напр., ретротранспозонов. транспозонов и вирусов). Рассмотрение того, как эпигенетический механизм оперирует у млекопитающих, д. поэтому учитывать перемешанную природу повторов и генов (Goll and Bestor 2005). Особенно тот факт, что интроны млекопитающих являются богаты повторами и, кроме того, гены способны становиться высоко транскрибируемыми, делает мало вероятным, что геном млекопитающих организован в крупные блоки из молчащего гетерохроматина или активного эухроматина. Эта точка зрения находит некоторое подтверждение в анализе всего генома в отношении паттерна хроматина у людей, показавшем, что активные гистоновые модификации в основном ограничены промоторами или короткими регионами, предположительно регуляторными элементами (Kim et al. 2005). Расположение импринтируемых генов в кластеры, которые содержат реципрокно экспрессируемые перекрывающиеся гены, а также гены, которые избегают импринтинга, всё вместе подтверждает вырисовывающуюся картину, что модификации хроматина могут не распространяться на значительные расстояния в геноме млекопитающих.
Как геномный импринтинг вносит вклад в понимание эпигенетики у млекопитающих? Хотя характеристика кластеров импринтируемых генов далека от завершения, они четко обладают потенциалом предоставлять информацию о том, как гены контролируются в локальных регионах или доменах. Кстати, кластеры импринтированных генов уже предоставили примеры цис-действующих последовательностей ДНК, которые регулируются с помощью метилирования ДНК; генов, которые молчат изначально в геноме млекопитающих и нуждаются в эпигенетической активации. чтобы экспрессироваться; дально-действующих регуляторных элементов, которые могут действовать как инсуляторы (изоляторы); и необычных ncRNAs, которые заставляют молчать крупные домены генов в цис-положении. Время покажет, являются ли эти типы эпигенетических регуляторных механизмов уникальными для имприрнтируемых кластеров или они могут также обнаруживаться как регулирующие экспрессию неимпринтируемых генов в геноме млекопитающих.
5 Future Directions
Genomic imprinting has been the focus of intense interest since the discovery of the first imprinted genes in mammals in 1991. Some questions still await conclusive answers, particularly those concerning why mammals alone among the vertebrates use imprinted genes to regulate embryonic and neonatal growth. This contrasts with the extensive progress during the intervening 15 years on elucidating the epigenetic mechanisms controlling imprinted expression in mammals. From this information, we think we understand the general principles of how the imprinting mechanism operates at imprinted gene clusters, although all the details are still not clear.
At this stage, we know that genomic imprinting uses the cell's normal epigenetic machinery to regulate parental-specific expression, and that everything is set in motion by restricting this machinery in the gamete, to just one parental allele. We know there are general similarities in the mechanism controlling imprinted expression of different gene clusters, but we do not yet understand how many variants of this mechanism exist in the mammalian genome.
In the future, we would very much like to know to what degree non-imprinted genes are controlled by the epigenetic mechanisms described for imprinted gene clusters. Ultimately, we want to know whether we can transfer this knowledge for therapeutic use in humans; for example, by inducing re-expression of the silent mRNA genes in patients with the Prader-Willi and Angel-man syndromes that show behavioral and growth defects, due to a deletion of the chromosome carrying the expressed alleles of imprinted mRNA genes (Jiang et al. 2004). An understanding of the way the cell controls epigenetic information is of increasing importance with the realization that epigenetic regulation can also be disturbed in cancers (see Chapter 24), in assisted reproductive technologies (see Chapter 22), and also in the aging process (Egger et al. 2004). We anticipate that an improved understanding of genomic imprinting will continue to provide an important model to discover how the mammalian genome uses epigenetic mechanisms to regulate gene expression.
Сайт создан в системе
uCoz
 Figure 1. Mouse Models to Study Genomic Imprinting That Allow the Maternal and Paternal Chromosome to Be Distinguished
Mammals are diploid and inherit a compete chromosome set from the maternal and paternal parents. However, mice can be generated that 0) inherit two copies of a chromosome pair from one parent and no copy from the other parent (known as uniparental disomy or UPD); (2) Inherit a partial chromosomal deletion from one parent and a wild-type chromosome from the other parent; (3) inherit chromosomes carrying stogte-nudeotide polymorphisms (known as SNPs) from one parent and a wild-type chromosome from the other parent Offspring with UPDs or deletions are likely to display lethal phenotypes, whereas SNPs will allow the production of viable offspring, (mat) Maternal, (stop sign) the imprint
Figure 1. Mouse Models to Study Genomic Imprinting That Allow the Maternal and Paternal Chromosome to Be Distinguished
Mammals are diploid and inherit a compete chromosome set from the maternal and paternal parents. However, mice can be generated that 0) inherit two copies of a chromosome pair from one parent and no copy from the other parent (known as uniparental disomy or UPD); (2) Inherit a partial chromosomal deletion from one parent and a wild-type chromosome from the other parent; (3) inherit chromosomes carrying stogte-nudeotide polymorphisms (known as SNPs) from one parent and a wild-type chromosome from the other parent Offspring with UPDs or deletions are likely to display lethal phenotypes, whereas SNPs will allow the production of viable offspring, (mat) Maternal, (stop sign) the imprint  Figure 2. A Maternal Genome and a Paternal Genome are Needed for Mammalian Reproduction.
The nuclear transfer technique used micropipettes and high-powered microscopes to remove the male or female nuclei from a newly fertilized egg and place them in various combinations into a second host* fertilized egg that had already been enucleated, thereby gen-rating anew, diploid embryos with two maternal (Gynogenetic) or tw paternal (Androgenetic) genomes or a btparental genome MM type). Gynogenetic and androgenetic embryos were lethal at any embryonic stages. Only reconstituted embryos that received oth a maternal and paternal nucleus (WWdtype) survived to pro-uce living young. These experiments show the necessity for both le maternal and paternal genome in mammalian reproduction and indicate that the two parental genomes express different sets of genes needed for complete embryonic development
Figure 2. A Maternal Genome and a Paternal Genome are Needed for Mammalian Reproduction.
The nuclear transfer technique used micropipettes and high-powered microscopes to remove the male or female nuclei from a newly fertilized egg and place them in various combinations into a second host* fertilized egg that had already been enucleated, thereby gen-rating anew, diploid embryos with two maternal (Gynogenetic) or tw paternal (Androgenetic) genomes or a btparental genome MM type). Gynogenetic and androgenetic embryos were lethal at any embryonic stages. Only reconstituted embryos that received oth a maternal and paternal nucleus (WWdtype) survived to pro-uce living young. These experiments show the necessity for both le maternal and paternal genome in mammalian reproduction and indicate that the two parental genomes express different sets of genes needed for complete embryonic development  Figure 3. Imprint Acquisition and Erasure in Mammalian Development
Imprints are acquired by the gametes; thus, oocytes and sperm already carry imprinted chromosomes (1st generation Imprints). After fertilization when the embryo is diploid, the imprint is maintained on the same parental chromosome after each cell division in cells of the embryo, membranes, placenta, and also in the adult The germ cells are formed in the embryonic gonad, and the imprints are erased only in these cells prior to sex determination. As the embryo develops into a male, the gonads differentiate to testes that produce haploid sperm which acquire a paternal imprint on their chromosomes. Similarly in developing females, chromosomes in the ovaries acquire maternal imprints (2nd generation imprints).
Figure 3. Imprint Acquisition and Erasure in Mammalian Development
Imprints are acquired by the gametes; thus, oocytes and sperm already carry imprinted chromosomes (1st generation Imprints). After fertilization when the embryo is diploid, the imprint is maintained on the same parental chromosome after each cell division in cells of the embryo, membranes, placenta, and also in the adult The germ cells are formed in the embryonic gonad, and the imprints are erased only in these cells prior to sex determination. As the embryo develops into a male, the gonads differentiate to testes that produce haploid sperm which acquire a paternal imprint on their chromosomes. Similarly in developing females, chromosomes in the ovaries acquire maternal imprints (2nd generation imprints).  (Maternal) Maternally expressed Imprinted gene. (Paternal) paternally expressed imprinted genes, (+) growth suppressing effect, (-/+) defect in daferentiation but growth regulatory status unclear, (o) additional dirfertntietfon defect (Reference http//www.mgu.har.mrc.ac.uk/research/imprinting/function.html)
(Maternal) Maternally expressed Imprinted gene. (Paternal) paternally expressed imprinted genes, (+) growth suppressing effect, (-/+) defect in daferentiation but growth regulatory status unclear, (o) additional dirfertntietfon defect (Reference http//www.mgu.har.mrc.ac.uk/research/imprinting/function.html)  Figure 4. Imprinted Genes Play a Role In Mammalian Reproduction
Mammals are diploid and reproduction requires fertilization of a haploid female egg by a haploid male sperm to recreate a diploid embryo. Only females are anatomically equipped for reproduction, but they cannot use parthenogenesis to reproduce because essential imprinted genes needed for fetal growth are imprinted and silenced on maternal chromosomes. These genes are expressed only from paternal chromosomes; thus, both parental genomes are needed for reproduction in mammals; Parthenogenesis is the production of diploid offspring from two copies of the same maternal genome.
Figure 4. Imprinted Genes Play a Role In Mammalian Reproduction
Mammals are diploid and reproduction requires fertilization of a haploid female egg by a haploid male sperm to recreate a diploid embryo. Only females are anatomically equipped for reproduction, but they cannot use parthenogenesis to reproduce because essential imprinted genes needed for fetal growth are imprinted and silenced on maternal chromosomes. These genes are expressed only from paternal chromosomes; thus, both parental genomes are needed for reproduction in mammals; Parthenogenesis is the production of diploid offspring from two copies of the same maternal genome. 
 Figure 5. Imprinted Genes Are Expressed from One Parental Allele and Often Clustered
Most imprinted genes are found in clusters that include multiple protein-coding mRNAs and at least one noncoding RNA (ncRNA). Non-imprinted genes can also be present. The imprinting mechanism is c/s-acting, and imprinted expression is controlled by an imprint control element that carries an epigenetic imprint inherited from one parental gamete. One pair of diploid chromosomes is shown pink (maternally expressed imprinted gene) and blue (paternally expressed imprinted gene). (IG) Imprinted mRNA gene, (IG-nc) imprinted ncRNA gene, (NG) non-imprinted gene, (ICE) imprint control element, (arrow) expressed gene, (filled circle) repressed gene.
Figure 5. Imprinted Genes Are Expressed from One Parental Allele and Often Clustered
Most imprinted genes are found in clusters that include multiple protein-coding mRNAs and at least one noncoding RNA (ncRNA). Non-imprinted genes can also be present. The imprinting mechanism is c/s-acting, and imprinted expression is controlled by an imprint control element that carries an epigenetic imprint inherited from one parental gamete. One pair of diploid chromosomes is shown pink (maternally expressed imprinted gene) and blue (paternally expressed imprinted gene). (IG) Imprinted mRNA gene, (IG-nc) imprinted ncRNA gene, (NG) non-imprinted gene, (ICE) imprint control element, (arrow) expressed gene, (filled circle) repressed gene. 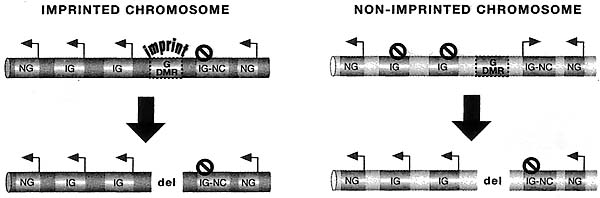 Figure 6. Imprinted Expression Is Regulated by Gametic DMRs
Left panel shows the effect of deleting the gametic DMR from the imprinted chromosome (green). Right panel shows the effect of deleting the gametic DMR from the non-imprinted chromosome (yellow). In many imprinted clusters (e.g., Igf2r, Kcnql, and Dlk1), experimental deletion of the G-DMR only affects the chromosome carrying the non-imprinted G-DMR. This results in a loss of repression of the imprinted protein-coding mRNA genes (IG) and a gain of repression of the imprinted ncRNA gene (IG-NC). Note that in some imprinted clusters (Igf2 and Pws) that are not illustrated here, the methylated G-DMR appears also to be required for expression of some of the imprinted mRNAs in cis. (del) Deleted DNA, (G-DMR) gametic differentially DNA-methylated region, (NG) non-imprinted gene, (arrow) expressed allele, (black stop sign) repressed allele, (IMPRINT) epigenetic modification leading to a change in gene expression in cis.
Figure 6. Imprinted Expression Is Regulated by Gametic DMRs
Left panel shows the effect of deleting the gametic DMR from the imprinted chromosome (green). Right panel shows the effect of deleting the gametic DMR from the non-imprinted chromosome (yellow). In many imprinted clusters (e.g., Igf2r, Kcnql, and Dlk1), experimental deletion of the G-DMR only affects the chromosome carrying the non-imprinted G-DMR. This results in a loss of repression of the imprinted protein-coding mRNA genes (IG) and a gain of repression of the imprinted ncRNA gene (IG-NC). Note that in some imprinted clusters (Igf2 and Pws) that are not illustrated here, the methylated G-DMR appears also to be required for expression of some of the imprinted mRNAs in cis. (del) Deleted DNA, (G-DMR) gametic differentially DNA-methylated region, (NG) non-imprinted gene, (arrow) expressed allele, (black stop sign) repressed allele, (IMPRINT) epigenetic modification leading to a change in gene expression in cis.  Figure 7. Two cis-Acting Silencing Mechanisms at Imprinted Gene Clusters
(a) Insulator model for the Igf2 cluster. The expression pattern for endoderm is shown. On the maternal chromosome the unmethylated ICE binds the CTCF protein and forms an insulator that prevents the common endoderm enhancers (E) from activating Igf2 and Ins2. Instead, the enhancers activate the nearby HI 9 ncRNA promoter. On the paternal chromosome, the methylated ICE cannot bind CTCF and an insulator does not form, hence the Igf2 and Ins2 mRNA genes are expressed only on this chromosome. The HI 9 ncRNA is methylated most likely because of spreading from the 2-kb distant methylated ICE, and silenced, (b) ncRNA model for the Igf2r cluster. The expression pattern for placenta is shown. On the maternal chromosome, the methylated ICE contains the Air ncRNA promoter that is directly silenced by the DNA methylation imprint. The Igf2r, Slc22a2, and Slc22o3 mRNA genes are expressed only on this chromosome. Mas 7 and Slc22al are not expressed in placenta. On the paternal chromosome, the Air ncRNA promoter lying in the unmethylated ICE is expressed, and silences Igf2r, Slc22a2, and Slc22a3 in cis. Note that in both models, the DNA methylation imprint silences the ncRNA and permits mRNA expression. (ICE) Imprint control element, (gray box) imprinted mRNA gene, (gene-NC) imprinted ncRNA gene, (arrow) expressed allele of an imprinted gene, (black stop sign) repressed allele of an imprinted gene, (filled diamond) tissue-specific gene silenced on both parental chromosomes, {gray arrows) long-distance effect in cis.
Figure 7. Two cis-Acting Silencing Mechanisms at Imprinted Gene Clusters
(a) Insulator model for the Igf2 cluster. The expression pattern for endoderm is shown. On the maternal chromosome the unmethylated ICE binds the CTCF protein and forms an insulator that prevents the common endoderm enhancers (E) from activating Igf2 and Ins2. Instead, the enhancers activate the nearby HI 9 ncRNA promoter. On the paternal chromosome, the methylated ICE cannot bind CTCF and an insulator does not form, hence the Igf2 and Ins2 mRNA genes are expressed only on this chromosome. The HI 9 ncRNA is methylated most likely because of spreading from the 2-kb distant methylated ICE, and silenced, (b) ncRNA model for the Igf2r cluster. The expression pattern for placenta is shown. On the maternal chromosome, the methylated ICE contains the Air ncRNA promoter that is directly silenced by the DNA methylation imprint. The Igf2r, Slc22a2, and Slc22o3 mRNA genes are expressed only on this chromosome. Mas 7 and Slc22al are not expressed in placenta. On the paternal chromosome, the Air ncRNA promoter lying in the unmethylated ICE is expressed, and silences Igf2r, Slc22a2, and Slc22a3 in cis. Note that in both models, the DNA methylation imprint silences the ncRNA and permits mRNA expression. (ICE) Imprint control element, (gray box) imprinted mRNA gene, (gene-NC) imprinted ncRNA gene, (arrow) expressed allele of an imprinted gene, (black stop sign) repressed allele of an imprinted gene, (filled diamond) tissue-specific gene silenced on both parental chromosomes, {gray arrows) long-distance effect in cis.