Мы видели в предыдущих разделах, как зрелые спермии и ооциты приобретают очень специфические и разные эпигенетические маркеры во время гаметогенеза. Некоторые из этих отличий, такие как родительские импринты, поддерживаются исправно у эмбрионов после оплодотворения. Большинство др. драматически перепрограммируются по мере достижения эмбриональным геномом тотипотентности. Важно знать до какой степени эпигенетические метки наследуются от гамет и играют роль в самых ранних событиях дифференцировки эмбрионов. Если жизнь начинается с одной клетки (оплодотворенной зиготы) с полным геномом, которая затем делится, то как дело доходит до дифференциальной экспрессии генов и онтогенетических программ в дочерних клетках?
У организмов с крупной яйцевой клеткой (таких как
Drosophila, Xenapus, или куры), некоторые матерью синтезированные белки или РНК располагаются асимметрично в яйце. Затем они только наследуются лишь некоторыми производными клетками, которые впоследствии приобретают определенную судьбу, тогда как др., которые не наслдуют эти детерминанты, развиваются по иному (Huynh and St Johnston 2004). Такая стратегия возможна с относительно крупными яйцеклетками, но становится затруднительной с более мелкими яйцеклетками млекопитающих. Однако, онтогенетическая программа может и не быть продиктованной просто из-за размера яйца, но, что важно, создана за счет потребности генерировать бластоцист у млекопитающих, который будет имплантироваться и генерировать плаценту, чтобы поддержать эмбрион. ICM можно рассматривать как онтогенетический эквивалент ооциту
Drosophila, т.к. она подвергается формированию паттерна в ответ на сигналы от внеэмбриональных соматических тканей во время раннего развития. Хотя имеются некоторые недавние предположения, что связь превращает симметрию оплодотворенной зиготы в симметрию бластоциста и даже постимплантационного эмбриона (Gardner 1997; Weber et aL 1999), не найдено асимметрично локализованных детерминант дифференцировки в яйцах млекопитающих. Более того, эмбрионы млекопитающих обнаруживают заметную способность "регуляции" развития; т.е. когда клетки удаляются или нарушаются. то компенсаторный рост или перемещения клеток часто способны обеспечить развитие нормального эмбриона (Kelly 1977). Тем не менее имеются вероятно слегка отличные правила отбора индивидуальных клеток (бластомеров), чтобы формировать клоны ICM и TE уже с 4-клеточной стадии (Fujimori et aL 2003; Piotrowska-Nitscheetal.2005).
3.2 Epigenetic Events at Fertilization
Во время развития и дифференцировки клоны соматических клеток приобретают очень специфические и специализированные паттерны метилирования ДНК и гистонов. Эти паттерны безусловно трудно стереть или обратить, когда соматическое ядро трансплантируется в ооцит (see Chapter 22). Эпигенетические метки ооцита и делают спермии также специализированными, но репрограммирование эффективно при оплодотворении, так что эмбриональный геном может приобрести свою новую функцию, именно, став тотипотентным (Reik et aL 2001; Surani 2001). Известен ряд признаков, обеспечивающий эпигенетический состав гамет и эпигенетическое репрограммирование после оплодотворения (Fig. 2). Геномы ооцита и спермия обладают значительными уровнями метилирования ДНК; в качестве примера определенный класс последовательностей, семейство ретротранспозонов, intracisternal A particles (IAP), которые появляются в количестве около 1000 копий на мышиный геном, являются высоко метилироваными как в геноме ооцитов. так и спермиев (Lane et aL 2003). Имеются, напротив, и определенные последовательности, в особенности differentially methylated regions (DMRs) в импринтированных генах, которые метилируются только в ооцитах или в спермиях (see Chapter 19).
Геном ооцита обладает также высокими уровнями гистоновых модификаций, как активирующих (напр., H3K9 acetylation, H3K4 methylation), так и репрессирующих (H3K9 methylation, H3K27 methylation) (Morgan et aL 2005). С этой точки зрения перед оплодотворением геном ооцита транскрипционно неактивен, но содержит матерински унаследованные транскрипты и белки, которые необходимы в течение первых нескольких делений дробления, включая те, что необходимы для событий репрограммирования (Fig. la). Геном спермия высоко специализирован, так что большинство гистонов замещается во время сперматогенеза высоко щелочными протаминами, которые могут облегчать упаковку ДНК в компактную головку спермия (McLay and Clarke 2003). Сегодня неизвестно, какие имеются модификации оставшихся гистонов и где они локализуются в геноме, что создает затруднения для изучения этих малораспространенных регионов хроматина. Вскоре после оплодотворения происходит высоко регулируемая последовательность событий репрограммирования в геноме спермия. Протамины быстро удаляются и замещаются гистонами. Скорее всего, что существующая ДНК replication independent (RI), поэтому включение гистонового варианта H33 осуществляется с помощью гистоновго хаперона HIRA (van der Heijden et aL 2005; see Chapter 13). В том же самом стиле по всему геному происходит деметилирование ДНК в самцовом пронуклеусе, затрагивая одиночные копии и повторяющиеся последовательности, но не отцовски метилированные импринтированные гены (Olek and Walter 1997; Mayer et aL 2000; Oswald et aL 2000; Dean et aL 2001; Santos et aL 2002; Lane et aL 2003).
Перед репликацией ДНК гистоны в отцовском пронуклеусе ацетилируются (H3 и H4), H3K4 метилируются и быстро приобретают H3K9mel и H3K27mel (Arney et aL 2002; Santos et aL 2002,2005; Lepikhov and Walter 2004). H3K9me2/3 и H3K27me2/3, однако, появляются только после репликации ДНК возможно в связи с инкорпорацией стержневого гистона H3.1, вместо H3.3 (Santos et al. 2005). В первом митозе большинство гистоновых меток, подробно проанализированных, оказываются совершенно сходными на материнских и отцовских хромосомах, по крайней мере, как определяется при низком уровне разрешения с использованием иммунофлюоресцентного окрашивания (Santos et al. 2005).
Активности энзимов, которые ответственны за эти ранние ступени репрограммирования, скорее всего все присутствуют в ооците или как белок или как РНК, которая может быстро транслироваться. Мы уже упоминали HIRA, но после репликации ДНК обнаруживается CAF-1, которые необходим для replication dependent (RD) включения гистона H3.1. Энзимы su(var) метилируют H3K9, a Ezh2 вместе со своим кофактором Eed метилирует H3K27 (Erhardt et aL 2003; Santos et al. 2005). Скорее всего, что драматическое деметилирование ДНК отцовского генома вызывается с помощью процесса "active demethylation," для которого предложены различные механизмы, но не выделено определенных энзимов (Morgan et al. 2005). Возможными кандидатами для механизма деметилирования у млекопитающих являются энзимы семейства Aid/Apobec, которые могут deaminate 5-methylcytosine в ДНК, превращая его в тимин и возникающий в результате T:G mismatch может быть репарирован с помощью эксцизионной репарации (Morgan et al. 2004). Путь деметилирования у растений также использует эксцизионную репарацию оснований, которая инициируется с помощью ДНК glycosyiase Demeter (Gehring et aL 2006). Сходные demethylases ммогут также присутствовать в цитоплазме ооцита при оплодотворении. Возникает вопрос, почему материнский геном не деметилируется в то же самое время, что и отцовский. Материнский хроматин или пронуклеус д. обладать неким специфическим механизмом защиты; колокализация метилированной ДНК в материнском пронуклеусе вместе с H3K9me2, подтверждает эту гистоновую модификацию как кандидата для защиты (Arney et al. 2002; Santos et al. 2002,2005).
Хотя доказательства в основном подтверждают, что гистоновые модификации приобретаются скорее. чем теряются на глобальном уровне во время этого периода, возможно, что метилирование аргинина гистона является более динамичным. В самом деле, кандидат на стирание метилирования аргинина гистона с помощью "deimination," Padi4, присутствует в ооцитах (Sarmento et al. 2004). Главный результат быстрых изменений хроматина, который происходит при оплодотворении, по-видимому, приходится на 2-клеточную стадию, когда отцовский геном оказывается сходным с материнским. Это исключает метилирование ДНК, которое отличается существенно в двух геномах, а в основном является результатом деметилирования генома спермия. Кроме того, уровень проведенного анализа не исключает, что имеются ген-спеыцифические отличия в модификациях гистонов, которые устанавливаются на этой стадии.
3.3 From the Zygote to the Blastocist
Общая тема дальнейшего репрограммирования, особенно паттерна метилирования ДНК всего генома, продолжается с 2-клеточной стадии через все стадии дробления преимплантационного развития вплоть до достижения эмбрионом стадии бластоциста (Monk et al. 1987; Hewlett and Reik 1991; Rougier et al. 1998). Точная динамика гистоновых модификаций ещё не описана полностью у мышей, но метилирование ДНК поэтапно редуцируется с каждым делением ядра вплоть до стадии 16-клеточной морулы. Причина этого Dnmtl, methyltransferase, которая поддерживает метилирование в CpG динуклеотидах полуконсервативным способом во время репликации ДНК, исключается из ядра (Carlson et aL 1992). Следовательно, при каждом делении 50% от всего геномного метилирования ДНК теряется. Известно только хорошо задокументированное исключение в виде DMRs в импринтированных генах. Неясно, поддерживается ли их метилирование в течение этого периода за счет неизвестной Dnmt, или за счет действия небольшого количества Dnmtl, которое способно поступать в ядро и специфически направляться на DMRs. Удивительно, на 8-клеточной ст. белок Dnmtl, по-видимому, проникает в ядро для одного цикла репликации. Если этот Dnmtl белок удаляется (с помощью его генетического устранения в ооците, который обладает большинством, если не всеми белками во время делений дробления), то метилирование в DMRs в самом деле редуцируется на 50%, это согласуется с его необходимостью для поддержания только одного раунда репликации (Howell et al. 2001).
На 8-16-клеточной стадии наружные клетки морулы уплощаются и становятся эпителиальными; это наз. компакцией. Это первый внешний признак дифференцировки у эмбрионов млекопитающих. В течение следующих 2-3 делений морула подвергается кавитации (т.е. образуется полость) и бластоцист отличается своей inner cell mass (ICM) и клетками наружной trophectoderm (TE). Клетки ICM идут на образование всех клонов эмбриона и плода, тогда как клетки TE формируют большинство ( но не все) клоны плаценты (внеэмбриональные клоны). Вскоре после этой стадии др. эпителиальный слой клеток формируется на поверхности ICM; это клетки первичной энтодермы, которые также вносят вклад в плаценту и желточный мешок, но не в эмбрион. Известны немногие генетические детерминанты этих ранних событий аллокации: Oct4, Nanog и Sox2 важны для детерминации или поддержания клеток ICM, тогда как Cdx2 необходим для раннего поддержания TE клеток (Nichols et aL 1998; Avilion et al. 2003; Chambers et al. 2003; Mitsui et aL 2003; Niwa et al. 2005). До какой степени материнский белок (присутствующий в ооците), или эпигенетическая регуляция этих генов у раннего эмбриона может вносить вклад в раннее решенеие клеточных судеб, или их поддержание, сегодня неизвестно (Dean and Ferguson-Smith 2001 ).
Основные события эпигенетического программирования происходят именно на этой стадии развития. Клетки ICM приобретают высокий уровень метилирования ДНК, по крайней мере, как демонстрирует иммунофлюоресценция, что, по-видимому, говорит о внесении de novo DNA methyltransferase Dnmt3b (Santos et aL 2002). Это сопровождается усилением метилирования гистонов H3K9 и H3K27, трансдуцируемых с помощью G9a и Eset, а также Ezh2, соот. (Erhardt et al. 2003). Хотя de novo метилирование ДНК не является критическим для инициального возникновения клеток ICM, но метилирование гистонов с помощью Ezh2 и Eset необходимо: при нокауте любого из генов развитие собственно ICM не происходит (O'Carroll et al.2001; Dodge et al. 2004).
В противоположность увеличению эпигенетических модификаций в ICM, TE остается в основном гипометилирована по ДНК, как и большинство клеточных клонов в поздней плаценте (Chapman et al. 1984; Santos et al. 2002). Считается, что плацентарные типы клеток нуждаются в меньшей эпигенетической стабильности, т.к. помимо всего прочего их продолжительность жизни значительно более ограничена, чем клеток плода, которые развиваются во взрослый организм.
Помимо этих крупномасштабных и характерных для всего генома эпигенетических событий, более локус-специфическое репрограммирование также имеет место на этой стадии. У XX женских эмбрионов от отцов наследуемая Х хромосома инактивируется во время стадий дробления и остается такой во внеэмбриональных тканях (т.e., в TE и плаценте) (Huynh and Lee 2003; Okamoto et al. 2005). В ICM, однако, неактивная Х реактивируется и это сопровождается случайной инактивацией одной из Х хромосом после дифференцировки в клоны, происходящие из ICM (Mak et al. 2004; for more detail, see Fig. 4 of Chapter 17). Механистически, инактивация импринтированной Х у преимплантационных эмбрионов связана с экспрессией некодирующей РНК Xist с отцовской Х хромосомы, чьё "покрытие" хромосомы, как полагают, ведет к генному молчанию и возникновению репрессивных эпигенетических модификаций (Heard 2004). Во вновь формируемых клетках ICM, транскрипция Xist подавляется, репрессивные гистоновые модификации постепенно теряются и хромосома оказывается реактивированной (Mak et al. 2004; Okamoto et al. 2004). Это происходит вскоре после инициации случайной инактивации Х в клетках эпибласта. Как увидим клетки ES оказываются "замороженными" на ст. после реактивации X хромосомы, так что ES клетки самок содержат две активные Х хромосомы
4 From Pluripotent Stem Cells to Somatic Cells and Back to Germ Cells
4.1 Derivation of Pluripotent Stem Cells
В предыдущей главе мы поняли, что существуют драматические эпигенетические события репрограммирования в зиготе, а др. у эмбрионов ст. дробления и бластоцистов, приводящие в результате к разным эпигенетическим паттернам в ICM и TE. Сегодня мы рассматриваем генетические и эпигенетические свойства ранних стволовых клеток, происходящих в культуре из бластоциста и более поздних клонов, таких как embryonic stem cells (Smith 2001), trophoblast stem (TS) клетки (Rossant 2001), endoderm stem (XEN) клетки (Kunath et al. 2005)и embryonic germ cell (EG) стволовые клетки (Matsui et al. 1992).
Общим в этих типах клеток является то, что они могут быть изолированы или воссозданы из интактных эмбрионов в виде культуры при определенных условиях культивирования. Появившись однажды. они могут быть культивированы в течение продолжительных периодов времени и не обнаруживать признаков старения. С ними можно также генетически манипулировать во время культивирования и заме повторно вносить в живые эмбрионы, чтобы вызывать развитие соотв. клонов.
Одним из наиболее важных открытий в эмбриологии млекопитающих в 1980s было разработка методов генерации плюрипотентных ES клеток из ICMs. Клетки ES, эксплантированные из мышиных бластоцистов в культуру, могут поддерживаться в культуре в течение длительного периода и затем микроинъецироваться обратно в бластоцисты, где они колонизируют все эмбриональные клоны, формируя таким образом химеры (Fig. 6; Evans and Kaufman 1981; Martin 1981). Особенно интересным оказалось то, что производные ES клеток могут колонизировать зародышевые клетки и давать нормальное потомство, которое происходит целиком из ES клеточного генотипа. Это вместе со способностью генетических манипуляций с геномом ES клеток с помощью гомологичной рекомбинации (приводящей к нокауту генов), революционизировало мышиную генетику и сделало мышей предпочтительной генетической моделью из млекопитающих.
ES клетки обладают общими свойствами с ICM/epiblast клетками, но существуют также и существенные различия, делающие их предпочтительными по-видимому, сравнению с "synthetic" типами клеток, которые не существуют у нормальных эмбрионов (это верно и для др. линий плюрипотентных клеток) (Smith 2001). Напр., в то время как самообновление мышиных ES клеток
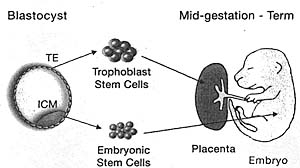 | Figure 6. Derivation of ES and TS Cells from the Blastocyst
ES cells are derived from inner cell mass (ICM) cells and can be kept in culture without differentiating. They can be genetically manipulated while in culture. ES cells can be reintroduced into blastocysts and can then colonize all tissues in the embryo, including the germ line, but excluding the trophoblast cells of the placenta. TS cells can be established similarly into culture from the trophectoderm cells of the blastocyst, and when reintroduced into blastocysts, contribute to placental cell types.
| Figure 6. Derivation of ES and TS Cells from the Blastocyst
ES cells are derived from inner cell mass (ICM) cells and can be kept in culture without differentiating. They can be genetically manipulated while in culture. ES cells can be reintroduced into blastocysts and can then colonize all tissues in the embryo, including the germ line, but excluding the trophoblast cells of the placenta. TS cells can be established similarly into culture from the trophectoderm cells of the blastocyst, and when reintroduced into blastocysts, contribute to placental cell types.
нуждается в Lif/gp 130/Stat3 сигнальном пути, эмбрионы с мутациями компонентов этого пути всё ещё дают нормальную ICM (Smith 2001). Очевидно. что происходят эпигенетические изменения и они необходимы для происхождения и поддержания ES клеток из ICM клеток. Разрастания ICM клеток в культуре быстро теряют экспрессию Oct4, и единственная линия мышей, из которых относительно легко получать ES клетки, называемая 129Sv, сохраняет некоторые Oct4-экспрессирующие клетки после культивирования (Buehr et al. 2003). Эпигенетические изменения были также описаны в импринтированных генах у мышей и макак резус в ES клетках, и у мышей это может приводить к аберрантному развитию клеток, если они повторно вносятся в химеры (Dean et aL 1998; Humpherys et al. 2001; Fujimoto et al. 2005).
4.2 Epigenetic Properties of Multipotent lol Cell Urns
ES клетки могут быть дифференцироваться
in vitro в ряд различных клеточных линий (Fig. 7). До какой степени эпигенетические механизмы поддерживают клетки недифференцированными или в дифференцированном состоянии? Очевидно, что имеются эпигеномные различия между недифференцированными ES клетками и соматическими клетками, когда плюрипотенциальные клетки в частности характеризуются гипердинамической пластичностью хроматина (Meshorer et aL 2006). Делеция в ES клетках Parp (poly-ADP ribosylase), которая участвует в контроле альтераций гистоновых меток, ведет к низкой частоте трансдифференцировки в клетки трофобласта, подтверждая, что dial эпигенетические метки в ES cells необходимы для поддержания их качественных особенностей (Hemberger et aL 2003). Метилирование ДНК может также вносить вклад в это,
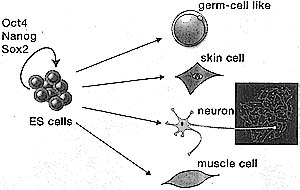 | Figure 7. DtfferentiatJon of ES Ce"s Into Different Cell Types In Vitro
ES cells can be differentiated in vitro under suitable culture conditions into many different cell types, such as neurons, muscle cells, and even germ cells (oocytes). The inset image shows neuroglial cells derived from ES cells in culture.
| Figure 7. DtfferentiatJon of ES Ce"s Into Different Cell Types In Vitro
ES cells can be differentiated in vitro under suitable culture conditions into many different cell types, such as neurons, muscle cells, and even germ cells (oocytes). The inset image shows neuroglial cells derived from ES cells in culture.
т.к тяжелая деплеция метилирования ДНК приводит к частичному блоку способности ES клеток дифференцироваться, и к появлению маркеров дифференцировки трофэктодермы (Jackson et al. 2004).
Поддержание плюрипотентности ES клеток зависит от транскрипционных факторов Oct4, Nanog, и Sox2. Они соединяются по-видимому, отдельности или в комбинации с многими генными локусами в ES клетках, которые необходимы или активными или молчащими для поддержания плюрипотентности (Boyer et al. 2005; Loh et al. 2006). Дифференцировка ES клеток in vitro характеризуется с помощью транскрипционного молчания генов плюрипотентности, которые затем остаются репрессированными во всех соматических тканях. Эпигенетические механизмы в самом деле важны для их молчания: промотор Oct4, напр., накапливает гистоновые модификации и метилирование ДНК во время дифференцировки (Feldmann et al. 2006). Потеря метилирования ДНК, напр., используя нокаутных по Dnmtl эмбрионов, ведет к реэкспрессии Oct4 при дифференцировке (Feldman et al. 2006).
ES клетки и их дифференцированные производные могут служить также в качестве модели эпигенетической регуляции инактивации Х хромосомы. ICM и ES клетки самок имеют подавленный ген Xist и две активные Х хромосомы. После дифференцировки in vitro, Xist активируется на одной их Х хромосом, Xist РНК начинает "покрывать" эту хромосому в cis-положении, а молчание генов на Х совпадает с накоплением репрессивных гистоновых модификаций и вытекающем из этого метилировании ДНК (Heard 2004).
Др. типы плюрипотентных клеток могут сходным образом поддерживаться в культуре, но их эпигенетические характеристики хуже охарактеризованы, чем таковые у ES клеток. Однако, известно из эпигенетических исследований Х инактивации, что у самок ЕS клетки с отцовской инактивированной Х хромосомой содержат репрессивные гистоновые метки (Huynh and Lee 2003). XEN клетки самок также имеют отцовскую Х хромосому, которая инактивирована (Kunath et aL 2005).
Линии плюрипотентных клеток также могут возникать из primordial germ cells (PGCs) или во время периода их миграции в эмбрионе (E8-E10.5) или когда они проникают в эмбриональные гонады (E11.5-E13.5) (Fig. 8) (Matsui et al. 1992). PGCs, на ст. E8.5-12.5 подвергаются экстенсивному эпигенетическому репрограммированию, индуцируя деметилирование ДНК импринтированных генов и др. последовательностей генома (Hajkova et al. 2002; Lee et al. 2002). В самом деле, большинство EG клеток подвергается устранению деметилирования ДНК с импринтированных генов и др. последовательностей и это изменяет из потенциал развития, как это демонстрируется внесением их в химеры (Tada et al. 1998). Пока неясно, существуют ли эпигенетические
 | Figure 8. Link between Germ-Line Development and Pluripotency
The oocyte and zygote are totipotent (the oocyte has restrictions imposed by parental imprinting) and so are morula cells up to a certain stage. Pluripotent cells can be derived into culture from the inner cell mass (ICM) cells, primordial germ cells (PGCs), and spermatogonia stem (SS) cells in the neonatal and adult testis. There is thus an intimate link between germ-line cells throughout their development, and pluripotency.
| Figure 8. Link between Germ-Line Development and Pluripotency
The oocyte and zygote are totipotent (the oocyte has restrictions imposed by parental imprinting) and so are morula cells up to a certain stage. Pluripotent cells can be derived into culture from the inner cell mass (ICM) cells, primordial germ cells (PGCs), and spermatogonia stem (SS) cells in the neonatal and adult testis. There is thus an intimate link between germ-line cells throughout their development, and pluripotency.
различия между эндогенными PGCs и
in vitro культивируемыми EG клетками, сходно с тем, предположительно существует между ICM и ES клетками.
4.3 Reprogramming Capacity of Stem Cells
Продолжающееся состояние плюрипотентности в культуре без клеточного старения нуждается в непрерывном эпигенетическом репрограммировании стволовых клеток. То, что эти клетки на самом деле обладают репрограммирующими активностями было продемонстрировано в экспериментах
в которых EG или ES клетки были слиты с дифференцированными соматическими клетками (Tada et al. 1997,2001; Cowan et al. 2005). В линии тетраплоидных клеток, возникших в результате слияния, соматический эпигенотип репрограммируется (Fig. 9). В слитых EG-соматические клетки соматический геном теряет метилирование ДНК импринтированных генов, а также др. последовательностей генома (Tada et al. 1997). В слитых ES-соматических клетках, напротив, метилирование ДНК импринтированных генов сохраняется, но неактивная Х хромосома (в женских клетках) реактивируется, а промотор гена Oct4 становится ДНК деметилированным, приводя в результате к реэкспрессии Oct4 (Tada et al. 2001; Cowan et al. 2005; Surani 2005).
Качественные особенности любого из репрограммирующих факторов, затрагивающих метилирование ДНК или модификации гистонов в этих клеточных гибридах, пока неизвестны. Неизвестно, напр., нуждается ли деметилирование в EG или ES клеточных гибридах в DNA demethylase активности, и происходит ли репликация ДНК в отсутствие Dnmtl, приводя в результате к пассивному деметилированию. Тем не менее, ES и EG клетки д. рассматриваться как важный рессурс для изоляции и характеристики факторов эпигенетического репрограммирования.
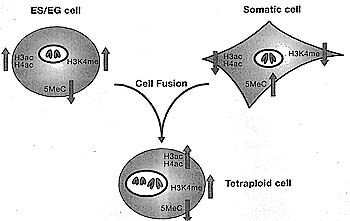 | Figure 9. Pluripotent Cells Have the Capacity to Reprogram Somatic Cells
ES or EG cells can be fused with somatic cells, resulting in tetraploid hybrids. This leads to epigenetic reprogramming of the somatic nucleus, with changes, for example, in 5meC, H3ac, H4ac, and H3K4me. The tetraploid cells resulting from this fusion and reprogramming also have a pluripotent phenotype: When injected into blastocysts they can contribute to many different cell types in the embryo.
| Figure 9. Pluripotent Cells Have the Capacity to Reprogram Somatic Cells
ES or EG cells can be fused with somatic cells, resulting in tetraploid hybrids. This leads to epigenetic reprogramming of the somatic nucleus, with changes, for example, in 5meC, H3ac, H4ac, and H3K4me. The tetraploid cells resulting from this fusion and reprogramming also have a pluripotent phenotype: When injected into blastocysts they can contribute to many different cell types in the embryo.
5. Perspective
The next few years will see decisive and exciting advances in our understanding of the genetic and epigenetic factors that are critical for totipotency and pluripotency of germ cells and stem cells. High throughput and sensitive methods for determining the various layers of epigenetic informati
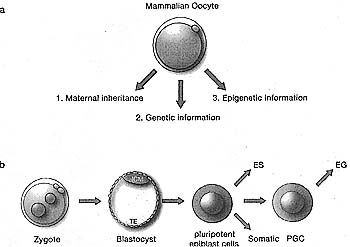 | Figure 1. The Mammalian Oocyte and Zygote
(a) The mammalian oocyte contains maternal RNAs and maternal proteins (maternal inheritance), which can determine early developmental events, genetic information (maternal chromosomes), and epigenetic information (DNA methylation and chromatin marks), (b) The zygote gives rise to the blastocyst with its inner cell mass cells, which give rise to ES cells (in culture), all somatic cells, and primordial germ cells (PGC), which can give rise to EG cells in culture.
| Figure 1. The Mammalian Oocyte and Zygote
(a) The mammalian oocyte contains maternal RNAs and maternal proteins (maternal inheritance), which can determine early developmental events, genetic information (maternal chromosomes), and epigenetic information (DNA methylation and chromatin marks), (b) The zygote gives rise to the blastocyst with its inner cell mass cells, which give rise to ES cells (in culture), all somatic cells, and primordial germ cells (PGC), which can give rise to EG cells in culture. 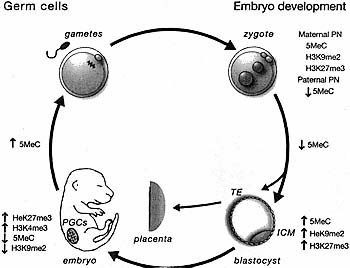 | Figure 2. Epigenetic Reprogramming Cycle in Mammalian Development
Immediately after fertilization in the zygote, the paternal pronucleus (PN) is packaged with histones that lack H3K9me2 and H3K27me3, whereas the maternal chromatin contains these marks. The paternal PN also rapidly loses 5-methylcytosine (5MeC) on a genome-wide scale, while the maternal does not. Passive loss of 5MeC occurs during preim-plantation development until the blastocyst stage, when the inner cell mass (ICM) cells begin to acquire high levels of 5MeC, H3K9me2, and H3K27me3. The placenta, which is largely derived from the trophectoderm (TE) of the blastocyst, remains relatively hypomethylated. Primordial germ cells (PGCs) undergo demethylation of 5MeC and H3K9me2 before and after entry into the gonads. De novo DNA methylation, Including parent-specific imprinting, takes place at later stages of germ-cell development.
| Figure 2. Epigenetic Reprogramming Cycle in Mammalian Development
Immediately after fertilization in the zygote, the paternal pronucleus (PN) is packaged with histones that lack H3K9me2 and H3K27me3, whereas the maternal chromatin contains these marks. The paternal PN also rapidly loses 5-methylcytosine (5MeC) on a genome-wide scale, while the maternal does not. Passive loss of 5MeC occurs during preim-plantation development until the blastocyst stage, when the inner cell mass (ICM) cells begin to acquire high levels of 5MeC, H3K9me2, and H3K27me3. The placenta, which is largely derived from the trophectoderm (TE) of the blastocyst, remains relatively hypomethylated. Primordial germ cells (PGCs) undergo demethylation of 5MeC and H3K9me2 before and after entry into the gonads. De novo DNA methylation, Including parent-specific imprinting, takes place at later stages of germ-cell development. 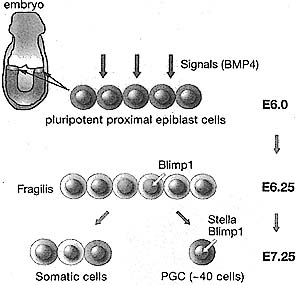 | Figure 3. Early Germ-Cell Determination in the Mouse .
Pluripotent proximal epiblast cells (blue) which are derived from the ICM (see Figs. 1 and 2) receive an extracellular signal from BMP4 which confers germ-line competence (pink). Activation of Blimpl commits these cells to the primordial germ cell lineage (red), whereas other cells become somatic cells.
| Figure 3. Early Germ-Cell Determination in the Mouse .
Pluripotent proximal epiblast cells (blue) which are derived from the ICM (see Figs. 1 and 2) receive an extracellular signal from BMP4 which confers germ-line competence (pink). Activation of Blimpl commits these cells to the primordial germ cell lineage (red), whereas other cells become somatic cells. 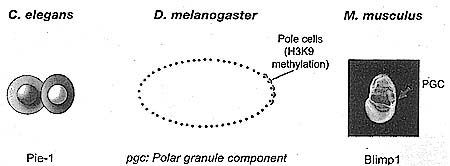 | Figure 4. Germ-Line Development in Different Animal Species
Blimp1
In C elegans, the germ-line lineage (red) is specified after the first division of the zygote by expression of Piel, which confers transcriptional quiescence. The other cell (blue) gives rise to somatic tissues. In D. melanogaster, the precursors of the germ cells are the so-called pole cells contained on one side of the zygote syncytium (i.e., multinucleated); transcriptional quiescence in these cells depends on localized RNA from the gene Pgc. In M. musculus, the earliest precursors of the germ cells are visible by expression of Blimpl at the base of the allantois. Blimpl initiates transcriptional quiescence in these cells.
| Figure 4. Germ-Line Development in Different Animal Species
Blimp1
In C elegans, the germ-line lineage (red) is specified after the first division of the zygote by expression of Piel, which confers transcriptional quiescence. The other cell (blue) gives rise to somatic tissues. In D. melanogaster, the precursors of the germ cells are the so-called pole cells contained on one side of the zygote syncytium (i.e., multinucleated); transcriptional quiescence in these cells depends on localized RNA from the gene Pgc. In M. musculus, the earliest precursors of the germ cells are visible by expression of Blimpl at the base of the allantois. Blimpl initiates transcriptional quiescence in these cells. 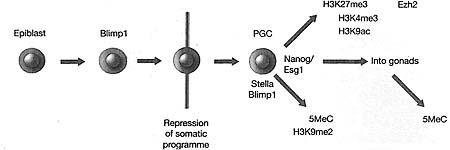 | Figure 5. Early Epigenetic Events during Germ-Cell Specification
Expression of Blimpl in descendants of epiblast cells leads to repression of the somatic gene expression program (red). This is followed by expression of Stella, Nanog, and Esg1; increase in H3K27me3, H3K4me3, and H3K9ac; and loss of H3K9me2 and 5MeC. The primordial germ cells then enter the gonads, after which time further epigenetic reprogramming takes place.
| Figure 5. Early Epigenetic Events during Germ-Cell Specification
Expression of Blimpl in descendants of epiblast cells leads to repression of the somatic gene expression program (red). This is followed by expression of Stella, Nanog, and Esg1; increase in H3K27me3, H3K4me3, and H3K9ac; and loss of H3K9me2 and 5MeC. The primordial germ cells then enter the gonads, after which time further epigenetic reprogramming takes place.  | Figure 6. Derivation of ES and TS Cells from the Blastocyst
ES cells are derived from inner cell mass (ICM) cells and can be kept in culture without differentiating. They can be genetically manipulated while in culture. ES cells can be reintroduced into blastocysts and can then colonize all tissues in the embryo, including the germ line, but excluding the trophoblast cells of the placenta. TS cells can be established similarly into culture from the trophectoderm cells of the blastocyst, and when reintroduced into blastocysts, contribute to placental cell types.
| Figure 6. Derivation of ES and TS Cells from the Blastocyst
ES cells are derived from inner cell mass (ICM) cells and can be kept in culture without differentiating. They can be genetically manipulated while in culture. ES cells can be reintroduced into blastocysts and can then colonize all tissues in the embryo, including the germ line, but excluding the trophoblast cells of the placenta. TS cells can be established similarly into culture from the trophectoderm cells of the blastocyst, and when reintroduced into blastocysts, contribute to placental cell types.  | Figure 7. DtfferentiatJon of ES Ce"s Into Different Cell Types In Vitro
ES cells can be differentiated in vitro under suitable culture conditions into many different cell types, such as neurons, muscle cells, and even germ cells (oocytes). The inset image shows neuroglial cells derived from ES cells in culture.
| Figure 7. DtfferentiatJon of ES Ce"s Into Different Cell Types In Vitro
ES cells can be differentiated in vitro under suitable culture conditions into many different cell types, such as neurons, muscle cells, and even germ cells (oocytes). The inset image shows neuroglial cells derived from ES cells in culture.  | Figure 8. Link between Germ-Line Development and Pluripotency
The oocyte and zygote are totipotent (the oocyte has restrictions imposed by parental imprinting) and so are morula cells up to a certain stage. Pluripotent cells can be derived into culture from the inner cell mass (ICM) cells, primordial germ cells (PGCs), and spermatogonia stem (SS) cells in the neonatal and adult testis. There is thus an intimate link between germ-line cells throughout their development, and pluripotency.
| Figure 8. Link between Germ-Line Development and Pluripotency
The oocyte and zygote are totipotent (the oocyte has restrictions imposed by parental imprinting) and so are morula cells up to a certain stage. Pluripotent cells can be derived into culture from the inner cell mass (ICM) cells, primordial germ cells (PGCs), and spermatogonia stem (SS) cells in the neonatal and adult testis. There is thus an intimate link between germ-line cells throughout their development, and pluripotency.  | Figure 9. Pluripotent Cells Have the Capacity to Reprogram Somatic Cells
ES or EG cells can be fused with somatic cells, resulting in tetraploid hybrids. This leads to epigenetic reprogramming of the somatic nucleus, with changes, for example, in 5meC, H3ac, H4ac, and H3K4me. The tetraploid cells resulting from this fusion and reprogramming also have a pluripotent phenotype: When injected into blastocysts they can contribute to many different cell types in the embryo.
| Figure 9. Pluripotent Cells Have the Capacity to Reprogram Somatic Cells
ES or EG cells can be fused with somatic cells, resulting in tetraploid hybrids. This leads to epigenetic reprogramming of the somatic nucleus, with changes, for example, in 5meC, H3ac, H4ac, and H3K4me. The tetraploid cells resulting from this fusion and reprogramming also have a pluripotent phenotype: When injected into blastocysts they can contribute to many different cell types in the embryo.