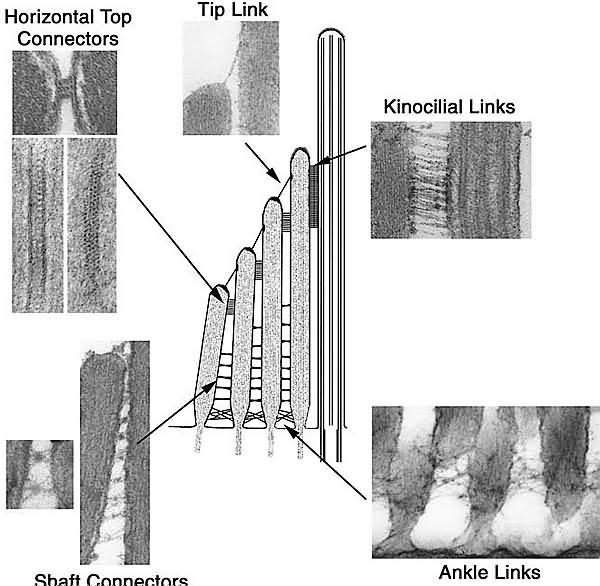
Из-за присутствия множественных связок на развивающихся пучках волосков неясно, когда дефинитивные кончиковые связки впервые появляются в развивающихся волосковых клетках. У птиц, трансдуцирующие токи и загрузка styryl краски FM1-43, постоянного блокатора механотрансдукторов каналов волосковых клеток (Gale et al., 2001), впервые могут быть измерены и выявлены на 12 день эмбриогенеза (Si et al., 2003). Это почти 3 дня спустя после того как косые связи впервые становятся видимыми между кончиками стереоцилий с помощью SEM (E9, что совпадает с началом фазы 1 элонгации) и незадолго до появления уплотнений, которые характеризуют точки инсерций (бляшки прикрепления) кончиковых связок, впервые могут наблюдаться спорадически с помощью TEM (на E13) (Pickles et al., 1991). В utricle мышей, измерения трансдукции токов и загрузки FM1-43 окраски показывают, что трансдукция начинается на ст. E17 (Geleoc and Holt, 2003), спустя 2 дня после первого появления потенциальных кончиковых связок (Denman-Johnson and Forge, 1999). Потенциал кончиковых связок обнаруживается с помощью SEM в IHCs крыс при рождении (Zine and Romand, 1996), в OHCs песчанок на P2 (Souter et al., 1995) и в культивируемых OHCs мышей на эквивалентной стадии P3 (Furness et al., 1989). Косые связки могут обнаруживаться на кончиках стереоцилий в OHCs базового витка улитки мышей на E17.5 (Goodyear et al., 2005), незадолго перед началом загрузки краски FM1-43 (загрузка и детекция трансдуцирующих токов в ответ на деформации пучков волосков (на P0 в OHCs базового витка, Marcotti, Richardson and Kros, unpublished observations).
В развивающейся улитке птиц (Si et al., 2003), трансдуцирующие токи, измеряемые с началом трансдукции, имеют широкую зону действия, малы по амплитуде и обнаруживают незначительные признаки адаптации, а вероятность открытия в покое высока (~0.5). Характерные для взрослых признаки приобретаются в период 5-10 дней. Напротив, зрелые характерные для взрослых свойства аппарата трансдукции в развивающейся utricle мышей приобретаются в течение 24 ч после начала трансдукции (Geleoc and Holt, 2003).
Важная информация о механизмах, лежащих в основе развития и поддержания структуры пучков волосков получена в исследованиях на мутантных мышах и рыбках данио и с открытием генов. необходимых для слуха. т. наз. 'deafness' гены. Эти исследования выявили критические роли для белков клеточной поверхности, ассоциированных с некотормми различными типами связей, вместе с ролями различных миозиновых моторов, поддерживающих белков и актиновых поперечных связей.
Cell surface proteins
Cadherin23 and protocadherin15
5 различных молекул клеточной поверхности ассоциируют с разными типами связей пучков волосков (Table 1). Cadherin23 (Cdh23) с кончиковыми связками, kinocilial связками и временно с боковыми связками (Sollner et al., 2004; Siemens et al., 2004; Michel et al., 2005), protocadherin15 (Pcdh15) кончиковыми и kinocilial связками (Ahmed et al., 2006), а protein tyrosine phosphatase receptor Q (Ptprq) с коннекторами стволов (Goodyear et al., 2003). Very large G-protein coupled receptor 1 (Vlgr1) и usherin ассоциируют с ankle связками (McGee et al., 2006, Adato et al., 2005a). У мышей, Cdh23, Pcdh15, Ptprq и Vlgr1, как известно, необходимы для развития и поддержания структуры пучков волосков (DiPalma et al., 2001a; Wilson et al., 2001; Alagramam et al., 2001; Goodyear et al., 2003; McGee et al., 2006; Yagi et al., 2007).
Cdh23 и Pcdh15 являются членами сверхсемейства cadherin межклеточных адгезивных молекул, трансмембранных белков. которые играют критическую роль во время эмбриогенеза и органогенеза. Классические cadherins взаимодействуют благодаря образованию анти-параллельных димеров и, как известно, обеспечивают основные клеточные процессы, подобные межклеточной адгезии, сортировке и миграции клеток (Tepass et al., 2000). Внеклеточный домен cadherin обладает варьирующими количествами повторяющихся последовательностей или cadherin мотивов, которые необходимы для межклеточной слипчивости. Кальций необходим для стабилизации этих внеклеточных cadherin доменов и для последующей адгезии соседних клеток. Цитоплазматический домен cadherin взаимодействует с цитоскелетом и др. внутриклеточными сигнальными белками (Goodwin and Yap, 2004). Cdh23 и Pchd15 отличаются от классических cadherins. Они обладают многочисленными внеклеточными cadherin повторами (EC домены) в своих эктодоменах (El-Amraoui and Petit, 2005), отсутствием консенсусных R1 и R2 сайтов связывания для β-catenins (Imamura et al., 1999) в своих внутриклеточных доменах и обладают класса I PDZ-binding motifs (PBMs) на C-конце своих цитоплазматических хвостов (Ahmed et al., 2001; Boлda et al., 2002; Bork et al., 2001; Siemens et al., 2002).
Cdh23 характеризуется чрезвычайно длинным внеклеточным доменом с 27 EC доменами, трансмембранной областью и коротким цитоплазматическим доменом с отсутствием сходства с какими-либо известными белками (Di Palma et al., 2001b). Эти изоформы Cdh23 экспрессируются во внутреннем ухе мышей, изоформы A, B и C (Di Palma et al., 2001b; Bork et al., 2001; Michel et al., 2005; Siemens et al., 2002). Изоформа A содержит 27 EC доменов, изоформа B имеет 7 EC доменов. а изоформа C представлена только цитоплазматическим доменом (Lagziel et al., 2005). Дополнительные сплайс-варианты отличаются своими внутриклеточными регионами благодаря присутствию или отсутствию последовательности. кодируемой exon 68, вставка в 35 аминокислот обнаруживается в цитоплазматическом домене (Siemens et al., 2002, Lagziel et al., 2005; Michel et al., 2005). Изоформа C, если экспрессируется как стабильный белок, то может конкурировать с др. изоформами Cdh23 за цитоплазматические партнеры по связыванию (Michel et al., 2005; Lagziel et al., 2005). Исследования по иммунофлюоресценции с антителами против или внутри- или внеклеточных доменов показали, что Cdh23 экспрессируется на высоких уровнях во время ранних стадий развития волосяных пучков и ассоциирует как с временными боковыми связями, так и с kinocilial связками (Boёda et al., 2002; Michel et al., 2005; Siemens et al., 2004). По мере развития пучков волосков Cdh23 постепенно ограничивается кончиком стереоцилий (Michel et al., 2005; Lagziel et al., 2005), где он может оставаться ассоциированным с кончиковыми связками (Siemens et al., 2004).
Pcdh15 имеет 11 EC доменов одиночный трансмембранный домен и цитоплазматический домен, заканчивающийся классом I, C-терминальным,
PBM (Demontis et al., 2006). RT-PCR эксперименты показали, что мРНК, кодирующие до 24 различных изоформ Pcdh15, могут экспрессироваться в развивающемся внутреннем ухе (Ahmed et al., 2006). Они распадаются на 4 класса изоформ, 3 из которых, CD1, CD2 и CD3, имеют разные внутриклеточные домены. 4-й класс лишен трансмембранного домена и скорее всего секретируется. Антитела, специфичные для трех трансмембранных форм Pcdh15 показывают, что CD1 изоформа экспрессируется униформно по поверхности развивающегося пучка волосков, но отсутствует на самом кончике зрелых стереоцилий и что CD2 экспрессируется в kinocilium и развивающихся, но не зрелых стереоцилиях и что CD3 экспрессируется на кончиках стереоцилий (Ahmed et al., 2006). Распределения CD1 и CD3 таковы, что они оказываются ассоциированными с верхним или нижним концом кончиковых связок, соотв.
Фенотипы мышей с мутациями или в Cdh23 (Waltzer mice, v) или вPcdh15 (Ames waltzer, av) согласуются с выполняемыми этими белками ролями в поддержании слипчивости элементов пучков волосков (DiPalma et al., 2001a; Alagramam et al., 2001). Дезорганизация и фрагментация пучков волосков в отдельные глыбки стереоцилий вместе со смещенным киноцилием являются общим свойством пучков волосков у этих мутантов (Fig. 2A, B). Однако, необходимо отметить, что имеются ранжированные по высоте ряды стереоцилий внутри индивидуальных глыбок и что стереоцилии внутри индивидуальных групп, по-видимому, связаны вместе, указывая тем самым, что имеется некоторая степень перекрывания процессов адгезии между стереоцилиями. Расходящиеся раструбом пучки волосков также являются признаком мутантов
sputnik и orbiter рыбок данио (Nicolson et al., 1998) , которые имеют мутации в
Cdh23 и Pcdh15 соотв. (Ernest et al., 2000; Seiler et al., 2005).
Ptprq
Ptprq является рецептор-подобной inositol lipid фосфатазой (Oganesian et al., 2003). Она была первоначально идентифицирована как hair-cell antigen (HCA) в скрининге с моноклональными антителами на белки, специфичные для волосковых клеток (Richardson et al., 1990; Goodyear et al., 2003). Ptprq имеет эктодомен, содержащий 18 fibronectin type III (FN3) повтора, один проход трансмембранной области и внутриклеточный домен, который обладает активностью против широкого спектра inositol phospholipid субстратов (Oganesian et al., 2003). У мышей альтернативный сплайсинг и использование альтернативных промоторов генерируют три изоформы Ptprq; форму полной длины, с отсутствием внутриклеточного каталитического домена, связанного с мембранным эктодоменом и не связанная с мембраной цитоплазматическая форма (Seifert et al., 2003).
Экспрессируемый с самых ранних стадий развития пучков волосков внутреннего уха птиц (Bartolami et al., 1991), Ptprq впервые обнаруживается на стереоцилиях мышей пучков волосков спустя 1-3 дня после того, как впервые обнаруживаются пучки (Goodyear et al., 2003). В OHCs базального завитка внутреннего уха мышей, Ptprq экспрессируется лишь временно во время периода примерно в 2 недели с E18.5 по P15, хотя он экспрессируется и в зрелых пучках волосков всех др. типов волосковых клеток мышей. У трансгенных мышей, лишенных Ptprq, наблюдаются варьирующие степени дезорганизации пучков и укорочения пучков в базальных регионах улитки на ст. P1 (Goodyear et al., 2003). На P8, большинство стереоцилий на IHCs отсутствуют, неправильно расположены или слиты вместе. Стереоцилии на OHCs также или теряются или неправильно расположены, но редко сливаются вместе. Если присутствуют, то пучки волосков OHCs короче, чем в норме и более U-образны
(Fig. 2F). Волосковые клетки во всем остальном выглядят нормально, по крайней мере до P22, после чего кортиев орган дегенерирует. Напротив, вестибулярные волосковые клетки мутантов
Ptprq затрагиваются мало; они доживают до взрослого периода и мыши не обнаруживают вестибулярных фенотипических отклонений, хотя пучки волосков на постнатальных стадиях развития короче, чем в контроле (Goodyear and Richardson, unpublished observations). Несмотря на потерю коннекторов стебельков волосков в вестибулярных пучках мутантов
Ptprq стереоцилии не обнаруживают признаков расширения, указывая тем самым, что связки этого типа не нужны для сцепления стереоцилий. Ptprq необходим, однако, для полного созревания и поддержания пучков волосков в улитке (Goodyear et al., 2003). Inositol фосфолипиды известны как ключевые регуляторы актинового цитоскелета (Takenawa and Itoh, 2001) и Ptprq может регулировать локальное содержание inositol фосфолипида и, следовательно, регулировать скорость обращения мембран и актина на апикальном конце волосковых клеток (Goodyear et al., 2003). Функциональное перекрывание может компенсировать потерю Ptprq и объяснять кажущиеся различия в чувствительности разных типов волосковых клеток.
Vlgr1
Vlgr1 является членом secretin семейства (family 2 or B) G-protein-coupled рецепторов и является одним из самых больших извесных белков клеточной мембраны (McMillan et al., 2002). Он представлен очень крупных эктодоменом, состоящим из 34 кальций связывающих Calx-повторов, одного LamG/TspN/PTX домена и ряда EAR/EPTP повторов и имеет 7-раз пронизывающий трансмембранный домен, характерный для G-protein coupled рецепторов. Vlgr1 недавно был идентифицирован как антиген ankle связок (ALA, Goodyear and Richardson , 1999; McGee et al., 2006). Хотя ALA экспрессируется в течение всей жизни пучков волосков у кур, Vlgr1 экспрессируется только до P11 на пучках волосков внутреннего уха мышей. Обычная онтогенетическая потеря Vlgr1 с волосковых клеток мышей коррелирует с исчезновением ankle связок из пучков волосков и ankle связки полностью отсутствуют в улитке мышей, у которых 7 трансмембранный домен Vlgr1 делетирован (McGee et al., 2006). Пучки волосков в улитке
Vlgr1 мутантов проходят через ранние стадии развития, но внезапно теряют свою характерную плотную V-образную форму и становятся плохо выровненными вскоре после того, как ankle связки обычно становятся морфологически различимы (Johnson et al., 2005; McGee et al., 2006). Vlgr1 , по-видимому, участвует в последних стадиях генеза пучков волосков и без сомнения необходим во время короткого, критического периода в раннем постнатальном развитии волосковых клеток улитки. Напротив, пучки волосковых клеток преддверия не обнаруживают подобной абсолютной потребности в Vlgr1 для своего развития и жизнеспособности (McGee et al., 2006).
Usherin
Мутации в гене, кодирующем usherin
USH2A, являются наиболее распространенной генетической формой глухоты/слепоты при Usher синдроме (Eudy et al., 1998; Van Wijk et al., 2004). Ген
USH2A кодирует две изоформы, короткую и длинную (Eudy et al., 1998; Van Wijk et al., 2004). Короткая изоформа, isoform a, состоит из N-терминального сигнального пептида, сопровождаемого одним laminin G-like доменом (LamGL), одним laminin N-terminal доменом (LamNT), 10 laminin-mngf EGF-like модулями и двумя наборами FN3 повторов, разделяемых двумя laminin G (LamG) доменами. Более длинная изоформа, isoform b, содержит дополнительно к ранее описанным функциональным доменам, два LamG domains, 28 FN3 повторов, трансмембранную область и цитоплазматический домен с класса I PBM на её C-терминальном конце (Eudy et al., 1998; Van Wijk et al., 2004). В волосковых клетках улитки, usherin локализуется на стереоцилиях и в синаптическом регионе (Reiners et al., 2005; Liu et al., 2007) и, как недавно было подтверждено, является компонентом ankle связок (Adato et al., 2005a). Пространственно-временной паттерн экспрессии usherin во внутреннем ухе мышей сходен с таковым, описанным для ankle связок. На E18 usherin обнаруживается вдоль всей поверхности стереоцилий OHC, а на ст. E20 ограничивается основанием стереоцилий как внутренних, так и OHCs. Usherin затем начинает постепенно уменьшаться и исчезать из волосковых клеток улитки на ст. P10, хотя он сохраняется во зрелых вестибулярных волосковых клетках (Adato et al., 2005a). Фенотипы usherin нулевых мутантных мышей ещё не описаны.
Myosin motors
Миозины являются молекулярными моторами, которые используют актиновые филаменты в качестве субстрата, генерируя силы и движение в ответ на гидролиз АТФ (Henn & De La Cruz, 2005; Mooseker & Cheney, 1995). Все миозины имеют консервативную область головки с местами для связывания актина и АТФ , шеечная область состоит из одной или нескольких богатых isoleucine и glutamine областей (IQ домены) и C-терминальной, класс-специфической хвостовой области с рядом различных мотивов. Мутации в трех нешаблонных миозинах myosin VI, myosin VIIa и myosin XVa, как известно, вызывают дефекты развития пучков волосков (Avraham et al., 1995; Gibson et al., 1995; Anderson et al., 2000).
Myosin VI необычен, т.к. он единственный из известных моторных миозинов, который движется в направлении сужающегося или минус конца актиновых филамент (Wells et al., 1999). Все др. миозины движутся в направлении колючего или плюс конца актиновых филамент, предпочтительного конца добавления актиновых мономеров. Миозин VI присутствует на высоких уровнях в цитоплазме и кутикулярной пластинке волосковых клеток и присутствует также в стереоцилиях (хотя уровни в пучках волосков могут варьировать в зависимости от вида) и может быть обнаружен в волосковых клетках вскоре после рождения (Hasson et al., 1997). У
Snell's waltzer мышей с эффективной нулевой мутацией в миозине VI, дефекты пучков волосков очевидны при рождении и включают нарушения формы пучков волосков (Self et al., 1999). Затем становятся видимы гигантские слитые стереоцилии (see Fig. 2H) и было предположено, что миозин VI может, как направленный к минус концу мотор, связывать мембрану вокруг основания каждого развивающегося стереоцилия с богатой актином кутикулярной пластинкой (Cramer, 2000).
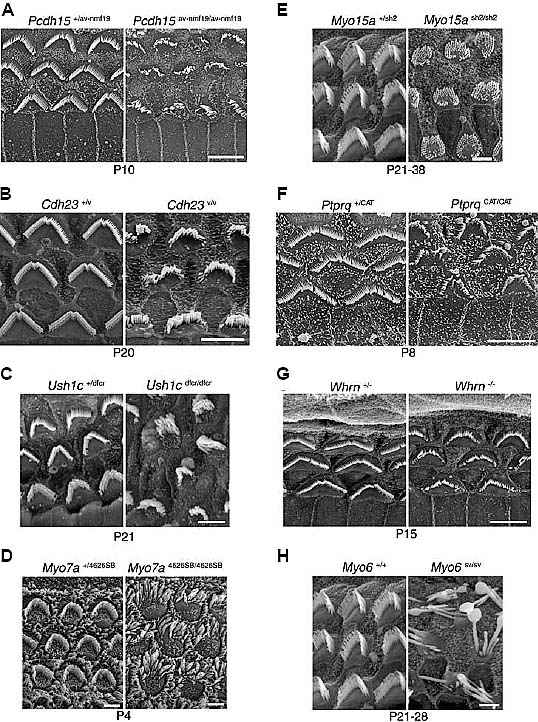 Fig. 2. Hair bundle morphology in mutant mouse strains. Scanning electron micrographs showing the hair bundles of cochlear outer hair cells from mice with mutations in (A) protocadherin 15, (B) cadherin 23, (C) harmonin (D) myosin 7a, (E) myosin XVa, (F) Ptprq, (G) whirlin and (H) myosin VI. In each pair of micrographs the image on the left is from a heterozygous or a wild type
control and that on the right is from the homozygous mutant. Mutations in orthologues of the Usher Type I syndrome genes generate splayed hair bundles (A-D), mutations in myosin XVa, whirlin and Ptprq have short hair bundles (E-G) and mutations in myosin VI cause hair bundle fusion (H). Images are adapted from Washington III et al., 2005 (A), Holme and Steel, 2002 (B,D), Johnson et al., 2003
(C), Karolyi et al., 2003 (E,H), Mburu et al., 2003 (G) and Goodyear et al., 2003 (F) with permission from the authors and the publishers (A,B,D, Elsevier; CEH, Oxford University Press; F, Society for Neuroscience; G, Nature Publishing Group). Bars, 5 µm.
Fig. 2. Hair bundle morphology in mutant mouse strains. Scanning electron micrographs showing the hair bundles of cochlear outer hair cells from mice with mutations in (A) protocadherin 15, (B) cadherin 23, (C) harmonin (D) myosin 7a, (E) myosin XVa, (F) Ptprq, (G) whirlin and (H) myosin VI. In each pair of micrographs the image on the left is from a heterozygous or a wild type
control and that on the right is from the homozygous mutant. Mutations in orthologues of the Usher Type I syndrome genes generate splayed hair bundles (A-D), mutations in myosin XVa, whirlin and Ptprq have short hair bundles (E-G) and mutations in myosin VI cause hair bundle fusion (H). Images are adapted from Washington III et al., 2005 (A), Holme and Steel, 2002 (B,D), Johnson et al., 2003
(C), Karolyi et al., 2003 (E,H), Mburu et al., 2003 (G) and Goodyear et al., 2003 (F) with permission from the authors and the publishers (A,B,D, Elsevier; CEH, Oxford University Press; F, Society for Neuroscience; G, Nature Publishing Group). Bars, 5 µm.
Myosin VI, как известно, играет жизненно важную роль в апикальном эндоцитозе поляризованных эпителиальных клеток (Buss et al., 2001) , а исследования на мутантах рыбок данио
satellite с мутациями в
myo6b подтверждают, что он поддерживает целостность апикальной поверхности волосковых клеток (Seiler at el., 2004).
Myosin VIIa щироко распределен по всем волосковым клеткам и может концентрироваться в области ankle связок пучков волосков у некоторых видов (Hasson et al., 1997). Shaker1 мыши имеют мутации в гене, кодирующем myosin VIIa (Gibson et al., 1995). При более тяжелых аллелях Shaker1, подобных по эффективности нулевым, sh6J и sh4626SB, наблюдаются тяжелые нарушения пучков волосков вскоре после рождения, при этом пучки волосков часто расщепляются на множественные маленькие групки, которые случайно расположены на клеточной поверхности (see Fig. 2D) (Self et al., 1998). Сходный раструбный фенотип пучков волосков обнаруживается также у мутантов рыбок данио, mariner (Ernest et al., 2000).
Myosin XVa обнаруживается в телах волосковых клеток и концентрируется на кончиках стереоцилий, где его количество пропорционально длине стереоцилия, так что самые длинные стереоцилии имеют наивысшие концентрации (Anderson et al., 2000; Belyantseva et al., 2003; Rzadzinska et al., 2004). У shaker2 с рецессивными мутациями в гене MyoXVa, белок отсутствует в пучках волосков и стереоцилии аномально коротки, хотя ряды стереоцилий всё ещё обнаруживают признаки ранжирования по высоте (see Fig. 2E) (Anderson et al., 2000; Beyer et al., 2000). Пучки волосков с ранжированными по высоте рядами стереоцилий обнаруживаются также у мышей с мутациями или в myosin VI или myosin VIIa, но мутации каждого из трех описанных миозинов генерируют самостоятельные фенотипы пучков волосков; слитые у myosin VI мутантов, фрагментированные и дезорганизованные у myosin VIIa мутантов и короткие у myosin XVa мутантов.
PDZ-domain and PDZ-domain-binding proteins
Белки, содержащие PDZ (postsynaptic density, discs-large and zona-occludens) домены, обычно считают, что они организуют ассоциированные с мембранами мультибелковые комплексы (Zimmermann, 2006). Мутации двух PDZ-доменовых белков whirlin и harmonin, как известно, затрагивают развитие пучков волосков у мутантных мышей (Holme et al., 2002, Mburu et al., 2003; Johnson et al., 2003), т.к. вызывают дефекты в PDZ связывающем домене для белка, известного как Sans (Weil et al., 2003; Kikkawa et al., 2003).
Два исследования показали. что whirlin экспрессируется лишь временно в развивающихся пучках волосков, локализуясь как на кончиках. так и основаниях стереоцилий (Kikkawa et al., 2005; Delprat et al., 2005). У мышей whirlin сначала появляется на кончиках стереоцилий самого длинного ряда и появляется последним на кончиках стереоцилий самого короткого ряда (Kikkawa et al., 2005) и, по-видимому, теряется в той же последовательности, сначала из самых длинных, а последним из самых коротких. Whirlin иммунореактивность, однако, присутствует в кончиках стереоцилий в зрелых улитках крыс и мышей (Belyantseva et al., 2005; van Wijk et al., 2006). Прогрессирующее появление whirlin на кончиках стереоцилий происходит во время ранних постнатальных стадий развития пучков волосков после инициального развития ранжированных по высоте рядов стереоцилий. У мышей с крупной длецией гена whirlin пучки волосков имеют нормальную ориентацию и имеют ранжированные по высоте ряды стереоцилий, но обладают аномалиями, подобными тем, что наблюдаются у shaker2 мышей с мутациями в гене myo15a , аномально короткими пучками (see Fig. 2G) (Holme et al., 2002). Короткая и длинная изоформы whirlin транскрибируются с помощью альтернативного сплайсинга с длинной формой, содержащей proline-rich (PR) домен и три PDZ домена, а короткая C-терминальная форма содержит только PR и третий PDZ домен. Фенотип whirlin может быть нормализован за счет избыточной экспрессии только короткой формы (Mburu et al., 2003). Whirlin взаимодействует с третим PDZ доменом myosin XVa, он отсутствует в кончиках стереоцилий у мышей shaker2, а избыточная экспрессия дикого типа myosin XVa в волосковых клетках мышей shaker2 рекрутирует эндогенный whirlin на кончики стереоцилий и восстанавливает элонгацию пучков волосков (Belyantseva et al., 2005). Имеются доказательства, что миозин XVa поставляет whirlin на кончики стереоцилий и что оба белка необходимы для запрограммированной элонгации стереоцилий, хотя ни один из них, по-видимому, не нужен для инициальных стадий морфогенеза пучков волосков.
Недавно подтверждено, что ассоциированная с мембраной guanylate kinase (MAGUK), p55 и белок 4.1R также взаимодействуют с whirlin и могут вместе формировать комплекс, ответственный за обеспечение полимеризации актина и развития стереоцилий (Mburu et al., 2006). Домен PDZ1 whirlin может также взаимодействовать с цитоплазматическими хвостами usherin и Vlgr1, оба из которых содержат C-терминальный класса I PBM (van Wijk et al., 2006) , и было предположено, что whirlin может участвовать в закреплении ankle связок посредством их ассоциации с usherin и Vlgr1, а также с myosin VIIa (van Wijk et al., 2006; Adato et al., 2005b; Kremer et al., 2006).
Имеются множественные изоформы harmonin, которые могут быть расклассифицированы на три самостоятельные группы, a, b и c, с изоформой harmonin b преимущественно экспрессируемой во внутреннем ухе (Verpy et al., 2000). Harmonin b имеет 3 PDZ домена, 2 двухспиральных домена, которые делают возможной димеризацию, богатую proline/serine/threonine область и сам содержит C-терминальный PBM. In vitro harmonin b обладает активностью связывания актина, может взаимодействовать с хвостом миозина VIIa посредством своего PDZ1 домена и с Cdh23 и Pcdh15 посредством своего PDZ2 домена (Boёda et al., 2002; Adato et al., 2005b). Harmonin b экспрессируетсяв пучках волосков с начала своего появления и его локализация в этой структуре зависимт от присутствия myosin VIIa (Boлda et al., 2002). Мыши Jackson deaf circler и deaf circler 2 имеют мутации в гене harmonin (Ush1c) , которые затрагивают экспрессию harmonin a и b
и harmonin b, соотв. (Johnson et al., 2003). В обоих случаях имеются дефекты в развитии пучков волосков, обнаруживающие признаки дезорганизации и расширения раструбом стереоцилий (see Fig. 2C), что не полностью отличается от наблюдаемого у мутантных по myosin VIIa, Cdh23 или Pcdh15 мышей.
Sans является каркасным белком с тремя N-терминальными ankyrin повторами, с центральной областью, сопровождаемой sterile alpha motif (SAM) доменом и class 1 PBM на С-конце (Nourry et al., 2003; Sedgwick and Smerdon, 1999). Анкириновые повторы, как известно, участвуют в связывании белков, но, по-видимому, не участвуют в белковых взаимодействиях, осуществляемых Sans (Adato et al., 2005b). Вместо этого, Sans соединяется с PDZ1 aи PDZ2 harmonin посредством своего SAM домена, тогда как центральная область Sans обеспечивает связывание с доменами в хвосте myoVIIa (Adato et al., 2005b). В развивающемся внутреннем ухе, Sans локализуется в апикальной области тел волосковых клеток под кутикулярной пластинкой волосковых клеток преддверия и улитки, но не в стереоцилиях. Sans иммунореактивность особенно сильна в области под базальным тельцем киноцилия в OHCs (Adato et al., 2005b) и Sans обнаруживается также в киноцилии (Adato et al., 2005b). Под кутикулярной пластинкой концентрируются микротрубочки и пузырьки и актиновые филаменты в направлении стереоцилий и киноцилия (Reiners et al., 2006; El-Amraoui and Petit 2005; Adato et al., 2005b). У Jackson shaker мышей мутации в Sans вызывают дефекты в развитии пучков волосков (Kikkawa et al., 2003).
Actin cross linkers
Два поперечно связывающих актин белка экспрессируются в актиновой сердцевине развивающихся и зрелых стереоцилий, espin и I-plastin (fimbrin) (Zine and Romand, 1996, Zheng et al., 2000; Li et al.,
2004) и третий, T-plastin,экспрессируется лишь временно во время развития пучков волосков (Daudet and Lebart, 2002). Имеются 4 изоформы espin, экспрессирующиеся во внутреннем ухе, все они имеют С-терминальный актин связывающий домен и Wiskott-Aldrich Syndrome protein homology 2 (WH2) домен и они обнаруживают сложные вариации своих временных паттернов экспрессии во время развития улитки (Sekerkova et al., 2006) с самой длинной изоформой (espin1 с 8 ankyrin повторами) и с самой короткой (espin 4 с PIP2 связывающей активностью), становящимися предоминантными во время более поздних стадий созревания пучков волосков. Espin может выявляться в пучках волосков вскоре поле того, как они впервые проявляются (Li et al., 2004), а уровни espin в зрелых пучках волосков коррелируют с длиной пучков волосков (Loomis et al., 2003). Уровни экспрессии espin , как было установлено экспериментально, регулируют длину микроворсинок в культивируемых эпителиальных клетках (Loomis et al., 2003) , а избыточная экспрессия espin в волосковых клетках улитки вызывает удлинение пучков волосков (Rzadzinska et al., 2005). Избыточная экспрессия espin в поддерживающих клетках улитки может приводить к появлению структур, которые напоминают пучки волосков. Эти исследования подтверждают критическую роль espin в развитии пучков волосков, и дефекты пучков волосков, описанные в улитке espin-дефицитных jerker мышей (Zheng et al., 2000) на ст. P12 (Sjostrom and Anniko, 1992). Существует, однако, определенная степень функционального перекрывания среди актин-связывающих белков. Последствия делеции одного или более членов plastin-семейства на развитие пучков волосков пока неизвестны.
Other proteins likely to be required for hair-bundle development
Изучение генов, необходимых для слуха у людей выявило ряд интересных белков, которые на базе своей локализации и известных функций, безусловно участвуют в различных аспектах развития и поддержания структуры пучков волосков. Они включают F-actin и TRIO-binding protein, TRIOBP, мутации которых вызывают prelingual потерю слуха в локусе несиндромальной потери слуха DFNB28 (Riazuddin
et al., 2006; Shahin et al., 2006), человеческом ортологе diaphanous, HDIA, нижестоящей мишени RhoA, которая в случае мутации вызывает прогрессирующую потерю слуха по локусу DFNA1 (Lynch et al., 1997) и myosin IIIa, неконвенционного миозина, который располагается на дистальных концах стереоцилий (Schneider et al., 2006) и является мутантным при прогрессирующей с позним началом рецессивной формой глухоты DFNB30 (Walsh et al., 2002). DOCK4, guanine nucleotide exchange factor (GEF) для Rho GTPase и мощного Rac активатора (Yan et al., 2006) , который был идентифицирован на базе его взаимодействий с harmonin при yeast 2-hybrid скрининге, может быть необходим для развития пучков волосков, т.к. содержит vezatin, трансмембранный белок слипчивых соединений, который взаимодействует с myosin VIIa и локализуется в ankle области пучка волосков (Kussl-Andermann et al., 2000). Др. белки, необходимые для развития или поддержания пучков волосков, включают radixin (Kitajiri et al., 2004), chloride intracellular channel 5 (Clic5, Gagnon et al., 2006), трансмембранный белок, экспрессируемый во внутреннем ухе (Tmie, Mitchem et al., 2002) и 4 раза пронизывающий мембрану белок, экспрессируемый в стереоцилиях волосковых клеток (Tmhs, Longo-Guess et al., 2005).
Control of hair-bundle form
Пучки волосков внутреннего уха обнаруживают огромное разнообразие формы и размеров. В гребешках полукружных каналов они приблизительно конической формы и чрезвычайно высокие , со стереоцилиями, которые могут быть до 40 microns или более в длину, тогда как в улитке они имеют W- или V-форму и могут быть очень короткими стереоцилиями (1 micron в высоту в базальном витке у некоторых видов). Даже внутри одного органа может существовать значительная изменчивость в морфологии пучков волосков. Пути, которые могут контролировать форму пучков волосков, далеки от решения, хотя недавние указания. подтверждают воль пути передачи сигналов Wnt. Усиление экспрессии активированного β-catenin в basilar papilla птиц вызывает образование участков волосковых клеток с четким вестибулярным фенотипом (Stevens et al., 2003). Предварительные данные также показывают, чтто передача сигналов hedgehog может контролировать спецификацию типа волосковых клеток в улитке млекопитающих. У мышей, которые экспрессируют только укороченную репрессорную форму Gli3, транскрипционного фактора, который может действовать как активатор, так и репрессор передачи сигналов hedgehog, волосковые клетки улитки приобретают фенотип вестибулярных с конической формой пучков волосков, противоположной характерной V- илиr W-образной форме слуховых пучков волосков
(Driver et al., ARO abstract, 2006).
Conclusion
Rapid progress has been made in our understanding of the molecular mechanisms underlying the process of hair-bundle development, due in large part to the study of mouse and zebrafish mutants and the discovery of genes required for hearing, many of which encode proteins required for the development and maintenance of hair-bundle structure. Nonetheless, there is still much to be learned and many a puzzle to
solve. Notably few, if any, genes have been identified that affect the very earliest stages of hair-bundle development and the initiation of stereociliary ranking. In most mutants that have been described to date, the hair bundle forms and has height-ranked rows of stereocilia even though the overall shape, form
and organisation of the hair bundle is disrupted. It is possible that the genes controlling the very early stages of hair-bundle development are also essential for basic fundamental processes and required for normal development of the embryo. Mutations in these genes may be lethal. Dissecting the interaction pathways and determining which of the potential protein-protein interactions revealed by in vitro pull down assays are
relevant for normal development will be one important task for the future, as will determining the pathways that control the final form, shape, and physiological properties of each hair bundle, both in the different sensory organs and along the length of the cochlea.
Сайт создан в системе
uCoz