C одной стороны, гипотеза гемангиобластов всё ещё дискуссионна. BL-CFCs могут не быть единственно, определяющими судьбы эндотелиальных и гематопоэтических клеток, но могут также давать гладкомышечные клетки (Yamashita et al., 2000; Ema et al., 2003). Flk1
клетки, как было установлено, также дают несосудистую ткань в дополнение к гематопоэтическим и эндотелиальным предшественникам, как показало картирование с помощью Cre клеточных судеб и Flk1:lacZ репортерных линий мышей (Motoike et al., 2003; Ema et al., 2006). Отслеживание клонов оказалось неспособным идентифицировать эквиваленты гемангиобластов с гематопоэтическим и эндотелиальным потенциалом во время гаструляции у эмбрионов мышей, используя комбинацию 4 разных клональных маркеров (Kinder et al., 1999). В первичной полоске эмбрионов отмечается 65% и 23% вклад клеток из первичной полоски и и 22% и 42% вклад клеток из проксимальной части эпибласта в кровяные островки и вителлиновых эндотелий, соотв. У middle streak эмбрионов, отмечается 4% и 48% вклад клеток от P2 области первичной полоски и 0.3% и 13.6% вклад от P3 области первичной полоски в кровь и эндотелий, соотв. Эти данные говорят, что существует различная временная потребность в клетках внеэмбриональных кровяных островков и сосудистых предшественников (Kinder et al., 1999). Используя систему ко-культуры OP-9, Furuta с коллегами выявили эндотелиальные предшественники, формируемые уже на ст. E5.5 и гематопоэтические клетки после E6.5, но не выявили гемангиобластов (Furuta et al., 2006). Эти наблюдения подтверждают, что эндотелиальные и гематопоэтические клетки возникают независимо из мезодермальных клеток, но они пришли к др. заключению, согласно которому обе клетки развиваются первыми у эмбрионов мышей (Kinder et al., 1999; Furuta et al., 2006). Несмотря на это эти исследования не исключают существования гемангиобластов у эмбрионов на стадии ранней и средней полоски из-за чувствительности используемого метода. Все эти наблюдения на эмбрионах рыбок данио (Vogeli et al., 2006) поддерживают идею, что небольшая фракция эндотелиальных и гематопоэтических клеток возникает из гемангиобластов, а др. независимо из мезодермальных клеток у эмбрионов мышей и рыбок данио.
Накапливаются доказательства, подтверждающие, что гемангиобласты могут существовать у взрослых (rev. Bailey and Fleming, 2003; Schatteman and Awad, 2004). Jiang с коллегами изолировали мультипотентные мезенхимные стволовые клетки из костного мозга взрослых мышей и людей и установили, что эти стволвые клетки могут продуцировать зрелые эндотелиальные клетки
in vitro и in vivo (Jiang et aL, 2002; Reyes et aL, 2002). Антиген стволовых клеток человека CD133 экспрессируется в CD34
+ гематопоэтических клетках, но не в зрелых эндотелиальных клетках. Loges с сотр. нашли, что одиночные человеческие CD133+ гемангиопоэтические клетки из мобилизированной периферической крови имеют двойную судьбу давать нейтрофилы или эндотелиальные клетки при использовании ретровирусной ген маркирующей техники
in vitro (Loges et aL, 2004). Клональный анализ установил, что гематопоэтические стволовые клетки, происходящие из костного мозга взрослых мышей и людей, обладают потенциалом дифференцироваться в функциональные эндотелиальные клетки у мышей (Grant et aL, 2002; Bailey et aL, 2004; Cogle et aL, 2004). Более того, трансплантированные сосудистые клетки их взрослой торакальной аорты или нижней вены могут участвовать в генерации гематопоэтических клеток у летально облученных реципиентов (Montfbrt et ah, 2002), Эти исследования демонстрируют, что гемангиобласты персистируют во взрослой жизни, тогда как молекулярные особенности и физиологическое значение их в костном мозге мышей и людей остаются неясными.
MOLECULAR PATHWAYS INVOLVED IN HEMANGIOBLAST DEVELOPMENT
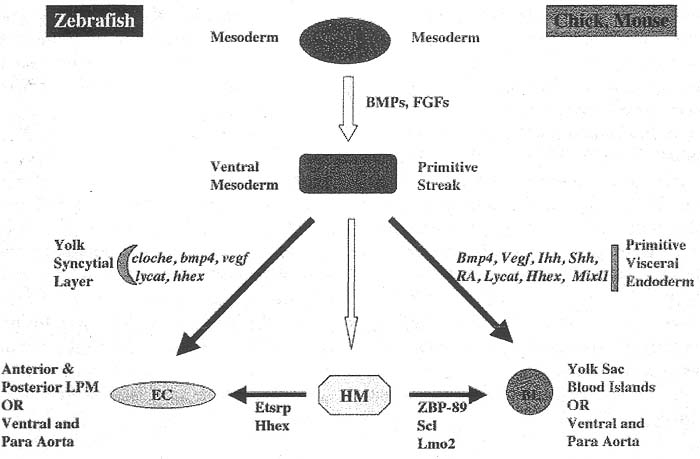
Несмотря на наши знания об гемангиобластах всё ещё в основном остаются неизвестными молекулярные механизмы формирования гемангиобластов из Bry+ мезодермы. VEGF, который родственен platelet-derived growth factor, и действует паракринным образом, секретируется энтодермой (Breier et aL. 1992; Breier and Risau, 1996; Porcher et aL, 1996), в то время как его тирозин киназные рецепторы ко-экспрессируются с мезодермальными клетками, ангиобластами и эндотелиальными клетками (Millauer et aL, 1993; Yamaguchi et aL, 1993; Fong et aL, 1995). Мыши, мутантные по VEGF, Fik1 и Plcg1,имеют пониженные количества эндотелиальных и гематопоэтических предшественников, это указывает на то. что передача сигналов VEGF/Flk1 является важной для обоих клонов (Carmeliet et aL, 1996; Ferrara et aL, 1996; Shalaby et aL. 1995; Liao et aL, 2002). Гомозиготные Flk1 мутантные ESCs, однако способны генерировать как эндотелиальный, так и гематопоэтический клоны и продуцировать немного BL-CFCs в in vitro системе дифференцировки ESC (Schuh et aL. 1999; Hidaka et aL, 1999), Следовательно, формирование BL-CFCs является, по крайней мере, частично независимым от передачи сигналов VEGF/Flk1. Сходным образом Scl мутантные мыши являются бескровными (bloodless), но у них относительно нормально формируются сосуды, хотя они и имеют ангиогенные дефекты в желточном мешке (Robb et aL, 1995; Shivdasani et aL, 1995; Visvader et aL, 1998). Scl не является обязательным для образования BL-CFCs и играет существенную роль в развитии гематопэтических и эндотелиальных клонов в EBs (Faloon et aL, 2000; Robertson et aL, 2000; D'Souza et aL, 2005). LM02, SCL-binding партнер, необходим для эритроидного развития и безразличен для образования мезодермальных и эндотелиальных клеток при использовании генного таргетинга у эмбрионов мышей и EBs (Warren et aL, 1994). Эти наблюдения при анализе потери функции у мышиных эмбрионов подтверждены наблюдениями над scl и lmo2 morphant эмбрионами при использовании антисмыслового morpholino нокдауна у рыбок данио (Dooley et aL, 2005; Patterson et aL, 2005, 2007; Zhou et aL, 2005; Qian et aL, 2007). Эктопическая экспрессия scl или scl и lmo2 у эмбрионов рыбок данио привела к экспансии как эндотелиальных, так и гематопоэтических маркеров за счет др. неаксиальных мезодерм, указывая тем самым, что scl и lmo2 могут быть достаточными для генерации гемангиобластов (Gering et al., 1998, 2003). Однако необходимо определить, как scl и lmo2 вносят вклад в развитие гемангиобластов. Runx1 необходим для дефинитивного, но не для примитивного гематопоэза у мышей (Wang et al., 1996). Runx1 безразличен также для генерации BL-CFCs в мышиных EBs дозово-зависимым способом (Lacaud et al., 2002, 2004). Следовательно, каждый из этих путей участвует, но не является абсолютно необходимым для генерации гемангиобластов. Большинство из этих ранних исследований рассмотрены в обзорах (Keller, 2005; Park et al., 2005) и суммированы на Figure 1. в
Одним из наиболее интригующих вопросов в этой области, какие сигналы управляют спецификацией и генерацией гемангиобластов из мезодермальных клеток бластулы и гаструлы позвоночных. У кур эндотелий вентральной части аорты идентифицирован как обладающий эндотелиальным и гематопоэтическим потенциалом (Pardanaud et al., 1996; Pouget et al.. 2006). Этот гемогенный эндотелий был использован для изучения энтодермальных сигналов в развитии гемангиобластов, т.к. спланхноплевра соседствует с энтодермой, а генерация эндотелия вентральной части аорты зависит от энтодермы. VEGF, basic fibroblast growth factor (bFGF) и transforming growth factor-1 (TGFβ1), как было показано, воспроизводят гемангиопоэтическую индукцию спланхноплевральной мезодермы с помощью энтодермы, тогда как EGF/TGFα могут устранять гемангиопоэтическую способность спланхноплевральной мезодермы с помощью эктодермы (Pardanaud and Dieterlen-Lievre, 1999). Однако эти ранние наблюдения в дальнейшем не были проверены; следовательно, bona fide передачу сигналов от энтодермы в этом процессе ещё предстоит определить.
При поиске индуцирующих факторов гематопоэза у эмбрионов мышей Belaoussoff с коллегами изобрели трансгенную систему культуры эксплантов. Они использовали β-like globin:LacZ в качестве источника маркированных эмбрионов и использовали ферментативное переваривание для отделения примитивной энтодермы и эктодермы. Эктодермальные экспланты затем были рекомбинированы и культивировались с висцеральной энтодермой в коллагеновом геле. Они установили. что первичная энтодерма существенна для генерации как эндотелиального, так и гематопоэтического клонов у эмбрионов до гаструляции и на ст . ранней полоски (Belaoussoff et al., 1998). Позднее они идентифицировали Ihh в качестве секретируемого фактора из первичной энтодермы и его одного достаточно для индукции генерации эндотелиальных и гематопоэтических клонов (Dyer et al., 2001). Передача сигналов hedgehog непосредственно регулирует Scl 3' энхансер во время спецификации гемангиобластов в ранней полоске эмбрионов мышей (Hochman et al., 2006). С др. стороны, Ihh-/-, Ibh-/-/Shh-/- и Smo-/- мутантные эмбрионы дают эндотелиальные и гематопоэтические клоны, т.к. они обнаруживают дефекты ремоделирования сосудов (Byrd et al., 2002; Astorga and Carlsson. 2007). В частности гомозиготные мутантные эмбрионы Smo, сигнального трансдуктора hedgehog, не обнаруживают передачи сигналов hedgehog (Zhang et al., 2001). Следовательно, передача сигналов hedgehog может быть не абсолютно необходимой для, или необходимы дополнительные сигналы для, развития гемангиобластов в кровяных островках желточного мешка у эмбрионов мышей in vivo.
У эмбрионов рыбок данио и лягушек энтодерма не нужна для генерации гематопоэтических и эндотелиальных клонов (Brown et al., 2000; Lawson et al., 2001; Vokes and Krieg, 2002: Jin et al., 2005). Чтобы понять роль энтодермы в гематопоэтическом развитии и развитии ангиобластов, Vokes and Krieg оценивали присутствие экспрессии гематопоэтических и эндотелиальных генов у истощенных по энтодерме гаструлирующих эмбрионов или за счет хирургического удаления энтодермы или за счет воздействия антисмысловых VegT олигонуклеотидов в гаструле лягушек или анимальных шапочках, обработанных bFGF, которые имели мезодерму, но не имели энтодермы (Vokes and Krieg, 2002). Сходным образом некоторые исследователи описали, что эндотелиальные и гематопоэтические клоны присутствуют у генетических мутантов рыбок данио, таких как
one-eyed pinhead, casanova, cyclops и squint, которые обнаруживали полное отсутствие или сильное уменьшение энтодермы (Brown et al., 2000; Lawson et al., 2001; Jin et al., 2005). Кроме того, гематопоэз и васкулогенез наблюдался в Gata4
-/- ESC-производных EBs, которые были лишены висцеральной энтодермы желточного мешка (Bielinska et al., 1996). Следовательно, наблюдение за химерами эктодерма-примитивная энтодерма у мышей оказываются совершенно отличными от таковых у EBs, эмбрионов лягушек и рыбок данио. Необходимо подчеркнуть, что только эктодерма и висцеральная энтодерма, выделенные из эмбрионов на ст. 6.0-6.25 dpc, но не 6.5-6.75 dpc, обнаруживают индукцию гематопоэза и васкулогенеза с помощью висцеральной энтодермы (Beloussoff et al., 1998). Это указывает на то, что энтодермальная индукция во внеэмбриональной области имеет место в течение очень короткого временного интервала, возможно непосредственно перед гаструляцией. Внеэмбриональный yolk syncytial layer (YSL) у рыбок данио, как полагают эквивалентен висцеральной энтодерме мышей (Ho et al., 1999) и выполняет важные роли в формировании паттерна зародышевых слоев у рыбок данио и необходим для образования вентролатеральной мезодермы и индукции генов, связанных с узелком в вентролатеральных маргинальных бластомерах (Chen and Kimelman, 2000). В то время как ген
casanova строго редуцирован у собственно эмбрионов, он обычно экспрессируется или активируется во внеэмбриональном YSL энтодермальных мутантов рыбок данио
casanova, bonnie and clyde и faust (Kikuchi et al.. 2001). Интересно, что вентролатеральные маргинальные бластомеры в основном приобретают судьбу гемангиобластов, клеток крови и эндотелия (Lee et al., 1994; Vogeli et al., 2006). Следовательно, разумно предположить, что висцеральная энтодерма или YSL рыбок данио могут выполнять эквивалентную функцию по контролю развития гемангиобластов у эмбрионов позвоночных. Возможно также, что комбинация нескольких факторов может быть необходима для формирования клонов гемангиобластов, эндотелиальных и гематопоэтических. Hedgehog, BMP4, retinoid acid, VEGF и неизвестные ещё факторы могут играть синергичные роли в этих процессах тесно регулируемым пространственным и временным способом, т.к. каждая из этих сигнальных молекул экспрессируется во внеэмбриональном желточном мешке и существенен для развития обоих клонов у мышей и/или рыбок данио (Winnier et al., 1995; Carmeliet et al., 1996; Ferrara et al., 1996; Dyer et al, 2001; Lawson et al, 2001; Byrd et al., 2002; Bohnsack et al., 2004; Covassin et al., 2006; Gupta et al., 2006; Bahary et al, 2007).
Система дифференцировки эмбриональных стволовых клеток широко используется для изучения развития гемангиобластов
in vitro (Nishikawa et al, 2001; Keller, 2005; Park et al., 2005). Чтобы идентифицировать индуцирующие факторы, включая erythroid Kurppel-like factor (EKLF), Adelman с коллегами идентифицировали BMP4 как необходимый и достаточный для экспрессии EKLF и Gatal в бессывороточной системе для формирования EB (Adelman et al., 2002). Такая индукция с помощью BMP4 может быть усилена за счет включения VEGF, SCF, erythropoietin (EPO)и тироидного гормона. Используя очень сходную бессывороточную систему, Choi с коллегами продемонстрировали, что BMP4 необходим для формирования FlklV Scl
+(hCD4
+) клеток, которые обогащены гемангиобластными активностями (Park et aL, 2004). Дополнительные доказательства, подтверждающие BMP4-обеспечиваемую передачу сигналов в развитии гемангиобластов, получены при анализе некоторых компонентов этого пути с использованием EBs. Endoglin, вспомогательный рецепторов для TGFβ и BMPs, экспрессируется в гемангиобластах и необходим для формирования гемангиобластов в подходе blast colony (Perlingeiro, 2007). Gata2, является непосредственной мишенью для BMP4, им богаты BL-CFCs и он необходим для генерации Flk1
+ мезодермы и гемангиобластов (Lugus et al., 2007). Smadl многочисленен в Bry4Flk1T гемангиобластах и достаточен для увеличения образования гемангиобластов (Zafonte et al., 2007), тогда как избыточная экспрессия ингибирующего Smad6 редуцирует генерацию Flkl
+ мезодермальных клеток в EBs (Park etal., 2004).
Мышиный Hex или Hhex экспрессируются в примитивной энтодерме, висцеральной энтодерме и во внеэмбриональной мезодерме желточного мешка во время гаструляции (Thomas et al., 1998). У
Hex мутантных эмбрионов, Hex необходим для дефинитивных энтодермальных органов (Keng et al., 2000; Martinez Barbera et al., 2000) и для развития сердца и сосудов (Hallaq et al., 2004), всё же происходит образование эндотелиальных и гематопоэтических клонов. Во время дифференцировки ESC
in vitro Hex экспрессируется в BL-CFCs и действует как негативный регулятор гемангиобластов и их дифференцировки в дефинитивные гематопоэтические и эндотелиальные клетки (Nakagawa et al, 2003; Kubo et al., 2005). Напротив, Guo с коллегами описали, что Hex не экспрессируется в BL-CFCs и безразличен для образования гемангиобластов, но необходим для их дифференцировки в гематопоэтические и эндотелиальные клоны (Guo et al., 2005). Различия между этими исследованияими могут отражать различия в культуральных условиях и стадиях EBs, использованных для RT-PCR, и методах blast колоний. У рыбок данио hhex не является необходимым, но достаточен для обоих клонов, а scl может компенчировать функцию hhex по развитию обоих клонов у рыбок данио (Liao et al., 2000). Следовательно, Hex и Scl могут взаимодействовать на уровне развиия и дифференцировке гемангиобластов у эмбрионов мышей и рабок данио, а внеэмбриональная висцеральная энтодерма в гаструле мышей играет существенную роль в развитии гемангиобластов (Belaoussoff et. al., 1998).
Одними из основных nodal/activin и BMP4 мишеней являются Mix/Bix гомеобоксные гены в гаструле эмбрионов
Xenopus laevis (Rosa, 1989; Mead et al., 1996; Vize, 1996; Henry and Melton, 1998). Одиночный мышиный Mix ген,
Mixl1, экспрессируетcя в висцеральной энтодерме прегаструляционного эмбриона, первичной полоске гаструлы и задней части первичной полоски и в аллантоисе на ст. 8.5 dpc (Pearce and Evans, 1999; Robb et aL, 2000). Гомозиготные
Mixl1 мутантные эмбрионы обнаруживают различные мезодермальные и энтодермальные дефекты и арест на ст. 9.5 dpc, но имеют в целом нормальные внеэмбриональные структуры. за исключением увеличенного аллантоиса (Hart et al., 2002). Т.к. первые гемангиобласты развиваются из внеэмбриональных кровяных островков, то это может говорить в пользу того, что Mixll играет какую-то роль в формировании гемангиобластов. Ng et aL, использовали систему дифференцировки мышиные эмбриональные ESCs, с помощью которой они метили Mixll-клетки путем инсерции EGFP репортера под контролем эндогенного Mixl1 промотора и делетировали ген
Mixl1 в мышиных ESCs, соотв. (Ng et al., 2005). Используя blast colony метод, они установили, что BL-CFCs обогащены Mixl1
+(EGFP
+)/Flk1
+ клетками и что Mixl1 необходим для формирования BL-CFCs. Кроме того, BMP4 и Activin A индуцируют экспрессию
Mixll в бессывороточной системе. Используя вызванную условиями избыточную экспрессию
Mixll в EBs, Willey с коллегами также обнаружили, что Mixll достаточен для образования мезодермального, гемангиобластного и гематопоэтического клонов (Willey et al., 2006). Следовательно, BMP4-индуцированный Mixl1 играет существенную роль как в мезодермальной индукции, так и в образовании гемангиобластов.
ZBP-89 является одним из членов семейства Kruppel-подобных белков с цинковыми пальчиками на своем С-конце (Bray et al., 1991). Гаплонедостаточность по ZBP-89 у мышей ведет к бесплодию из-за ареста роста и апоптоза зародышевых клеток плода и она также не позволяет исследовать его функцию в др. органогенезах у мышей (Takeuchi et al., 2003). Т.к. было установлено, что ZBP-89 репрессирует экспрессию маркера миэлоидной дифференцировки CD lib, то он может также участвовать в гематопоэзе (Park et al., 2003). Чтобы понять функцию ZBP-89 в гематопоэтическом развитии мы манипулировали с его экспрессией, используя антисмысловой morpholino нокдаун и эктопическую экспрессию системы дифференцировки ESCs у мшей и рыбок данио и установили, что zbp-89 morphant эмбрионы бескровны, а неправильная экспрессия zbp-89 у эмбрионов рыбок данио или в мышиных ESCs ведет к экспансии клонов гемангиобластных и гематопэтических клонов (Li et al., 2006). Кроме того, микроинъекции zbp-89 мРНК частично могут восстанавливать гематопоэтические, но не эндотелиальные клоны у мутантных эмбрионов
cloche рыбок данио. Эти данные подтверждают, что zbp-89 абсолютно необходим для генерации гематопоэтических клонов, но его функция в развитии и дифференцировке гемангиобластов остается неясной.
Мутанты
cloche рыбок данио впервые были идентифицированы и охарактеризованы по уменьшению у них клеток крови и сосудистых эндотелиальных клеток, включая эндокард (Stainier et aL, 1995). Это была первой одиночной генной мутацией, которая элиминировала как эндотелиальный. так и гематопоэтический клоны возможно на уровне гемангиобластов. Эпистатический анализ показал, что cloche действует выше zbp-89, scl, lmo2, gatal, gata2, runxl, c-myb, flil, flkl, tie2, hhex и etsrp в развитии гематопоэтических и эндотелиальных клеток у рыбок данио (Stainier et al., 1995; Fou-quet et al., 1997; Liao et al, 1997, 1998, 2000; Brown et al., 2000; Burns et al., 2002; Patterson et al., 2005, 2007; Li et al., 2006; Pham et al., 2006; Sumanas and Lin, 2006). Кроме того, анализ микромассивов при сравнении мутантов
cloche и эмбрионов дикого типа выявил, что
cloche специфически регулирует панель гематопоэтических и эндотелиальных генов (Qian et ah, 2005; Sumanas et al., 2005; Weber et al., 2005). Все эти ранние исследования показали, что
cloche является самым ранним геном, действующим в развитии гемангиобластов. Однако, идентификация гена
cloche оказалась чрезвычайно затруднительной частично из-за его физической локализации в теломере хромосомы 13 (Xiong et al., 2008; Liao et al., 2000). Мы недавно идентифицировали ген lysocardiolipin acyltransferase (lycat) из cloche
m39 делеционного интервала, но мы не обнаружили какой-либо причинной мутации в кодирующей области lycat в двух ENU-индуцированных аллелях
cloche (cloche
fv0S7b и cloche
m378). Следовательно, остается определить, как lycat связан с геном
cloche (Xiong et al., 2008; Wang et al., 2007). Мы исследовали функцию lycat, используя антисмысловой morpholino нокдаун и неправильную экспрессию
lycat у эмбрионов рыбок данио и установили, что lycat абсолютно необходим для развития как эндотелиального, так и гематопоэтического клонов и что lycat действует выше некоторых известных гемангиобластных маркерных генов (Xiong et al., 2008). Более того, мышиный ген
Lycat также играет существенную роль в развитии гемангиобластных, гематопоэтических и эндотелиальных клонов в системе дифференциации мышиных ESCs (Wang et al., 2007). Кроме того, неправильная экспрессия мышиного Lycat в ESCs ведет к позитивной регуляции панели гемангиобластных маркерных генов в EBs (Wang et al, 2007). Следовательно, lycat является новым важным геном для развития гемангиобластов у эмбрионов рыбок данио и в мышиных ESCs.
Гены lycat у мышей и рыбок данио кодируют трансмембранную acyl-transferase с C-терминальным endoplasmic reticulum (ER) локализационным сигналом. Мышиный Lycat белок локализуется в ER и обладает acyltransferase ферментативной активностью в отношении monolysocardiolipin и dilysocardiolipin в качестве субстратов (Cao et al., 2004). Lipid palmitate модификация белков с помощью acyltransferase выступает в качестве важного механизма для регуляции трафика, сортировки белков и развития (Bijlmakers and Marsh, 2002; El-Husseini and Bredt, 2002; Nybakken and Perrimon, 2002; Linder and Deschenes, 2003; Nusse, 2003). Мутации в ERF2 и ERF4 вызывают снижение palmitoylation Ras2p и вызывают неправильную локализацию GFP-Ras2p (Bartels et al., 1999). Комплексы Erf2p и Erf4p являются Ras palmitoyltransferase. Erf2p является интегральным белком, локализованным в ER, который содержит консервативный Asp-His-His-Cys богатый цистеином домен (DHHC-CRD; Lobo et al., 2002). Другой DHHC-CRD белок , Akrlp, как было установлено, необходим для Yck2p palmitoylation у дрожжей (Roth et al., 2002). С помощью скрининга мутаций у мух, найден и охарактеризован Porcupine (Pore) как важный для процессинга белка wingless. Pore является новым трансмембранным белком с acyltransferase доменом, концентрирующийся в ER (Kadowaki et al., 1996). Pore необходим для добавления palmitate к Wnt3a и Wnt1, это ведет к продукции полностью функциональных белков Wnt (Reya et al., 2003; Willert et al., 2003). Skinny hedgehog (Ski), также известный как Rasp, sightless, and central missing (emn), изолирован и установлено, что он является др. acyltransferase, необходимой для palmitoylation и биологической активности hedgehog (Amanai and Jiang, 2001; Chamoun et al., 2001; Lee and Treisman, 2001; Micchelli et al., 2002). Следовательно, некоторые protein acyltransferases могут быть высоко специфичными и существенными для регуляции формирования эмбрионального паттерна и органогенеза у разных видов. Остается изучить, как Lycat вовлекается в липидную модификацию своих белков мишеней, которые безусловно существенны для развития белков.
FUTURE DIRECTIONS AND PERSPECTIVES
The mouse and human ESC differentiation systems will continue to be
used as a wonderful experimental model for dissecting signaling pathways involving in hemangioblast development and differentiation. The blast colony assay will be aided by genetic manipulation of mouse and human ESCs such as knockin and knockout by homologous recombination (Thomas and Capecchi, 1987: Chung et al., 2002; D'Souza et al., 2005; Davis et al., 2007; Irion et al., 2007). Isolating hemangioblasts and other progenitor cell populations by fluorescence-activated cell sorting (FACS) will help to identify additional players in hemangioblast development with the aid of microarray (Lugus et al., 2007) and proteomics approaches. The blast colony assay in a serum-free system will be useful for isolating growth factors and cytokines to promote hemangioblast development (Adelman et al., 2002; Park et al., 2004; Lu et al., 2006). It is foreseeable that ESCs will continue to play central roles in identifying master genes in hemangioblast development by incorporating the blast colony assay with other cellular, genetic, and genomic approaches.
With the development of somatic cell nuclear transfer ESCs (ntESCs) as well as of induced pluripotent stem (iPS) cells in mice and humans, therapeutic cloning will be promising and achievable in humans (Rideout et al., 2002; Takahashi et al., 2007; Yu et al., 2007). Isolation and expansion of human hemangioblasts from patient-specific ntESCs will be possible for therapeutic angiogenesis and hemato-poiesis. This area of studies is highly anticipated and will have great potential for regenerative medicine. Another area is to perform chemical screens for agonists selectively in promoting mouse and human hemangioblast development and growth. The agonists for hemangioblasts can be used to promote generation of the hemangioblast in vitro as well as can be developed as drugs for therapeutic utility. Furthermore, isolation of target proteins by small molecules will also help to understand the underlying molecular mechanisms in hemangioblast development. The small-molecule libraries are now both commercially available and freely distributed by the National Institute of Health and are widely used for identifying agonists and antagonists in different signaling pathways in vitro and in vivo (Ding and Schultz, 2004; Zon and Peterson, 2005). The Bry+/ Flk1+, Flk1+/Scl+, and Mixl1+/Flk+ cells are enriched with the BL-CFCs in EBs, and can be used for chemical screens if the generation of these progenitors can be scaled up (Chung et al., 2002; D'Souza et al., 2005; Ng et al., 2005). Therefore, the chemical genetic approach will serve well for both basic mechanisms and therapeutic utility of the hemangioblast.
One of the biggest challenges in this field is how we can label and follow hemangioblast development and identify master genes controlling hemangioblast development in live vertebrate embryos. Zebrafish {Danio rerio) has become a powerful genetic model organism for the study of vertebrate organogenesis particularly on cardiovascular development. Zebrafish has several features that facilitate the recognition and characterization of mutations (Streisinger et al., 1981; Fish-man, 2001). The genetic potential is well recognized by chemical and inser-tional mutagenesis screens for genes that affect nearly every aspect of zebrafish development (Driever et al., 1996; Haffter et al., 1996; Amsterdam et al., 2004), Furthermore, genomic infrastructure is now well established to speed up cloning of mutant genes (Fishman, 1999). Deciphering the molecular nature of the cloche locus should provide important insights into the origin of hemangioblasts. It is highly anticipated that future genetic screens and positional cloning in zebrafish will reveal additional novel mutant loci like cloche and signaling pathways in hemangioblast development. Furthermore, zebrafish embryos are optically clear, so individual cells can be labeled and followed to learn how individual cells develop and how mutations affect embryonic cell fates (Stainier et al., 1993, 1995; Lee et al., 1994; Melby et al., 1996; Keegan et al., 2004; Vogeli et al., 2006). Trans-genesis can be efficiently carried out to establish transgenic reporter zebrafish (Kawakami et al., 2004). Transgenic photoactivatable or photo-convertable GFP zebrafish can be generated and used for selective photola-beling of embryonic cells such as mesodermal cells that are fated to the hemangioblast (Ando et al., 2002;
Murray and Saint, 2007). This line of studies may reveal novel tools for labeling and investigating the hemangioblast in live embryos.
We are entering a very exciting era in many aspects of biomedical research. Likewise, the field of hemangioblast development biology is moving forward to deciphering basic mechanisms and their utility in regenerative medicine with the availability of human ESC lines, genetic manipulation of mouse and human ESCs, classic genetics in animal model systems, molecular imaging, and abundant genomic resources in microarray, proteomics, and chemical biology. Capturing and defining the hemangioblast and underlying signaling pathways in model organisms and human ESCs will eventually lead to therapeutic angiogenesis and hematopoie-sis in human patients.
Сайт создан в системе
uCoz