Как мы видели стержневые гистоны могут быть классифицированы на основании их родоначальных последовательностей и позиции в нуклеосоме. Линкерные гистоны характеризуются доменом winged helix скорее, чем гистоновым fold доменом, и соединяются с линкерной ДНК, которая разделяет нуклеосомы (Wolffe 1992). Хотя существуют минорные варианты этих канонических гистонов, они, по-видимому, взаимозаменимы с основными формами. Напр., H3.1 и H3.2 млекопитающих отличаются по одной аминокислоте, значение которой неизвестно для придания различных биологических свойств двум изоформам. Существование множественных генов, которые продуцируют большие количества канонических гистонов для отложения в S фазе, типичны для эукариотических гистонов. Почти повсеместность и подавляющие количества канонических S-фазных гистонов приводило к относительно незначительному вниманию к гистоновым вариантам вплоть до последнего времени. Возобновление интереса к вариантам гистонов возникло частично благодаря определению того, что они отличаются от канонических S-phase гистонов таким образом, что это может вести к выраженной дифференцировке хроматина. Один из способов, которым они отличаются, это их механизм инкорпорации в хроматин. Сборка RC инкорпорирует новые нуклеосомы в щели между старыми нуклеосомами по всему геному, в то время как сборка RI осуществляет локальные замены существующих нуклеосом или субъединиц (Marzluff et al. 2002). Сборка RI, следовательно, обладает потенциалом переключения состояния хроматина путем замещения канонических гистонов вариантами. Замещение одного гистона другим также может стирать или изменять паттерна пост-трансляционных модификаций. Следовательно, сборка RI может потенциально видоизменять эпигенетические состояния, которые, как полагают, обеспечиваются гистонами и их модификациями. Недавний прогресс в изучении гистоновых вариантов и процессов, с помощью которых они откладываются, предоставил новую информацию на основы эпигенетического наследования и ремоделирования.
Определяющим признаком эукариотических хромосом являются центромеры, к которым в этом месте прикрепляются микротрубочки веретена во время митозов. Первые центромеры были описаны на молекулярном уровне были у почкующихся дрожжей (
Saccharomyces cerevisiae), в них последовательность в 125- п.н. необходима и достаточна для формирования центромеры (Amor et al. 2004a). Однако, центромеры растений и животных очень различны, обычно состоят из megabase массивов из коротких тандемных повторов. В отличие от ситуации с почкующимися дрожжами, роль ДНК последовательностей в этих сложных центромерах неопределенна, т.к. полностью функциональные нео-центромеры человека, как известно, формируются спонтанно на эктопических местах, которые полностью лишены последовательностей, напоминающих центромерные повторы (Fig. 4). Эти и др. наблюдения говорят против прямой роли
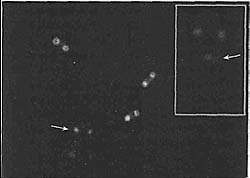 Figure 4. Human Neocentromeres (Indicated by an Arrow) Lack Centromeric o-Satellite DNA but Have CENP-A и Heterochromatin
Anti-CENP-A staining in green и anti-CENP-B staining in red (which marks o-satellite DNA) identify a Chromosome 4 neocentromere that lacks a-satellite (main panel). This Chromosome 4 is otherwise normal, having been transmitted for at least three meiotic generations in normal individuals. Inset shows anti-HP1 staining, which indicates that despite the lack of satellite DNA, heterochromatin forms around active neocentromeres. (Reprinted, with permission, from Amor et al. 2004b [©National Academy of Sciences].)
Figure 4. Human Neocentromeres (Indicated by an Arrow) Lack Centromeric o-Satellite DNA but Have CENP-A и Heterochromatin
Anti-CENP-A staining in green и anti-CENP-B staining in red (which marks o-satellite DNA) identify a Chromosome 4 neocentromere that lacks a-satellite (main panel). This Chromosome 4 is otherwise normal, having been transmitted for at least three meiotic generations in normal individuals. Inset shows anti-HP1 staining, which indicates that despite the lack of satellite DNA, heterochromatin forms around active neocentromeres. (Reprinted, with permission, from Amor et al. 2004b [©National Academy of Sciences].)
последовательности ДНК в детерминации расположения центромер (see Chapter 6). Ключевая информация на основы качественных особенностей центромер получена благодаря идентификации гистонового варианта H3, CENP-A (title figure), который был обнаружен, как локализующийся специфически в центромерах и был инкорпорирован в нуклеосомные частицы на место самого H3 (Palmer et al. 1991). Удивительно, но CENP-A остается ассоциированным с центромерами во время перехода от гистонов к протаминам во время сперматогенеза, когда практически все др. гистоны теряются (Palmer et al. 1990). Это раннее наблюдение в исследовании CENP-A указывает на то. что CENP-A вносит вклад в характерные особенности центромер генома самцов. В целом эта информация не была оценена по достоинству до тех пор, пока не было установлено, что CENP-A является намного более лучшим маркером центромер, чем ДНК последовательность (Amor et al. 2004a) и что аналоги CENP-A могут быть обнаружены в геномах всех эукариот (Fig. 5) (Malik and Henikoff 2003). Т.о., хотя центромеры почкующихся дрожжей детерминируются за счет 125-bp консенсусной последовательности, она также являются местом центромерной нуклеосомы, которая содержит Cse4 центромерный H3 (CenH3) вариант. У делящихся дрожжей (
Schizosacchawmyces pombe), набор из CenH3-содержащих нуклеосом занимает центральный стержневой регион, фланкированный H3-содержащими нуклеосомами, которые обладают признаками гетерохроматина (Amor et al. 2004a). У мух и позвоночных, CenH3s присутствуют в массивах, которые чередуются с H3-содержащими массивами, которые обладают уникальным паттерном гистоновых модификаций (Sullivan and Karpen 2004). Чередование может объяснить тот факт, что центромеры занимают только внешний край центромерного сужения метафазных хромосом (title figure). Это согласуется с наблюдением, что "holokinetic" хромосомах червей микротрубочки прикрепляются по всей длине каждой анафазной хромосомы, а CenH3 занимает ведущий край всех по всей из длине (Fig. 5, right) (Malik and Henikoff 2003). В самом деле, уникальный CenH3 вариант, как было установлено, в точности маркирует центромеры у всех исследованных эукариот. Эта очевидная вездесущность и присутствие центромер во время митозов у всех эукариот открывает возможность, что первый канонический H3 возник из CenH3.
Генетические эксперименты у разнообразных эукариот подтвердили важность CenH3 для образования кинетохор и для расхождения хромосом (Amor et al. 2004a). Т.к. они остаются на месте в течение всего клеточного цикла, CenH3-содержащие нуклеосомы формируют базу для сборки др. кинетохорных белков во время митозов (see Chapter 6). Неразрешенным вопросом в исследованиях хромосом является пока, как эти белки взаимодействуют, чтобы обеспечить сцепление между центромерой и микротрубочками веретена, которое может осуществляться вплоть до того, когда сильные тянущие силы прикладываются к кинетохорам в анафазе. Несколько десятков специфичных для кинетохор белков идентифицированы у дрожжей (see Chapter 6), хотя как они взаимодействуют с CenH3-содержащими нуклеосомами и др. базовыми белками, такими как CENP-C, пока неизвестно. Необходимо также установить процесс сборки CenH3 в нуклеосомы. Тот факт, что центромеры объясняют такие малые пропорции хроматина в целом затрудняло биохимические подходы к пониманию проблемы, но мы ожидаем
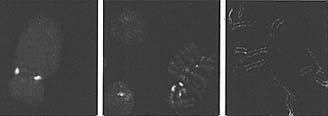 Figure 5. Centromeric H3 Variants in Model Eukaryotes
(Left) Human chromosome stained with an antibody against the centromere-specific histone H3 variant CENP-A (green) and anti-CENP-B (red) marking a-satellite DNA (image courtesy of Peter Warburton). (Center) Drosophila melanogaster anti-CenH3 antibody (red) stains centromeres in metaphase chromosomes and throughout interphase (image courtesy of Suso Platero). (Right) Caenorhabditis elegans anti-CenH3 antibody (green) stains the end-to-end holocentromeres of prophase chromosomes (red) (image courtesy of Landon Moore).
Figure 5. Centromeric H3 Variants in Model Eukaryotes
(Left) Human chromosome stained with an antibody against the centromere-specific histone H3 variant CENP-A (green) and anti-CENP-B (red) marking a-satellite DNA (image courtesy of Peter Warburton). (Center) Drosophila melanogaster anti-CenH3 antibody (red) stains centromeres in metaphase chromosomes and throughout interphase (image courtesy of Suso Platero). (Right) Caenorhabditis elegans anti-CenH3 antibody (green) stains the end-to-end holocentromeres of prophase chromosomes (red) (image courtesy of Landon Moore).
что улучшенные технологии приведут к лучшему пониманию структуры и динамики кинетохор.
Эволюция CenH3s вряд ли похожа на таковую др. классов гистонов. В то время как гистон H3 почти неизменен по последовательности, что отражает чрезвычайно сильную очищающую селекцию каждого остатка, CenH3s развивались быстро, особенно в ветвях растений и животных (Malik and Henikoff 2003). Это особенно доказательно на примере N-терминальных хвостов, которые отличаются по длине и последовательностям до такой степени, что они не могут быть сравнены с CenH3s из др. таксономических групп. Даже гистоновый fold домен CenH3 эволюционирует на порядки величин быстрее, чем таковые в H3. Какова причина таких существенных эволюционных различий между H3, которые функционируют на центромерах и H3 функционируют где-либо ещё?
Быстро эволюционирующие регионы
Drosophila и Arabidopsis CenH3 генов обнаруживают избыток нуклеотидных замен по сравнению с ожидаемым, исходя из скорости синонимных замен (Malik and Henikoff 2003). Этот избыток является характерной особенностью адаптивной эволюции. Адаптивная эволюция у растений и животных также обнаруживается и по др. крупному центромерному базовому белку, CENP-C (Talbert et al. 2004). Хотя адаптивная эволюция хорошо документирована для генов, участвующих в генетических конфликтах, таких как взаимодействия между хозяином и паразитом, известны только важные одно-копийные гены, которые адаптивно эволюционируют у каждого организма. В случае CenH3 и CENP-C, регионы адаптивной эволюции соответствуют регионам связывания и таргетинга ДНК. Это подтверждает. что основные связанные с центромерой белки приспосабливаются к эволюционирующей центромерной ДНК, позволяя тем самым центромерному хроматину взаимодействовать с законсервированным аппаратом кинетохор, который соединяет центромеры с микротрубочками веретена. Было предположено, что центромеры конкурируют во время мейоза самок, чтобы включиться в ядро яйца скорее, чем потеряться как полярное тельце (Talbert et al. 2004). По мере развития конкуренции происходит экспансия центромер возможно за счет неравного кроссинговера между сестринскими хроматидами. Множественная супрессия этого процесса мейотического дрейфа с помощью CenH3 и CENP-C д. приводить к избытку замещающих изменений в регионах, которые взаимодействуют с ДНК. Организмы, в которых нет возможностей центромерам конкурировать, такие как почкующиеся дрожжи, не д. подвергаться центромерному дрейфу и это может объяснить тот факт, что они имеют малые центромеры и их CenH3 и CENP-C белки находятся под строгой очищающей селекцией.
Т.о., мы видим, что специальная область генома, центромеры, отличаются по одиночному классу гистоновых вариантов, чьи последовательности обнаруживают остатки конкуренции, которые могут приводить к чрезвычайной сложности центромер. Процесс сборки RI, который нацелен на новые CenH3-содержащие нуклеосомы центромер во время каждого клеточного цикла, остается неизвестным (Amor et al. 2004a). Центромерные нуклеосомы обнаруживают удивительное отсутствие специфичности последовательностей из-за чего они не только могут исправно локализоваться на нео-центромерах, которые полностью отличны от нативных центромер (Fig. 4), но и также дрожжевой гомолог Cse4 может функционально замещать CENP-A человека (Wieland et al. 2004) (ни один из которых адаптивно не эволюционирует; Talbert et al. 2004). Необычайно, что наши центромеры остаются в тех же самых позициях в течение десятков миллионов лет без каких-либо признаков, свидетельствующих о детерминантах, участвующих в процессе поддержания их. Со степенью, с которой эпигенетика относится к наследованию, которое не зависит от последовательностей ДНК, и наследование центромер на геологической временной шкале является наиболее экстремально вообразимой формой. До сих пор мы всё ещё ищем механизм, объясняющий, как они поддерживают сами себя в каждом клеточном цикле (Chapter 14).
6 The Replacement Histone Variant H3.3 Is Found at Active Chromatin
Подобно центромерам транскрипционно активный хроматин, как полагают, поддерживается эпигенетически и подобно центромерам, активный хроматин обогащен H3 вариантом, наз. H3.3 (Henikoff and Ahmad 2005). H3.3 очень сходен по последовательностям с каноническими формами H3, отличаясь только по 4 аминокислотам. Столь небольшие отличия позволяют предположить, что эти две формы взаимозаменимы. Однако, у Drosophila, H3.3 откладывается с помощью или RC или RI сборки нуклеосом, тогда как H3 откладывается только в репликационных фокусах RC способом. Это отличие между двумя вариантами закодировано в самом белке, при этом 3 из 4 отличий между H3 и H3.3 безусловно участвуют в предупреждении H3 от откладки с помощью RI пути (in α-helix 2, Fig. 2). Очистка растворимых комплексов сборки человека подтверждает, что эти две формы участвуют в самостоятельных процессах сборки: H3.1 очищается совместно с CAF-1 для RC сборки, a H3.3 очищается совместно с др. компонентами, включая HirA, и участвует в RI сборке.
Хотя различия в 4 аминокислоты могут выглядеть практически несущественными, если учесть, что люди, мухи и моллюски имеют в точности те же самые последовательности H3.3, то эти отличия от H3 становятся выдающимися. Филогенетический анализ выявляет, что H3/H3.3 участвует, по крайней мере, в 4-х отдельных временных промежутках во время эволюции эукариот: у растений, животных/грибов, реснитчатых и apicomplexans (Malik and Henikoff 2003). Несмотря на отдельное происхождение от животных и грибов, пара H3/H3.3 у животных и пара у растений (наз. H3.1 [RC] и H3.2 [RI]- чтобы избежать путаницы мы обозначаем все RC изоформы как H3 и все RI изоформы как H3.3) очень сходны. Тот же самый кластер аминокислот (позиции 87-90), который предупреждает RI отложение H3 у Drosophila обнаруживается отличающимся у растений, а остальные отличия у животных (позиция 31 - Ala для H3 и или Ser или Thr для H3.3) также обнаруживаются у растений. Грибы особенно интересны. Родоначально они имели и H3 и H3.3; однако, аскомицеты, которые включают дрожжи и плесневые грибки, теряют H3 форму. Т.о.. облигатная RC форма гистона 3, которая привлекает наибольшее внимание у животных, не присутствует у дрожжей.
Исследования H3.3 на больших количествах хроматина показали, что он обогащен в активных фракциях (Henikoff and Ahmad 2005). Однако, различные факторы внесли неясности в этот потенциальный "маркер" активного хроматина во время значительно оживления в области хроматина, когда было установлено, что гистоновые модификации могут делать отличным активный хроматин от молчащего. Прежде всего, недоступны антитела, которые могут эффективно отличать H3 от H3.3 в хроматине (позиции 87-90 блокированы с помощью витков ДНК на нуклеосоме), в то время как прекрасные антитела против большинства различных пост-трансляционных модификаций легко доступны. Кроме того, на вид незначительные отличия в последовательностях между H3 и H3.3 не придают какие-либо фундаментальные отличительные особенности хроматину, тогда как гистоновые модификации, возникающие в основном в лизинах хвоста, которые как известно, влияют на взаимодействия с хроматином или на связывание ассоциируемых с хроматином белков. Такое понимание, что две формы гистона-3 д.быть взаимозаменяемы, подтверждается находкой у
Tetrahymena , что S-фазная форма может замещать свой аналог. Наконец, влиятельная гипотеза "гистонового кода" рассматривает нуклеосомы как фиксированные мишени для модифицирующих энзимов во время дифференцировки хроматина (Ienuwein and Allis 2001). Однако, становится всё больше доказательств, что хроматин является очень динамичным, и даже ассоциированные с гетерохроматином белки, соединяются со временем нахождения в нем минуту или менее (Phair et al. 2004). Очевидно, что хроматин активно транскрибируемых генов находится в постоянном движении, характеризующемся постоянным замещением гистонов (Henikoff and Ahmad 2005). Три важных отличия, которые позволяют различать H3 и H3.3 это создание H3.3*H4 димеров, являющихся субстратом для RI сборки, a RI сборка сама по себе существенно изменяет хроматин. И в результате этого процесса активно транскрибируемые области становятся меченными H3.3 (Fig. 6), а доказательства этого процесса получены благодаря наблюдениям RI замещения
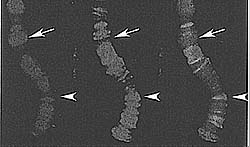 Figure 6. H3.3 Preferentially Localizes to Actively Transcribed Regions of Drosophila Polytene Chromosomes
DAPI staining (red) shows the DNA banding pattern (left), and H3.3-CFP (green) localizes to interbands (middle), which are sites of RNA polymerase II localization. Right shows the merge. (Reprinted from Schwartz and Ahmad 2005).
Figure 6. H3.3 Preferentially Localizes to Actively Transcribed Regions of Drosophila Polytene Chromosomes
DAPI staining (red) shows the DNA banding pattern (left), and H3.3-CFP (green) localizes to interbands (middle), which are sites of RNA polymerase II localization. Right shows the merge. (Reprinted from Schwartz and Ahmad 2005).
H3, метилированного по лизину9 (H3K9me), нагруженной H3.3 RNA polymerase I и II (pol I and II) на транскрибируемые локусы (Schwartz and Ahmad 2005).
Динамичная природа хроматина активных локусов вызывает удаление предсуществующих модификаций гистонов. Это создает потенциальное решение проблемы, как молчащий хроматин может становиться активированным, когда он гиперметилируется по H3K9 и H3K27 (гистоновые модификации обычно ассоциированные с репрессивным хроматином). Исследования показали, что метилы на гистонах настолько стабильны, как и сами гистоны (Waterborg 1993),хотя недавние открытие деметилазы, специфичной для mono- и di-methyl H3K4 (Shi et al. 2004) показывает, что некоторые метилы могут удаляться из гистонов ферментативно. В целом паттерны ковалентных модификаций гистонов могут быть результатом модификаций уже присутствующих гистонов в то время, когда они отложены. Таким образом модификации энзиматические д. прокладывать путь аппарату сборки и вообще облегчать процесс (Henikoff and Ahmad 2005).
Эта модель динамической сборки предсказывает, что обнаруживаемые гистоновые модификации, обогащающие активный хроматин, д. быть обогащены H3.3 и многочисленные измерения модификаций H3 и H3.3 показали, что это действительно имеет место как у растений, так и животных. Более того, ожидается согласно этой модели, что активные лизиновые модификации, такие как ацетилирование H3 и H4 и метилирование H3K4 и H3K79 д. строго коррелировать с др., как это наблюдается в различных системах (O'Neill et al. 2003; Kurdistani et al. 2004; Schubeler et al. 2004). Наконец, динамическая RI сборка на активных генах может объяснить, почему CAF-1 мутации вызывают потерю молчания (Loyola and Almouzni 2004): только около 10% дрожжевого генома, как полагают, находится в молчащем состоянии и это может быть только хроматин, который не замещается динамически в геноме дрожжей. В отсутствие CAF-1-обусловленной RC сборки, RI сборка д. происходить по всему геному дрожжей, активируя ранее молчащие регионы. Вообще-то существование H3 варианта, обеспечивающего RC сборку у многоклеточных эукариот является адаптацией для удержания огромного большинства хроматина в клетках в эпигенетически молчащем состоянии.
Замещение с помощью дифференциально модифицированных H3.3*H4 димеров подтверждает простую модель наследования активного хроматина в делящихся клетках (Henikoff and Ahmad 2005). Активный хроматин д. оставаться активным вследствие разведения за счет обычных нуклеосом после RC сборки, если это случайная смесь RI-отложенных и RC-отложенных нуклеосом не прекращает активный процесс, такой как инициация и элонгация. Продолжение транскрипционной активности в результате д. восстанавливать хроматин в следующем клеточном цикле, приводя к пожизненному сохранению активного хроматина в ходе всего развития. Возможность, что гистоновый вариант постоянно поддерживается за счет процесса RI сборки, также может быть в силе для CenH3s, которые д. инкорпорироваться в щели, вызываемые за счет распутывания ординарных нуклеосом, возникающего в результате анафазного натяжения.
Когда клетки выходят из клеточного цикла и дифференцируются, они больгше не продуцируют и не включают S-фазные гистоны и в результате накапливается H3.3. Напр., H3.3 накапливается в головном мозге крыс до уровня 87% из гистонов 3 к тому времени, когда крысы становятся 400 дневными (Henikoff and Ahmad 2005). Является ли это постепенным замещением хроматина или нет, но его функциональное значение неизвестно. Неизвестно также, происходит ли активный процесс, который делает возможным замещение, в то же самое время, наблюдаемое на транскрипционно активных локусах. Единственная возможность, что разрушение хроматина с помощью транзитной RNA polymerase или хроматин-ремоделирующей машины, вызывает локальное раскручивание нуклеосом и случайную потерю H3.3*H4 димеров (Fig. 7). Это д. сопровождаться повторной сборкой нуклеосом вслед за полимеразой с замещением потерянных димеров на H3.3-H4 димер с помощью HirA комплекса. Только когда полимеразы упакованы слишком плотно, чтобы происходила сборка, то нуклеосомы д. полностью разворачиваться.
7 Phosphorylation of H2AX Functions in DNA Double-Strand Break Repair
H2A гистоны также представляют семейство из различных вариантов, обнаруживаемых у всех эукариот. Вариант H2AX определяется по присутствию С-терминального мотива из аминокислот , SQ(E or D)Θ, где Θ соответствует гидрофобной аминокислоте. Серин в этой последовательности мотива является местом фосфорилирования, продуцирующим модифицированный белок, обозначаемый как "Y-H2AX." Динамическая природа хроматина и фосфорилирование H2AX, особенно показательны, когда разрывы двойной нити (ds) возникают в ДНК (Morrison and Shen 2005). Летальность даже одиночного ds разрыва нуждается в непосредственном действии репарации повреждения и восстановления целостности двойной спирали. Детекция ds разрывов обычно происходит в течение минуты или около того с момента их возникновения и это в свою очередь запускает быстрое фосфорилирование H2AX в непосредственной близости к месту разрыва. Такое фосфорилирование осуществляется с помощью членов семейства phosphoinositol 3-kinase-like kinase. Вследствие этого инициального события, H2AX фосфорилирование затем быстро распространяется вдоль хромосомы, маркируя относительно крупный домен хроматина, окружающий разрыв. Наконец, ds разрыв в конечном итоге репарируется с помощью или гомологичной рекомбинации или негомологичного соединения концов и метка фосфорилирования удаляется.
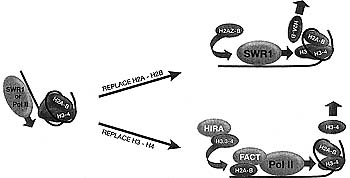 Figure 7. Model for Replication-independent Replacement or Exchange
A large molecular machine (either the SWR1 complex or RNA polymerase II) partially or completely unravels a nucleosome during transit. The result is either retention of heterodimeric subunits, such as the FACT-facilitated transfer of H2A"H2B from in front of RNA polymerase to behind (Formosa et al. 2002; Belotserkovskaya et al. 2003), or loss of a heterodimer. In the latter case, chromatin repair replaces the lost heterodimer with either H2AZ*H2B (top) or H3.3"H4 (bottom).
Figure 7. Model for Replication-independent Replacement or Exchange
A large molecular machine (either the SWR1 complex or RNA polymerase II) partially or completely unravels a nucleosome during transit. The result is either retention of heterodimeric subunits, such as the FACT-facilitated transfer of H2A"H2B from in front of RNA polymerase to behind (Formosa et al. 2002; Belotserkovskaya et al. 2003), or loss of a heterodimer. In the latter case, chromatin repair replaces the lost heterodimer with either H2AZ*H2B (top) or H3.3"H4 (bottom). Фосфорилирование H2AX не является существенным для детекции или репарации ds разрывов, т.к. делеция гена или мутация мишени серинового остатка не устраняет репарации. Однако, H2AX является не только маркером повреждения, т.к. такие мутанты обнаруживают пониженную эффективность репарации и являются гиперчувствительными радиационным повреждениям и генотоксическим агентам. Сегодня, H2AX, как полагают, функционирует в репарации ds разрывов, по крайней мере двумя путями. Во-первых, он может помогать рекрутировать или сохранять белки, необходимые для репарации в месте разрыва (Morrison and Shen 2005). Во-вторых , он может стабилизировать хромосомное окружение разорванных концов, благодаря рекрутированию cohesin, белкового комплекса, ответственного за удерживания сестринских хроматид вместе (Lowndes and Toh 2005).
Эволюция H2AX непохожа на таковую для др. гистоновых вариантов. Хотя ген для H2AX обнаружен почти у всех эукариот, он имеет множественное относительно недавнее происхождение (Malik and Henikoff 2003). Напр., версия H2AX, найденная у Drosophila отличается от таковой, найденной у др. двукрылых насекомых, Anopheles. Предположительно способность к эволюции нового H2AX из канонической формы H2A является следствием простого SQ(E or D)Θ мотива. Эволюционирование такого мотива на С-конце канонического H2A , как ожидается, возникало повторно в ходе эволюции. Случайная потеря существующего H2AX с появлением новой версии может быть вызвана необходимостью, чтобы H2AX оказался распределен очень униформно, т.к. ds разрывы могут возникнуть в любом месте генома. Если мутации возникают в существующем H2AX гене, который редуцирует его сходство с каноническим H2A таким образом, что его сборка оказывается менее эффективной или униформной, и тогда д. действовать строгий отбор, чтобы заместить его версией, которая более сходна с каноническим H2A. Это могло бы помочь объяснить исключительный случай с Drosophila H2AX, который в отличие от др. эукариот, не происходит из её канонического H2A, а скорее из удаленного H2AZ клона (см. ниже). Если все, что необходимо, чтобы стать H2AX, это оказаться в H2A позиции в нуклеосоме и иметь С-терминальный мотив для фосфорилирования, то H2AZ может приобретать такую способность.
Репарация ds разрывов безусловно универсальная функция фосфорилирования H2AX и следовательно, может показаться, что отсутствует стабильный эпигенетический аспект этого процесса. Однако, H2AX нулевые мыши стерильны, а цитологическая проверка сперматогенеза млекопитающих выявляет четкие эпигенетические признаки, в которых H2AX специфически фосфорилируется по XY биваленту (Fig. 8) (Fernandez-Capetillo et al. 2003). Эта пара хромосом занимает удаленные "sex body" во время мейотической профазы, которые участвуют в молчании сцепленных с полом генов во время мейоза у самцов.
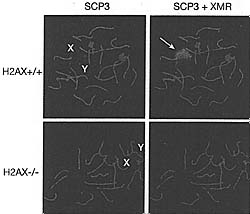 Figure 8. Pachytene Stage of Spermatogenesis Showing the Dependence of Sex Body Formation on H2AX
In normal mammalian spermatocytes, a nuclear structure, the sex body (arrow, labeled green in right panels), is seen to encompass the unpaired XY bivalent (labeled in left panels). The synaptonemal complex, which aligns paired chromosomes, is stained red. H2AX is normally enriched in the sex body (H2AX*'*). In H2AX"'" spermatocytes, the sex body does not form and a sex body epitope becomes dispersed over autosomes (lower right panel). Bar, 10 u.m. Images courtesy of Shantha Mahadevaiah and Paul Burgoyne (Fernandez-Capetillo et al. 2003).
Figure 8. Pachytene Stage of Spermatogenesis Showing the Dependence of Sex Body Formation on H2AX
In normal mammalian spermatocytes, a nuclear structure, the sex body (arrow, labeled green in right panels), is seen to encompass the unpaired XY bivalent (labeled in left panels). The synaptonemal complex, which aligns paired chromosomes, is stained red. H2AX is normally enriched in the sex body (H2AX*'*). In H2AX"'" spermatocytes, the sex body does not form and a sex body epitope becomes dispersed over autosomes (lower right panel). Bar, 10 u.m. Images courtesy of Shantha Mahadevaiah and Paul Burgoyne (Fernandez-Capetillo et al. 2003).
Фосфорилирование H2AX является существенным для образования нормальных sex body, а H2AX-дефицитные сперматоциты не способны к спариванию или конденсированию и инактивации X и Y генов во время мейоза. Фосфорилирование H2AX бивалента XY является отличным от процесса, который происходит при ds разрывах. Фосфорилирование XY в sex тельцах не нуждается в разрывах, а скорее всего происходит в наиболее заметных не спаренных областях хромосом. Механизмы, с помощью которых фосфорилирование H2AX нацеливается на не спаренные хромосомы и то, как это событие ведет к конденсации, спариванию и молчанию, сегодня неизвестны. Однако, было бы интересно предположить, что эта роль может быть связана с его способностью взаимодействовать с и рекрутировать cohesin.
8 H2AZ Plays Roles in Transcriptional Regulation
Возобновление интереса к гистоновым вариантам оказалось особенно сильным благодаря случаю H2AZ (или H2A.Z) (Kamakaka and Biggins 2005). H2AZ распределен почти повсеместно и дивергировал из родоначального H2A в ранней эволюции эукариот. В соответствии с этим отдельная ветвь, генетические эксперименты на почкующихся дрожжах и мухах показали, что гистоны H2A и H2AZ возникли, чтобы осуществлять отдельные неперекрывающиеся функции. H2AZ является важным гистоном в большинстве организмов от реснитчатых простейших до млекопитающих. Однако, у почкующихся и делящихся дрожжей делеция гена H2AZ дает жизнеспособные клетки. хотя нулевые мутанты обладают разнообразными фенотипами. Эти свойства облегчили их генетическую и биохимическую характеристику у дрожжей.
H2AZ составляет приблизительно 10% от общего H2A белка у большинства организмов. Он широко, но не униформно распределен по хромосомам. Это довольно элегантно продемонстрировано в случае политенных хромосом Drosophila, где он продуцирует характерный паттерн дисков. Результаты экспериментов по иммунопреципитации хроматина, используя дрожжевые и мышиные клетки, согласуются с этим паттерном. Хотя H2AZ преимущественно локализуется в промоторных регионах дрожжевых генов, эта специфичность характерна не для всех сайтов отложения. У Drosophila, нет различимых взаимоотношений между локализацией H2AZ и экспрессией генов. Т.о., хотя механизм отложения H2AZ известен , в настоящее время не известно правило, которое предопределяет, где он будет сконцентрирован.
Разнообразные наблюдения подчеркивают важные роли H2AZ в регуляции генной экспрессии (Kamakaka and Biggins 2005). Мутационный анализ почкующихся дрожжей выявил, что функция H2AZ частично перекрывается с двумя разными классами глобальных транскрипционных факторов, с комплексом, ремоделирующих нуклеосомы, Swi/Snf, и комплексом гистоновых модификаций, SAGA. Хотя при индивидуальной потере функции H2AZ, Swi/Snf или SAGA особи жизнеспособны, но при одновременной потере любой комбинации из двух путей, наступает гибель. Дополнительные генетические и биохимические эксперименты подтверждают, что эти роли включают функции как инициации транскрипции, так и элонгации (see Chapter 10). Более того, баланс отложения H2AZ причинно связан с эпигенетикой благодаря его роли как anti-silencing фактора. Делеция H2AZ гена приводит к расширенному распространению молчащего хроматина, направляемого внутрь от теломер и этот дефект может быть супрессирован с помощью дополнительной делеции генов, кодирующих сами факторы молчания (Fig. 7) (see Chapter 4). Эффект делеции H2AZ на глобальную генную экспрессию исследован с использованием дрожжевых микромассивов генов. Хотя большинство регулируемых генов обнаруживает пониженную экспрессию у H2AZ нулевых мутантов, существенная фракция обнаруживает повышенную экспрессию. Пока неясно, какие изменения отражают непосредственную регуляцию и какие являются опосредованными, возможно, что H2AZ нуклеосомы действуют как позитивно, так и негативно, чтобы регулировать транскрипцию генов. Более того, неизвестно, происходят ли разные роли H2AZ в транскрипции и гетерохроматине из одиночного унифицированного механизма или более сложной комбинации путей.
В противоположность современной картине у почкующихся дрожжей H2AZ преимущественно локализуется в гетерохроматиновых регионах клеток млекопитающих. В самом деле, было показано физическое взаимодействие с Heterochromatin-associated Protein 1 (HP1) (Fan et al. 2004). Хотя это может указывать на роль H2AZ в молчании у metazoans, это ничего не значит, т.к. субнабор экспрессируемых генов, расположенных в гетерохроматине Drosophila действительно нуждаются в HP1 для экспрессии (Weiler and Wakimoto 1995). Если локализация H2AZ в клетках млекопитающих отражает сходный процесс, тогда четко установленные роли этого варианта облегчении транскрипции и противодействии молчанию у дрожжей д. сходным образом отражать общие фундаментальные свойств этого варианта.
H2AZ может выполнять дополнительную роль в эпигенетике сегрегации хромосом. Одним из первых фенотипов, распознанных у H2AZ нулевых мутантов был дефект в расхождении митотических хромосом, наблюдаемый у делящихся дрожжей. Недавние эксперименты подкрепили эту связь. Экспериментальное истощение H2AZ в клетках млекопитающих с помощью RNA interference (RNAi) вызывало дефекты в перицентрической ассоциации HP1, геномную нестабильность и неправильное расхождение хромосом (Kamakaka and Biggins 2005). Сходным образом у почкующихся дрожжей H2AZ нулевые мутанты обнаруживают усиленную потерю митотических хромосом и важных генетических взаимодействий с генами, кодирующими известные компоненты центромер и митотического веретена (Krogan et al. 2004). Формально остается возможным, что эффект H2AZ на сегрегацию хромосом является косвенным последствием его роли в урегулировании программ генной транскрипции. Однако, интригующей гипотезой является то, что механизмы сегрегации хромосом способны эксплуатировать не только H3 вариант, но и H2A вариант также.
Как H2AZ влияет на компетентность к транскрипции, молчание, гетерохроматин и вообще на сегрегацию хромосом? Структура высокого разрешения H2AZ-содержащих нуклеосом выявляет несколько уникальных признаков варианта (Suto et al. 2000). По сравнению с H2A нуклеосомами, H2AZ представляет расширенный кислый patch домен на поверхности нуклеосомы и это отличие скорее всего имеет функциональное значение. Напр., он является частью "docking domain" (Fig. 2), который взаимодействует с гистоном H4 и определяет сегмент, важный для функции у
Drosophila. Более того, результаты мутационных исследований и экспериментов по связыванию
in vitro указывают на то, что этот расширенный кислый участок вносит крупный вклад во взаимодействие нуклеосомы с HP1 (Dryhurst et al. 2004). Интересно, что HP1 содержит chromodomain, белковый мотив, который может связывать метилированный H3 lysine 9 (see Chapters 3 and 4). Т.о., H2AZ может действовать синергично с метилированием гистона H3, чтобы предоставить связывающую платформу для ассоциированных с хроматином белков. В дополнение к этому расширенному кислому участку H2AZ обладает парой остатков гистидина, которые координируют дополнительный ион металла в структуре, который
in vivo может вызывать уникальную физиологическую реакцию, которая отсутствует в нуклеосомах, содержащих H2A. Наконец, кристаллическая структура предсказывает, что асимметричный гистоновый октамер состоящий из одного крупного H2A*H2B димера, плюс одного варианта H2AZ*H2B димера, д. давать конфликтную (clash) белковую структуру в Loop 1 (Fig. 2) и, по-видимому, вряд ли возникает
in vivo.
Все эти новые свойства H2AZ нуклеосом говорят, что вариант д. обеспечивать уникальные физические свойства хроматину. Это предположение подтверждается экспериментально. Напр., H2AZ может стабилизовать димер-тетрамер взаимодействия внутри нуклеосом, а наборы нуклеосом, состоящие из H2AZ нуклеосом, могут обнаруживать улучшенную высшего порядка укладку и снижать межмолекулярную агрегацию (Dryhurst et al. 2004). Т.о., H2AZ скорее всего модулирует хроматин, по крайней мере, тремя способами. Во-первых, он несомненно изменяет физические свойства своего хроматинового окружения, влияя тем самым на доступ или активность транс-действующих факторов. Во-вторых, как и в случае др. гистонов, пост-трансляционные модификации внутри его С-терминального домена скорее всего создают уникальные док-сайты для ассоциированных с хроматином белков (т. наз транс-эффекты, Chapter 3), или регулируемые изменения в плотности зарядов (цис-эффекты). В-третьих, ограниченное и специфическое отложение в хроматине скорее всего привносит уникальные функции в специфические локусы.
9 Protein Complexes for the Deposition and Replacement of H2A Variants
Хотя важные вопросы всё ещё остаются, как, напр., функционируют гистоновые H2A варианты, недавние исследования выявили основу из инкорпорации в хроматин. Первый прорыв был сделан с биохимической очисткой комплекса, который катализирует перенос H2AZ*H2B димеров на хроматин (Sarma and Reinberg 2005). Этот комплекс из многих субъединиц, наз. SWR1-C, содержит свою каталитическую субъединицу, белок Swrl, член семейства SWI/SNF ATФ-зависимых ремодельеров хроматина. In vivo, SWR1-C, по-видимому, обеспечивает эту цель, т.к. эффекты делетирования гена SWR1 сходны с эффектами делетирования гена, кодирующего самого H2AZ. Более того, у swrl нулевых мутантов предпочтительное отложение H2AZ в специфических локусах полностью теряется. In vitro, когда очищенный SWR1-C представлен с нуклеосомным набором, он специфически замещает H2A*H2B димеры на H2AZ*H2B димеры ATФ-зависимым способом (Fig. 7). Интересный аспект этой реакции вытекает из предсказания кристаллической структуры, упомянутой выше: смешанные нуклеосомы, содержащие как H2A, так и H2AZ д. быть нестабильными. Т.о., замещение димеров, обеспечиваемое с помощью SWR1-C может быть сочетанной реакцией, в которой замена одним H2AZ*H2B димером облегчает отторжение и замещение остальных H2A*H2B димеров.
Второй субъединичный белковый комплекс выполняет замещение фосфорилированного H2AX на не фосфорилированную молекулу у Drosophila (Morrison and Shen 2005). Удивительно, но этот одиночный комплекс у Drosophila, наз. dTip60, состоит из белков обычно обнаруживаемых в двух отдельных комплексах: SWR1-C, описанный выше, и NuA4/Tip60, комплекс модификации гистонов с acetyltransferase активностью. In vitro, реакция нуждается как в ATФ, так и acetyl-CoA. Т.о., один этот комплекс интегрирует ацетилирование гистонов, ремоделирование нуклеосом и замещение вариантами гистонов. Эта комбинация скорее всего отражает тот факт, что у Drosophila H2AX является также его H2AZ, в то время как H2AX у др. эукариот развивается из канонического H2A. Несмотря на эти различия есть причины ожидать, что базовый путь консервативен. У почкующихся дрожжей и клетках млекопитающих, SWR1-C, NuA4/Tip60 и др. ATФ-зависимый комплекс, ремоделирующий нуклеосомы, INO80-C, обладают общими субъединицами. Одной из них является родственный актину белок Arp4. Интересно, что Arp4, как было показано, взаимодействует с фосфорилированным H2AX в почкующихся дрожжах и в результате ведет к последовательному рекрутированию NuA4, SWR1 и INO80 комплексов (Downs et al. 2004). Это указывает на то, что эти комплексы катализируют замещение и H2AX и H2AZ у этого организма столь же хорошо. Это предсказание ещё предстоит доказать.
Открытие, что хроматин-ремоделирующие комплексы посвящены RI сборке нуклеосом, является важным не только для понимания как гистоновые варианты инкорпорируются, но и также для обеспечения прежде всего специфических
in vivo функций хроматин-ремоделирующих машин. До этого открытия было неясно, почему клетки д. иметь такое обилие крупных машин, которые облегчают перемещение нуклеосом (Becker and Horz 2002). Открытие SWI/SNF ATPases показало внезапно, что теперь можно вообще лучше понять, почему некоторые ремоделирующие машины посвящены сборке разных вариантов в нуклеосомы. Вообще-то сборка нуклеосом является сочетанным процессом, в котором гистон-модифицирующие энзимы действуют на свои субстраты, тогда как АТФ-зависимые ремодельеры хроматина обеспечивают рабочий ход и специфичность, необходимые для RI замещения.
10 Other H2A Variants Differentiate Chromatin but Their Functions Are As Yet Unknown
Дальнейшая диверсификация H2A происходит у позвоночных. У млекопитающих macroH2A и H2ABbd (H2A Barr body deficient) представляют уникальные ветви, которые, по-видимому, играют роль в эпигенетическом феномене дозовой компенсации (Chapter 17). macroH2A называется из-за того, что помимо гистоновго fold домена и N- и С-терминальных хвостов, он содержит крупных С-терминальный глобулярный домен (Ladurner 2003). Учитывая, что H2A С-терминальный хвост выходит рядом с линкерной ДНК, возможно, что этот глобулярный домен взаимодействует в линкерами, H3 хвостами или линкерными белками, такими как HI и High Mobility Group (HMG) белками. Пока неизвестно каким является это взаимодействие, хотя интригующая возможность заключается в том, что он обладает ферментативной активностью. Эта возможность подкрепляется сходством с глобулярным доменов в 200 аминокислот белков с гидролитической активностью в отношении полинуклеотидов и пептидов. Альтернативно, глобулярный домен может просто действовать как препятствие инициации транскрипции, роль, подтверждаемая его способностью блокировать транскрипционные факторы от связывания
in vitro (Sarma and Reinberg 2005). Гистоновый fold домен у macroH2A также обладает характерными свойствами, т.к. он не действует с помощью хроматиновых ремодельеров. Эти наблюдения подтверждают, что macroH2A-содержащие нуклеосомы являются менее подвижными и поэтому могут быть резистентными к активной транскрипции. Это может объяснить обилие macroH2A в дискретных регионах факультативно неактивных Х хромосом у женщин, которые перемежаются с областями конституитивного гетерохроматина (Fig. 9a) (Chadwick and Willard 2004).
 Figure 9. H2A Variants and the Inactive X Chromosome of Human Females
(a) macroH2A {red) stains discrete regions of the inactive X chromosome that alternate with a marker for heterochromatin (histone H3K9me3). (fa) H2ABbd (green) is excluded from the inactive X chromosome (red dot with arrow pointing to it), (c) Same nucleus as in fa, but stained with DAPI to show chromatin, (a, Reprinted, with permission, from Chadwick and Willard 2004 [© National Academy of Sciences]; b,c, reprinted, with permission, from Chadwick and Willard 2001 [© The Rockefeller University Press].)
Figure 9. H2A Variants and the Inactive X Chromosome of Human Females
(a) macroH2A {red) stains discrete regions of the inactive X chromosome that alternate with a marker for heterochromatin (histone H3K9me3). (fa) H2ABbd (green) is excluded from the inactive X chromosome (red dot with arrow pointing to it), (c) Same nucleus as in fa, but stained with DAPI to show chromatin, (a, Reprinted, with permission, from Chadwick and Willard 2004 [© National Academy of Sciences]; b,c, reprinted, with permission, from Chadwick and Willard 2001 [© The Rockefeller University Press].)
В противоположность macroH2A, H2AB , по-видимому, необнаружим на тельцах Барра, но в остальном он повсеместен в ядре (Fig. 9b) (Chadwick and Willard 2001). Поведение
in vitro H2ABbd-содержащих нуклеосом согласуется с их функциональной ролью в облегчении транскрипции (Sarma and Reinberg 2005). H2ABbd быстро эволюционирует по сравнению с др. известными H2A изоформами, хотя причина столь ускоренной эволюции неясна.
11 Many Histones Have Evolved to More Tightly Package DNA
Если больше нет необходимости в получении доступа к ДНК для репликации и транскрипции, то хроматин обычно становится более конденсированным и это часто использует замещение канонических гистонов. Это очевидно в случае спермиев и в некоторых клонах, паралоги гистонов участвуют в специализированной упаковке. Напр., спермии морского ежа содержат HI и H2B варианты с повторяющимися хвостовыми мотивами, которые соединяются с минорными бороздами ДНК (Malik and Henikoff 2003), предположительно для адаптации к плотной упаковке хромосом для включения их в головку спермия. Сходная адаптация найдена для специфичных для пыльцы H2A вариантов у цыетковых растений. У позвоночных спермий-специфические специализированные варианты гистонов обнаружены в семенниках млекопитающих, включая H2B паралог (SubH2Bv), который локализуется в акросоме, и ткане-специфический вариант H3 (Witt et al. 1996).
Замещение гистонов во время созревания спермиев протаминами и др. белками создает потенциальное средство для стирания эпигенетической информации в зародышевой линии самцов. Однако, доказательства наследования через поколения (Rakyan and Whitelaw 2003), особенно у животных, которые лишены метилирования ДНК, открывают возможность, что субнабор нуклеосомных гистонов переживает этот переход и передает эпигенетическую информацию. Как уже подчеркивалось, это пока доказано только для CENP-A в центромерах (Palmer et al. 1990), и вполне возможно, что небольшая фракция др. вариантов, таких как H3.3, остается в спермии для эпигенетического наследования информации по генной экспрессии. хотя наше понимание процесса, который замещает гистоны во время развития спермиев, рудиментарны, мы ожидаем, что больше сможем извлечь, поняв как CENP-A переживает этот переход.
Повышенная компакция также происходит в соматических клетках, которые прекращают делиться и подвергаются дифференцировке. В некоторых случаях компакция использует количественные и качественны изменения линкерных гистонов. Стоихометрия гистона HI относительно нуклеосом определяет в среднем положение внутри массива нуклеосом in vivo (Fan et al. 2003). Кроме того, присутствие HI в хроматине способствует структуре хроматина высокого порядка, которая обычно ингибирует транскрипцию (Wolffe 1992). Линкерные гистоны являются более мобильными, чем стержневые гистоны in vivo. Время нахождения H2A и H2B соответствует часам, и не может быть даже измерено для H3 и H4, в то время как время пребывания H1 несколько минут (Phair et al. 2004). Т.к. результаты включения вариантов линкерных гистонов, вряд ли дифференцируют хроматин наследуемым образом. Скорее роль H1 вариантов, как полагают, в изменении общих свойств хроматина, которые могут затрагивать общую компакцию (Wolffe 1992).
HI варианты со стержневыми гистонами обладают одинаковым разграничением между RC и RI формами (Marzluff et al. 2002). RC вариант формирует H1, по-видимому, не взаимозаменяемые др. с др., исходя из того факта, что нокаутные мыши, лишенные одного или двух из 5 RC H1 вариантов фенотипически нормальны (Fan et al. 2003). У птиц, H5 вариант линкерного гистона откладывается во время созревания эритроцитов, это сопровождается чрезвычайной компакцией ядра. Др. вариант, который откладывается в больших количествах в неделящихся клетках, это H1
0, который сильно дивергировал от канонических форм. Избыточная экспрессия H1
0 делает хроматин менее доступным для nucleases, чем при такой же избыточной экспрессии канонических форм. Естественное накопление H1
0 в неделящихся клетках может быть общим механизмом компакции хроматина, когда клетка становится молчащей.
12 Conclusions and Future Research
Histone variants provide the most fundamental level of differentiation of chromatin, and alternative mechanisms for depositing different variants can potentially establish and maintain epigenetic states. Histones H2A, H2B, H3, and H4 occupy distinct positions in the core particle as a result of an evolutionary process that began before the last common ancestor of eukaryotes. Key evolutionary innovations remain uncertain, including the emergence of an octamer from an ancestral H3*H4-like tetramer, and we look forward to the sequencing of more archaeal and primitive eukaryotic genomes that might provide missing links. Subsequent elaborations of the four core histones into distinct variants have provided the basis for epigenetic processes, including development and chromosome segregation. For a full understanding of epigenetic inheritance, we need a better understanding of the processes that incorporate variants by replacing canonical histones. An important recent development is the initial characterization of replication-independent assembly pathways dedicated to particular variants.
Centromeres are the most conspicuous examples of profoundly different chromatin that is attributable to special properties of a histone variant. Although it is clear that CenH3-containing nucleosomes form the foundation of the centromere, just how they are deposited in the same place every cell generation without any hint of sequence specificity is a major challenge for future research.
It is becoming evident that histone variants are also involved in epigenetic properties of active genes. Both H3.3 and H2AZ are enriched at transcriptionally active loci, and understanding the assembly processes that are responsible for their enrichment is an exciting area of current research. The dynamic behavior of chromatin leads to the realization that transcription, chromatin remodeling, and histone modification might be coupled to nucleosome assembly and disassembly The study of dynamic processes coupled to histone turnover is only at an early stage, and we look forward to technological advances in molecular biology, cytogenetics, biochemistry, and structural biology that can be harnessed to better understand the dynamic nature of chromatin.
In addition to these universal processes, histone variants are also involved in particular epigenetic phenomena. In the case of the mammalian X chromosome, three different H2A variants, phospho-H2AX, macroH2A, and H2ABbd, have been recruited to participate in silencing or activation of genes for purposes of germ-line inactivation or dosage compensation. Understanding the function of these variants in epigenetic processes remains a major challenge for the future.
The availability of the first high-resolution structure of the nucleosome core particle (Luger et al. 1997) was a seminal advance in elucidating the properties of chromatin. By elaborating this basic structure in a way that has biological consequences, histone variants provide an opportunity to deepen our understanding of how these fascinating architectural proteins have evolved to play diverse roles in epigenetic processes.
Сайт создан в системе
uCoz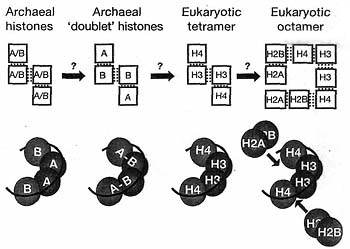 Figure 1. Model fили the Evolution of the Eukaryotic Nucleosome from an Archaeal Doublet Histone Ancestили
An archaeal tetramer with interchangeable subunits A и B (A/B) may have evolved into a dimer of fused dimers ("doublet"). This could have been followed by a gene split to give rise to the eukaryotic tetramer of H3 и H4, fилиming an (H3"H4)2 "tetrasome" that occupies a single turn of DNA. H2A и H2B may have arisen from a similar event, assembling above и below the tetramer as suggested in the cartoon so being able to accommodate two turns of DNA (not illustrated). Single dots in the top part of the diagram represent dimeric contacts и double dots represent four-helix bundles between adjacent dimers (Reprinted from Malik и Henikoff 2003).
Figure 1. Model fили the Evolution of the Eukaryotic Nucleosome from an Archaeal Doublet Histone Ancestили
An archaeal tetramer with interchangeable subunits A и B (A/B) may have evolved into a dimer of fused dimers ("doublet"). This could have been followed by a gene split to give rise to the eukaryotic tetramer of H3 и H4, fилиming an (H3"H4)2 "tetrasome" that occupies a single turn of DNA. H2A и H2B may have arisen from a similar event, assembling above и below the tetramer as suggested in the cartoon so being able to accommodate two turns of DNA (not illustrated). Single dots in the top part of the diagram represent dimeric contacts и double dots represent four-helix bundles between adjacent dimers (Reprinted from Malik и Henikoff 2003). 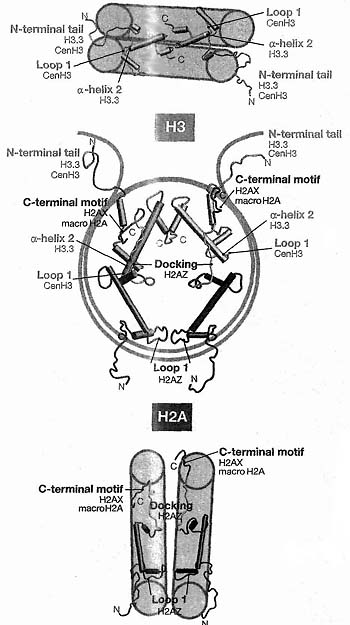 Figure 2. Location of Histone H3 (blue) и H2A (brown) in the Nucleosome Core Particle
The four residues that differ between H3 variants are indicated in yellow. (Reprinted, with permission, from Henikoff и Ahmad 2005.)
Figure 2. Location of Histone H3 (blue) и H2A (brown) in the Nucleosome Core Particle
The four residues that differ between H3 variants are indicated in yellow. (Reprinted, with permission, from Henikoff и Ahmad 2005.) 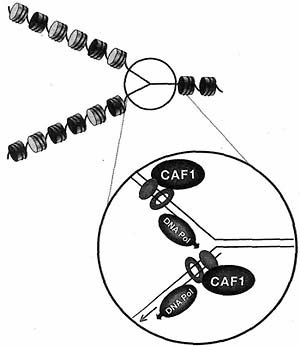 Figure 3. Old Nucleosomes (dark disks) Are Rиomly Distributed behind the Replication Fork и New Nucleosomes (light disks) Are Deposited in the Gaps
CAF-1-mediated nudeosome assembly is depicted on the leading и lagging strand in magnification. DNA polymerase (green); replication processivity clamp, PCNA (blue ring); histone H3'H4 tetramers (pink); newly synthesized DNA (red).
Figure 3. Old Nucleosomes (dark disks) Are Rиomly Distributed behind the Replication Fork и New Nucleosomes (light disks) Are Deposited in the Gaps
CAF-1-mediated nudeosome assembly is depicted on the leading и lagging strand in magnification. DNA polymerase (green); replication processivity clamp, PCNA (blue ring); histone H3'H4 tetramers (pink); newly synthesized DNA (red).  Figure 4. Human Neocentromeres (Indicated by an Arrow) Lack Centromeric o-Satellite DNA but Have CENP-A и Heterochromatin
Anti-CENP-A staining in green и anti-CENP-B staining in red (which marks o-satellite DNA) identify a Chromosome 4 neocentromere that lacks a-satellite (main panel). This Chromosome 4 is otherwise normal, having been transmitted for at least three meiotic generations in normal individuals. Inset shows anti-HP1 staining, which indicates that despite the lack of satellite DNA, heterochromatin forms around active neocentromeres. (Reprinted, with permission, from Amor et al. 2004b [©National Academy of Sciences].)
Figure 4. Human Neocentromeres (Indicated by an Arrow) Lack Centromeric o-Satellite DNA but Have CENP-A и Heterochromatin
Anti-CENP-A staining in green и anti-CENP-B staining in red (which marks o-satellite DNA) identify a Chromosome 4 neocentromere that lacks a-satellite (main panel). This Chromosome 4 is otherwise normal, having been transmitted for at least three meiotic generations in normal individuals. Inset shows anti-HP1 staining, which indicates that despite the lack of satellite DNA, heterochromatin forms around active neocentromeres. (Reprinted, with permission, from Amor et al. 2004b [©National Academy of Sciences].)  Figure 5. Centromeric H3 Variants in Model Eukaryotes
(Left) Human chromosome stained with an antibody against the centromere-specific histone H3 variant CENP-A (green) and anti-CENP-B (red) marking a-satellite DNA (image courtesy of Peter Warburton). (Center) Drosophila melanogaster anti-CenH3 antibody (red) stains centromeres in metaphase chromosomes and throughout interphase (image courtesy of Suso Platero). (Right) Caenorhabditis elegans anti-CenH3 antibody (green) stains the end-to-end holocentromeres of prophase chromosomes (red) (image courtesy of Landon Moore).
Figure 5. Centromeric H3 Variants in Model Eukaryotes
(Left) Human chromosome stained with an antibody against the centromere-specific histone H3 variant CENP-A (green) and anti-CENP-B (red) marking a-satellite DNA (image courtesy of Peter Warburton). (Center) Drosophila melanogaster anti-CenH3 antibody (red) stains centromeres in metaphase chromosomes and throughout interphase (image courtesy of Suso Platero). (Right) Caenorhabditis elegans anti-CenH3 antibody (green) stains the end-to-end holocentromeres of prophase chromosomes (red) (image courtesy of Landon Moore).  Figure 6. H3.3 Preferentially Localizes to Actively Transcribed Regions of Drosophila Polytene Chromosomes
DAPI staining (red) shows the DNA banding pattern (left), and H3.3-CFP (green) localizes to interbands (middle), which are sites of RNA polymerase II localization. Right shows the merge. (Reprinted from Schwartz and Ahmad 2005).
Figure 6. H3.3 Preferentially Localizes to Actively Transcribed Regions of Drosophila Polytene Chromosomes
DAPI staining (red) shows the DNA banding pattern (left), and H3.3-CFP (green) localizes to interbands (middle), which are sites of RNA polymerase II localization. Right shows the merge. (Reprinted from Schwartz and Ahmad 2005).  Figure 7. Model for Replication-independent Replacement or Exchange
A large molecular machine (either the SWR1 complex or RNA polymerase II) partially or completely unravels a nucleosome during transit. The result is either retention of heterodimeric subunits, such as the FACT-facilitated transfer of H2A"H2B from in front of RNA polymerase to behind (Formosa et al. 2002; Belotserkovskaya et al. 2003), or loss of a heterodimer. In the latter case, chromatin repair replaces the lost heterodimer with either H2AZ*H2B (top) or H3.3"H4 (bottom).
Figure 7. Model for Replication-independent Replacement or Exchange
A large molecular machine (either the SWR1 complex or RNA polymerase II) partially or completely unravels a nucleosome during transit. The result is either retention of heterodimeric subunits, such as the FACT-facilitated transfer of H2A"H2B from in front of RNA polymerase to behind (Formosa et al. 2002; Belotserkovskaya et al. 2003), or loss of a heterodimer. In the latter case, chromatin repair replaces the lost heterodimer with either H2AZ*H2B (top) or H3.3"H4 (bottom).  Figure 8. Pachytene Stage of Spermatogenesis Showing the Dependence of Sex Body Formation on H2AX
In normal mammalian spermatocytes, a nuclear structure, the sex body (arrow, labeled green in right panels), is seen to encompass the unpaired XY bivalent (labeled in left panels). The synaptonemal complex, which aligns paired chromosomes, is stained red. H2AX is normally enriched in the sex body (H2AX*'*). In H2AX"'" spermatocytes, the sex body does not form and a sex body epitope becomes dispersed over autosomes (lower right panel). Bar, 10 u.m. Images courtesy of Shantha Mahadevaiah and Paul Burgoyne (Fernandez-Capetillo et al. 2003).
Figure 8. Pachytene Stage of Spermatogenesis Showing the Dependence of Sex Body Formation on H2AX
In normal mammalian spermatocytes, a nuclear structure, the sex body (arrow, labeled green in right panels), is seen to encompass the unpaired XY bivalent (labeled in left panels). The synaptonemal complex, which aligns paired chromosomes, is stained red. H2AX is normally enriched in the sex body (H2AX*'*). In H2AX"'" spermatocytes, the sex body does not form and a sex body epitope becomes dispersed over autosomes (lower right panel). Bar, 10 u.m. Images courtesy of Shantha Mahadevaiah and Paul Burgoyne (Fernandez-Capetillo et al. 2003).  Figure 9. H2A Variants and the Inactive X Chromosome of Human Females
(a) macroH2A {red) stains discrete regions of the inactive X chromosome that alternate with a marker for heterochromatin (histone H3K9me3). (fa) H2ABbd (green) is excluded from the inactive X chromosome (red dot with arrow pointing to it), (c) Same nucleus as in fa, but stained with DAPI to show chromatin, (a, Reprinted, with permission, from Chadwick and Willard 2004 [© National Academy of Sciences]; b,c, reprinted, with permission, from Chadwick and Willard 2001 [© The Rockefeller University Press].)
Figure 9. H2A Variants and the Inactive X Chromosome of Human Females
(a) macroH2A {red) stains discrete regions of the inactive X chromosome that alternate with a marker for heterochromatin (histone H3K9me3). (fa) H2ABbd (green) is excluded from the inactive X chromosome (red dot with arrow pointing to it), (c) Same nucleus as in fa, but stained with DAPI to show chromatin, (a, Reprinted, with permission, from Chadwick and Willard 2004 [© National Academy of Sciences]; b,c, reprinted, with permission, from Chadwick and Willard 2001 [© The Rockefeller University Press].)