Модель RNA-RNA targeting также подтверждается наблюдением, что компоненты RITS и RDRC комплексов могут быть локализованы на некодирующих центромерных РНК, используя
эксперименты по поперечному связыванию (Motamedi et al. 2004). Такое расположение является siRNA-зависимым, это указывает на то, что оно использует взаимодействия спаривания оснований с некодирующей РНК. Кроме того, оно нуждается в Clr4 HKMT, указывая тем самым, что оно купировано со связыванием RITS с метилированными H3K9 и происходит на хроматине. Несмотря на это возможность того, что siRNAs могут также распознавать непосредственно ДНК посредством взаимодействий спаривания оснований не может быть исключено, Напр., у растений siRNAs, которые комплементарны промоторным регионам, которые являются (преимущественно) не транскрибируемыми, всё ещё могут управлять метилированием ДНК, др. модификацией, которая имеет место во время образования гетерохроматина внутри этих регионов (see Chapter 9).
Рекрутирование Clr4 и Swi6 является ключевой ступенью в инициации метилирования гистона H3K9 и сборки гетерохроматина, согласно ауторегуляторной связанной с модификациями модели (Figs. 3 and 4) (Grewal and Moazed 2003). Однако, ассоциация RITS с хроматином и Clr4-катализируемое метилирования гистона H3K9 являются независимыми процессами, поэтому трудно определить событие, которое является инициальным триггером для RNAi-зависимой сборки гетерохроматина. Одним из решений этой проблемы является то, что siRNA-зависимые взаимодействия спаривания оснований могут предоставлять инициальный сигнал для сборки гетерохроматина (Fig. 4). В согласии с этой гипотезой, генерация de novo generation of ura4+ siRNAs способствует молчанию ранее активной копии ura4+ гена, которое связано с рекрутированием RITS и Swi6 на хроматин (Buhler ct al. 2006). Инициальное связывание RITS может быть, однако, временным и трудно определимым; стабильное связывание RITS с хроматином нуждается в двойных взаимодействиях между (1) RITS-связанными siRNAs и синтезируемым транскриптом и (2) связыванием chromo-домена Chpl с метилированным H3K9. В этой модели RITS сам по себе непосредственно рекрутирует Clr4. Альтернативно, Clr4 может рекрутироваться с помощью параллельного пути, который использует один или более ДНК-связывающих белка, как в случае замалчивания генов типа спаривания и в теломерных регионах (Jia et al. 2004; Kanoh et al. 2005). При любом сценарии, Clr4-обусловленное метилирование H3K9 д. быть необходимо для стаблизиции ассоциации RITS ч хроматином, что затем ведет к рекрутированию RDRC, синтезу dsRNA и генерации siRNA (Fig. 5).
Clr4, как недавно было установлено, является компонентом мультипротеиновго комплекса, который содержит гетерохроматиновый белок Rik1, a Cullin E3 ubiquitin ligase, Cul4, и несколько др. белков (Hong et al. 2005; Horn et al. 2005; Jia et al. 2005; Li et al. 2005). Эти Clr4-ассоциированные белки еще больше подкрепляют связь между РНК и формированием гетерохроматина. Белок Rik1 является членом большого семейства β propeller WD repeat белков, которые участвуют в связывании ДНК и РНК. Члены этого семейства белков включают include the Cleavage Polyadenylation Specificity Factor A (CPSF-A)? участвующий в сплайсинге пре-мРНК, a DNA damage binding 1 (Ddbl) белок участвует в связывании поврежденной УФЛ ДНК. CPSF-A является особенно интересным т.к. Rik1 обладает сходными последовательностями с его предполагаемым РНК-связывающим доменом, участвующим в распознавании последовательностей полиаденилирования мРНК (Barabino et al. 2000). Белок Ddbl, подобно Rik1, является компонентом Cul4 E3 ubiquitin ligase комплекса и участвует в распознавании и репарации поврежденной УФЛ ДНК (Higa et aL 2003; Zhong et al. 2003). Интересная возможность заключается в том, что Rik1 действует способом. который сходен с CPSF-A и Ddbl, соединяясь с RNAi-генерируемыми продуктами во время сборки гетерохроматина (Fig. 5).
8 RNAI-mediated Chromatin and DNA Modifications in Arabidopsis
Механизм, с помощью которого RNAi производит гетерохроматиновые модификации у растений, сходен с механизмом у делящихся дрожжей, но имеются также и множество отличий. Наиболее важным отличием является то, что растения имеют метилированную ДНК во многих репрессивных областях гетерохроматина. В этом отношении они напоминают позвоночных, но отличаются от червей и Drosophila (Lippman and Martienssen 2004). 4 генетических скрининга по мутациям, которые имеют отношение к РНК-обеспечиваемому TGS, открыли мутации в H3K9-специфических HKMTs и в компонентах RNAi, но они также выявили необходимую функцию DNA methyltransferases, SWI/SNF ремоделирующие комплексы и новую РНК полимеразу (Baulcombe 2004). Эти скрининги описаны в деталях в Chapter 9, но здесь мы кратко сравним механизм у делящихся дрожжей и растений.
Каждый из скринингов по silencing мутациям использовал инвертированные повторы, введенные в транс-положение, чтобы индуцировать молчание эндогенных или трансгенных репортерных генов. Смягчение молчания указывает на мутации, которые возникли в необходимом компоненте пути молчания. Использованными эндогенными генами были
PAI2 (участвует в биосинтезе аминокислот) (Mathieu and Bender 2004) и SUPERMAN (транскрипционный фактор, который регулирует развитие цветков) (Chan et al. 2004), а в качестве репортерных генов были использованы, управляемы или с помощью сильного вирусного промотора или сильного специфичного для семян промотора (Matzke et al. 2004). В каждом случае, промотор был предназначен к молчанию, в некоторых случаях вместе с остальной частью гена. Ряд генов был обнаружен благодаря этим скринингам (Figure 6) (see also Table 1 of Chapter 9). Идентифицирован только один RNAi мутант только в одном из скринингов и это был ген
argonaute (AG04). Однако, три из скринингов открыли мутации в DNA methyltransferases, включая
MET1 и CMT3. Третья DNA methyltransferase, родственная DNMT3 млекопитающих, открыта с помощью reverse генетики, т.к. её активность кодируется с помощью DRM1 и DRM2, двух перекрывающихся генов, неспособных быть детерминированными в одиночном мутантном скрининге (see Chapter 9). В самом деле, перекрывание может объяснить неспособность обнаружения дополнительных компонентов аппарата RNAi: напр., хотя DCL3 (DICER-LIKE 3) b RNA-DEPENDENT RNA POLYMERASE2 (RDRP) преимущественно необходимы для продукции 24-nt siRNA, ассоциированной с транспозонами и повторами, по крайней мере, два др. DCL гена у
Arabidopsis могут замещать DCL3 до некоторой степени (Gasciolli et al. 2005).
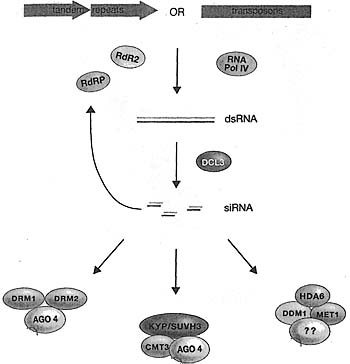 Figure 6. Summary of RNAi and Chromatin Proteins Required for RNAi-mediated DNA and Histone Mcthytation fa Arabidopsis
Synthesis of dsRNA from repeated DNA elements provides a substrate for Dicer-mediated cleavage and siRNA generation (DCL3 and other Dicers). RNA-directed RNA polymerases (RdRP, RdR2) and RNA polymerase IV (RNA Pol IV) may be directly involved in the synthesis of dsRNA or its amplification siRNAs then load onto Argonaute proteins (e.g., AG04), which is likely to help target cognate repeat sequences for DNA and H3K9 methylation in association with other factors.
Figure 6. Summary of RNAi and Chromatin Proteins Required for RNAi-mediated DNA and Histone Mcthytation fa Arabidopsis
Synthesis of dsRNA from repeated DNA elements provides a substrate for Dicer-mediated cleavage and siRNA generation (DCL3 and other Dicers). RNA-directed RNA polymerases (RdRP, RdR2) and RNA polymerase IV (RNA Pol IV) may be directly involved in the synthesis of dsRNA or its amplification siRNAs then load onto Argonaute proteins (e.g., AG04), which is likely to help target cognate repeat sequences for DNA and H3K9 methylation in association with other factors.
Lh/ мутанты, обнаруженные при
PAI2 скрининге, включают мутантов в гене H3K9 метилтрансферазы
KYP/SUVH4 и в chromodomain-содержащем гене ДНК метилтрансферазы
CMT3. Параллелизм в делящимися дрожжами в данном случае поразителен, т.к. комплекс RITS содержит как белок Argonaute, так и chromodomain белок Chpl, который зависит от H3K9 метилирования для свой ассоциации с хромосомой. В отличие от делящихся дрожжей, однако, потеря CMT3 или H3K9me2 не ведет к потере siRNA у
Arabidopsis (Lippman et al. 2003), и пока не совсем ясно, действительно ли эти белки формируют комплекс с AG04. Существуют однако несколько иных H3K9-специфических HKMTs у
Arabidopsis, по крайней мере, три из которых имеют генетическую функцию, так что перекрываемость также может быть частью объяснения (Ebbs et al. 2005).
Мутации в др. ДНК метилтрансферазах, MET1 и DRM1/2, в противопооложность мутациям в CMT3 ведут к потере накопления siRNA, по крайней мере, с субнабора транспозонов и с тандемных повторов, которые обычно дают siRNA, если они транскрибируются (Martienssen 2003). В этих случаях потеря siRNA коррелирует с потерей H3K9me2 (Cao et aL 2003; Lippman et al. 2003). Мутации в SWI2/SNF2 chromatin-ремоделирующей ATPase DDMl (decreased DNA methylation) также устраняют siRNA и накопление H3K9me2 с широкого круга транспозонов, хотя если siRNA сохраняется, то она является H3K9me2 (Lippman et al. 2003). Возможно, следовательно, что siRNA у растений связана с хромосомами посредством метилированных ДНК вместо или в дополнение к связыванию посредством метилированных гистонов, как в случае S. pombe (Fig. 7).
DDMl обладает изысканной специфичностью к транспозонам и повторам и д. каким-то образом распознавать их как являющихся отличными от генов. siRNA, вообще-то соединяющаяся с хромосомами посредством methyl-связывающих белков, д. обладать специфичностью, чтобы осуществлять подобное предназначение. Транспозоны и повторы у Arabidopsis являются главным источником 24-nt и некоторых 21-nt, siRNA, это согласуется с данной идеей (Lippman et al. 2004). Центромерные сателлитные повторы, которые располагаются в виде десятков тысяч тандемных копий на каждой из сторон каждой из центромер, также транскрибируются и превращаются с помощью RNAi (Fig. 6). Этот процессинг зависит от DCL3, RDR2 и DDMl. Молчание зависит также от H3K9me2 и CMT3. Однако, молчание более сложное, чем у делящихся дрожжей, т.к. ретротранспозоновые инсерции в повторы могут заставлять их молчать и это зависит от др. механизмов, включая MET1, DDMl и histone deacetylase HDA6 (May et al. 2005).
Как упоминалось ранее, у делящихся дрожжей субъединицы RNA pol II необходимы для молчания и продукции siRNA, это подтверждает идею, что аппарат RNAi- и chromatin-модификации рекрутируется на хромосомы с помощью синтезируемых транскриптов (Fig. 5). У
Arabidopsis две субъединицы новой RNA polymerase (RNA pol IV) были выявлены в одном из 4-х упомянутых выше скринингов (Kanno et al. 2005), но впервые были изолированы как слабые мутации в PTGS, вместе с мутациями РНК-зависимой RNA polymerase (Herr et al. 2005). Пока неизвестно, какая матрица используется RNA pol IV, но предполагается, что это как метилированная ДНК (Onodera et aL 2005), так и двунитчатая РНК (Vaughn and Martienssen 2005). Толькол самые крупные субъединицы являются уникальными для RNA pol IV, которые, по-видимому, используют тот же самый набор из малых субъединиц, что и RNA pol II. Кроме того, SWI2/SNF2 ремодельеры хроматина, которые также были открыты в этих скринингах, могут изменять локальную структуру хроматина, чтобы усилить производительность РНК полимераз. Следовательно, возможно, что они облегчают транскрипцию посредством RNA pol IV (Kanno et al. 2004). Сходную роль можно предположить для DDMl, хотя потребность в
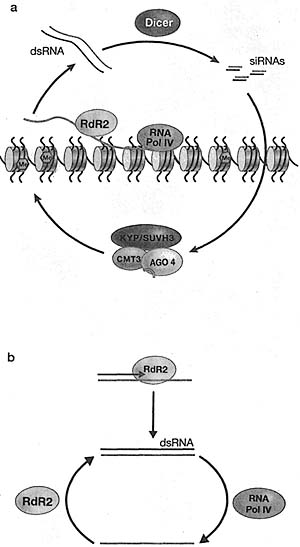 Figure 7. Hypothetical Models for the Role of RNA Pol IV In RNAi-directed DNA and/or Histone H3 Methylation
(a) RNA pol IV transcribes methylated DNA; RdR2 synthesizes dsRNA using the RNA pol IV product. siRNAs then direct a methyltransferase complex to the chromosome, (b) RNA pol IV uses a dsRNA template synthesized by RdR2 to produce more siRNA template.
Figure 7. Hypothetical Models for the Role of RNA Pol IV In RNAi-directed DNA and/or Histone H3 Methylation
(a) RNA pol IV transcribes methylated DNA; RdR2 synthesizes dsRNA using the RNA pol IV product. siRNAs then direct a methyltransferase complex to the chromosome, (b) RNA pol IV uses a dsRNA template synthesized by RdR2 to produce more siRNA template.
DDM1 (а также ремодельеров хроматина) в молчании транспозонов более сильная, чем таковая для RNA pol IV или др. SWI2/SNF2 белков.
Гены могут замалчиваться эпигенетически с помощью соседних транспозонов и важным примером у Arabidopsis является импринтированный гомеобоксный ген FWA (Kinoshita et al. 2004). Первые два экзона этого гена являются некодирующими и формируют тандемный повтор благодаря древней интеграции элемента SINE в этом сайте (Lippman et al. 2004). siRNAs с элемента SINE теряются у met1 (т.e., DNA methyltransferase) мутантов, а ген становится строго активированным в меристеме соцветия, приводя позднее к цветению. подобных фенотипов не наблюдалось у мутантов RNAi, даже если siRNA терялись, Вместо этого RNAi может играть роль в инициации молчания FWA, т.к FWA трансгены быстро становятся молчащими, когда впервые вносятся в растения и это молчание зависит от DCL3, RDR2 и AG04 (Chan et al. 2004). Молчание может затем поддерживаться с помощью метилирования ДНК, регулируемого за счет MET1. Сходным образом транспозоны, которые теряют siRNA у met1 мутантов, не могут быть принуждены к повторному молчанию при возвратных скрещиваниях, но те, которые не теряют siRNA могут замалчиваться посвторно, привлекая siRNA в возобновление молчания в цис-положении скорее, чем в транс (Lippman et al. 2003). Сходным образом, поздно цветущие FWA аллели стабильно наследуются в возвратных скрещиваниях после своего удаления из met1 или ddm1 мутантного фона, т.к. поддержание epialleles наследуемо (Soppe et al. 2000).
Наконец, возможно, что miRNA может управлять ДНК метилированием генов в некоторых условиях. DNA methylation of genes in some circumstances. мРНК с гена
PHABULOSA направляется на расщепление с помощью miRNA 165 и 166 у
Arabidopsis, a ген сам по себе метилируется ниже от области, которая соединяется (matches) с miRNA. Интересно, что эти match перекрывают соединения экзонов, так что сплайсированная РНК д. взаимодействовать с miRNA, если она ведет к метилированию (Bao et al. 2004). Однако, др. члены того же самого семейства генов не метилируются подобным образом и ни один из них не является геном мишенью для др. miRNA target genes (Martienssen et al. 2004; Ronemus and Martienssen 2005). Напротив, некоторые др. гены метилируются в геноме
Arabidopsis и обычно на своём 3' конце, с помощью механизма, который нуждается в MET1, но не в DDM1 (Lippman et al. 2004; Tran et al. 2005). Остается посмотреть, участвует ли РНК в этом случае.
9 Conservation of RNAi-mediated Chromatin Modifications in Animals
Вообще-то наиболее изученные примеры эпигенетического молчания обнаружены у животных, включая Drosophila и C. elegans, а также мышей. Роль РНК и RNA interference в транскрипционном молчании и модификациях гетерохроматина, по-видимому, законсервирована у некоторых модельных животных, а также у простейших и растений. У Drosophila, и PIWI и PIWI класса гомолог Argonaute, Aubergine (Sting), необходимы для эпигенетическго и гетерохроматинового молчания (see also Chapter 5). Gypsy ретротранспозоны являются мишенями для молчания в клетках овариальных фолликулов и в гонадах самок с помощью самого PIWI (Sarot et al. 2004). Это обеспечивается с помощью гетерохроматинового гена Flamenco (с ещё неизвестной функцией), и нуждается в 5'UTR из Gypsy polyprotein гена. Обнаружение 25-27-nt малых РНК в этой области подтверждает, они появляются за счет RNAi-обеспечиваемого механизма. Cut-and-paste ДНК транспозоны также затрагиваются RNAi. Напр., определенные теломерные Р элементы (типа ДНК транспозона) могут супрессировать транспозицию куда-либо в геноме, если наследуются посредством зародышевой линии самок, приводя к строго репрессивному "цитотипу". Эта репрессия полностью зависит от PIWI гомолога Aubergine, а также от Swi6 гомолога HP1 (Reiss et aL 2004). Оэне все P-репрессивные цитотипы, такие как те, что обеспечиваются др., не теломерными P элементами, зависят от Aubergine или HP1.
Несцепленные трансгены у Drosophila замалчиваются пост-транскрипционно, если присутствуют во многих копиях (Pal-Bhadra et al. 1997, 2002). Молчание ассоциирует с большими количествами 21-nt siRNA и зависит от PIWI. Слившиеся трансгены также могут заставлять молчать др. др. транскрипционно, по способу, который нуждается в хроматиновом репрессоре Polycomb. Такое молчание не ассоциирует с повышенными уровнями siRNA с трансгенных транскриптов, но (в основном) зависят от PIWI. Вовлечение Polycomb в этом примере и HP1 в др. примерах PlWI-зависимого молчания связано с использованием RNAi пути и метилирования гистонов в процессе молчания. Тандемное расположение трансгенов также вызывает мозаичный эффект положения у Drosophila, и это variegation строго супрессируется с помощью мутаций в HP1, а также в piwi, aubergine, и предполагаемой RNA helicase Spindle-E (homeless) (Pal-Bhadra et al. 2004). Трансгены, вставленные в центрический гетерохроматин, также затрагиваются, м гетерохроматические уровни H3K9me2 редуцируются в spindle-E мутантных клетках. Эти наблюдения строго подтверждают роль как белков хроматина, так и компонентов пути RNAi молчания генов в гетерохроматине Drosophila.
В зародышевой линии самцов Drosophila гетерохроматиновые Suppressor of Stellate повторы {Su(ste)), локализованные на Y хромосоме, транскрибируются первыми на антисмысловой нити и затем на обеих нитях во время развития сперматоцитов, возможно благодаря инсерции соседнего транспозона (Aravin et aL 2001). Эти ядерные транскрипты необходимы для замалчивания смысловых транскриптов близко родственного Х-сцепленного Stellate гена, чья избыточная экспрессия приводит к дефектам сперматогенеза. Хотя гетерохроматиновые последовательности участвуют, молчание в этом случае возникает пост-трансприционно, оно ассоциирует с 25-27-nt siRNA и зависит от Aubergine и Spindle-E.
У C elegans описан пример TGS в соматических клетках. Он зависит от генов RNAi пути rde-1, dcr-1 rde-4 и rrf-1, а также гомолога HP1 и аппарата модификации гистонов (Grishok et aL 2005). Соматический гетерохроматин не является широко распространенным у C. elegans, но пример естественно возникшего RNAi-зависимого гетерохроматинового молчания был описан в зародышевой линии (Sijen and Plasterk 2003). Во время мейоза не спаренные последовательности, такие как X хромосома у самцов молчат за счет H3K9me2 и это молчание зависит от РНК-зависимой RNA polymerase (Maine et al. 2005; see Chapter 15), напоминая мейотическое молчание не спаренной ДНК (MSUD) у Neurospora (see Shiu et al. 2001; Chapter 6). Однако, др. компоненты RNAi аппарата ещё не обнаружили свое участие в этом процессе и неизвестно, связано ли это механистически с RNAi-обеспечиваемой сборкой гетерохроматина у делящихся дрожжей.
Наконец, подобно Drosophila, клетки млекопитающих лишены генов, связанных с РНК-зависимыми RNA polymerases, обнаруженными у растений, червей и грибов. Тем не менее антисмысловая РНК участвует в большинстве широко изученных эпигенетических феноменов, импринтинге и Х инактивации (see Chapters 19 and 17, respectively). В случае инактивации Х 17-kb сплайсированная и полиаденилированная некодирующая РНК, известная как Xist, необходима для молчания неактивной Х хромосомы, с которой она экспрессируется. Напротив, Xist сама молчит на активной Х хромосоме, процесс, который зависит частично от антисмысловой РНК Tsix. Молчание сопровождается модификациями гистонов, ассоциированных с вышестоящими регионами хроматина, которые помечены H3K9me2 и H3K27tae3 (see Chapter 17). Молчание др. импринтированных локусов у мышей, включая Igf2r и Dtkl-Gtl2 регион, также поддерживается за счет антисмысловых транскриптов с отцовского и материнского аллеля, соотв. В случае Dlkl-Gtl2 эта некодирующая РНК специфически превращается в miRNA, которая находит антисмысловые транскрипты с отцовского аллеля, кодирующего sushi (gypsy) класса ретротранспозон (Davis et al. 2005).
Хотя параллели с прямой и обратной транскрипцией с гетерохроматиновых повторов у
S. pombe многочисленны, но роль самой RNAi в импринтинге и Х инактивации пока ускользает. Тем не менее внесение siRNA в линию раковых клеток может приводить к маркированию хроматина с помощью H3K9me2 на гомологичных промоторах (Ting et al. 2005). В некоторых случаях это может быть также результатом метилирования ДНК (Morris et aL 2004), вообще-то обеспечиваемым прямым связыванием малых РНК с ДНК-метилтрансферазами и DNA methylation binding белками (Jeffery and Nakielny 2004). Наконец, нокаут в клеточных линиях млекопитающих приводит к дефектам сегрегации хромосом, напоминающим те, что обнаружены у мутантных делящихся дрожжей, которые сопровождаются изменениями морфологии гетерохроматина, экспрессии сателлитных повторов и неправильной локализацией cohesin (Fukagawa et al. 2004; Kanellopoulou et aL 2005).
10 Concluding Remarks
The possibility that genes may be regulated by small RNA molecules was suggested over 40 years ago (Jacob and Monod 1961), as well as the notion that "control RNA" might be related to repeats (Britten and Davidson 1969). Since the identification of the lambda and lac repressors as site-specific DNA-binding proteins in Escherichia coli and the infecting bacteriophage lambda (Gilbert and Muller-Hill 1966; Ptashne 1967), studies of gene regulation have focused almost exclusively on the role of nucleic-acid-binding proteins as specificity factors. The discovery of small RNA molecules as specificity agents in diverse RNA silencing mechanisms now clearly establishes a role for RNA as a sequence-specific regulator of genes and their RNA products. Studies in fission yeast, Arabidopsisy and other model organisms have revealed a surprisingly direct role for small RNAs in mediating epi-genetic modifications of the genome that direct gene silencing and contribute to heterochromatic domains necessary for genome stability and nuclear division. Many important mechanistic questions remain at large, and future studies are likely to provide more surprises about how RNA regulates gene expression.
Сайт создан в системе
uCoz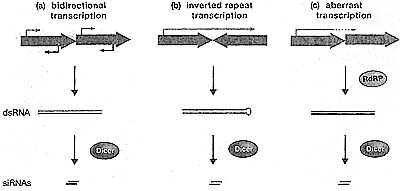 Figure 1. Sources of dsRNA, Which Act as a Substrate for Generation of siRNAs by the Dicer Ribonuclease, and Are the Trigger for RNA Silencing
(a) Bidirectional transcription has been observed at the 5. pombe centromeric repeats and the cenH region of the silent mating-type locus, (b) Transcription through inverted repeats found in many plant and animal cells can potentially produce dsRNA. (c) Transcription of aberrant RNAs that may lack proper processing signals may trigger dsRNA synthesis by RdRPs.
Figure 1. Sources of dsRNA, Which Act as a Substrate for Generation of siRNAs by the Dicer Ribonuclease, and Are the Trigger for RNA Silencing
(a) Bidirectional transcription has been observed at the 5. pombe centromeric repeats and the cenH region of the silent mating-type locus, (b) Transcription through inverted repeats found in many plant and animal cells can potentially produce dsRNA. (c) Transcription of aberrant RNAs that may lack proper processing signals may trigger dsRNA synthesis by RdRPs. 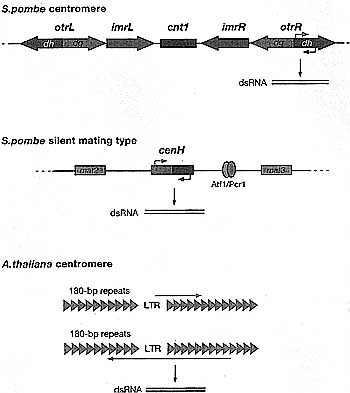 Figure 2. Organization of Heterochromatic Chromosome Regions in 5. pombe and A. thaliana
The centromere of 5. pombe chromosome 1 is shown as an example. The unique central core (cntl) region is flanked by innermost (imrL and imrR) and outermost (otrL and otrR) repeats. The otr region is transcribed in both directions, giving rise to forward (blue) and reverse (red) transcripts. The region between the mat2 and mat3 genes contains a domain that is homologous to the centromeric dg and dh repeats (cenH) and is also bidirectionally transcribed. Atfl and Perl are DNA-binding proteins that act in parallel with RNAi in mating-type silencing. Arabidopsis centromeres are composed of 180-bp repeats (green) interspersed with retrotransposable elements (yellow). Forward transcripts initiating within the long terminal repeat (LTR) of the retroelement and reverse transcripts initiating within the 180-bp repeats are indicated.
Figure 2. Organization of Heterochromatic Chromosome Regions in 5. pombe and A. thaliana
The centromere of 5. pombe chromosome 1 is shown as an example. The unique central core (cntl) region is flanked by innermost (imrL and imrR) and outermost (otrL and otrR) repeats. The otr region is transcribed in both directions, giving rise to forward (blue) and reverse (red) transcripts. The region between the mat2 and mat3 genes contains a domain that is homologous to the centromeric dg and dh repeats (cenH) and is also bidirectionally transcribed. Atfl and Perl are DNA-binding proteins that act in parallel with RNAi in mating-type silencing. Arabidopsis centromeres are composed of 180-bp repeats (green) interspersed with retrotransposable elements (yellow). Forward transcripts initiating within the long terminal repeat (LTR) of the retroelement and reverse transcripts initiating within the 180-bp repeats are indicated. 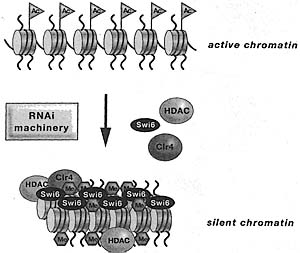 Figure 3. Assembly of Heterochromatin Involves the Concerted Action of Histone-modifying Enzymes (HDACs and Clr4). and Histone-Wnding Proteins (e.g., Swti) and Can Be Directed by the RNAi Machinery
Figure 3. Assembly of Heterochromatin Involves the Concerted Action of Histone-modifying Enzymes (HDACs and Clr4). and Histone-Wnding Proteins (e.g., Swti) and Can Be Directed by the RNAi Machinery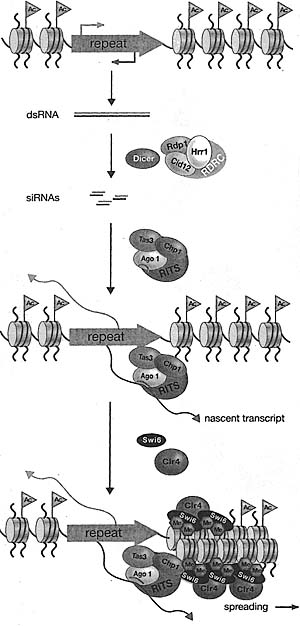 Figure 4. RNAi and siRNA-directed Assembly of Heterochromatin in S. pombe
Both Dicer and RDRC are required for siRNA generation. Initial targeting is proposed to involve RITS and siRNA-mediated recognition of cognate transcripts. The binding of RITS is stabilized by association of the chromodomain of Chpl with H3K9 methylated histone. The recruitment of Clr4 and Swi6 mediates the spreading of H3K9 methylation.
Figure 4. RNAi and siRNA-directed Assembly of Heterochromatin in S. pombe
Both Dicer and RDRC are required for siRNA generation. Initial targeting is proposed to involve RITS and siRNA-mediated recognition of cognate transcripts. The binding of RITS is stabilized by association of the chromodomain of Chpl with H3K9 methylated histone. The recruitment of Clr4 and Swi6 mediates the spreading of H3K9 methylation. 
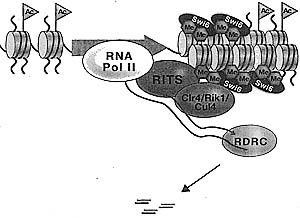 Figure 5. Model for Co-transcriptional dsRNA and siRNA Cener-ation, and Recruitment of the Or4-Wk1-Cul4 Histone Methyt-transferase Complex in 5. pombe
Figure 5. Model for Co-transcriptional dsRNA and siRNA Cener-ation, and Recruitment of the Or4-Wk1-Cul4 Histone Methyt-transferase Complex in 5. pombe  Figure 6. Summary of RNAi and Chromatin Proteins Required for RNAi-mediated DNA and Histone Mcthytation fa Arabidopsis
Synthesis of dsRNA from repeated DNA elements provides a substrate for Dicer-mediated cleavage and siRNA generation (DCL3 and other Dicers). RNA-directed RNA polymerases (RdRP, RdR2) and RNA polymerase IV (RNA Pol IV) may be directly involved in the synthesis of dsRNA or its amplification siRNAs then load onto Argonaute proteins (e.g., AG04), which is likely to help target cognate repeat sequences for DNA and H3K9 methylation in association with other factors.
Figure 6. Summary of RNAi and Chromatin Proteins Required for RNAi-mediated DNA and Histone Mcthytation fa Arabidopsis
Synthesis of dsRNA from repeated DNA elements provides a substrate for Dicer-mediated cleavage and siRNA generation (DCL3 and other Dicers). RNA-directed RNA polymerases (RdRP, RdR2) and RNA polymerase IV (RNA Pol IV) may be directly involved in the synthesis of dsRNA or its amplification siRNAs then load onto Argonaute proteins (e.g., AG04), which is likely to help target cognate repeat sequences for DNA and H3K9 methylation in association with other factors.  Figure 7. Hypothetical Models for the Role of RNA Pol IV In RNAi-directed DNA and/or Histone H3 Methylation
(a) RNA pol IV transcribes methylated DNA; RdR2 synthesizes dsRNA using the RNA pol IV product. siRNAs then direct a methyltransferase complex to the chromosome, (b) RNA pol IV uses a dsRNA template synthesized by RdR2 to produce more siRNA template.
Figure 7. Hypothetical Models for the Role of RNA Pol IV In RNAi-directed DNA and/or Histone H3 Methylation
(a) RNA pol IV transcribes methylated DNA; RdR2 synthesizes dsRNA using the RNA pol IV product. siRNAs then direct a methyltransferase complex to the chromosome, (b) RNA pol IV uses a dsRNA template synthesized by RdR2 to produce more siRNA template.