Role for EphrinB2 in Postnatal Lung Alveolar Development and Elastic Matrix Integrity | |
|
Alveoli are formed in the lung by the insertion of secondary tissue folds, termed septa, which are subsequently remodeled to form the mature alveolar wall. Secondary septation requires interplay between three cell types: endothelial cells forming capillaries, contractile interstitial myofibroblasts, and epithelial cells. Here, we report that postnatal lung alveolization critically requires ephrinB2, a ligand for Eph receptor tyrosine kinases expressed by the microvasculature. Mice homozygous for the hypomorphic knockin allele ephrinB2ΔV/ΔV, encoding mutant ephrinB2 with a disrupted C-terminal PDZ interaction motif, show severe postnatal lung defects including an almost complete absence of lung alveoli and abnormal and disorganized elastic matrix. Lung alveolar formation is not sensitive to loss of ephrinB2 cytoplasmic tyrosine phosphorylation sites. Postnatal day 1 mutant lungs show extracellular matrix alterations without differences in proportions of major distal cell populations. We conclude that lung alveolar formation relies on endothelial ephrinB2 function
|
Постнатальное развитие органов нуждается в скоординированном росте и коммуникациях между разными типами клеток. включая сосудистые эндотелиальные клетки. Напр., легкие млекопитающих высоко специализированы, чтобы оптимизировать газообмен между кровотоком и взыхаемым воздухом. Мыши рождаются с легкими, состоящими из простых тканевых стенок, наз. первичными перегородками, состоящими из двойного капиллярного слоя и интерстициальных клеток, заключенными в оболочку из эпителия. Во время последующего развития воздушные пространства легких быстро оказываются подразделенными за счет инсерций васкуляризованных тканевых складок,наз. вторичными перегородками, которые в конечном счете созревая формируют альвеолярные стенки (Burri, 2006). Движущая сила предоставляется интерстициальными миофибробластами, которые экспрессируют контрактильные белки во время образования вторичных перегородок (Adler et al., 1989; Jostarndt-Fogen et al., 1998; Wagner et al., 2003; Yamada et al., 2005). Клеточные процессы, детерминирующие образование вторичных перегородок, известны плохо, но предполагается существование реципрокных взаимодействий среди клеточных типов, присутсвующих в дистальных частях легких, а также в отложениях специализированного extracellular matrix (ECM; Massaro and Mas-saro, 2001; Schittny and Burri, 2004). Семейство Eph рецепторных тирозин киназ и их лигандов, ephrins, участвует в разнообразных морфогенетических процессах, включая развитие нейронов и сосудов (Pasquale, 2005; Heroult et al., 2006). EphrinB2, трансмембранный белок, обладающий своим собственным сигнальным потенциалом, экспрессируется в артериальных и лимфатических endothelial cells (ECs) , а также в периваскулярных клетках, а его рецептор, EphB4, в основном ограничен венозным и лимфатическим эндотелием (Wang et al., 1998; Adams et al., 1999; Gerety et al., 1999; Makinen et al., 2005) Э"rxgthbvtyns с использованием генного таргетинга у мышей показали. что эти белки являются критическими для эмбрионального sprouting ангиогенеза и вместе с др. членами семейства могут вносить сщественный вклад в специали зацию и созревание сосудистого ложа (Heroult et al, 2006).
Связанные с мембранами ephrin лиганды нуждаются в межклеточных контактах и в мультимерном задействовании для полной сигнальной активности (Davis et al., 1994; Stein et al., 1998; Egea et al., 2005). Финальная сосудистая реакция на взаимодействие ephrinB2 со своими рецепторами на соседних клетках осуществляется с помощью двунаправленных сигнальных взаимодействий внутри эндотелиальных популяций и между эндотелиальными клетками и соседними не-эндотелиальными популяциями (Heroult et al., 2006). Взаимодействие между ephrinB2 и EphB4 внутри сосудистого эндотелия м. предоставлять критические отталкиваюдщие сигналы, необходимые для закладки артерио-венозных границ, напоминающие репульсивное наведение конусов роста аквонов (Wang et al., 1998; Adams et al., 1999; Gerety et al., 1999; Gerety and Anderson, 2002). Однако взаимодействие ephrinB-Eph может также стимулировать врастание эндотелиальных клеток (Adams et al., 1999; Palmer et al., 2002). Эндотелиальный ephrinB2 может также взаимодействовать с рецепторами муральных клеток или околососудистой мезенхимы, чтобы влиять на сосудистое развитие (Adams et al., 1999; Oike et al., 2002; Umeda et al., 2004). Наконец, ephrinB2 в не-васкулярных клетках такж может влиять на формирование паттерна сосудов (Zhang et al., 2001; Foo et al., 2006). Т.о., результат передачи сигналов ephrinB2-рецептор может зависеть от клеточного контекста и вовлечение др. сигнальных компонентов, таких как рецепторы ростовых факторов (Pasquale, 2005; Zhang and Hughes, 2006).
Изучали гипоморфные аллели ephrin B2, мутантные кДНК которых, кодирующих модифицированный ephrinB2 белок , были нокаутированы в локусе ephrinB2 (Makinen et al., 2005; Bouzi-oukh et al., 2007). Аллель ephrinB2ΔV (Makinen et al., 2005) специфицирует ephrinB2, лишенный С-терминального valine, что нарушает сайт связывания белков. содержащих PDZ домен. Мыши гомозиготные по этому аллелю обнаруживали существенные лимфатические дефекты. включая тяжелые лимфатические пороки развития кожи, при этом кровеносные сосудистые сплетения кожи затрагивались лишь слегка. В этой работе расширили предыдущие исследования, чтобы описать нарушения развития легких у ephrinB2ΔV/ ΔV мышей. Эти мыши обнаруживали выраженные постнатальные дефекты легких, включая почти полное отсутствие альвеол. Снижение функции ephrinB2, который принципиально экспрессируется ECs аретриальных микрососудов в постнатальных легких, связано с приведением в беспорядок эластического матрикса, с аномалиями интерстициальных клеток и неспособностью к образованию вторичных перегородок. Более того, мыши, лишенные ephrinB2 рецепторов EphB3 обнаруживали более умеренные нарушения компонета эластического матрикса fibrillin-1. Полученные результаты указывают на вклад передачи сигналов Eph-ephrin в развитие альвеол легких и указывают на то, что этот путь может затрагиваться при болезнях легки х, связанных с нарушением образования альвеол.
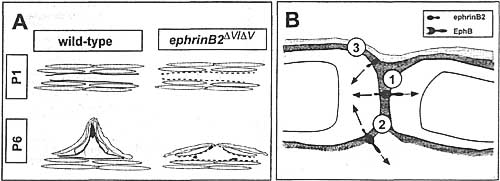 Fig. 9. Model of abnormal lung development ephrinB2ΔV/ΔV mice and molecular interactions between cells. A: Comparision of lung development in wild-type (left) and ephrinB2ΔV/ΔV (right) mice. Capillaries are shown in pale red; type I epithelial cells in grey; and contractile interstitial cete are shown in green, and normal and abnormal interstitial extracellular matrix (ECM) is indicated with solid and dashed blue lines, respectively, and elastin is Shown in bottom panels with black. Top panels: Postnatal day (P) 1 lung ECM components fibronectin and tenascin-C are impacted idashed blueines)before detected differences in cell proportion. Bottom panels: Lungs of P6 mutant mice show reduced secondary septation and disorganized smooth muscle actin (SMA) immune reactivity and elastin deposits. B: Possible routes for ephrinB2 signaling to influence ECM. The color scheme is the same as in A. Vascular ephrinB2 could interact with receptors expressed on adjacent endothelial cells or (indicated with 7); or with EphB3 on interstitial eels (2) to promote reverse signaling and possibly bidirectional signaling. Finally, unbound ephrinB2 (3) might also have signaling activity.
Fig. 9. Model of abnormal lung development ephrinB2ΔV/ΔV mice and molecular interactions between cells. A: Comparision of lung development in wild-type (left) and ephrinB2ΔV/ΔV (right) mice. Capillaries are shown in pale red; type I epithelial cells in grey; and contractile interstitial cete are shown in green, and normal and abnormal interstitial extracellular matrix (ECM) is indicated with solid and dashed blue lines, respectively, and elastin is Shown in bottom panels with black. Top panels: Postnatal day (P) 1 lung ECM components fibronectin and tenascin-C are impacted idashed blueines)before detected differences in cell proportion. Bottom panels: Lungs of P6 mutant mice show reduced secondary septation and disorganized smooth muscle actin (SMA) immune reactivity and elastin deposits. B: Possible routes for ephrinB2 signaling to influence ECM. The color scheme is the same as in A. Vascular ephrinB2 could interact with receptors expressed on adjacent endothelial cells or (indicated with 7); or with EphB3 on interstitial eels (2) to promote reverse signaling and possibly bidirectional signaling. Finally, unbound ephrinB2 (3) might also have signaling activity.
|