Транскрипционный фактор forkhead Foxc2 экспрессируется в развивающихся лимфатических сосудах и в лимфатических клапанах у взрослых (60, 61). У Foxc2
эмбрионов раннее лимфатическое развитие, по-видимому, происходит нормально. На более поздних стадиях лимфатические сосуды Foxc2-дефицитных эмбрионов, по-видимому, обнаруживают нерегулярный паттерн, оказываются тесно ассоциированными с аномально высоким количеством перицитов (PCs)/vSMCs и обнаруживают повышенное отложение белка BM коллагена IV (61). Присутствие PCs/vSMCs вокруг лимфатических капилляров у эмбрионов Foxc2
может быть обусловлено повышенной экспрессией Pdgfb и endoglin, участвующих в рекрутировании муральных клеток в кровеносные сосуды. Кроме того, собирающие лимфатические сосуды у Foxc2
эмбрионов лишены лимфатических клапанов. Аномально расположенные лимфатические сосуды с тесно ассоциированными PCs/vSMCs обнаруживаются также у мышей, двойных гетерозигот по Foxc2 и Vegfr3, указывая тем самым на кооперацию между этими двумя сигнальными путями. Эти данные указывают на то, что хотя и не нужный для раннего лимфатического развития, FOXC2 оказывается существенным на поздних стадиях, регулируя морфогенез лимфатических клапанов и контролируя взаимодействия LECs с муральными клетками, супрессируя экспрессию PDGF-B и endoglin и вызывая отложения коллагена of collagen IV, тем самым поддерживая фенотип лимфатических капилляров.
Syk and Slp76 Are Involved in the Separation of the Lymphatic and Vascular Systems
Лимфа возвращается в кровоток в основном посредством торакального и правого лимфатического протоков, которые соединяются с венами в яремной области. Дополнительные лимфатико-венозные сообщения существуют, по крайней мере, в почках, надпочечниках и печени, но они считаются нефункциональными за исключением случаев повышения внутри-лимфатического давления. Лимфатико-венозные анастомозы могут наблюдаться при lymphedema, chylous ascites и chylothorax (rev. in Reference 62).
Мыши, дефицитные по внутриклеточным сигнальным молекулам Syk или Slp76, экспрессируемыми почти исключительно в гематопоэтических, но не в эндотелиальных клетках, обнаруживают артерио-венозные шунты и аномальные лимфатико-венозные соединения, приводящие к заполнению кровью лимфатических сосудов (63). Это указывает на то, что циркулирующие гематопоэтические клетки, преимущественно эндотелиальные предшественники, необходимы для разделения лимфатической и кровеносной сосудистых систем. Syk и Slp76 могут быть необходимы для integrin-опосредованным ведением циркулирующих клеток эндотелиальных предшественников в сосудистый эндотелий.
LYMPHATIC VESSELS IN PATHOLOGICAL CONDITIONS
Tumor Lymphangiogenesis and Lymphatic Metastasis
Смертность при раке редко вызывается первичной опухолью, а скорее метастатическим распространением злокачественных клеток в удаленные органы. Хотя диссеминация опухолевых клеток может происходить посредством различных механизмов, включая локальную тканевую инвазию, непосредственное обсеменение полостей тела и распространение посредством кровеносной сосудистой системы, некоторые клинические и патологические наблюдения указывают на то, что многие типы плотных опухолей у людей используют наиболее распространенный путь инициальных метастазов посредством лимфатической системы в региональные лимфатические узлы (rev. in Reference 64). Распространение опухолевых клеток в лимфатические узлы посредством лимфатических сосудов давно используется в качестве важного прогностического признака агрессивности опухоли и в качестве критерия для выбора способа лечения (rev. in References 65 и 66). Несмотря на это механизмы лимфатических метастазов всё ещё плохо изучены.
Лимфатические сосуды часто содержат кластеры опухолевых клеток, часто наблюдаемые на периферии злокачественных опухолей. Однако существование функциональных лимфатических сосудов внутри раковых опухолей у людей и способность опухолей активно стимулировать лимфангиогенез пока дискуссионно. Лимфатические сосуды внутри опухолей выявляются в некоторых раковых опухолях у людей, а в некоторых случаях присутствие лимфатических сосудов внутри опухоли коррелирует позитивно с метастазами в лимфатические узлы и плохим прогнозом (67, 68). Однако внутриопухолевые лимфатические сосуды могут плохо функционировать и не нужны для лимфатических метастазов (69, 70).
Многие типы solid опухолей человека экспрессируют лимфангиогенный ростовой фактор VEGF-C, и многие клинико-патологические исследования сообщают о позитивной корреляции между его экспрессией и лимфатической инвазией, лимфатическими узлами и удаленным метастазированием и плохой выживаемостью пациентов, но не обязательно с плотностью ассоциированных с опухолью лимфатических сосудов (rev. in References 66, 71 и 72). Более того, VEGFR-3 позитивно регулируется в кровеносных сосудах опухолей и считается, что он вносит вклад в ангиогенез или в целостность сосудов опухолей (73, 74). Недавнее исследование прояснило участие VEGFR-3 в опухолевом ангиогенезе, показав, что блокирующие антитела против VEGFR-3 снижают ангиогенез и рост опухолей (75).
Во время последних нескольких лет роль VEGF-C и VEGF-D в прогрессировании опухолей служила предметом интенсивных экспериментальных исследований. В некоторых исследованиях использовались или ксенотрансплантации или модели трансгенных мышей, показавшие, что экспрессия этих факторов роста опухолевыми клетками индуцирует рост новых лимфатических сосудов - главным образом по краю опухоли, хотя в некоторых моделях также и внутри опухолей - а также расширение предсуществующих лимфатических сосудов, дренирующих опухоль (Figure 5) (69, 76-82).
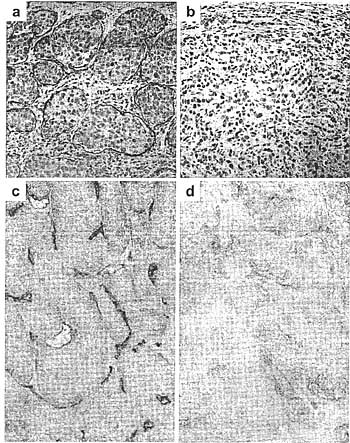 Figure 5
VEGF-C/VEGFR-3 pathway in tumors, (a) Expression of VEGF-C in MCF-7 human breast cancer cells implanted into the mammary fat pads of SGTD mice induces abundant lymphangiogcnesis at the tumor periphery (red Lyvel staining) and intralymphatic tumor growth, (b) The control MCF-7 tumors do not contain Lyve1-positive lymphatic vessels, (c and d) A human renal cell carcinoma stained with antibodies against VEGFR-3 (c, red-brawn) or control antibodies (d). VEGFR-3 is predominantly localized in endothelial cells of tumor blood and lymphatic vessels but not in minor cells. Figures in panels c and d courtesy of Leif Anderson.
Figure 5
VEGF-C/VEGFR-3 pathway in tumors, (a) Expression of VEGF-C in MCF-7 human breast cancer cells implanted into the mammary fat pads of SGTD mice induces abundant lymphangiogcnesis at the tumor periphery (red Lyvel staining) and intralymphatic tumor growth, (b) The control MCF-7 tumors do not contain Lyve1-positive lymphatic vessels, (c and d) A human renal cell carcinoma stained with antibodies against VEGFR-3 (c, red-brawn) or control antibodies (d). VEGFR-3 is predominantly localized in endothelial cells of tumor blood and lymphatic vessels but not in minor cells. Figures in panels c and d courtesy of Leif Anderson.
Более того, ассоциированный с опухолями лимфангиогенез увеличивает лимфатическое метастазирование опухолей (Figure 6) (69, 76-78, 80-82). Опухолевый лимфангиогенез и лимфатическое метастазирование могут эффективно ингибироваться с помощью взаимодействия с лигандом индуцированным путем VEGFR-3 или с помощью растворимых VEGFR-3 слитых белков, действующих как ловушки VEGF-C/-D (55, 79, 83-85), с помощью нейтрализующих VEGFR-3 антител (75, 86, 87), с помощью малыми interfering РНК обусловленным подавлением VEGF-C (88) и с помощью нейтрализующих VEGF-D антител (77). Ингибирование VEGF-C/-D VEGFR-3 пути не затрагивает нормальных лимфатических сосудов у взрослых и может таким образом служить мощным и безопасным методом, предупреждающим лимфатическое метастазирование опухолей (26). Активированные сосуды в опухолях
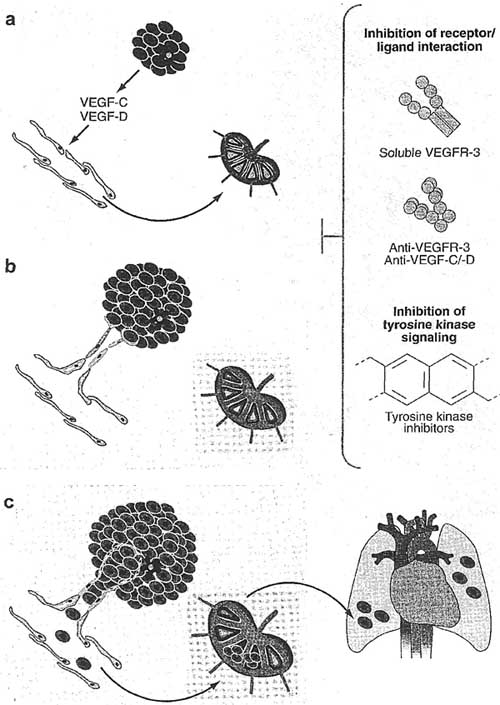 Figure 6
Lymphangiogenesis promotes lymphatic tumor metastasis, (a) Many tumor cells and stromal cells, especially tumor-associated macrophages (stellate red cell), secrete lymphangiogenic growth factors, most importantly VEGF-C and VEGF-D. (b) These stimulate die nearby lymphatic endothelium to sprout toward the tumor, leading to the formation of new lymphatic vessels at the nunor margin and, in some tumor types, occasionally also inside the tumor, (c) The lymphatic vessels in the tumor periphery frequently contain clusters of tumor cells, which may be actively entrapped by the sprouting lymphatic endothelium. Tumor-secreted lymphangiogenic factors also stimulate dilation of the preexisting lymphatic vessels draining the tumor area, which leads to increased lymph flow. Furthermore, tumors may stimulate lymphangiogenesis and sinusoidal hyperplasia also in the draining lymph nodes already before die entry of tumor cells (insets in a-c). All these events promote tumor cell dissemination through the lymphatic vessels to lymph nodes. From there, further spread to distant organs may occur either through the efferent lymphatic vessels draining to veins or directly via the blood vessels. Lymphatic tumor metastasis may be prevented by blocking die VEGF-C/-D/VEGFR-3 pathway, for example, by-inhibiting receptor/ligand interaction or downstream signaling.
Figure 6
Lymphangiogenesis promotes lymphatic tumor metastasis, (a) Many tumor cells and stromal cells, especially tumor-associated macrophages (stellate red cell), secrete lymphangiogenic growth factors, most importantly VEGF-C and VEGF-D. (b) These stimulate die nearby lymphatic endothelium to sprout toward the tumor, leading to the formation of new lymphatic vessels at the nunor margin and, in some tumor types, occasionally also inside the tumor, (c) The lymphatic vessels in the tumor periphery frequently contain clusters of tumor cells, which may be actively entrapped by the sprouting lymphatic endothelium. Tumor-secreted lymphangiogenic factors also stimulate dilation of the preexisting lymphatic vessels draining the tumor area, which leads to increased lymph flow. Furthermore, tumors may stimulate lymphangiogenesis and sinusoidal hyperplasia also in the draining lymph nodes already before die entry of tumor cells (insets in a-c). All these events promote tumor cell dissemination through the lymphatic vessels to lymph nodes. From there, further spread to distant organs may occur either through the efferent lymphatic vessels draining to veins or directly via the blood vessels. Lymphatic tumor metastasis may be prevented by blocking die VEGF-C/-D/VEGFR-3 pathway, for example, by-inhibiting receptor/ligand interaction or downstream signaling.
скорее всего экспрессируют специфические маркеры, отличные от нормального лимфатического эндотелия, которые могут служить дополнительными специфическими мишенями для терапии (89, 90).
VEGF-C-стимулированный рост новых ассоциированных с опухолью лимфатических сосудов может элиминировать одну из скорость-ограничивающих ступеней процесса метастазирования за счет простого увеличения области контакта злокачественных клеток с лимфатической сосудистой сетью (55, 69, 76-78, 80, 82, 83,91). Наблюдение, что ближайший лимфатический эндотелий экстенсивно формирует филоподии в направлении опухолевых клеток, продуцирующих VEGF, подтверждает, что опухолевые эмболы также могут активно отлавливаться внутри отрастающих лимфатических сосудов (55, 92). Увеличение размеров существующих лимфатических каналов, дренирующих опухоли, ещё сильнее увеличивает высвобождение опухолевых клеток в охранных лимфатических узлах, возможно путем увеличения скорости тока лимфы (55,93). Тот факт, что ингибирование опухолевых метастазов с помощью растворимого VEGFR-3 блокирует опухолевый лимфангиогенез, но не затрагивает предсуществующих лимфатических сосудов, указывает на то, что вновь формируемые ассоциированные с опухолью лимфатические сосуды необходимы для лимфатического метастазирования (55, 83-85). Однако некоторые исследования указывают на то, что лимфангиогенез не обязателен и что предсуществующие сосуды достаточны для метастазирования в лимфатические узлы (70).
VEGF-C может активировать лимфатический эндотелий, чтобы облегчить вхождение опухолевых клеток в лимфатическую сеть, способствуя молекулярным взаимодействиям между опухолевыми клетками и LFCs. Это д. обеспечиваться за счет секреции паракринных факторов таких как протеазы и хемотактические агенты лимфатическим эндотелием, который индуцирует отсоединение, миграцию или инвазию опухолевых клеток или альтерации функциональных свойств лимфатического эндотелия, чтобы облегчить адгезию и проникновение в лимфатические сосуды злокачественных клеток. Хемокин CCL21, секретируемый LECs, как было показано, способствует миграции CCR7-экспрессирующих метастатических клеток злокачественной меланомы (94).
Активация лимфатического эндотелия посредством пути VEGFR-3 подтверждается наблюдением, что ингибирование передачи сигналов VEGFR-3 наиболее эффективно супрессирует метастазирование в лимфатические узлы и удаленные органы, чем ингибирование VEGFR-2, хотя любое воздействие потенциально супрессирует опухолевый лимфангиогенез, а блокада VEGFR-2 более эффективно ингибирует опухолевый ангиогенез и рост (87). Более того, в некоторых клинико-патологических исследованиях высокие уровни VEGF-C коррелируют с инвазией лимфатических сосудов и метастазированием в лимфатические узлы, но не обязательно ассоциирует с повышенной плотностью лимфатических сосудов. Напротив, VEGF-C может активировать лимфатический эндотелий к продукции факторов, которые способствуют выживанию злокачественных клеток в лимфатической системе.
Недавние экспериментальные исследования показали, что опухоли индуцируют лимфангиогенез в охранных лимфатических узлах до диссеминации опухолевых клеток (95, 96). Сходные изменения наблюдались в подмышечных лимфатических узлах у пациенток с раком груди в отсутствие признаков метастазирования (96). Лимфангиогенные ростовые факторы, секретируемые первичной опухолью усиливают рост лимфатических сосудов в охранных лимфатических узлах и опухолевое метастазирование (97, 98). Это наблюдение указывает на то, что опухоли начинают подготовку микроусловий для вторичных опухолей еще до диссеминации опухолевых клеток. Индукция лимфангиогенеза лимфатических узлов до проникновения в них опухолевых клеток, как установлено, зависит от В клеток (95). Лимфангиогенез в лимфатических узлах, дренирующих опухоли, усиливает ток лимфы, что способствует транспорту опухолевых клеток. Лимфангиогенез в лимфатических узлах может также способствовать просачиванию (extravasation) и/или росту злокачественных клеток в охранных лимфатических узлах.
Хотя метастазирование в удаленные органы происходит посредством кровообращения, оно может нуждаться в инициальном распространении опухолевых клеток по лимфатическим сосудам в лимфатические узлы, откуда они метастазируют далее или по лимфатической системе в венозное кровообращение, и в этом случае они будут оказываться прежде всего в легочных капиллярах, или непосредственно через кровеносную сеть. metastasize further either through the lymphatic system draining into venous circulation, in which case they would end primarily in the pulmonary capillaries, or directly via the blood vasculature. Это подтверждается наблюдением, что в модели химически индуцированной карциномы кожи VEGF-C усиливает опухолевое метастазирование не только охранных (sentinel) лимфатических узлов, но и также удаленных мест (98). Наиболее важно то, что метастазы в удаленных органах не наблюдаются в отсутствие метастазирования в лимфатические узлы (98). Более того, в некоторых случаях легочные метастазы также ммогут ингибироваться с помощью растворимого VEGFR-3 (84).
Опухолевое метастазирование не является случайным событием, а чрезвычайной сложный, высоко организованный ткане-специфический процесс из многих последовательных ступеней (rev. in Reference 99). Природа молекулярных сигналов, наводящих определенные типы опухолей на разных стадиях метастазирования в специфические органы мишени оказалась установленной. Сосудистый эндотелий обладает специфическими молекулярными характеристиками в каждой ткани, это облегчает адгезию опухолевых клеток и проникновение в избранные органы (rev. in Reference 100). Интересно, что хемокиновые рецепторы CCR7 и CXCR4 экспрессируются на высоком уровне, по крайней мере, в некоторых клетках рака груди человека, тогда как их соотв. лиганды, вторичные лимфоидные хемокины (SLC/CCL21) и CXCL12, продуцируются лимфатическим эндотелием в лимфатических узлах, костном мозге, легких, печени, которые представляют собой преимущественные места предназначения метастазирования при раке груди (101, 102). Ингибирование взаимодействия CXCL12/CXCR4 существенно редуцирует метастазирование раковых опухолей груди в лимфатические узлы и легкие (101). Сходным образом экспрессия CCR7 в клетках меланомы у мышей способствует метастазированию в лимфатические узлы, что блокируется нейтрализующими SLC/CCL21 антителами (103). Такого типа молекулярные сигналы д. представлять собой наиболее общий механизм наведения опухолевых клеток на специфические места предназначения и может представлять собой потенциальную терапевтическую мишень для ингибирования прогрессирования опухолей до летальных заболеваний от метастазов (104).
Lymphedema
Нарушение дренирования лимфы, вызываемое дисфункцией лимфатических сосудов ведет к интерстициальному накоплению белков и ассоциированной жидкости и, наконец, к лимфангиоэктатическому отеку (lymphedema), хроническому прогрессирующему набуханию затронутой ткани. Lymphedema может быть или наследственной или не идентифицированной этиологии - в таком случае она называется первичной lymphedema-или следствием болезни, травмы, хирургического вмешательства или радиотерапии, тогда она обозначанеися как вторичная или благоприобретенная lymphedema (Figure 7). Широко распространенными осложнениями lymphedema являются прогрессирующий дермальный фиброз, накопление жировой и соединительной ткани, нарушение заживления ран, снижение иммунной защиты и тем самым повышенной чувствительностью к инфекциям и последующему целлюлиту (rev. in Reference 105). В редких случаях, долговременная lymphedema может наделять пациентов риском развития lymphangiosarcoma. Хотя лимфедема редко угрожает жизни, она выводит из строя уродует тяжело затронутых пациентов, снижая качество их жизни. На сегодня лечения не существует. Традиционным поддерживающим ведением болезни является мануальное дренирование лимфы с помощью физиотерапии, массажа и наружного сдавливания. Недавно в преклиничиеских исследованиях на мышах использовали вирусные вектора, кодирующие лимфангиогенные факторы роста и получили обещающие результаты по разработке prolymphangiogenic терапии (106). Рост новых функциональных лимфатических сосудов успешно индуцируется на мышиной модели лимфостаза, а также при заживлении диабетических и хирургических ран (29, 107, 108). VEGFR-3-специфическая мутантная форма VEGF-C, VEGF-C156S, эффективна в стимулировании роста лимфатических сосудов без побочных эффектов на кровеносные сосуды, такие как усиление текучести, вызываемой VEGF-C дикого типа, который также активирует VEGFR-2 (40).
В то время как lymphedema обычно затрагивает конечности тела, chylous ascites и chylothorax являются редкими заболеваниями, вызываемыми просачиванием лимфы в результате травм или аномального развития лимфатических сосудов, ведущих к накоплению жидкости с большим количеством жировых капель в животе или тораксе.
Primary lymphedema. Хотя наиболее распространенным способом наследования первичной
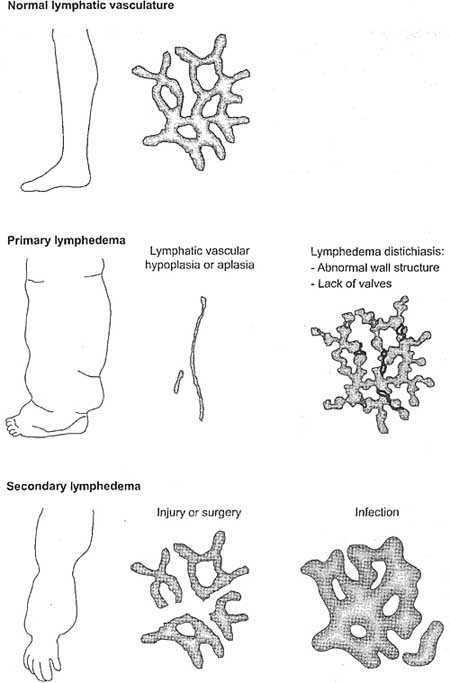 Figure 7
Lymphedema. Failure in lymphatic vascular function can be caused by various developmental or acquired structural defects. Hereditary lymphedema can be caused either by total absence or severe reduction of lymphatic vessels or l>v abnormal lymphatic vessel morphology. Secondary or acquired lymphedema is usually due to disruption or trauma of lymphatic vessels by injury, surgery, or infection.
Figure 7
Lymphedema. Failure in lymphatic vascular function can be caused by various developmental or acquired structural defects. Hereditary lymphedema can be caused either by total absence or severe reduction of lymphatic vessels or l>v abnormal lymphatic vessel morphology. Secondary or acquired lymphedema is usually due to disruption or trauma of lymphatic vessels by injury, surgery, or infection.
lymphedema является аутосомно доминантное, пенетрантность в некоторых случаях редуцирована или вариабельна, что указывает на олигогенное заболевание или на важный вклад генов модификаторов и/или средовых факторов (109, 110). Более того классификация lymphedema синдромов по фенотипическим признакам не отражает непосредственно лежащие в основе генетические нарушения (111). Первичные lymphedemas, как подсчитано, затрагивают приблизительно 1 на 6000 человек, с соотношением полов примерно 1 мужчина на 3-х женщин.
Наследственная lymphedema типа I, известная как болезнь Milroy's или первичная врожденная lymphedema (Online Mendelian Inheritance in Man, OMLM, number 153100), является формой лимофостаза с ранним началом, отек обнаруживается при рождении и затрагивает в первую очередь ноги и стопы. Как было установлено с помощью лимфангиографии лимфатические сосуды таких пациентов отсутствуют или чрезвычайно гипопластичны в затрагиваемых областях, но не изменены в др. (109). Наследование этого заболевания, по крайней мере в некоторых семействах, сцеплено с локусом VEGFR-3 на хромосоме 5q35.3. Большинство из ассоциированных с болезнью аллелей содержат missense мутации, кодирующие tyrosine-kinase-negative VEGFR-3 белки с увеличенным клеточным периодом полу-жизни, которые могут также действовать как доминантно негативные рецепторы, уменьшающие нижестоящую передачу сигналов (27, 28).
Наследственная lymphedema типа II, известна также как болезнь Meige или lymphedema praecox (OMIM 153200), является формой с поздним началом первичной lymphedema, очень часто обнаруживаемой среди подростков. По крайней мере в одной семье, наследование этой болезни сцеплено с инактивирующей мутацией гена FOXC2 (111).
Lymphedcma-distichiasis syndrome (LD; OMIM 153400) также как lymphedema и yellow nail синдром (OMIM 153300) являются мультисимптомными нарушениями, характеризующимися lymphedema конечностей с пубертатным или варьирующим возрастом начала, ассоциированной с разнообразными врожденными аномалиями. В некоторых семьях с LD, наследование было связано с мутациями в гене FOXC2 (112). Большинство из этих мутаций являются маленькими инсерциями или делециями, ведущими к преждевременному сдвигу рамки считывания, инактивирующему укорочению транскрипционного фактора, но были идентифицированы и две одиночные missense замены нуклеотидов. В двух семьях, несмотря на сцепление с локусом FOXC2, не выявлено мутаций в кодирующей области FOXC2, это указывает на мутации в промоторе (113).
Индивиды с LD имеют дополнительный ряд ресниц; вызывающий раздражение роговицы. Др. ассоциированными осложнениями могут быть кардиальные дефекты, расщепление нёба, спинальные extradural кисты, варикозные вены и фотофобия (114). Недавнее исследование сообщает о почечной болезни и diabetes mellitus в комбинации с LD, вызванных FOXC2 мутацией, что отражает онтогенетическую роль FOXC2 во множественных тканях (115). В отличие от врожденной lymphedema, где лимфатические сосуды апластичны или гипопластичны, LD ассоциирует с нормальным или даже увеличенным количеством лимфатических сосудов, которые однако обладают пониженным притоком и оттоком трассера (116). Притоку лимфы, по-видимому, мешают PCs/vSMCs аномально покрывающие кожные лимфатические капилляры в конечностях, но что интересно, не затрагивают руки индивидов с LD (61). более того, нерегулярный паттерн лимфатических капилляров и повышенные periendothelial отложения BM, также как и отсутствие лимфатических клапанов, наблюдаемое у FoAr2-дефицитных мышей, в дополнение к нескоординированным сокращениям vSMCs, могут также мешать притоку и оттоку лимфы у LD пациентов (61).
Необычная ассоциация lymphedema с hypotrichosis и telangiectasia (OMIM 607823) недавно описана и сцеплена с мутацией в гене, кодирующем транскрипционный фактор SOX18 (117). Локус для синдрома cholestasis-lymphedema , известный также как синдром Aagenaes (OMLM 214900), был картирован в хромосоме 15q, но затрагиваемый ген пока неизвестен (118). Локус, ответственный за варьирующие симптомы при синдроме Turner, часто ассоциируемый с lymphedema, был картирован в области Xp11.2-p22.1, которая содержит ген VEGF-D (119).
Secondary lymphedema. Отеки после хирургических вмешательств особенно часто после мастэктомии, представлены в первую очередь lymphedema в индустриальных странах. Её показатель примерно от 6% до 30% оперированных пациенток увеличивается при радиотерапии, но её этиология и патофизиология всё ещё до конца не поняты и, по-видимому, мультифакторны (rev. in Reference 105). Некоторые из чувствительностей могут иметь генетическую основу.
Во всем мире наиболее общей причиной lymphedema является filariasis, на сегодня затрагивающий свыше 120 миллионов человек, в основном в тропических регионах. Он вызывается передающейся москитами инфецией паразитической нематоды Wuchereria bancrofti, Brugia malayi или Brugia timori. Эти паразиты живут и репродуцируются в лимфатической системе, вызывая массивные расширения лимфатических сосудов и наконец полное и постоянное нарушение транспорта лимфы, что ведет к предрасположенности к долговременным повторным бактериальным инфекциям и заболеваниям известным как слоновость (rev. in Reference 120). Хотя некоторые microfilaricidal агенты сегодня используются, но эти лекарства являются лишь частично эффективными против долгоживущих взрослых червей и поэтому необходимо длительное лечение до 20 лет. Недавно был использован тетрациклин, чтобы воздействовать на эндосимбиотические бактерии
Wolbachia, что приводит к задержке роста и бесплодию filarial.
Lymphangiectasia and Lymphatic Neoplasms
Lymphangiectasia, локальное мешкооразное расширение лимфатических сосудов, видимых как прозрачные пузырьки. Они в большинстве своем ассоциируют с постхирургической lymphedema, но могут также появляться как следствие др. локальных лимфатических повреждений. Lymphangioma, доброкачественное лимфатическое нарушение, представлено сходными симптомами в виде lymphangiectasia , но имеет генетическую, в основном наследственную причину. Lymphangiosarcomas, злокачественные лимфатические опухоли, являются редкими и появляются в основном как следствие длительных лимфостазов. Мало известны её генетические основы.
Kaposi sarcoma, характеризуется узелками из опухолевых клеток веретенообразной формы с хорошо развитой васкулатурой, она ассоциирует с инфекцией Kaposi sarcoma herpesvirus (KSHV)/human herpesvirus 8. Kaposi саркомные веретенообразные клетки экспрессируют маркеры как кровеносного, так и лимфатического эндотелия и, как полагают, имеют эндотелиальное происхождение (121). Один из KSHV гликопротеинов оболочки взаимодействует с и активирует VEGFR-3 and integrin α 3β 1,приводя к повышению роста и миграции EC (122). Транскрипционный профиль Kaposi саркомных клеток сильно напоминает таковой для LECs, и, более того, инфекция BECs
in vitro с помощью KSHV ведет к экспрессии некоторых LEC-специфических генов (123, 124).
Lymphangioleiomyomatosis
Lymphangioleiomyomatosis (LAM) является редким прогрессирующим и часто фатальным кистозным заболеванием легких, которое затрагивает женщин репродуктивного возраста. Оно характеризуется пролиферацией аномальных мышце-подобных клеток (LAM клеток), колонизирующих легкие и аксиальные лимфатические узлы и оно часто ассоциирует с почечными angiomyolipomas (Figure 8). LAM возникает как следствие мутаций в одном из генов tuberous sclerosis (обычно TSC2) и, как полагают, зависит от женских гормональных стимулов (rev. in Reference 125). Поврежденные LAM клетки продуцируют VEGF-C и VEGF-D и растут вдоль и дугообразно в тесной ассоциации с лимфатическими сосудами (126). Наивысшие уровни VEGF-D наблюдаются в сыворотке LAM пациентов (127). Кластеры LAM клеток, покрытые LECs, часто наблюдаются в лимфатической циркуляции, и лимфатической (chylous) жидкости LAM пациентов. Предполагается, что такое распространение кластеров LAM клеток может объяснить способность LAM клеток метастазировать в удаленные места (128).
Lymphatic Vessels in Inflammatory Diseases
Помимо уменьшения отеков, индуцируемых воспалением лимфатические сосуды активно регулируют воспалительную реакцию путем транспортирования лейкоцитов от места воспаления во вторичные воспалительные органы. Несколько молекул, как недавно было установлено, участвуют в процессе рециркуляции лейкоцитов по лимфатической системе. Хемокиновый рецептор CCR7 является важным для миграции дендритных клеток в афферентные лимфатические сосуды, которые экспрессируют его лиганд SLC/CCL21 (see Reference 130 and references therein). Mannose receptor 1 и common lymphatic endothelial and vascular endothelial receptor 1,
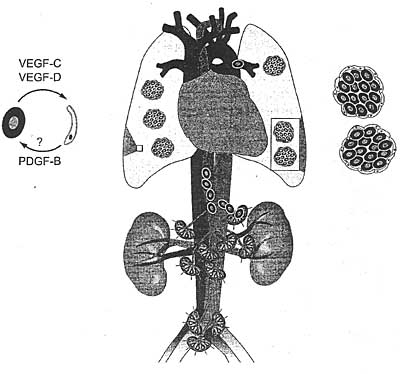 Figure 8
A hypothetical model for pathogenesis of lymphangioleiomyomatosis (LAM). The origin of the abnormal smooth muscle-like cells (LAM cells, red) proliferating in die lungs of LAM patients is currently unknown. These cells form tumors along the great vessels in the abdominal and lumbar regions, from where they are apparently transported via the thoracic duct into the jugular vein and further into the lungs, where they often enter the alveolar spaces and induce cyst formation and fluid accumulation. LAM cells secrete the lymphangiogenic growth factors VEGF-C and VECF-D, which attract lymphatic endothelial cells (LECs; green). An elevated level of PDGF-B has been reported in a related Gorham's lymphangiomatosis (129). LECs may produce PDGF-B (61), which may stimulate the growth of PDGFR-positive LAM cells, creating a paracrine growth stimulatory loop. This would lead to the growth of LAM cells along lymphatic vessels, enveloping of LAM cell clusters by LECs, and shedding of these clusters into the lymphatic vessels, which might facilitate die metastatic spread of the LAM cells. Considering the likely paracrine loop in LAM, the patients could profit from therapy with tyrosine kinase inhibitors mat block both VTGFR-3 and PDGFR signaling.
Figure 8
A hypothetical model for pathogenesis of lymphangioleiomyomatosis (LAM). The origin of the abnormal smooth muscle-like cells (LAM cells, red) proliferating in die lungs of LAM patients is currently unknown. These cells form tumors along the great vessels in the abdominal and lumbar regions, from where they are apparently transported via the thoracic duct into the jugular vein and further into the lungs, where they often enter the alveolar spaces and induce cyst formation and fluid accumulation. LAM cells secrete the lymphangiogenic growth factors VEGF-C and VECF-D, which attract lymphatic endothelial cells (LECs; green). An elevated level of PDGF-B has been reported in a related Gorham's lymphangiomatosis (129). LECs may produce PDGF-B (61), which may stimulate the growth of PDGFR-positive LAM cells, creating a paracrine growth stimulatory loop. This would lead to the growth of LAM cells along lymphatic vessels, enveloping of LAM cell clusters by LECs, and shedding of these clusters into the lymphatic vessels, which might facilitate die metastatic spread of the LAM cells. Considering the likely paracrine loop in LAM, the patients could profit from therapy with tyrosine kinase inhibitors mat block both VTGFR-3 and PDGFR signaling.
экспрессируются лимфатическим эндотелием, контролируя доставку лимфоцитов в лимфатические сосуды (131, 132).
VEGF-C активируется в ответ на провоспалительные цитокины, указывая тем самым на роль стимуляции роста лимфатических сосудов во время воспаления (13 3). Эта позитивная регуляция, по-видимому, осуществляется посредством NFkB, который является важным транскрипционным фактором для передачи сигналов провоспалительных факторов и обладает предположительно сайтом связывания в промоторе VEGF-C (134). Интересно, что NFkB постоянно активен, по крайней мере, в некоторых лимфатических сосудах (135).
Макрофаги экспрессируют VEGFR-1 и VEGFR-3 и таким образом привлекаются ангиогенными и лимфатическими ангиогенными сигналами. Они также стимулируют дальнейший лимфангиогенез путем секреции VEGF-C и VEGF-D (91, 136, 137). Более того, недавние сообщения подтвердили, что макрофаги могут также вносить вклад в лимфангиогенез за счет трансдифференцировки в LECs и включения их в лимфатический эндотелий (8, 9).
Пролиферация лимфатических сосудов описана в трансплантатах почек человека, подвергающихся отторжению, в мышиных моделях хронического воспаления дыхательных путей и моделях воспалительной неоваскуляризации роговицы (136, 138-141). Лимфатическая гиперплазия наблюдается также в УФЛ-облучением индуцированых воспалениях кож, в мышиных моделях хронического воспаления кожи, напоминающего псориаз и псориатическх повреждениях кожи у людей (142, 143). В почечных трансплантантах лимфатические сосуды вносят вклад в экспорт богатого лимфоцитами воспалительного инфильтрата, но также участвуют в поддержании вредной аллореактивной иммунной реакции путем привлечения CCR7-позитивных иммунных клеток благодаря продукции SLC/CCL21 (138). Инфекция эпителия воздушных путей мышей с помощью Mycoplasma pulmonis приводит к массивному лимфангиогенезу, индуцируемому с помощью VEGF-C/-D-продуцирующих воспалительных клеток. Ингибирование лимфангиогенеза с помощью VEGF-C/-D ловушек ведет к тяжелым отекам слизистой, указывая на важность лимфатических сосудов в качестве путей выхода для иммунных клеток и жидкости (139).
CONCLUDING REMARKS
Despite the tremendous interest and progress in lymphatic vascular biology during the past decade and the close resemblance to processes involved in developmental angiogenesis, several key players and mechanisms in lymphatic vascular development and maturation remain unresolved. Detailed understanding of the mechanisms regulating normal and aberrant lymphatic vessel development and the involvement of lymphatic vessels in various pathological conditions is necessary for the development of diagnosis and therapies for these diseases. The recent elucidation of important mechanisms of blood vessel sprout-ing and recognition of the shared guidance cues in blood vascular and neuronal patterning are likely to shed light on the analogous, poorly known processes of lymphatic vascular development. Characterization of the functionally and molecularly conserved lymphatic vessels in model organisms such as zebrafish and frog may greatly facilitate lymphatic vascular research in the future (6, 151, 1 52). Markers presently used in the basic research may eventually provide diagnostic relevance in inflammation and cancer as well as in acquired and developmental lymphatic vessel disorders. Initial preclinical studies in mouse models have already provided promising results in the inhibition of lymphatic tumor metastasis as well as in the stimulation of lymphatic growth in lymphedema and wound healing.
SUMMARY POINTS
1. Identification of lymphatic-specific markers, discovery of key regulators of lymphatic vessel formation, characterization of animal models, and development of techniques for isolation and culture of LECs have greatly facilitated lymphatic vascular research during recent years and led to a better understanding of die basic mechanisms of lymphangiogenesis and the significance of the lymphatic vessels in health and disease.
2. Lymphatic development starts after the onset of blood circulation by differentiation of LECs from the venous endothelium and, apparently in some organisms, from mesenchymal progenitor cells.
3. Many tumors secrete lymphangiogenic growth factors and stimulate lymphangiogenesis at the tumor margin, surrounding tissues, and in sentinel lymph nodes, which actively promotes lymphatic metastasis.
4. Tumor lymphangiogenesis and lymphatic metastasis can be effectively inhibited by blocking the VEGF-C/-D/VEGFR-3 signaling pathway in mouse models.
5. Failure in lymphatic vascular function due to a developmental defect or acquired disruption leads to accumulation of protein-rich fluid and swelling of the affected tissues.
6. Studies in animal models have provided promising indications for the development of prolymphangiogenic therapy for the treatment of lymphedema and wound healing.
7. Lymphangiogenesis is stimulated by and involved in the regulation of various inflammatory conditions.
FUTURE ISSUES
1. Further research is required to elucidate whether and to what extent mesenchymal precursor cells contribute to the lymphatic endothelium during development and the role of bone marrow-derived cells in adult lymphangiogenesis.
2. The genetic control of lymphatic development and the contribution of physical factors such as hydrostatic pressure and interstitial fluid flow should be analyzed in detail to fully understand die processes involved in the formation of the lymphatic vasculature.
3. The detailed molecular and cellular natures of lymphatic vascular remodeling, patterning, valve generation, and postnatal maturation remain a challenge for lymphatic vascular research in the future.
4. Deeper knowledge on the complex mechanisms of tumor metastasis is likely to reveal additional targets for efficient inhibition of cancer spread.
5. The exact properties of the various lymphangiogenic factors must be determined to develop powerful and safe prolymphangiogenic therapies for the treatment of different forms of lymphedema.
6. Further investigation of the role of lymphatic vessels in inflammation might reveal novel ways to manage inflammatory diseases.
Сайт создан в системе
uCoz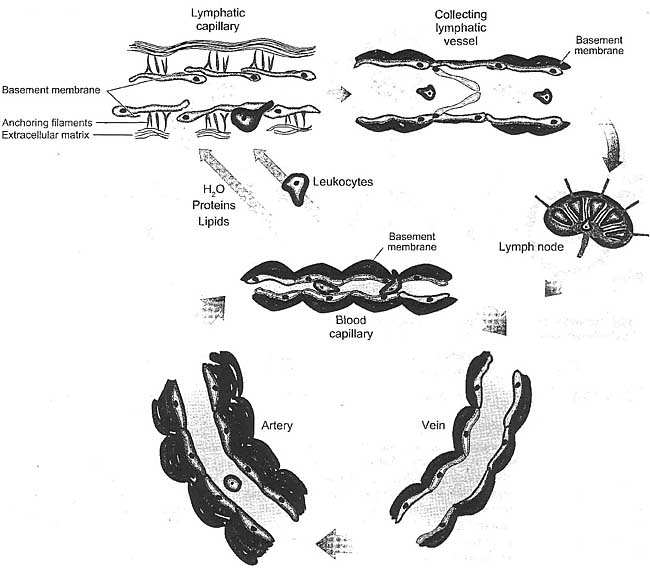 Figure 1
Structure of the lymphatic vessels. Compared with blood vessels, lymphatic vessels are thin walled and have a relatively wide lumen. The endothelial cells of lymphatic capillaries (green) lack tight junctions. Instead, the neighboring endothelial cells partly overlap, forming valve-like openings, which allow easy access for fluid, macromolecules, and cells into the vessel lumen. Lymphatic capillaries lack vascular mural cells and have no or only an incomplete basement membrane. Elastic fibers known as anchoring filaments connect lymphatic capillary endothelial cells to the surrounding stroma and maintain vessel patency during increased interstitial pressure. The lymph drains from the lymphatic capillaries to precollecting and collecting lymphatic vessels, which are finally emptied into veins in the jugular region. The precollecting and collecting lymphatic vessels have a basement membrane, are surrounded by vascular smooth muscle cells (vSMCs; red) with intrinsic contractile activity to promote lymph flow, and, like veins, contain valves that prevent backflow of the lymph. The valve regions are devoid of vSMCs. On its way, the lymph is filtered through a series of lymph nodes. In contrast, the endothelial cells of blood vessels form tight and adherence junctions, have a distinct basement membrane, and are surrounded by pericytes/vSMCs, which form one or multiple layers increasing in thickness with vessel size.
Figure 1
Structure of the lymphatic vessels. Compared with blood vessels, lymphatic vessels are thin walled and have a relatively wide lumen. The endothelial cells of lymphatic capillaries (green) lack tight junctions. Instead, the neighboring endothelial cells partly overlap, forming valve-like openings, which allow easy access for fluid, macromolecules, and cells into the vessel lumen. Lymphatic capillaries lack vascular mural cells and have no or only an incomplete basement membrane. Elastic fibers known as anchoring filaments connect lymphatic capillary endothelial cells to the surrounding stroma and maintain vessel patency during increased interstitial pressure. The lymph drains from the lymphatic capillaries to precollecting and collecting lymphatic vessels, which are finally emptied into veins in the jugular region. The precollecting and collecting lymphatic vessels have a basement membrane, are surrounded by vascular smooth muscle cells (vSMCs; red) with intrinsic contractile activity to promote lymph flow, and, like veins, contain valves that prevent backflow of the lymph. The valve regions are devoid of vSMCs. On its way, the lymph is filtered through a series of lymph nodes. In contrast, the endothelial cells of blood vessels form tight and adherence junctions, have a distinct basement membrane, and are surrounded by pericytes/vSMCs, which form one or multiple layers increasing in thickness with vessel size. 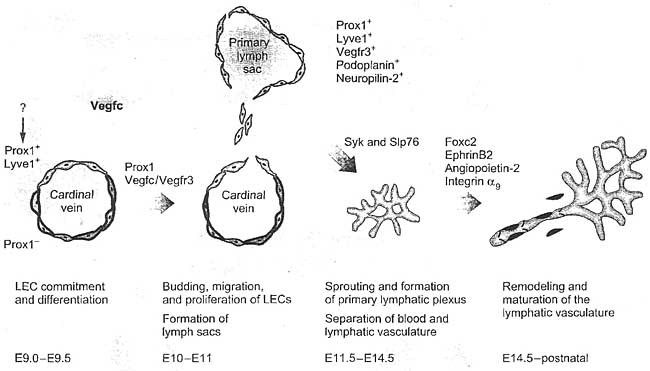 Figure 2
Development of the lymphatic vasculature in mice. Upon stimulation by an as yet unidentified signal(s), a subset of venous endothelial cells becomes committed to the lymphatic endothelial fate. These differentiating limphatic endothelial cells (LECs) express Lyve1, Proxl, and Vegfr3. Stimulated by Vegfc. which is secreted by the adjacent tissue, they migrate and proliferate to form primary lymph sacs, from which the lymphatic vessels start sprouting. The primary lymphatic vascular plexus {green) becomes separated from the blood vessels. It undergoes remodeling and maturation to create the lymphatic vasculature consisting of a lymphatic capillary network, which lacks pericytes, and of collecting lymphatic vessels, which contain valves {green) and are associated with vascular smooth muscle cells {purple). Molecules involved at these later stages of the lymphatic development include ephnnB2, neuropilin-2, Angiopoietin-2, podoplanin, integrin ag, and the transcription factors Foxc2, Net, Sox18, and Vezf1.
Figure 2
Development of the lymphatic vasculature in mice. Upon stimulation by an as yet unidentified signal(s), a subset of venous endothelial cells becomes committed to the lymphatic endothelial fate. These differentiating limphatic endothelial cells (LECs) express Lyve1, Proxl, and Vegfr3. Stimulated by Vegfc. which is secreted by the adjacent tissue, they migrate and proliferate to form primary lymph sacs, from which the lymphatic vessels start sprouting. The primary lymphatic vascular plexus {green) becomes separated from the blood vessels. It undergoes remodeling and maturation to create the lymphatic vasculature consisting of a lymphatic capillary network, which lacks pericytes, and of collecting lymphatic vessels, which contain valves {green) and are associated with vascular smooth muscle cells {purple). Molecules involved at these later stages of the lymphatic development include ephnnB2, neuropilin-2, Angiopoietin-2, podoplanin, integrin ag, and the transcription factors Foxc2, Net, Sox18, and Vezf1. 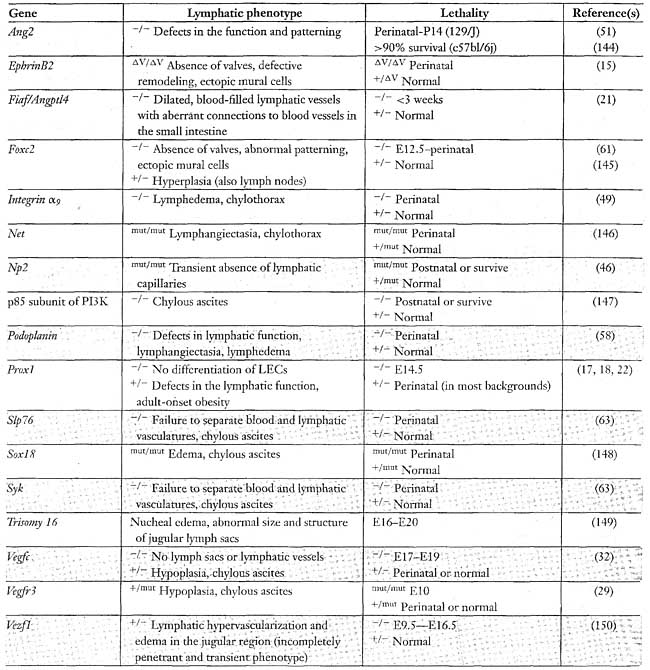 Table 1 Genes identified, on the basis of studies in mouse mutants, and maturation
to be involved in lymphatic vascular development
Table 1 Genes identified, on the basis of studies in mouse mutants, and maturation
to be involved in lymphatic vascular development 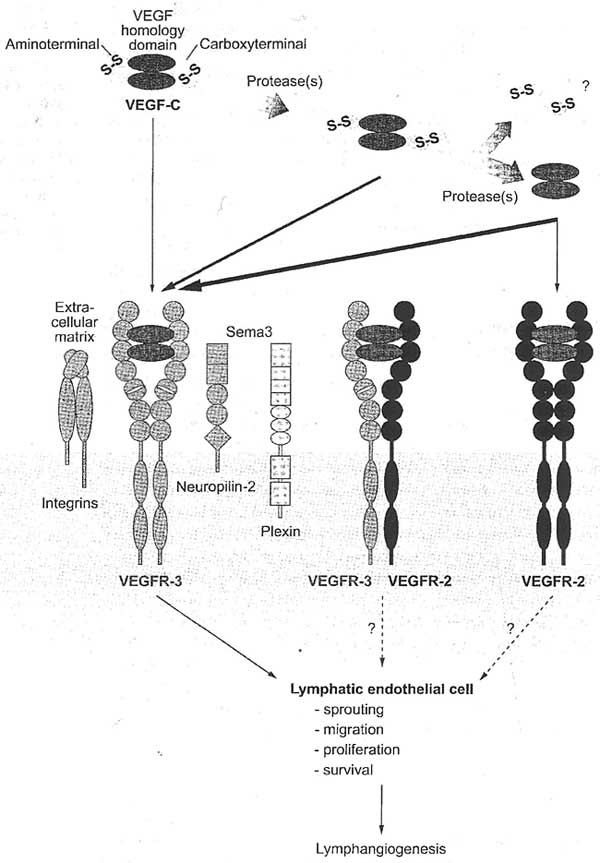 Figure 3
Proteolytic processing, receptor binding specificity, and biological effects of VEGF-C. The VEGF-C precursor is an antiparaller homodimer covalently coupled by disulfide bonds (S-S) between the amino-and carboxyterminal propeptides. The propeptides are proteolytically removed in a stepwise manner, which increases the affinity of VEGF-C toward VEGFR-3 and provides the mature, noncovalent dimer with the ability to bind VEGFR-2. The fate of the amino- and carboxy terminal propeptides is currently unknown. VEGF-C signaling through VEGFR-3 is modulated by several coreceptors. These include neuropilin-2, which binds VEGF-C and becomes internalized along with VEGFR-3 upon ligand binding; integrin β1, which associates with VEGFR-3 and induces its phosphorylation upon ligation with the extracellular matrix proteins fibronectin or collagen even in the absence of VEGF-C or VEGF-D; and integrin α9, which may bind VEGF-C. The role of plexins, which provide a signaling function for the neuropilins, in lymphatic endothelium is unknown. Activation of downstream signaling molecules induces endothelial cell sprouting, migration, proliferation, and survival, leading to formation of new lymphatic vessels. VEGFR-2 is expressed in at least some lymphatic vessels, but its role as well as the role of VEGFR-3 A'EGFR-2 heterodimers in lvmphangiogenesis is still unclear.
Figure 3
Proteolytic processing, receptor binding specificity, and biological effects of VEGF-C. The VEGF-C precursor is an antiparaller homodimer covalently coupled by disulfide bonds (S-S) between the amino-and carboxyterminal propeptides. The propeptides are proteolytically removed in a stepwise manner, which increases the affinity of VEGF-C toward VEGFR-3 and provides the mature, noncovalent dimer with the ability to bind VEGFR-2. The fate of the amino- and carboxy terminal propeptides is currently unknown. VEGF-C signaling through VEGFR-3 is modulated by several coreceptors. These include neuropilin-2, which binds VEGF-C and becomes internalized along with VEGFR-3 upon ligand binding; integrin β1, which associates with VEGFR-3 and induces its phosphorylation upon ligation with the extracellular matrix proteins fibronectin or collagen even in the absence of VEGF-C or VEGF-D; and integrin α9, which may bind VEGF-C. The role of plexins, which provide a signaling function for the neuropilins, in lymphatic endothelium is unknown. Activation of downstream signaling molecules induces endothelial cell sprouting, migration, proliferation, and survival, leading to formation of new lymphatic vessels. VEGFR-2 is expressed in at least some lymphatic vessels, but its role as well as the role of VEGFR-3 A'EGFR-2 heterodimers in lvmphangiogenesis is still unclear.  Figure 4
VEGF induces enlargement of lymphatic vessels but no sprouting lymphangiogene-sis. Whole-mount staining with antibodies against die
lymphatic-specific Lyvel (a-c) and largely blood vessel-enriched Pecaml (d-f) of the ear skin from transgenic mice expressing human VEGF165 and d) or mouse VEGF164 (b and e) in the skin under keratin 14 (K14) promoter and from a wild-type littermate (c and f). The image pairs are from the same microscopic field. The scale bar in panel/applies to all panels. Figure courtesy of Maria Wirzenius.
Figure 4
VEGF induces enlargement of lymphatic vessels but no sprouting lymphangiogene-sis. Whole-mount staining with antibodies against die
lymphatic-specific Lyvel (a-c) and largely blood vessel-enriched Pecaml (d-f) of the ear skin from transgenic mice expressing human VEGF165 and d) or mouse VEGF164 (b and e) in the skin under keratin 14 (K14) promoter and from a wild-type littermate (c and f). The image pairs are from the same microscopic field. The scale bar in panel/applies to all panels. Figure courtesy of Maria Wirzenius.  Figure 5
VEGF-C/VEGFR-3 pathway in tumors, (a) Expression of VEGF-C in MCF-7 human breast cancer cells implanted into the mammary fat pads of SGTD mice induces abundant lymphangiogcnesis at the tumor periphery (red Lyvel staining) and intralymphatic tumor growth, (b) The control MCF-7 tumors do not contain Lyve1-positive lymphatic vessels, (c and d) A human renal cell carcinoma stained with antibodies against VEGFR-3 (c, red-brawn) or control antibodies (d). VEGFR-3 is predominantly localized in endothelial cells of tumor blood and lymphatic vessels but not in minor cells. Figures in panels c and d courtesy of Leif Anderson.
Figure 5
VEGF-C/VEGFR-3 pathway in tumors, (a) Expression of VEGF-C in MCF-7 human breast cancer cells implanted into the mammary fat pads of SGTD mice induces abundant lymphangiogcnesis at the tumor periphery (red Lyvel staining) and intralymphatic tumor growth, (b) The control MCF-7 tumors do not contain Lyve1-positive lymphatic vessels, (c and d) A human renal cell carcinoma stained with antibodies against VEGFR-3 (c, red-brawn) or control antibodies (d). VEGFR-3 is predominantly localized in endothelial cells of tumor blood and lymphatic vessels but not in minor cells. Figures in panels c and d courtesy of Leif Anderson.  Figure 6
Lymphangiogenesis promotes lymphatic tumor metastasis, (a) Many tumor cells and stromal cells, especially tumor-associated macrophages (stellate red cell), secrete lymphangiogenic growth factors, most importantly VEGF-C and VEGF-D. (b) These stimulate die nearby lymphatic endothelium to sprout toward the tumor, leading to the formation of new lymphatic vessels at the nunor margin and, in some tumor types, occasionally also inside the tumor, (c) The lymphatic vessels in the tumor periphery frequently contain clusters of tumor cells, which may be actively entrapped by the sprouting lymphatic endothelium. Tumor-secreted lymphangiogenic factors also stimulate dilation of the preexisting lymphatic vessels draining the tumor area, which leads to increased lymph flow. Furthermore, tumors may stimulate lymphangiogenesis and sinusoidal hyperplasia also in the draining lymph nodes already before die entry of tumor cells (insets in a-c). All these events promote tumor cell dissemination through the lymphatic vessels to lymph nodes. From there, further spread to distant organs may occur either through the efferent lymphatic vessels draining to veins or directly via the blood vessels. Lymphatic tumor metastasis may be prevented by blocking die VEGF-C/-D/VEGFR-3 pathway, for example, by-inhibiting receptor/ligand interaction or downstream signaling.
Figure 6
Lymphangiogenesis promotes lymphatic tumor metastasis, (a) Many tumor cells and stromal cells, especially tumor-associated macrophages (stellate red cell), secrete lymphangiogenic growth factors, most importantly VEGF-C and VEGF-D. (b) These stimulate die nearby lymphatic endothelium to sprout toward the tumor, leading to the formation of new lymphatic vessels at the nunor margin and, in some tumor types, occasionally also inside the tumor, (c) The lymphatic vessels in the tumor periphery frequently contain clusters of tumor cells, which may be actively entrapped by the sprouting lymphatic endothelium. Tumor-secreted lymphangiogenic factors also stimulate dilation of the preexisting lymphatic vessels draining the tumor area, which leads to increased lymph flow. Furthermore, tumors may stimulate lymphangiogenesis and sinusoidal hyperplasia also in the draining lymph nodes already before die entry of tumor cells (insets in a-c). All these events promote tumor cell dissemination through the lymphatic vessels to lymph nodes. From there, further spread to distant organs may occur either through the efferent lymphatic vessels draining to veins or directly via the blood vessels. Lymphatic tumor metastasis may be prevented by blocking die VEGF-C/-D/VEGFR-3 pathway, for example, by-inhibiting receptor/ligand interaction or downstream signaling.  Figure 7
Lymphedema. Failure in lymphatic vascular function can be caused by various developmental or acquired structural defects. Hereditary lymphedema can be caused either by total absence or severe reduction of lymphatic vessels or l>v abnormal lymphatic vessel morphology. Secondary or acquired lymphedema is usually due to disruption or trauma of lymphatic vessels by injury, surgery, or infection.
Figure 7
Lymphedema. Failure in lymphatic vascular function can be caused by various developmental or acquired structural defects. Hereditary lymphedema can be caused either by total absence or severe reduction of lymphatic vessels or l>v abnormal lymphatic vessel morphology. Secondary or acquired lymphedema is usually due to disruption or trauma of lymphatic vessels by injury, surgery, or infection. Figure 8
A hypothetical model for pathogenesis of lymphangioleiomyomatosis (LAM). The origin of the abnormal smooth muscle-like cells (LAM cells, red) proliferating in die lungs of LAM patients is currently unknown. These cells form tumors along the great vessels in the abdominal and lumbar regions, from where they are apparently transported via the thoracic duct into the jugular vein and further into the lungs, where they often enter the alveolar spaces and induce cyst formation and fluid accumulation. LAM cells secrete the lymphangiogenic growth factors VEGF-C and VECF-D, which attract lymphatic endothelial cells (LECs; green). An elevated level of PDGF-B has been reported in a related Gorham's lymphangiomatosis (129). LECs may produce PDGF-B (61), which may stimulate the growth of PDGFR-positive LAM cells, creating a paracrine growth stimulatory loop. This would lead to the growth of LAM cells along lymphatic vessels, enveloping of LAM cell clusters by LECs, and shedding of these clusters into the lymphatic vessels, which might facilitate die metastatic spread of the LAM cells. Considering the likely paracrine loop in LAM, the patients could profit from therapy with tyrosine kinase inhibitors mat block both VTGFR-3 and PDGFR signaling.
Figure 8
A hypothetical model for pathogenesis of lymphangioleiomyomatosis (LAM). The origin of the abnormal smooth muscle-like cells (LAM cells, red) proliferating in die lungs of LAM patients is currently unknown. These cells form tumors along the great vessels in the abdominal and lumbar regions, from where they are apparently transported via the thoracic duct into the jugular vein and further into the lungs, where they often enter the alveolar spaces and induce cyst formation and fluid accumulation. LAM cells secrete the lymphangiogenic growth factors VEGF-C and VECF-D, which attract lymphatic endothelial cells (LECs; green). An elevated level of PDGF-B has been reported in a related Gorham's lymphangiomatosis (129). LECs may produce PDGF-B (61), which may stimulate the growth of PDGFR-positive LAM cells, creating a paracrine growth stimulatory loop. This would lead to the growth of LAM cells along lymphatic vessels, enveloping of LAM cell clusters by LECs, and shedding of these clusters into the lymphatic vessels, which might facilitate die metastatic spread of the LAM cells. Considering the likely paracrine loop in LAM, the patients could profit from therapy with tyrosine kinase inhibitors mat block both VTGFR-3 and PDGFR signaling.