Molecular evolution of the vertebrate mechanosensory cell and ear | |
|
The molecular basis of mechanosensation, mechanosensory cell development and
mechanosensory organ development is reviewed with an emphasis on its evolution. In contrast
to eye evolution and development, which apparently modified a genetic program through
intercalation of genes between the master control genes on the top
(Pax6, Eya1, Six1) of the
hierarchy and the structural genes
(rhodopsin) at the bottom, the as yet molecularly unknown
mechanosensory channel precludes such a firm conclusion for mechanosensors. However, recent
years have seen the identification of several structural genes which are involved in mechanosensory
tethering and several transcription factors controlling mechanosensory cell and organ develop-
ment; these warrant the interpretation of available data in very much the same fashion as for eye
evolution: molecular homology combined with potential morphological parallelism. This asser-
tion of molecular homology is strongly supported by recent findings of a highly conserved set of
microRNAs that appear to be associated with mechanosensory cell development across phyla.
The conservation of transcription factors and their regulators fits very well to the known or
presumed mechanosensory specializations which can be mostly grouped as variations of a
common cellular theme. Given the widespread distribution of the molecular ability to form
mechanosensory cells, it comes as no surprise that structurally different mechanosensory organs
evolved in different phyla, presenting a variation of a common theme specified by a conserved set
of transcription factors in their cellular development. Within vertebrates and arthropods, some
mechanosensory organs evolved into auditory organs, greatly increasing sensitivity to sound
through modifications of accessory structures to direct sound to the specific sensory epithelia.
However, while great attention has been paid to the evolution of these accessory structures in
vertebrate fossils, comparatively less attention has been spent on the evolution of the inner ear
and the central auditory system. Recent advances in our molecular understanding of ear and brain
development provide novel avenues to this neglected aspect of auditory neurosensoy evolution.
|
В зрительной системе два озарения помогли простимулировать молекулярные эволюционные исследования: A) Небольшой набор генов (напр., Pax6, Atoh7/atonal, Eya1) продуцирует важные транскрипционные факторы для развития глаз независимо от очертаний и формы (Gehring, 2005).
B) Все rhodopsins, обеспечивающие фотостимуляцию, связаны на молекулярном уровне так, что разнообразной формы фоторецепторы располагаются на общей молекулярной основе (Arendt et al., 2004).
Поэтому было предположено, что молекулярная эволюция рецепторов, рецепторных клеток и рецепторных органов тонко взаимосвязана посредством наборов гнёзд консервативных генов, необходимых для спецификации экспрессии rhodopsins в рецепторных клетках и для гарантии, что эти клетки будут расположены правильно внутри органа, чтобы направлять свет на клетки, которые содержат наивысшую концентрацию родопсинов. Эта точка зрения на эволюцию фоторецепторов отражает тот простой факт, что даже одноклеточные организмы обладают специализированными фоторецепторными областями и что многоклеточные организмы обладают восприятием фотонов без специализированных клеток или со специализированными клетками, которые не формируют самостоятельного органа. Последующая эволюция различных типов глаз может происходить путем модификации оригинальной генетической программы путем интеркаляции генов между генами программного управления на верху иерархии и структурными генами, подобными rhodopsin в основании
(Gehring, 2005) или др. способами (Alonso and Wilkins, 2005). По существу появление паноптического разнообразия структурно отличающихся глаз может быть результатом перестановок (permutations) родоначального предмета. Фактически некоторые из молекул, ассоциированные с глазами, законсервированы также в ушах (Fritzsch et al., 2005b). Наиболее важно то, что несмотря на возникновение и возможно унификацию молекулярных эволюционных основ для этой крупной сенсторной системы срез структурного разнообразия смотрится как непреодолимое препятствие для выстраивания эволюции уха в филогенетическом плане.
Частично это из-за того, эволюция наземного слуха давно исследуется с точки зрения эволюции трех косточек среднего уха и тимпанической мембраны благодаря их доступности, но это по-прежнему трудно интерпретировать по органическим останкам (Brazeau and Ahlberg, 2006, Clack, 2002, Fritzsch, 1992, Fritzsch, 1999, Massa et al., 2006). Однако, эволюционные изменения во внутреннем ухе, которое обеспечивает избирательное восприятие звуков, в специализированный орган привлекли внимание много позже, несмотря на тот факт, что любые адаптивные изменения в среднем ухе нуждаются прежде всего в существовании внутреннего уха, чтобы сделать пригодными изменения в терминах восприятия звуков (Fritzsch, 1992, Fritzsch et al., 2006c). В отношении внутреннего уха возможна только придирчивая интерпретация данных по существующим таксонам. Будут рассмотрены аспекты эволюции уха только позвоночных.
Логично начать рассмотрение эволюции восприятия звука с волосковых клеток и их аппарата механотрансдукции, stereocilia с их кончиковыми связками, открывающими и закрывающими всё ещё неизвестный канал. Канал позволяет току ионов изменять потенциал покоя, чтобы отражать звуком обусловленные стимуляции. Мы впервые рассматриваем эволюцию механосенсации на молекулярном и клеточном уровне. Добавочные структуры и группировка волосковых клеток в органы, котрые делают возможным восприятие разнообразных стимулов является следующей логической ступенью эволюции и молекулярные доказательства того, как это может происходить, будут рассмотрены следующими. Среди позвоночных уже давно распознано, что чисто вестибулярное ухо, предназначенное для восприятия гравитационных и угловых стимулов, произошло прежде эволюции целого эпителия или его частей, предназначенных для восприятия звуков. Поэтому мы затем рассмотрим эволюцию уха позвоночных, включая молекулярную эволюцию образования плакоды и молекулярной основы для морфогенеза, чтобы сформировать лабиринт позвоночных. Наконец, эволюция слуховой системы нуждается в изменениях в программе развития уха, чтобы генерировать сенсорный эпителий, предназначенный для восприятия звуков и набора сенсорных нейронов, предназначенных для передачи звуковой информации в головной мозг и центральную область мишень, предназначенную для восприятия звука. В этой части мы рассмотрим, как отдельный эпителий может возникать, как он трансформируется в эпителий восприятия звука посредством специфических взаимодействий с соседней периотической мезодермой и как отдельные сенсорные нейроны могут быть генерированы и специфицированы, чтобы проецировать отростки в разные центральные мишени. Molecular evolution suggests conservation of tethers, but not of channels Механочувствительность означает механическими стимулами управляемое открытие и закрытие ионного канала, чтобы изменить потенциал покоя сенсорной клетки. Несмотря на значительные успехи механосенсорный эквивалент белку фототрансдукции родопсину ещё не найден. Молекулярная эволюция механочувствительности не может быть понята на примере эволюции родопсина (Arendt et al., 2004, Gehring, 2005). Сравнение филетических групп показывает, что механосенсация базируется на двух основных принципах: 1) Натяжение внутри мембраны открывает канал. 2) Натяжение внутриклеточных и/или внеклеточных связей открывает канал (Fig. 1). Очевидно, что натяжение мембраны существует уже у одноклеточных организмов, тогда как механосенсация с помощью связок (tethers) требует клеточных специализаций, таких как специфическая жесткость внутри клетки (сборка микротрубочек, промежуточные филаменты или актиновые филаменты) или связей вне клетки (таких как др. клетки, др. выпячивающиеся части той же самой клетки или внеклеточный матрикс) чтобы соотв. организоваться (Fig. 1). Интересно, что некоторые из молекул, ассоциированные с такими связками, обнаруживают ту же самую степень консервации. Напр., редкий миозин VIIa ассоциирует с потерей слуха как у позвоночных, так и мух (Todi et al., 2005), VLGR мутации вызывают потерю слуха у людей и этот ген существует у многих Deuterostomes, включая морских ежей, а protocadherins обнаруживаются в большинстве типов метазоа (Burke et al., 2006, Sodergren et al., 2006).
В противоположность этой очевидной консервации и функции в качестве части процесса механотрансдукции молекул известных или подозреваемых в закреплении, отсутствуют гены кандидаты, представляющие собой законсервированные каналы. В самом деле, все кандидаты предполагаемых генов канала у позвоночных, которые были мутированы, к стати, давали минимальные эффекты, но не потерю механочувствительности (Kwan et al., 2006, Lin and Corey, 2005). Единственные гены каналов известны у червей C. elegans (O'Hagan et al., 2005). Эти гены принадлежат к ENaC/BNaC семейству генов, но не имеют ортологов у позвоночных. Тем не менее наиболее вероятные кандидаты на роль механосенсорных каналов находятся среди ENac/BNaC и Trp генов каналов (Sukharev and
Corey, 2004). Детальное сравнение последовательностей с использованием существующей базы данных показало только ограниченную консервацию немногих генов у позвоночных, все они принадлежат одним и тем же механосенсорным клеткам, волосковым клеткам (Beisel et al., 2007). В самом деле, один ген, идентифицированный как критический для механосенсорной функции у рыбок данио не существует у млекопитающих (Gillespie et al., 2005, Sidi et al., 2003). Комбинирование этих данных показывает, что белки механосенсорного канала могут быть не законсервированы и действительно могут быть организованы из нескольких отличающихся компонентов, которые формируют гетеромультимеры. Такие мультимеры с варьирующими функиями были недавно описаны для TRPV термочувствительных каналов (Cheng et al., 2007). Если это верно для 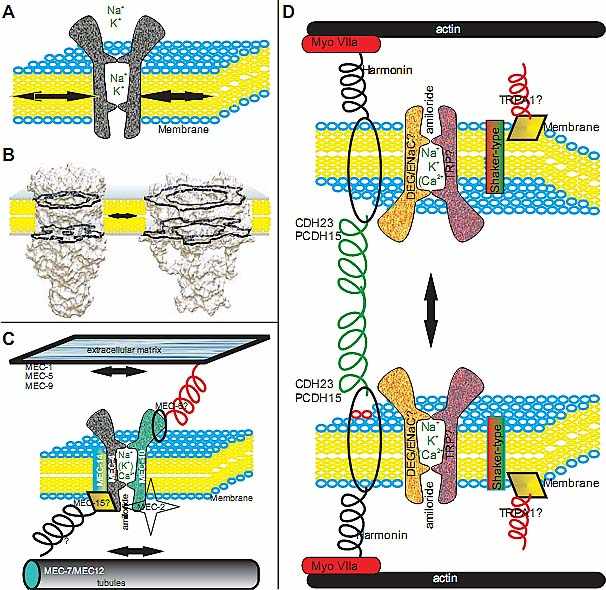 Fig. 1. Various channels that respond to changes in turgor resulting in stretch of the membranes (double arrow in A, B) have been found in single cell organisms. Detailed models of the pentameric mechanosensitive channel of bacteria suggests an iris-like opening upon tension acting in the plane of the membrane (B). It is possible that such mechanosensitive channels were modified in the unicellular ancestor of metazoans through extracellular or intracellular matrix attachments to provide increased sensitivity for shearing forces. Molecular evidence suggests that, across metazoans, only members of two cation channel families are candidates for mechanosensitive channels (C,D). It thus remains possible that metazoan ancestors evolved either or both families for specific properties that allow increased sensitivity to detect mechanical stimulations. What such properties could be remains unknown in the absence of any model of sensitive mechanosensory channel in any metazoan taxon. Mutational analysis has identified several genes that are essential for the function in nematodes (C) and vertebrates (D). In nematodes, fine touch is lost when either specific molecules of the extracellular matrix to which the channel is anchored are lost (Mec-1, 5, 9), or if specific components of the channel complex are lost (Mec-2, 4, 10, 14). However, loss to the intracellular tubules (Mec-7, 12) may lead only to a reduced sensitivity, not a complete loss of sensation. In contrast, in vertebrates there is no extracellular matrix or cuticular connection. Instead, two stereocilia are interconnected presumably by Cdh23 that is hypothesized to be anchored to MyoVIIa via harmonin. Loss of any of these genes results in deafness indicating that in vertebrates mechanosensation requires relative movement against the actin core of the stereocilia. Additional connections exist between Cdh23 and Myo1c but no knockout data support the claimed function as an adaptor. It is speculated that MyoVIIa transports the still unknown amiloride sensitive mechanosensory channel to the tip but it is unclear whether this connection remains past development. In nematodes at least two essential subunits of the mechanosensitive channel are known whereas it is not clear what the vertebrate channel is composed of. Certain candidates have been excluded as mutants in, for example, TRPA1 do hear excluding an essential role of this protein in mechanosensory transduction. Note that both nematode and vertebrate have a shaker-type channel associated with the mechanosensory channel, but details are unknown. Modified after (Bryant et al., 2005, Chiang et al., 2004, Syntichaki and Tavernarakis, 2004). механосенсорных каналов, то элиминация одиночного гена будет приводить только и измеримым эффектам, если ген обеспечивает основной или единственный компонент мультимерного механосенсорного канала. Очень вероятно, что лишь единственный аспект, который законсервирован через филетические группы, для таки х белков каналов является способность прикрепляться к безусловно законсервированным белкам связок. Ограничений, накладываемых этим базовым принципом, немного и это д. позволять множественные клеточные решения, для гарантии, что с мембраной связанный канал может управляться механическими стимулами. Сравнительный анализ механосенсорных клеток и органов показал т.о., как и следовало ожидать, значительное разнообразие специализаций с предполагаемой или известной функцией в контексте механочувствительности. Скоординированная экспрессия, по-видимому, множественных генов в данной механосенсорной клетке для того чтобы собрать механосенсорный комплекс, нуждается в транскрипционных факторах высокого уровня, которые обладают способностью регулировать пространственно-временную экспрессию всех этих белков внутри клетки, а в случае межклеточных соединений, и между клетками. Поэтому проанализируем эволюцию клеточных транскрипционных факторов, известных или предполагаемых своим участием в этих процессах в филетических группах. Conserved transcription factors regulate mechanosensory cell development Клеточная дифференцировка нейронов и сенсорных клеток нуждается в bHLH генах (Bertrand
et al., 2002, Kageyama et al., 2005) высоко консервативном наборе генов, которые появляются у одноклеточных организмов, у который они функционируют. регулируя метаболизм (Simionato
et al., 2007). Два из этих bHLH семейств генов, achaete-scute и atonal семейство, по-видимому, ассоциированы с возникновением механо-, хемо- и фоторецепторов в филетических группах. Из этих генов семейств генов atonal наиболее тесно ассоциировано с фото- и механовосприятием (Fig. 2). Особенно, atonal гены развиты у многоклеточных организмов (Seipel et al., 2004) и находятся среди немногих белок кодирующих генов, которые структурно и функционально законсервированы в той же степени, что и ортологи мух и мышей atonal и Atoh1, могут взаимно изменяться и обнаруживать компенсаторную функцию у разных организмов (Wang et al., 2002). bHLH семейство обнаруживают экспансию, согласующуюся с потребностью в дополнительных членах , чтобы регулировать дифференцировку онтогенетически и физически соединенных клеток позвоночных, сенсорных нейронов и волосковых клеток (Fritzsch et al., 2000, Fritzsch et al., 2006b). Наиболее известен нижестоящий фактор atonal генов Barlh, ген, необходимый для поддержания волосковых клеток, которые прогрессивно теряются у нулевых мутантовA (Li et al., 2002). Остается неясным как Atoh1 влияет в целом на развитие волосковых клеток, но недифференцированные предшественники образуются у Atoh1 нулевых мышей, которые в конечном счете дегенерируют (Bermingham et
al., 1999, Chen et al., 2002, Fritzsch et al., 2005a). Сходным образом atonal нулевые мутантные мухи теряют большинство из своей механосенсорной проприоцепции, включая слух (Caldwell and Eberl, 2002). Atonal-подобные гены, по-видимому, обладают отчасти более широкой функцией у кишечнополостных, у которых они специфицируют сенсорные нейроны, также как и миосенсорные клетки (Seipel et al., 2004).
Помимо bHLH генов, Pou доменовые факторы являются важными и консервативными факторами клеточной дифференцировки, включая волосковые клетки уха (Erkman et al., 1996, O'Brien
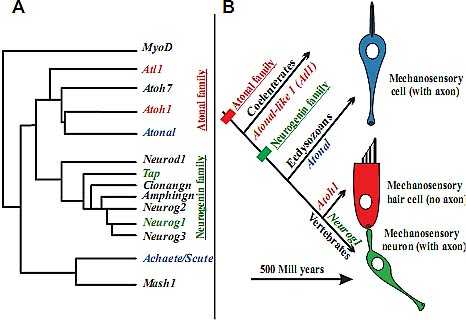 Fig. 2. The evolution of the atonal and neurogenin families of bHLH genes (A) and the evolution of the
mechanosensory cells and their associated neurons that require those family members for cellular development (B) is shown. Note that atonal and achaete/scute family evolved already in coelenterates. However, the neurogenin family may have evolved only in triploblasts. Evolution of a pair of cells (a secondary mechanosensory cell without an axon and a mechanosensory neuron connecting the cell to the brain) evolved out of a primary mechanosensory cell (with an axon) only after the neurogenin family had evolved. Whether atonal family members are always associated with mechanosensory cells in triploblasts and whether neurons associated with mechanosensory cells in other triploblasts require neurogenin for development is unknown. Modified after (Fritzsch and Beisel, 2004, Furlong and Graham, 2005).
Fig. 2. The evolution of the atonal and neurogenin families of bHLH genes (A) and the evolution of the
mechanosensory cells and their associated neurons that require those family members for cellular development (B) is shown. Note that atonal and achaete/scute family evolved already in coelenterates. However, the neurogenin family may have evolved only in triploblasts. Evolution of a pair of cells (a secondary mechanosensory cell without an axon and a mechanosensory neuron connecting the cell to the brain) evolved out of a primary mechanosensory cell (with an axon) only after the neurogenin family had evolved. Whether atonal family members are always associated with mechanosensory cells in triploblasts and whether neurons associated with mechanosensory cells in other triploblasts require neurogenin for development is unknown. Modified after (Fritzsch and Beisel, 2004, Furlong and Graham, 2005).
and Degnan, 2002), которые первоначально формируются, но вскоре дегенерируют у Pou4f3 нулевых мышей (Hertzano et al., 2004, Xiang et al., 2003). Стоящий ниже Pou4f3 др. важный фактор, существенный для сенсорного развития, это белок цинковые пальчики Gfi1 (Hertzano et al., 2004, Wallis et al., 2003). Волосковые клетки формируются в отсутствие Gfi1, но дегенерируют со временем (Hertzano et al., 2004). Ортолог Gfi1 у насекомых (senseless) необходим для дифференцировки сенсорных клеток и может даже замещать atonal у насекомых (Jafar-Nejad et al., 2003). Взаимодействия senseless и bHLH генов , по-видимому, функционируют как бинарный переключатель, чтобы способствовать или супрессировать сенсорную судьбу и тем самым усиливать др. ассоциированные процессы, такие как delta-notch латеральную ингибицию (Daudet and Lewis, 2005, Kageyama et al., 2007). Очевидно, что развитие механосенсорных клеток управляется с помощью гнездовой экспрессии транскрипционных факторов, которые кооперируют, чтобы обеспечить полную дифференцировку и поддержание таких клеток. Ни одна из индивидуальных функций, ни взаимодействия транскрипционных факторов, необходимых для достижения желаемого исхода, не поняты окончательно (Fritzsch et al., 2006a, Kelley, 2006a). Однако, ясно, что эти гены являются родоначальными для triploblasts и возможно многоклеточных животных и это может составить основу эволюции механосенсорных клеток. Несмотря на безусловную важность таких транскрипционных факторов для развития механосенсорных клеток, их регуляция до сих пор остается неясной за исключением того, что Pou4f3 регулирует Gfi1 и что Atoh1 регулирует Barlh. Кажется, что Sox2 млекопитающих регулирует непосредственно или опосредованно экспрессию Atoh1, т.к. не наблюдается экспрессии Atoh1 у Sox2 гипоморфов (Kiernan et al., 2005). Однако, как регулируется экспрессия Sox2, остается неизвестным, несмотря на огромную информацию о промоторном регионе Sox2 (Uchikawa et al., 2003). Более того, у насекомых нет доказательств для экспрессии Sox генов в нейросенсорных предшественниках (McKimmie et al., 2005), это подтверждает, что Sox2 в GYC является достижением позвоночных, которое может быть связано с клональным увеличением нейросенсорных предшественников, необходимых для образования крупных сенсорных массивов, таких как сенсорный эпителий уха (Pauley et al., 2005). Напротив, мухи, по-видимому, используют EGFr для в чем-то сходной клональной экспансии (Eberl and Boekhof-Falk, this volume). Как регулируется экспрессия Pou4f3 даже ещё менее ясно и остается также неизвестным, несколько независима его экспрессия от Atoh1.
В дополнение к регуляции молекулярных компонентов, которые возможно управляют организацией механосенсорного аппарата, эти рано экспрессируемые транскрипицонные факторы, также необходимы для гарантии, что механосенсорные клетки развиваются путем супрессии альтернативной судьбы, напр., поддерживающих клеток или генерализованной эктодермы. Очевидно, что первые преимущественно регулируются посредством повсеместной delta/notch системы для латеральной ингибиции судеб клеток (Daudet and Lewis, 2005, Fritzsch et al., 2006a, Kageyama et al., 2007, Lanford and Kelley, 2005) , тогда как последняя может нуждаться в присутствии специфических ингибиторов транскрипции и/или трансляции, чтобы элиминировать мРНК, которая способствует противоположной судьбе. Помимо специфичной для волосковых клеток мРНК для транскрипционных факторов, которые позитивно регулируют развитие механосенсорных клеток, microRNAs (miRNAs) , которые, как известно, избирательно экспрессируются в механосенсорных клетках (Weston et al., 2006), могут репрессировать существующие специфические мРНК и тем самым могут обеспечивать надежный переход от одной презумптивной клеточной судьбы к др. Наиболее важно, что эти механизмы подобны образовавшимся ранее для формирования механосенсорных органов. 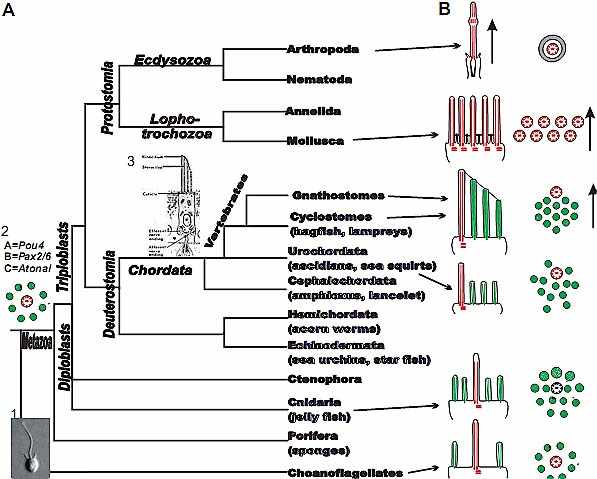 Fig. 3. Evolution of mechanosensory cells. Kinocilia (red) and microvilli pected mechanosensory cells
in various eukaryotic unicellular (1) and multicellular (3) organisms are shown. Orthologues of structural genes relevant for mechanosensation or for development of polarity such as actin, tubulin, rare myosins, cadherins, espin, - catenin and Wnt genes and several transcription factors are known in protists, Diploblasts (2) and various triploblasts and are thus ancestral to vertebrates. Note that the single celled ancestor of all multicellular animals, the choanoflagellates (1), has a single, actively beating kinocilium surrounded by microvilli that carry an actin core (A). In some diploblasts the central kinocilium is surrounded by an asymmetric assembly of microvilli of various diameters, potentially providing directional sensitivity (B). Among deuterostomes, urochordates have various presumed mechanosensory cells that have a kinocilium with asymmetrically arranged microvilli. Vertebrates are unique in that a highly polarized, organ-pipe assembly of actin rich stereocilia is attached via tip links with each other and the asymmetrically placed kinocilium. Among protostomes, mollusks may have numerous, interconnected kinocilia on mechanosensory cells. Ecdysozoans have either mechanosensory cells with cilia or have a kinocilium that is stretched by the stimulus. Arrows indicate the direction of stimulation. Statocysts are known for many taxa of metazoans, but a lateral line system is restricted to few. Modified after (Arkett et al., 1988, Budelmann, 1989, Burighel et al., 2003, Fritzsch et al., 2006b, Jorgensen, 1989, Steenkamp et al., 2006, Todi et al., 2005).
Fig. 3. Evolution of mechanosensory cells. Kinocilia (red) and microvilli pected mechanosensory cells
in various eukaryotic unicellular (1) and multicellular (3) organisms are shown. Orthologues of structural genes relevant for mechanosensation or for development of polarity such as actin, tubulin, rare myosins, cadherins, espin, - catenin and Wnt genes and several transcription factors are known in protists, Diploblasts (2) and various triploblasts and are thus ancestral to vertebrates. Note that the single celled ancestor of all multicellular animals, the choanoflagellates (1), has a single, actively beating kinocilium surrounded by microvilli that carry an actin core (A). In some diploblasts the central kinocilium is surrounded by an asymmetric assembly of microvilli of various diameters, potentially providing directional sensitivity (B). Among deuterostomes, urochordates have various presumed mechanosensory cells that have a kinocilium with asymmetrically arranged microvilli. Vertebrates are unique in that a highly polarized, organ-pipe assembly of actin rich stereocilia is attached via tip links with each other and the asymmetrically placed kinocilium. Among protostomes, mollusks may have numerous, interconnected kinocilia on mechanosensory cells. Ecdysozoans have either mechanosensory cells with cilia or have a kinocilium that is stretched by the stimulus. Arrows indicate the direction of stimulation. Statocysts are known for many taxa of metazoans, but a lateral line system is restricted to few. Modified after (Arkett et al., 1988, Budelmann, 1989, Burighel et al., 2003, Fritzsch et al., 2006b, Jorgensen, 1989, Steenkamp et al., 2006, Todi et al., 2005).
Вполне возможно, что по аналогии с эволюцией фоторецепторных органов, большое разнообразие органов может быть сформировано, используя высоко законсервированный набор генов, охарактеризованных на сегодня для механосенсторного развития в филетических группах (Fritzsch and Beisel, 2004, Todi et al., 2005). Среди этих консервативных наборов генов, miRNAs наиболее консервативны. В самом деле, не единое основание может быть не изменено внутри всего phyla. Такая консервация в конечном счете позволяет нам понять молекулярную эволюцию развития механосенсорных клеток за счет понимания генов, предназначенных для репрессии с помощью miRNAs. Такие гены, как ожидается, противодействуют передаче сигналов Atoh1/atonal и стабилизируют стандартное развитие клеток по пути эктодермы/кожи. Клеточные переходы судеб несут риск для клеток, в которых новые паттерны экспрессии генов взаимодействуют с существующим профилем. Минимизация такого риска нуждается в молекулярных средствах для гарантии предшественников от клеточной гибели, делая такие переходы возможными. Ряд молекул, недавно идентифицированных, обладающих такой способностью, это Pax гены (Bouchard et al., 2002, Torban et al., 2000). Как и в случае развития глаз экспрессия Pax2/5/8 ассоциирует с механосенсорным развитием по всему phyla (Czerny et al., 1997, Kozmik et al., 2003), возможно обеспечивая эту важную функцию выживаения клеток посредством молекулярного перехода в ходе эволюции. Дополнительные факторы, позволяющие просенсорную трансформацию и последующую клональную экспансию, это Eya1, Six1 и Gata3 (Karis et al., 2001, Schlosser, 2006, Zou et al., 2006). Комбинирование этих факторов формирует основу для органного развития, а их отсутствие обязательно будет ассоциировать с тяжелой редукцией, если не с полной потерей специфического сенсорного развития. Mechanosensory cells may represent an evolutionary variation of a generalized cellular theme Приведенный выше анализ показывает, что механочувствительность в качестве клеточной функции возникла у одноклеточных организмов, обеспечивая им собственно организацию клеточных протруберанцев к пограничным каналам или от пограничных связывающих каналов к окружающему матриксу. В самом деле, источником одноклеточных организмов являются простейшие, которые имеют центральный kinocilium, окруженный микроворсинками, которые могут быть заключены в оболочку минерализованного матрикса, choanoflagellates. Различные апикальные специализации в клетках многоклеточных, которые, как подозревают, играют роль в восприятии механических сигналов, могут быть организованы в вариации на общую тему (Fig. 3). В частности тип вторичноротых напоминает организацию кишечнополостных и обнаруживает вариации общей темы, центральный киноцилий, окруженный микроворсинками. Волосковые клетки позвоночных всегда образуют центральный киноцилий, окруженный микроворсинками и дают асимметричную организацию киноцилия с ступенчато-образным паттерном стереоцилий под действием факторов планарной полярности (Jones and Chen, 2007, Montcouquiol et al., 2006, Wang and Nathans, 2007). Напротив, большинство сенсорных систем у protostomia , по-видимому, происходят посредством редукции стереоцилий/волосков из-за киноцилиев. Scolopidial органы артропод, по-видимому, в основном происходят, стресс вдоль скрее, чем поперек киноцилия, является соотв. стимуляцией (Todi et al., 2005). Предполагаемые механосенсоры от менее скроенных protostomia д. быть исследованы для понимания взаимоотношений кажущихся более продвинутыми признаков в этом phylum с теми, что обнаруживаются у Coelenterates и Deuterostomes.
В комбинации с строгими доказательствами эволюционного родоначального происхождения многих клеточных транскрипционных факторов и возможно определенных компонентов для связок механосенсорных трансдукционных каналов, описанных выше, кажется возможным, что волосковые клетки хордовых представляют уникального происхождения признак родоначальной темы механосенсорных клеток и он может вести назад к механосенсорным клеткам кишечнополостных, которые также обнаруживают некоторую степень асимметричного развития (Fritzsch et al., 2006b). Группировка этих молекулярных и анатомических признаков делает всё менее вероятным, что механосенсорные клетки возникли в результате независимых эволюционных событий как это предполагалось ранее (Coffin et al., 2004). Эта группировка согласуется также с недавними молекулярными данными, которые подтверждают тесное сродство между кишечнополостными и вторичноротыми (Putnam et al., 2007). Evolution of mechanosensory organs: grouping single mechanosensory cells into arrays and organs for specialized signal perception Догмой эволюционной биологии является то, что одноклеточные организмы возникли прежде, чем более сложные многоклеточные организмы. Однако, если рассматривается эволюция сенсорных органов, то концептуально, по-видимому, трудно воспринять эквивалентность механосенсоров, представленных или одиночными, распределенными по телу клетками или хорошо организованными участками сенсорных клеток с узко направленной функцией эпителия в ухе позвоночных. Однако, показано, что родоначальное глобальное формирование паттерна тела сосуществует с комбинированной диффузной нервной сетью и одиночно распределенными сенсорными клетками (Burke et al., 2006, Lowe et al., 2003). Более того, basiepithelial нервная сеть или skin brain (Holland, 2003) могут быть родоначальными условиями у вторичноротых, от которых ЦНС развилась путем концентрации специфических регионов (Fritzsch and Glover, 2006, Lowe et al., 2003)}. Кажется, что такая фокальная генерация нервной системы может сопровождаться изменением паттерна гаструляции (Meinhardt, 2004). Наиболее важно, что молекулярной основой процесса концентрации по формированию ЦНС являются молекулярные различия между protostomia и deuterostomia: первые нуждаются в передаче сигналов Fgf, последние нет (Bertrand et al., 2003, Delaune et al., 2005, Fritzsch and Glover, 2006). Сравнимое с этим фокальным образованием нервной системы является и локальное образование всех основных сенсорных органов у хордовых. Как и в случае развития ЦНС развитие уха нуждается в эпителиальном переходе, который использует многие из тех же самых семейств транскрипционных факторов, также используемых при формировании ЦНС (Bailey et al., 2006, Fritzsch et al., 2006a, Litsiou et al., 2005). Поскольку эмбриональными предшественниками головного мозга является нервная пластинка, то эмбриональным предшественником уха является отическая плакода. Напротив, эволюционным предшественником головного мозга является диффузная нервная сеть, тогда как эволюционными предшественниками уха могут быть единичные, диффузно распределенные механосенсорные клетки.
Если мы примем эту интерпретацию, то из этого последует, что эволюция плакод может быть интерпретирована как эмбриональная адаптация для гарантии развития механосенсоров только в определенных местах по сравнению с повсеместным распределением по всей коже. В самом деле, у многих хордовых, а также у amphioxus обнаруживается распределение одиночных сенсорных клеток в коже, подтверждая, что способность кожи генерировать диффузно распределенные сенсорные клетки не полностью супрессирована у этих видов (Fritzsch et al., 2006b, Holland, 2005). Более того, очевидно, что такая концентрация сенсорных предшественников развивается независимо несколько раз у многоклеточных организмов, но может использоваться только ограниченный набор законсервированных транскрипционных факторов, так что это д. приводить к ложному впечатлению о гомологии, которая в основном базируется на общих и родоначальных транскрипционных факторах, регулирующих клеточное развитие.
У позвоночных Pax8 находится среди самых ранних генов несомненно экспрессируемых в развивающейся отической плакоде рыб и мышей (Nornes et al., 1990, Pfeffer et al., 1998) и, по-видимому, он в основном ко-экспрессируется с Pax2 в ушах мышей (Bouchard et al., 2002, Zou
et al., 2006). По крайней мере частично охарактеризованы уши Pax2 нулевых мышей (Burton et al., 2004, Favor et al., 1996, Torres et al., 1996, Zou et al., 2006) и показано, что функция Pax2 существенна для развития улитки мышей и людей. Хотя улитка млекопитающих является новшеством (Fritzsch
et al., 2006b, Fritzsch et al., 2006c), обнаруживатся экспрессия Pax2 в ушах костистых рыб, которые не имеют улитки (Pfeffer et al., 1998,Riley, 2003). Экспрессия Pax2 у млекопитающих, т.о., вряд ли отражает родоначальную функцию Pax2 в развитии уха позвоночных.
Кроме того, функциональный анализ d-Pax2, ортолога Pax2/5/8 у мух, показал участие этого гена в процессе выбора щетинок и что более важно в дифференцировке shaft и sheath клеток (Kavaler et al., 1999). Однако, играет ли d-Pax2 какую-либо роль в формировании chordotonal органа, в частности в развитии слухового органа Johnston мух, неизвестно. На клеточном уровне некоторые гены указывают на гомологию между chordotonal оргнами мух и волосковыми клетками млекопитающих, но существенно меньше доказательств для поверхностных механорецепторов, связанных со щетинками (Caldwell and Eberl, 2002, Fritzsch and Beisel, 2004, Todi et al., 2005). Pax8 позвоночных экспрессируется на высоком уровне как в нейросенсорных (включая сенсорные нейроны), так и в не-сенсорных областях, напоминая тем самым экспрессию d-Pax2 в развитии механосенсорных щетинок мух. Pax2/5/8 ассоциирует также со слуховым пузырьком (statocyst) моллюсков, указывая на более специфическую ассоциацию с восприятием механических стимулов у некоторых первичноротых (Protostomes) (O'Brien and Degnan, 2003). Вопросы с Pax2/5/8 столь же неясны и для вторичноротых (Deuterostomes). Проблематичной для каких-либо попыток использование Pax2 для установления гомологии органов является широко распространенная экспрессия Pax2 в tube feet морских ежей (Czerny et al., 1997) , эта структура не содержит, как известно, механосенсорного органа (Burkeet al., 2006) , и отстутствует экспрессbя Pax2 в эктодерме amphioxus (Kozmik et al., 1999), которая, как известно, имеет одиночные сенсорные клетки, подозреваемые частично, что являются механочувствительными (Holland, 2005). В комбинации с кажущимся отсутствием функции d-Pax2 в развитии chordotonal органа мух, это указывает на то, что ассоциация транскрипционного фактора Pax2 с формированием механосенсорных органов более изменчива, чем ассоциация Pax6 с фоторецепторами и может указывать на то, что Pax2/5/8 может не играть роли в развитии одиночных механосенсорных клеток. Пока остается неясным в какой момент эволюции отической плакоды позвоночных Pax2/8 становится ассоциированным, но сегодня Pax2/8 является обязательным аспектом молекулярного развития ушей позвоночных. Помимо этой неясной ситуации с Pax2/8, эволюция плакод д. быть интерпретирована в контексте формирования глобального паттерна в ходе эволюции дорсальной ЦНС хордовых. Очевидно, что Deuterostomes, такие как amphioxus и sea squirts обнаруживают один и тот же процесс формирования центрального паттерна, но только sea squirts обнаруживают экспрессию Pax2/5/8 вне ЦНС в структурах, интерпретируемых некоторыми как возможные гомологи уха позвоночных (Kozmik et al., 1999, Krelova et al., 2002, Mazet et al., 2005, Mazet and Shimeld, 2005, Schlosser, 2006, Wada et al., 1998). Такие интерпретации, по-видимому, подтверждаются существованием клеток в этих областях, которые имеют апикальные специализации, согласующиеся с их возможной функцией в качестве механосенсоров (Burighel et al., 2003), но др. выступают против этого (Holland, 2005). Мы только начинаем понимать, как различные факторы взаимодействуют др. с др., чтобы генерировать отическую плакоду из значительно большей протоплакоды (Bailey et al., 2006,
Litsiou et al., 2005, Schlosser, 2006, Torres and Giraldez, 1998) путем превращения эктодермальных клеток в новую судьбу, образования нейросенсорных и не-нейросенсорных отических клеток (Fritzsch
et al., 2006a). Ясно, что разрешения этих споров необходимы исследования значительно большего количества факторов, участвующих в формировании глобального паттерна (Wnt, Bmp, Shh) и генов, которые экспрессируются в ухе (Sox2, Gata3, Neurog1, Atoh1, Prox1, Isl1, Foxg1, Six1, Eya1) у большинства Deuterostomes (Fritzsch et al., 2006a, Ohyama et al., 2006, Schlosser, 2006) , прежде чем можно будет придти к заключению. Вполне возможно, что определенный, небольшой набор сходств генов, специфичных для хемосенсорных органов внутри phyla, может возникать с помощью возможно эволюционно независимой трансформации генов, вовлеченных в формирование механосенсорных клеток и в организацию локальных групп клеток, управляемых с помощью процесса формирования глобального паттерна. Скорее всего, родоначальные наборы генов необходимы для развития механосенсорных клеток делают трудным решение этой проблемы. Следовательно, важно критически проанализировать развитие otocyst/statocyst у таких удаленных видов как squids и кубовидных медуз, чтобы оценить сходство молекулярных основ развития органа. В комбинации с лучшим пониманием молекулярных путей мы в конечном итоге д. быть способны различать между случайностью и необходимостью молекул в развитии органов.
Итак, наиболее вероятным эволюционным сценарием для statocysts и otocyst хордовых является трансформация широко распределенных, родоначальных одиночных механосенсорных клеток в механосенсорные органы (Fritzsch et al., 2006b, Jorgensen, 1989). Очень похожее обсуждение эволюции зрительной системы (многие структурно отличающиеся глаза состоят из фоточувствительных модулей, которые конвергентно организуются в органы) может быть разрешено с помощью этого подхода (Gehring, 2005), кажущиеся молекулярные сходства во всем остальном довольно отличающиеся органы могут рассматриваться как множественная, конвергентная эволюция различных statocysts, включая ухо позвоночных, из диффузно распределенных одиночных механосенсорных клеток. В самом деле, у некоторых морских звезд tube feet влизи кончика луча могут дифференцироваться в глаз-подобные органы, демонстрируя, как внутри организма диффузная экспрессия гена Pax6 может быть реорганизована в определенные области, управляющие только развитием фоторецепторов.
Более старая идея касалась системы бокововй линии как предшественника уха. Однако, сравнения превалирования боковой линии и statocysts у многоклеточных показывает, что каждое водное, свободно плавающее животное имеет statocyst, но лишь небольшое количество имеет развитые органы, подобные органам боковой линии (Bleckmann et al., 1991, Jorgensen, 1989). Развитие как hydrodynamic, так и gravistatic органов из родоначальных одиночных механосенсорных клеток указывает на то, что это спорное обсуждение может быть в основном устаревшим, т.к. оба могут развиваться как следствие изменений формирования глобального паттерна, что ведет к образованию ЦНС и отических плакод у хордовых (Fritzsch and Glover, 2006, Lowe et al., 2003, Meinhardt, 2004). Ear morphogenesis requires conserved genes for branching morphogenesis Многие, если не все, транскрипционные факторы, используемые в развитии уха, существуют у родоначальников хордовых и, по-видимому, развиваются как собранные в гнёзда наборы генов для различных аспектов морфогенеза ветвления, включая проникновение или вытеснение (intrusion or extrusion) легких, желез, трахей и конечностей. Эволюция уха, по-видимому, дала ветвь в этот уже доступный ресурс генов, в качестве. базового модуля для управления инвагинацией и формированием каналов (Fig. 4). Однако, т.к. морфогенез ветвления обычно процесс mesenchym/ectoderm взаимодействия, то факторы, обычно экспрессируемые в мезодерме, экспрессируются в сенсорном эпителии уха. Напр., в развитии легких и слезных желез Fgf10 экспрессируется в мезодерме вблизи ведущего края инвагинации эктодермы (Govindarajan et al., 2000, Makarenkova et al., 2000)). Однако, в ухе экспрессия Fgf10 перемещается быстро в эктодерму, где она становится фокальной в развивающихся сенсорных органах (Pauley et al., 2003, Wright et al., 2003).
Поскольку вовлечение пути передачи сигналов Fgf/branchless/breathless не известно в развитии слухового органа мух, но имеющееся четкое сходство в общей консервации генов указывает на взаимодействие с др.генами в развитии уха позвоночных и трахей мух (Fig. 4). Эта впечатляющая консервация возможных функциональных взаимодействий генов в общем-то в негомологичных органах указывает на степень стабильности молекулярной сети, которая необходима для перемещения всего функционального модуля в качестве компонентов развивающихся систем. Возможно, что контекст др. генов, экспрессируемых в развивающихся трахеях мух и ухе позвоночных позволит определить исход в терминах профилей экспрессии нижестоящих генов. По аналогии с идеей, предложенной для эволюции глаз, а именно, что только вышестоящий транскрипционный регулятор и нижние функциональные гены могут быть законсервированы (Gehring, 2005), этот пример указывает на то, что целый каскад генов может быть вставлен или добавлен в качестве функционального модуля в существующую программу для в общем-то сходных и ещё не совсем четко отличимых функций. Т.о.,
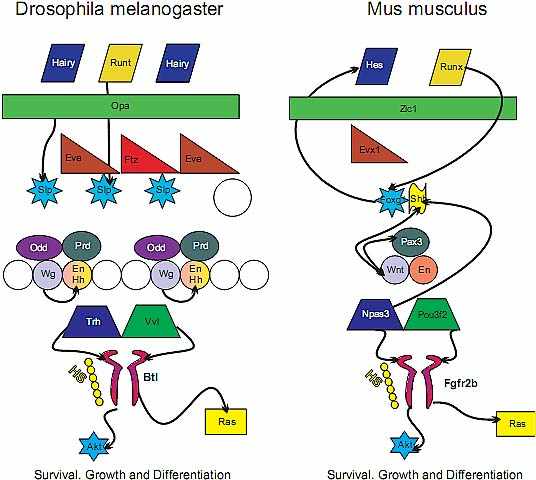 Fig. 4. Comparison of the genes involved in trachea formation in flies with inner ear development in mice.
Icons of the same shape and color represent homologous genes in Drosophila m. and Mus m. Known interactions between genes are demonstrated by the black arrows. Several homologous genes have
been identified in these developmental pathways, but their interactions have not yet been fully described in either species. Putative sequence of activation is from the top with the fly and louse Fgf/Fgfr system providing the integration between patterning events outside the trachea/ear and intracellular signaling that
leads to morphogenesis The striking resemblance of these genes as a complex interacting module supports a model in which not only are individual genes conserved across phyla, but the entire signaling network is conserved and utilized in the development of diverse structures, governing various aspects of
branching morphogenesis. We recently tested the predictive value of this model and reported
on the effect of Foxg1, the orthologue of Slp1+2 (Lee and Frasch, 2004, Mondal et al., 2007), in mouse ear development (Pauley et al., 2006). More of the listed genes should be tested for such conserved function to assess how much of the entire developmental module is invariable and thus needs to be inherited as an entire cascade of gene interactions with modifications to suit the need of the specific tissue in
question. Modified after (Swantek and Gergen, 2004). Gene names follow the nomenclature as published in PubMed.
Fig. 4. Comparison of the genes involved in trachea formation in flies with inner ear development in mice.
Icons of the same shape and color represent homologous genes in Drosophila m. and Mus m. Known interactions between genes are demonstrated by the black arrows. Several homologous genes have
been identified in these developmental pathways, but their interactions have not yet been fully described in either species. Putative sequence of activation is from the top with the fly and louse Fgf/Fgfr system providing the integration between patterning events outside the trachea/ear and intracellular signaling that
leads to morphogenesis The striking resemblance of these genes as a complex interacting module supports a model in which not only are individual genes conserved across phyla, but the entire signaling network is conserved and utilized in the development of diverse structures, governing various aspects of
branching morphogenesis. We recently tested the predictive value of this model and reported
on the effect of Foxg1, the orthologue of Slp1+2 (Lee and Frasch, 2004, Mondal et al., 2007), in mouse ear development (Pauley et al., 2006). More of the listed genes should be tested for such conserved function to assess how much of the entire developmental module is invariable and thus needs to be inherited as an entire cascade of gene interactions with modifications to suit the need of the specific tissue in
question. Modified after (Swantek and Gergen, 2004). Gene names follow the nomenclature as published in PubMed. морфогенез ветвления в трахеях мух и в ухе позвоночных имеют лишь очень рудиментарные онтогенетические аспекты в общем, рост посредством пролиферации и расщепление ростовой пластинки на две части, которые приводя к разным результатам. Наиболее важным для наших рассуждений является то, что онтогенетическая программа отического пузырька у ранних хордовых уже обладает потенциалом передавать сигнал в существующий модуль, который может управлять специфическими аспектами морфогенеза. Эффективное использование этого ресурса нуждается в регуляции экспрессии всего модуля в ухе, а модификация сигналов для достижения новых целей; а именно, образования двух или трех каналов вместо одного, как у миксин. В то время как сравнение с развитием трахей мух строго подтверждает эту модель, демонстрируя, что миксины имеют тот же самый модуль, но не экспрессируют его в развивающемся ухе, это предоставляет даже ещё большее подтверждение этой модели. Ограниченные доказательства подтверждают эту идею для определенных генов морфогенеза уха (Fritzsch et al., 2001, Hammond et al., 2002, Hammond and Whitfield, 2006). Evolution of the vertebrate ear through segregation of
epithelial patches into a multifunctional organ Сравнение между группами подтверждает, что оригинальное ухо позвоночных скорее всего является gravistatic органом, несхожим со многими statocysts, обнаруживаемыми у многоклеточных животных. Эволюция системы углового ускорения, обеспечиваемого с помощью полукружных каналов, по-видимому, появляется только среди ракообразных, головоногих и позвоночных (Budelmann,
1987) и может поэтому рассматриваться как производный признак statocysts. Рассматривая в этой перспективе, одной из главных движущих сил эволюции уха возможно является сегрегация и морфологическая специализация определенного эпителия, предназначенного для детекции специфических сенсорных стимулов. Это может быть достигнуто посредством ассоциации с уникальной морфологией, которая отфильтровывает специфические компоненты стимулов (полукружные каналы и otoconia, напр.). У позвоночных это вдет к эволюции до 9 самостоятельных сенсорных органов [три гребня полукружных каналов, utricle, saccule, lagena, cochlea/basilar papilla, neglected papilla, amphibian
papilla; gymnophionans (Fritzsch and Wake, 1988)] из единственной общей macula и двух канальных гребешков [hagfish (Lewis et al., 1985)].
Сегрегация сенсорных участков (Fig. 5) связана с увеличением числа волосковых клеток, но стереотипическая сегрегация сенсорных органов комбинируется с различными способами добавления волосковых клеток у позвоночных [непрерывное добавление в течение длительного времени как у костистых рыб (Millimaki et al., 2007, Riley, 2003), миног (Hammond and Whitfield, 2006)), акул (O'Neill
et al., 2006)) или амфибий (Fritzsch et al., 1988) или кратковременное взрывообразное формирование всех волосковых клеток как у млекопитающих (Matei et al., 2005, Ruben, 1967)] , указывая тем самым, что два процесса на определенном уровне независимы. Что управляет сегрегацией сенсорных участков до сих пор неясно (Fritzsch et al., 2002) , несмотря на предположения о возможном участии определенных молекул (Daudet and Lewis, 2005). Необходимо различать между генами, необходимыми для осуществления разделения от генов, которые действительно инициируют такую сегрегацию. Т.к. система delta/notch безусловно играет роль в этом процессе (Daudet and Lewis, 2005) она может нуждаться во взаимодействии с др. факторами для сегрегации, сравнимыми с активностью Hes7 при формировании сомитов (Dequeant et al., 2006). Сравнение между группами показывает существование пути delta/notch уже у мух, следовательно, скорее всего она существует у миксин и миног, которые имеют общую macula, которая не подразделена на участки. По существу один или несколько генов необходимы, которые выполняют эту роль подобно генами Sox2/Atoh1, выполняющими эту роль для формирования волосковых клеток [которая также подкрепляется с помощью системы delta/notch (Fritzsch et al., 2006a, Kelley, 2006b)].
Одним из генов, участвующих в сегрегации сенсорного эпителия, является Otx1. У нулевых мутантов по этому гену наблюдается неполная сегрегация utricle и saccule через utriculo-saccular отверстие, горизонтальный гребень может полностью оказаться не отделенным от остальных сенсорных участков (Fritzsch et al., 2001, Morsli et al., 1999). В самом деле, отсутствие морфогенетической сегрегации у миног было недавно связано с отсутствием Otx1 (Hammond and Whitfield, 2006) как это и предполагалось (Fritzsch et al., 2001). Данные по мутантам Otx1 , а также др. (see below) подтверждают, что сегрегация и морфогенез сцеплены, но молекулярные основы такой связи не очень ясны (Chang et al., 2004a, Chang et al., 2004b, Fritzsch et al., 2006b, Fritzsch and Wake, 1988). Многие гены, которые действуют подобно Otx, необходимы для полного понимания, что движет сегрегацией сенсорного эпителия; в частности сегрегацией гребешка канала от gravistatic органов.
Сегрегация позволяет сенсорному эпителию развивать уникальные молекулярные свойства, которые инициируют образование, напр., бесклеточных покрывающих структур, которые делают возможным получение специфических стимулов (гребень полукружного канала имеет cupulae, gravistatic органы имеют otoconia/otoliths , а слуховые органы имеют текториальные мембраны, за исключением костистых рыб), и обладают специфической связанной с этим морфологией для направления стимулов к чувствительным элементам (гребешки каналов ассоциированы с полукружными каналами для восприятия углового ускорения; gravistatic органы находятся в тайниках, которые ориентированы в разных направлениях для восприятия горизонтальных и вертикальных стимулов; слуховые органы ассоциированы со специфическими звук проводящими путями, которые начинаются от места вхождения звука (напр., основания стремени) до места выхода звука (напр., круглое отверстие).
Очевидно, что диверсификация сенсорного эпителия идет рука об руку с гистологическими и морфологическими изменениями в ухе. В принципе существуют два пути, с помощью которых скоординированный морфогенез и гистогенез могут быть достигнуты: или набор генов управляет морфогенезом из зачатка сенсорного эпителия, или существуют общие вышестоящие регуляторы, которые одновременно регулируют и гистогенез сенсорного эпителия и морфогенез окружающих добавочных структур. Существует мало доказательств на сегодня для второго пути регуляции развития уха, а нормальный морфогенез уха у Atoh1 нулевых мышей (которые лишены дифференцированных волосковых клеток) указывает на то, что не волосковые клетки, а предшественники сенсорного эпителия регулируют морфогенез уха (Fritzsch et al., 2005a). В согласии с этим предположением и морфогенетические дефекты, описанные для Sox2 гипоморфных мышей, которые даже не дают распознаваемых просенсорных участков (Kiernan et al., 2005). Согласуется с этим предположением также то, что мутанты по некоторым генам, экспрессируемым в просенсорных участках до формирования волосковых клеток, таким как Foxg1, Fgf10 и Jag1 нулевые мыши, лишенные или с сильно уменьшенным образованием просенсорного гребня канала, все они имеют дефекты формирования каналов (Brooker et al., 2006, Kiernan et al., 2006, Pauley et al.,
2003, 2006). Напротив, когда нарушено образование просенсорного эпителия до образования просенсорных участков как у Neurog1 нулевых мышей (Matei et al., 2005) или Tbx1 мутантов (Raft et al., 2004, Xu et al., 2007), то наблюдается нарушения морфогенеза. Следовательно, зачатки сенсорного эпителия и поддерживающие клетки, но не волосковые клетки, являются критическими для развития канала (Matei et al., 2005, Pauley et al., 2003, Wright and Mansour, 2003). Ниже мы рассмотрим некоторые детали, как Fgf10 может вызывать подобный эффект.
Многие критические функции FGFs законсервированы внутри phyla. В противоположность позвоночным, где FGFs играют критическую роль в формировании нервной пластинки (Bertrand et al., 2003), нет доказательств передачи сигналов FGF в этом контексте в развитии мух, указывая тем самым, что функция FGF в формировании нервной пластинки является новым приобретением для Fgfs позвоночных (Fritzsch and Glover, 2006). У Drosophila, эти гены регулируют миграцию клеток и паттерны ветвления в трахеях и формирование зачатков конечностей (Sutherland et al., 1996) , тогда как передача сигналов EGFr выполняет передачу сигналов, ассоциированных с передачей сигналов FGF у позвоночных, наиболее важных для развития chordotonal органа (Eberl and Boekhof-Falk, this volume). Эта роль в морфогенезе ветвления законсервирована у позвоночных наиболее легко обнаруживается у Fgf10 нулевых мышей, которые не формируют легких, желез и конечностей. FGFs , как известно, участвуют в развитии внутреннего уха млекопитающих, это Fgf 3, 8, 10. Др. из 20 FGFs ещё не исследованы (Zhang et al., 2006). Как и в случае ЦНС, FGFs отсутствуют в механосенсорной системе насекомых, но играют важную роль в развитии внутреннего уха позвоночных. Так, Fgf10 мутанты обнаруживают существенные дефекты в выростах и развитии каналов особенно системы заднего канала (Pauley et al., 2003). FGF10 обнаруживает наивысшее сродство к B изоформе FGFR2 (Zhang et al., 2006); а Fgfr2b нулевые мыши обнаруживают агенез уха из-за ареста морфогенеза
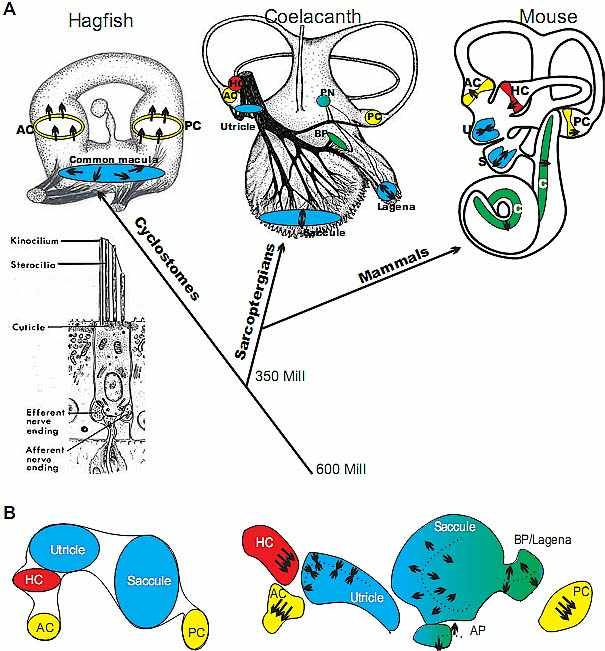 Fig. 5. Crucial steps in vertebrate ear evolution (A) and development (B) are depicted. It is assumed that the vertebrate hair cells with afferents and efferents co-evolved with the ear (insert) some 600 million years ago. Note that the ears of the three depicted vertebrate species differ in the number of canal cristae (hag- fish has two, coelacanth [Latimeria] and mouse have three), number of vestibular organs (hagfish has one [common macula], coelacanth has three [utricle, U; saccule, S; lagena, L] and mouse has two [utricle, U; saccule, S]) and number of organs near perilymphatic ducts (none in hagfish, two [basilar papilla, BP; papilla neglecta, PN] in coelacanth and one [organ of Corti of the cochlea, C] in mouse). Major morphological evolutionary changes are the addition of a horizontal canal in gnathostomes and the transformation of the utricle into several recesses containing the saccule, lagena and cochlea. It is suggested that the evolution of up to nine sensory organs of the vertebrate ear (A) comes about through ontogenetic segregation of a single primordium into multiple sensory patches (B). After segregation, each sensory patch differentiates along a unique trajectory to form adult epithelia that perceive discrete aspects of the mechanical stimulation that reaches the ear (A). Development (B) therefore recapitulates the evolutionary segregation and differentiation of various epithelia from a common precursor. Integrated into this differentiation is the organization of different polarities of hair cells (arrows in B) that can be opposing (utricle, saccule, lagena) or one polarity (canal cristae). Note that the polarity of hair cells in the cristae is similar in anterior and posterior crista (away from the gravistatic organs), whereas the horizontal crista is polarized toward the gravistatic organs. How the ancestral molecular pathway to set up cellular polarity in the various sensory epithelia has been modified remains unclear. Modified after (Fritzsch and Beisel, 2004, Fritzsch et al., 2002). на ст. отического пузырька (Pirvola et al., 2000). Др. члены семейства Fgf также являются критическими для развития уха. Нокдаун Fgf3/Fgf8 рыбок данио ведет к отсутствию отических пузырьков (Maroon et al., 2002, Riley, 2003) , а Fgf3/Fgf8 комбинация существенна для формирования плакод у мышей и кур (Ladher et al., 2005). Сходным образом, Fgf3/Fgf10 двойные нулевые мыши обнаруживают только ограниченное образование случайных микропузырьков (Alvarez et al., 2003, Wright and Mansour, 2003). Ухо формируется у мутантных мышей Fgf3, но уменьшение размера уха безусловно отличается от такового у двух Fgf3 нулевых линий, варьируя от пузырек-подобного (Mansour, 1994) до почти нормального (Alvarez et al., 2003). Морфогенез канала может быть нарушен рядом факторов (Chang et al., 2004a, Pauley et al., 2006). FGF10, как и звестно, взаимодействует с BMP4, который по-видимому, участвует в раннем развитии механосенсоров Drosophila и является частью вышестоящей регуляции детерминации судьбы клеток. Во внутреннем ухе млекопитающих Fgf10 и Bmp4 экспрессируются в презумптивном сенсорном эпителии и взаимодействуют во время морфогенеза канала (Chang et al., 2004b). Далее,
Bmp4, как было показано, редуцирует размер просенсорных участков, тогда как Noggin, BMP-ингибитор, увеличивает просенсорный домен, увеличивая тем самым область экспрессии Fgf10 (Pujades et al., 2006).
Мы полагаем, что Fgf10, в соответствии со своей законсервированной функцией в морфогенезе ветвления (Fig. 4), действует как центральный узел в морфогенезе канала. Мы полагаем, что размер просенсорного гребня и количества клеток предшественников сенсорного эпителия детерминируются с помощью молекулярной сети, описанной выше, детерминируя уровень экспрессии Fgf10, который в свою очередь регулирует рост канала во взаимодействии с др. генами. Недавно установлены гены, влияющие на рост и морфогенез уха, которые соединяются с промоторным регионом гена Fgf10. Среди этих генов Gata3, ген, который влияет на морфогенез уха (Karis et al., 2001) и некоторые др., как известно, затрагивающие формирование канала, такие как HoxA1, HoxB1, Dlx и Nkx гены (Chang et al., 2004a, Ohuchi et al., 2005). К сожалению, многие из этих генов не были изучены в отношении их роли в гистогенезе или в отношении экспрессии ключевых Fgfs или Bmps в сенсорном эпителии. Дальнейшим подтверждением идеи, что Fgf10 является центральным узлом морфогенеза канала, является отсутствие образования всех каналов у Fgf10 нулевых мышей (Ohuchi et al., 2005, Pauley et al.,
2003). Др. категория генов, которая, по-видимому, действует ниже Fgf10 и детерминирует слияние canal plate. Одним из таких генов является Netrin, который, по-видимому, влияет на общий радиус канала (Salminen et al., 2000). EphB2 и Nor-1 ответственны за диаметр канала (Cowan et al., 2000, Ponnio et al., 2002). Далее, финальный диаметр каналов также зависит от продукции эндолимфы и увеличен у Foxi1 нулевых мышей из-за эндолимфатического отека (Hulander et al., 2003). Важно, что потеря образования гребня у Jag1 или Foxg1 нулевых мышей ведет к частичной потеря образования канала (Brooker et al., 2006, Kiernan et al., 2006, Pauley et al.,2006). У Fgf10 нулевых мышей обнаруживается некоторое 'восстановление' переднего канала. Это скорее всего обусловлено Fgf3, который экспрессируется в передней части развивающегося отоциста (Wright et al., 2003). Эта экспрессия Fgf3 находится слишком далеко от заднего гребня, чтобы восстановить развитие его гребеня и канала.
Наши данные показывают, что Foxg1 является, по крайней мере, одним из дополнительных факторов, которые кооперируют с Fgf10, чтобы детерминировать размер сенсорного эпителия, следовательно, необходима передача сигнала, чтобы взаимодействовать с BMPs для собственно роста канала (Chang et al., 2004a) скорее всего посредством взаимодействия с передачей сигнала Smad (Massague et al., 2005). Комбинированные Foxg1 с Jag1 нулевые мыши д. помочь выяснению сложных взаимодействий, возникающих в сигнальной системе NOTCH/HES/bHLH в ухе (Brooker et al., 2006, Fritzsch et al., 2006a, Matei et al., 2005).
Помимо FGFs и BMPs, необходимых для развития всех каналов, новые гены рекрутируются для развития горизонтального гребня. Система горизонтального канала обладает некоторой способностью к независимому формированию горизонтального гребня, как это демонстрируется с помощью Foxg1 нулевых мышей, у которых горизонтальный канал формируется, но отсутствует гребень горизонтального канала (Pauley et al., 2006). Др. ген, который является критическим для системы горизонтального канала является ген Otx1. Otx1 нулевые мыши полностью лишены горизонтального канала, хотя гребешок гороизонтального кнала формируется и
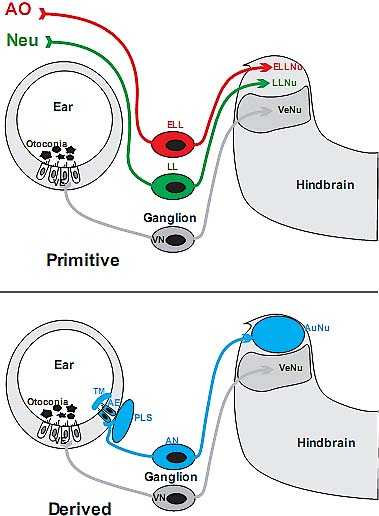 Fig. 6. The transformation of the ear, sensory neurons and brainstem from a non-auditory, primitive condition, into the derived condition, enabling a tetrapod vertebrate to hear, is shown. The primitive
ear has vestibular sensory epithelia (VE) that are connected with vestibular sensory neurons (VN) to the vestibular nuclei of the brainstem (VeNu). Additional sensory systems in primary aquatic vertebrates are
the electroreceptive ampullary organs (AO) and the mechanosensory neuromasts of the lateral line (NEU). These organs are connected via specific sets of sensory neurons (ELL, LL) to specific brainstem nuclei
(ELLNu, LLNu). Derived land vertebrates have lost these senses and have a sound pressure receiving sense, called hearing. This sense is characterized by the auditory epithelium (AE) that sits at or near a sound
conducting perilymphatic system (PLS) and is covered with a tectorial membrane (TM). Auditory neurons (AN) conduct the information from the auditory epithelium to the auditory nuclei (AuNu) of the brainstem.
This basic organization may have evolved in the aquatic ancestor of terrestrial vertebrates, but was modified in amphibians through the addition of the amphibian papilla and in amniotes through the formation
of the cochlea. Modified after (Fritzsch and Neary, 1998).
Fig. 6. The transformation of the ear, sensory neurons and brainstem from a non-auditory, primitive condition, into the derived condition, enabling a tetrapod vertebrate to hear, is shown. The primitive
ear has vestibular sensory epithelia (VE) that are connected with vestibular sensory neurons (VN) to the vestibular nuclei of the brainstem (VeNu). Additional sensory systems in primary aquatic vertebrates are
the electroreceptive ampullary organs (AO) and the mechanosensory neuromasts of the lateral line (NEU). These organs are connected via specific sets of sensory neurons (ELL, LL) to specific brainstem nuclei
(ELLNu, LLNu). Derived land vertebrates have lost these senses and have a sound pressure receiving sense, called hearing. This sense is characterized by the auditory epithelium (AE) that sits at or near a sound
conducting perilymphatic system (PLS) and is covered with a tectorial membrane (TM). Auditory neurons (AN) conduct the information from the auditory epithelium to the auditory nuclei (AuNu) of the brainstem.
This basic organization may have evolved in the aquatic ancestor of terrestrial vertebrates, but was modified in amphibians through the addition of the amphibian papilla and in amniotes through the formation
of the cochlea. Modified after (Fritzsch and Neary, 1998). соотв. иннервируется (Cantos et al., 2000, Fritzsch et al., 2001). Эти наблюдения подтверждают идею, что эволюция системы горизонтального канала происходит в две фазы: i) образование отдельного сенсорного эпителия, скорее всего посредством дополнительного роста и расщепления существующего эпителиального участка, обеспечиваемого частично с помощью Foxg1; и ii) формирование горизонтального канала за счет рекрутирования Otx1. Комбинированные эти данные подчеркивают критические ступени для морфогенеза канала в целом и проливают некоторую информацию на эволюцию системы горизонтального канала. Экспрессия большинства из этих генов до выхода волосковых клеток из клеточного цикла указывает на то, что размер популяции нейросенсорных предшественников и экспресасия критических генов, таких как Fgf10 и Bmp4, которые связаны с нейросенсорным гистогенезом, участвуют в морфогенезе уха в системе каналов. В противоположность развитию каналов рост улитки происходит за счет конвергентного расширения (convergent extension) (Lee et al., 2006) , но этот процесс также может быть нарушен за счет элиминации некоторых генов, как известно, затрагивающих морфогенез канала и gravistatic рецепторов (Otx, Neurog1, Foxg1, Sox2, Delta, Notch). Evolution of auditory receptors: from a simple sensory patch to complex morphogenesis Как skj представлено выше, диверсификация сенсорной функции уха следует хорошо известным принципам молекулярной эволюции: дипликации, мутации и выбор новых генов для новой функции, используя изменения в цис-регуляторных элементах (Sodergren et al., 2006) , в то же время с сохранением стараой родоначальной функции. Существует униформное согласие, что эволюция уха стартует с восприятия gravistatic и угловых ускорений вестибулярного уха (Fig. 6). Возникновение новых функций в вестибулярной системе нуждается в генах для образования нового сенсорного эпителия, чтобы соответствовать новым аспектам морфогенеза, которые могут использовать др. гены, чем те, что используются для морфогенеза переднего и заднего канала. Возможно, что одно из таких событий, расщепление сенсорного эпителия, может уже сгенерировать новый эпителий у родоначальников водных тетрапод (Fritzsch, 1992, Fritzsch, 2003). Однако, вовлечение этого нового сенсорного эпителия в новый тип рецепторов, слуховых рецепторов, нуждается в сложной реорганизации периотического пространства, чтобы была возможность образованию перилимфатической жидкости, заполняющей пространство между вхождением и выходом звука в ухе, т.е. между овальным и округлым окном. Это вполне возможно, но не известен молекулярный уровень, с помощью которого формируемый сенсорный эпителий улитки д. помочь организовать перилимфатическое пространство, окружающее улитку. Важно отметить, что такие перилимфатические специализации развиваются независимо от того, какой сенсорный эпителий превращается в слуховую систему (Fritzsch, 1999), подтверждая тем самым, что имеющие отношение к делу гены являются родоначальным модулем развития уха. Будущие исследования д. сконцентрироваться на этой важной проблеме перилимфатической реорганизации, без которой проведение звука от барабанной перепонки к округлому окошечку было бы невозможно. К сожалению, почти ничего не известно об этом предмете,т.к. не были исследованы мутанты с нарушенным морфогенезом улитки.
Помимо направления звука к этому новому сенсорному эпителию, д. сформироваться новый набор нейронов, предназначенных для проведения звуковой информации в головной мозг с молекулярными механизмами для обеспечения дискретных соединений с звук перерабатывающим сенсорным эпителием и с набором центральных нейронов, предназначенных для восприятия этой информации скорее, чем вестибулярных стимулов. Напр., второй neurotrophin, Ntf3 (NT-3) экспрессируется в базальном витке улитки и избегает образования новых путей для вестибулярных волокон, что может быть индуцировано экспериментально у трансгенных животных, которые экспрессируют neurotrophin Bdnf под контролем промотора Ntf3 (Tessarollo et al., 2004). Кроме того, млекопитающие экспрессируют транскрипционный фактор Gata3 в нейронах спирального ганглия и этот фактор может играть роль в нахождении пути (Karis et al., 2001). Безусловно, необходимо знать больше об этом предмете, прежде чем мы начном оценивать ступени, преодолеваемые на молекулярном уровне, обеспечивающие соответ. пути клетками спирального ганглия и сможеи использовать эту информацию для усиления роста волокон во время регенерации (Martinez-Monedero
et al., 2006).
Молекулярное понимание развития ядра улитки продвигается вперед. У кур и мышей сегодня мы знаем о ромбомерном происхождении кохлеарных ядер (Cramer et al., 2000, Farago et al., 2006, Fritzsch et al., 2006c) и знаем также, что большинство нейронов зависит от того же самого транскрипционного фактора, который существенен для дифференцировки волосковых клеток, Atoh1 (Fritzsch et al., 2006c, Wang et al., 2005). Эти инициальные ступени определенно слишком сырые, чтобы определить большинство нейронов, распознаваемых кохлеарными ядрами позвоночных, но удивительно то, что ромбомерное происхождение разумно согласуется с с хорошо распознаваемыми подразделениями кохлеарных ядер у мышей. Rhombomere 2 д. генерировать переднее подразделение переднего вентрального кохлеарного ядра, rhombomere 3 д. давать заднее подразделение кохлеарного ядра, rhombomere 4 д. генерировать нейроны нижнего подразделения задней чати вентрального кохлеарного ядра, rhombomere 5 д. генерировать клетки octopus дорсального кохлеарного ядра и rhombomere 6 д. генерировать оставшуюся часть дорсального кохлеарного ядра (Ehret and Romand, 1997). Во многих работах используется ромбомер специфическая экспрессия Cre (Farago et al., 2006) в комбинации с floxed Atoh1 или Neurod1 для избирательной элиминации развития кохлеарных ядер ромбомер-специфическим образом с анализом эффектов на ЦНС.
Summary and outlook Within recent years it has become clear that evolution of senses is predominantly evolution at the receptor level while tapping into neuronal plasticity for information processing. For example, evolution of trichromatic vision has been reconstructed in mice through expression of a long wavelength opsin. Surpris-
ingly, mice can process this new information through the apparently built in plasticity in their neuronal information processing system (Jacobs et al., 2007). It has also been shown that Wnt induced formation of ‘vestibular’ hair cells in the chicken cochlea results in altered innervation with the possibility that these cells
are connected to vestibular rather than auditory nuclei (Stevens et al., 2003). It thus appears that we need to interpret evolution of mechanosensors and evolution of auditory organs out of vestibular organs primarily at the level of the receptor changes. It appears likely that the candidate receptor molecules evolved with multicellular organisms (Beisel et al., 2007). When and how they were selected for the hair cells remains to be shown. Other issues such as formation of new sensory epithelia and segregated projections of innervating afferents to a distinct information processing part of the brain may be instantly sorted owing to the brain’s capacity to plastically respond to altered sensory input. Of course, selection will ultimately drive complete segregation through picking developmental modules via changes in their promoter region. Such changes will accommodate more refined information processing through the evolution of accessory structures and the evolution of uniquely dedicated information processing pathways. While gathering information about such structures is informative in its own right, it is the receptor that primarily drives sensory evolution. In this context, it is important to reiterate that more work is needed to resolve open issues on the molecular basis of mechanoreceptor cell evolution to reconcile the apparent histological differences with the apparent conservation of certain cell fate determining genes.
|