Почти все miRNAs животных регулируют свои мРНК мишени путем соединения с их 3' UTRs с частичной комплементарностью (rev. Jackson and Standart, 2007; Nilsen, 2007), где спаривание критических оснований происходит между 2nd и 8th нуклеотидами на 5' конце. Т.о., одиночная miRNA распознает множественные мишени. Более важно, что miRNAs скоординировано регулируют свои гены мишени, кодирующие белки с родственными функциями; напр., специфичная для печени
может регулировать множественные гены, участвующие в метаболизме холестерола и жирных кислот (Esau et al., 2006). В принципе в результате активации одиночной miRNA, клетки могут специфически модифицировать экспрессию множественных мРНК мишеней в ответ на средовые стрессы. В самом деле, в ответ на повреждения ДНК или онкогенный стресс белок опухолевого супрессора p53 активирует транскрипцию miR-34a, которая в свою очередь регулирует экспрессию программы клеточного цикла и генов, отвечающих на повреждения ДНК, чтобы предупредить неадекватную клеточную пролиферацию (Brommer et al., 2007; Chang et al., 2007; He et al., 2007; Raver-Shapira et al., 2007; Tarasov et al., 2007). Точно также транскрипционный фактор HIFa индуцирует экспрессию избранных немногих miRNAs, чтобы усилить жизнеспособность неопластических клеток в микроусловиях гипоксии (Kulshreshtha et al., 2007). Фактически, эта стрессом индуцированная позитивная регуляция miRNAs, по-видимому, является универсальной. Напр., ограничение растениям питательных веществ, таких как sulfate и phosphate, ведет к активации экспрессии miR-395 и miR-399, соотв., которые скоординированно репрессируют экспрессию своих транспортеров неорганических ионов и ассимиляцию энзимов (Chiou et al., 2006; Jones-Rhoades and Bartel, 2004; reviewed in Sunkar et al., 2007). Следовательно, аналогично оперонам прокариот или транскрипционным факторам эукариот, которые регулируют общий набор клеточных генов, одиночная miRNA обладает потенциалом регулировать множественные функционально родственные мРНК пост-транскрипционно в ответ на стресс.
Не все miRNA меняют уровни экспрессии в ответ на стресс; напр., экспрессия специфичной для сердца miR-208 остается неизменной, хотя она и играет незаменимую роль в ремоделировании перегруженного сердца, чтобы усилить пропускную способность сердца (van Rooij et al.,
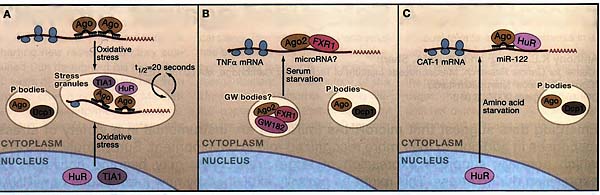 Figure 1. Argonautes, miRNAs, and Stress
(A) Argonaute proteins become localized to stress granules (SGs) upon exposure of the cell to a variety of stresses, and the localization is dependent on miRNAs.
Figure 1. Argonautes, miRNAs, and Stress
(A) Argonaute proteins become localized to stress granules (SGs) upon exposure of the cell to a variety of stresses, and the localization is dependent on miRNAs.
(B and C) Argonaute associates with other RNA-binding proteins and becomes an activator. The absence of Argonaute/miRNA targets from specific cellular structures during stress might be important for miRNA regulation. For example, a fraction of Argonaute is associated with the fragile X protein FXR1 in GW bodies (a variant of P bodies; PBs) in HEK293 cells cultured in serum (B). Upon serum starvation, such structures disassemble while Argonaute and FXR1 become associated with polysomes. Similarly, Bhattacharyya et al. (2006) have shown that the mRNA for cationic amino acid transporter (CAT-1), which is a target of miR-122, is present in PBs of Huh7 cells, but the signal at PBs becomes undetectable when cells are starved (C). The absence of signals at PBs requires not only miR-122 but also the RNA-binding protein HuR, which coincides with the association of CAT-1 мРНК with polysomes. In both cases, it seems that the structural localization of factors is inversely correlated with polysome association and hence translation.
2007). Это указывает на то, что способ регуляции miRNA может меняться в ответ на стресс. microRNAs обеспечивают репрессию трансляции или деградацию мРНК посредством ключевого связывающего белка Argonaute. Интересно, что один из стабильно ассоциированных партнеров для Argonaute, Hsp90, является чувствительным к стрессам и участвует в его стабильности (Liu et al., 2005; Tahbaz et al., 2001), хотя является ли это изменение ассоциации в ответ на стресс, ещё необходимо исследовать. Альтернативно, эти белки участвуют в регуляции miRNA и могут быть модифицированы после трансляции стресс-специфическим способом. Это наблюдается с др. ключевыми регуляторами генной экспрессии, такими как транскрипционный фактор HIFa, гидроксилирование пролина которого зависит от уровня внутриклеточного кислорода (rev. Kaelin, 2005). Здесь мы упомянем два недавно открытых аспекта Argonaute, которые меняются в ответ на стресс: доступность и соседнее расположение на сайте, связывающем miRNA (Figure 1). Мы установили, что все члены семейства Argonaute (Ago1-4) меняют свое положение внутри клетки в ответ на стресс (Figure 1A) (Leung et al., 2006). Ассоциация Argonaute с др. РНК-связывающими белками, как недавно было показано, переключает обычно репрессивную miRNA в активатор своих мишеней, когда клетки обеднены сывороткой или аминокислотами (Figures 1B и 1C) (Bhattacharyya et al., 2006; Vasudevan and Steitz, 2007).
Accessibility
В цитоплазме располагается большинство зрелых miRNAs, они спариваются с основаниями своих мишеней транскриптов, чтобы ингибировать трансляцию или индуцировать деградацию мРНК. Хотя большинство Argonautes и miRNAs распределены диффузно в цитоплазме, часть их оказывается локализованными на специфических клеточных структурах (rev. Leung and Sharp, 2006; Nilsen, 2007). Эти структуры потенциально содержат локальные концентрации факторов, которые уже доступны для miRNA комплексов, участвующих в регуляции. В отсутствии стресса в клетках Argonaute и miRNAs локализуются диффузно в цитоплазме и незначительная их часть оказывается в processing bodies (PBs или их варианте GW тельцах). Однако, после воздействия стресса, такого как оксидативный стресс, Argonaute и miRNAs дополнительно оказываются локализованы во вновь собираемых структурах, известных как stress granules (SGs) (Leung et al., 2006).
SGs являются местами, где poly(A)+ мРНК, связанные с помощью остановившихся 40S рибосом, накапливаются, когда инициация трансляции ингибирована во время гипогликемии, вирусной инфекции, солевых стрессов, УФЛ иррадиации или гипоксии (Anderson and Kedersha, 2006). Сборка SG обычно инициируется с помощью фосфорилирования фактора инициации трансляции elF2a, это происходит, когда разные средовые стрессы активируют индивидуальные elF2a киназы (напр., PKR, HRI, PERK и GCN2). Следовательно, разнообразные стрессовые условия, по-видимому, запускают локализацию Argonautes, miRNAs, и их мишеней на SGs. Важно, что хотя SGs могут выглядеть структурно стабильными, эти структуры разбираются в ответ на освобождение от стресса (Anderson and Kedersha, 2006). Более того, факторы, локализованные в SGs постоянно перемещаются взад и вперед между SGs и цитоплазмой (напр., 50% Argonautes в SGs замещается в течение 20 сек) (Leung et al., 2006). Т.о., сборка этих органелл может быстро прекращаться в ответ на изменение микроусловий. в
Удивительно, но локализация Argonaute в SGs нуждается в присутствии miRNAs (Leung et al., 2006), указывая тем самым, что Argonaute вступают в SGs благодаря ассоциации с miRNAs. Следовательно, возникающая в результате ко-локализация с др. компонентами, которые также рекрутируются на SGs во время стресса, может представлять собой новую возможность модулировать свойства мишеней miRNA. Напр., мРНК-связывающие белки, такие как TIA-1, TIAR, FXR1, HuR, TTP, p54/rck, Staufen, CPEB и ZBP1, также рекрутируются в SGs в условиях стресса (rev. Anderson and Kedersha, 2006). Эти компоненты SG, как известно, регулируют трансляцию и/или оборот мРНК в нормальных и стрессовых условиях. Так, некоторые из этих факторов, включая FXR1, HuR, p54/rck и TTP, как уже показано, ассоциируют с Argonaute (Bhattacharyya et al., 2006; Chu and Rana, 2006; Jing et al., 2005; Vasudevan and Steitz, 2007), хотя зависит ли это от образующих мостики последовательностей мРНК еще не проверено. Эти, возможно новые взаимодействия могут приводить к перестройке ассоциированных с Argonaute комплексами внутри SGs, и следовательно, к потенциальному изменению стабильности или транслируемости мишеней для miRNA.
SGs сегодня рассматриваются как места для сортировки мРНК и ремоделирования mRNP в ответ на воздействие на клетки стрессов. Это может приводить к хранению/молчанию определенных мРНК в SGs, тогда как остальные переходят в PBs для деградации (Anderson and Kedersha, 2006). Даже если поставка poly(A)
+ мРНК в SGs является неспецифической, то субнабор мРНК, которые соединяются со специфическими локализованными в SG белками, такими как ZBP1, оказывается преимущественно стабилизированным во время стресса (Stohr et al., 2006). Могут ли Argonaute/miRNA потенциально также затрагивать стабильность транскриптов при стрессовых воздействиях ещё предстоит определить; известно подавление стабильности субнабора их мишеней в клетках без стресса (Bagga et al., 2005; Lim et al., 2005). Активность miRNAs в отношении своих мРНК мишеней зависит от относительной концентрации miRNAs и мРНК (Doench and Sharp, 2004). Т.о., если происходят дифференциальные изменения в относительной концентрации мРНК мишеней в ответ на стресс, то существующий пул miRNAs может быть связан с разными наборами мишеней в течение короткого временного промежутка. Более важно, что ассоциация miRNAs со своими мишенями во время стресса не обязательно ведет к репрессии, но может также вызывать активацию (Bhattacharyya et al., 2006; Vasudevan and Steitz, 2007).
Adjacency
Bhattacharyya et al. (2006) и Vasudevan and Steitz (2007) продемонстрировали др. свойство модулирующей функции miRNA во время стресса: потребность в оккупации места РНК-связывающим белком рядом с сайтом связывания miRNA на предназначенной мРНК. Напр., ELAV РНК-связывающий белок, член семейства HuR (Bhattacharyya et al., 2006) и fragile X protein FXR1 (Vasudevan and Steitz, 2007) оба необходимы для Argonaute-обусловленной позитивной регуляции; нокдаун этих компонентов устраняет активацию. Однако, потребность в соседстве белок-связывающего сайта не ограничена miRNA-обусловленной активацией. Напр., у червей один из членов основателей miRNA, let-7, определенно нуждается в спейсере в 27 нуклеотидов между двумя консервативными miRNA-связывающими сайтами на 3' UTR её транскрипта мишени lin-41 для подавления активности этого гена (Vella et al., 2004). Спейсер не может быть замещен др. последовательностями той же самой длины, это указывает на то, что он может содержать др. сайт для РНК-связывающего белка. Генетические данные подтверждают, что член законсервированного семейства Puf - который соединяется со специфическими РНК регуляторными элементами в 3' UTR- является ответственным за репрессию let-7 мишеней, включая lin-41, во время развития червя (Nolde et al., 2007). Также Jing et al. (2005) сообщили, что miR-16 негативно регулирует TNFα, необходимый не только для того, чтобы связывать miRNA с Ago2/4, но и также для того, чтобы РНК-связывающий белок tristetra-prolin (TTP) соединялся с соседними AU-rich elements (AREs). Эти данные указывают на то, что члены семейства Argonaute часто взаимодействуют с др. РНК-связывающими белками, чтобы модулировать функции miRNAs.
Итак, как внешние стимулы изменяют обычно репрессивные miRNA на активаторные? Интересно, что многие ARE-связывающие белки, такие как TTP и HuR, локализуются преимущественно в ядре и оказываются перераспределенными в цитоплазму в ответ на внеклеточные стимулы. С др. стороны, большинство зрелых miRNAs и их стержень, связывающий белки Argonaute, обнаруживаются в цитоплазме. Следовательно, цитоплазма является общим основанием, где miRNA-обусловленные функции могут быть модулированы с помощью этихх РНК-связывающих белков. Мишени для miRNAs т.о., могут регулироваться за счет ограниченного количества этих снующих между ядром и цитоплазмой РНК-связывающих белков в цитоплазме в ответ на определенные клеточные состояния. Напр., транспорт HuR в цитоплазму репрессируется с помощью AMP-активированной киназы. Активность регулируется с помощью внутриклеточного соотношения AMP:ATP. Клеточные стрессы, которые снижают это соотношение, такие как УФЛ, обусловливают повышение транспорта HuR в цитоплазму, тогда как простая деплеция ATP, вызываемая с помощью гипогликемии и потери ростовых факторов, нет (Wang et al., 2002). Альтернативно, эти РНК-связывающие белки, которые уже локализованы в цитоплазме могут быть активированы с помощью пост-трансляционных модификаций сигнал-зависимым образом. Напр., TTP нуждается в фосфорилировании, по крайней мере, одного остатка серина на своем C конце, чтобы оказаться способным соединяться с каркасным белком 14-3-3, который облегчает его цитоплазматическую локализацию (Johnson et al., 2002; Stoecklin et al., 2004). Кроме того, miRNA, Argonaute и субнабор этих РНК-связывающих белков могут также локализоваться на специфических структурах, подобных SGs после определенных стрессов, тем самым возможно создавая специализированные места действия для определенных функций miRNAs. Заслуживает внимание то, что SGs содержат также белки, которые регулируют разнообразные клеточные сигнальные пути (такие как TRAF2; roquin; plakophilin 1 и 3; а также DISC-1, Disrupted-in-Schizo-phrenia-1) (rev. Anderson and Kedersha, 2006). Подобные комбинированные потребности как в miRNAs, так и РНК-связывающих белках могут указывать на механизм для изменения транскриптома и протеома на глобальной шкале даже со специфичностью - miRNA-связывающие сайты д. обеспечивать специфичность мишеней , а др. 3' UTR-связывающие сайты д.оценивать клеточное состояние. связанное с сигнальными путями. Напоминая детектор совпадений, miRNA мишени дю активироваться дифференциально только, когда оба компонента связаны с 3' UTR (Bhattacharyya et al., 2006; Vasudevan and Steitz, 2007).
microRNAs: Gatekeepers of Gene Expression
В случае недостаточности miRNAs, их мишени д. неправильно регулироваться и организм может быть способен справляться с изменяющимися условиями. Напр., отсутствие miR-14 у
Drosophila приводит к более значительной чувствительности мух к дисбалансу солей (Xu et al., 2003); между тем, кардиоспецифическая miR-208 необходима у мышей для ремоделирования их сердец во время кардиальных стрессов (van Rooij et al., 2007). Эти фенотипы могут быть объяснены отсутствием одного или более мастеров регуляторов для определенных стрессов, обусловленным отсутствием специфических miRNAs. Альтернативно, эти фенотипы могут быть куммулятивным эффектом едва различимых неправильных регулировок miRNA мишеней или скоординированных программ генной экспрессии (если мишени выполняют родственные функции). Некоторые проанализированные эндогенные miRNA мишени, как было показано, репрессируются при относительно умеренных уровнях (~1 - до 2-раз). Такие примеры включают транскрипционный коактиватор THRAP1, регулируемый с помощью miR-208 (van Rooij et al., 2007) и сигнального белка Ras, регулируемого с помощью let-7 (Chu and Rana, 2006; Johnson et al., 2005). Следовательно, регуляторный эффект miRNAs может не проявляться физиологически в нормальных условиях, но может играть незаменимую роль в обеспечении организму способности преодолевать стрессовые средовые изменения. Такая возможность продемонстрирована отсутствием видимого фенотипа у взрослых мышей, лишенных miR-208 до тех пор, пока они не повергались стрессу (van Rooij et al., 2007).
microRNAs обладают несколькими свойствами, которые делают их идеальными кандидатами на защитников организма во время стрессов. Во-первых, miRNAs стратегически регулируют финальные ступени трансляции генов в их продукты: т.е. они контролируют стабильность и трансляцию многочисленных мРНК мишеней, которые уже присутствовали до стресса. Т.о., когда стрессовые условия исчезают, то клетки д. быть программированы, чтобы начать многие корректирующие процессы немедленно, усиливая тем самым жизнеспособность. Во-вторых, miRNAs могут настраивать экспрессию генов, включая или выключая, в зависимости от ассоциации miRNP с др. РНК-связывающими белками. В третьих, одна miRNA может соединяться с множественными транскриптами, что обусловлено её относительно низкой потребностью комплементарности, тем самым оказывается возможным переключение между мишенями во время стресса.
Cancer, Stress, and miRNA Regulation
Восприятие опухолевыми клетками разнообразных стрессов, таких как гипоксия, ухудшение питания и конечно воздействие облучения и химиотерапевтических соединений во время лечения пациентов. Если miRNA регуляция является критической ступенью в стрессовой реакции, то знание её молекулярных аспектов может позволить идентифицировать мишени для лекарств, чтобы повысить эффективность лечения рака. Это не кажется натянутым, учитывая, что с помощью сходной логики были идентифицирован хитшоковый белок Hsp90 в качестве современной мишени для будущих противораковых лекарств (Vastag, 2006). По сравнению со своими нормальными аналогами. раковые клетки могут обладать уникальными изменениями путей, контролируемых с помощью miRNAs, которые могут быть использованы для специфического устранения опухолей.
Conclusion
The conservation of target sites in the 3' UTR of мРНК strongly indicates that miRNAs regulate expression of a sizeable fraction of all animal genes (e.g., > 25% in mammals). Many of these sites could be critical for controlling responses to stress but may not be essential under normal conditions. During stress, binding of miRNAs could activate gene expression in contrast to their ostensibly default silencing mode. Future studies should more clearly elucidate the importance of miRNAs in regulating gene expression and promoting survival during times of stress.
Сайт создан в системе
uCoz