В своем трактате On Growth and Form, опубликованном в 1917, D'Arcy Thompson высказал мнение, что к морфогенезу следует подходить как к проблеме механики, ветви физики, связанной с силами и движениями (11). Эта очень оригинальная концепция не стала основным направлением и позднее была замещена мнением генетического контроля морфогенеза (12). Однако недавние исследования возродили спор о том, что механические силы являются фундаментальными формовщиками клеток и эмбрионов. Было предположено, что используемые комбинаторным способом небольшое количество модулярных механических (т.e., генерирующих силы) свойств-а именно, межклеточной адгезии, адгезии между клетками и матриксом, выпячиваний и контрактильности-могут руководить морфогенезом. Интерпретируя функции специфических молекул и сигнальных путей внутри конструкции из элементарных сил, которые придают форму клеткам и тканям, можно представить себе возможность объединения механистической точки зрения на морфогенез с моделью молекулярной генетики, чтобы объяснить разнообразие клеточных форм, расположений и движений.
Идея, что онтогенетические клеточные движения являются разнообразными и могут отличаться от EMT иллюстрируется немногими примерами развития дрозофилы. Ранние эмбрионы плодовых мух состоят из одного слоя эпителиальных клеток, который в процессе гаструляции превращается во многие слои посредством многочисленных и сложных перемещений клеток (13-15). Одним из хорошо известных является элонгация зародышевого диска (Fig. IA), который удваивает длину участвующей клеточной группы (зародышевого диска) и уменьшает его ширину вдвое (16). На тканевом уровне эффект является драматическим, но на уровне каждой индивидуальной клетки, движения относительно умеренные: клетки меняются соседями направленным способом, никогда не теряя своих эпителиальных характеристик.
После гаструляции клетки, которые обычно формируют разветвленную трубчатую сеть системы трахей у дрозофилы начинают свои экстраординарные перемещения (Fig. 1B) [see also (17)]. Первоначально, -SO клетки на поверхности каждого полу-сегмента эмбриона инвагинируют (IS). Специфические субнаборы образуют выпячивания и активно мигрируют. Остальные не образуют видимых выпячиваний, а вместо этого интеркалируют тем самым удлиняя и сужая трубку. Во время этого процесса трахейные клетки сохраняют свою апикально/базальную поляризацию и слипчивость др. с др.,следовательно, они не подвергаются EMT (6). в
В овариях взрослых
Drosophila (Fig, 1C), происходят морфогенетические перемещения, которые отличны от описанных выше. Функциональной единицей яичников является яйцевая камера. Каждая яйцевая камера состоит из ~650 кубоидальных эпителиальных фолликулярных клеток, окружающих 16 клеток зародышевой линии. Клетки зародышевой линии включают 15 питающих клеток, которые являются поддерживающими клетками и одного ооцита, который развивается в яйцо. В ходе оогенеза происходят три самостоятельных изменения внутри фолликулярного клеточного эпителия (19). Большинство клеток приобретают цилиндрическую морфологию (Fig. 1C), удлиняют свои боковые клеточные поверхности, сокращая свои апикальный и базальный домены. Тем временем клетки в передней половине яйцевой камеры уплощаются, приобретая чешуевидную морфологию. Такой переход требует, чтобы латеральная мембрана съёживалась, а апикальная и базальная поверхности расширялись. Напротив, клетки на переднем полюсе яйцевой камеры (пограничные клетки ) собираются в кластер, выпускают выпячивания между питающими клетками, отсоединяются от остального эпителия и затем мигрируют как слипшийся кластер в ооцит (20).
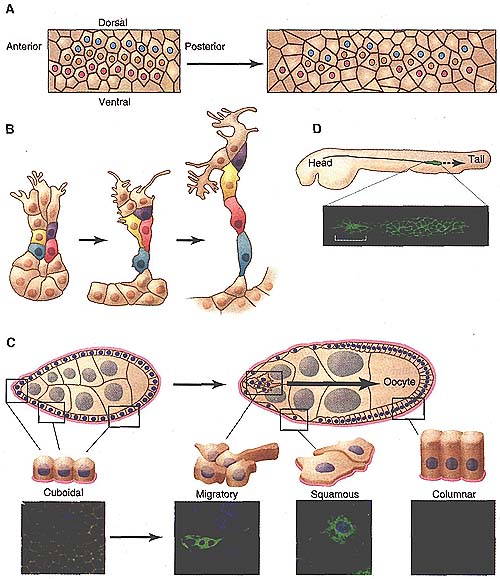 Fig. 1. Morphogenetic cell movements are diverse. (A) Schematic representation of germband elongation in the early Drosophila embryo. Three rows of cells are marked with colored dots to highlight their changes in position and shape. (Right) The same cells 30 min later. Individual cells intercalate, and the group lengthens and narrows. (B) Schematic drawing of one branch of the developing Drosophila tracheal tree at three time points. Cells at the tip exhibit obvious, elaborate protrusions whereas others do not. (0 Schematic representation of Drosophila follicle cell rearrangements during egg chamber development. Follicle cell nuclei, dark blue; nurse cell nuclei, gray; basement membrane, pink. At stage 7 of development (left), follicle cells are uniformly cuboidal in morphology. At stage 9 (right), follicle cells in different regions (boxed) undergo different morphological transformations. (D) Migration of the zebrafish lateral line primordium. (Top) Schematic of a fish embryo showing the overall migration path. (Bottom) Micrograph of migrating cells and one rosette (white bracket) being left behind.
Fig. 1. Morphogenetic cell movements are diverse. (A) Schematic representation of germband elongation in the early Drosophila embryo. Three rows of cells are marked with colored dots to highlight their changes in position and shape. (Right) The same cells 30 min later. Individual cells intercalate, and the group lengthens and narrows. (B) Schematic drawing of one branch of the developing Drosophila tracheal tree at three time points. Cells at the tip exhibit obvious, elaborate protrusions whereas others do not. (0 Schematic representation of Drosophila follicle cell rearrangements during egg chamber development. Follicle cell nuclei, dark blue; nurse cell nuclei, gray; basement membrane, pink. At stage 7 of development (left), follicle cells are uniformly cuboidal in morphology. At stage 9 (right), follicle cells in different regions (boxed) undergo different morphological transformations. (D) Migration of the zebrafish lateral line primordium. (Top) Schematic of a fish embryo showing the overall migration path. (Bottom) Micrograph of migrating cells and one rosette (white bracket) being left behind.
Морфогенетические перемещения, описанные выше не напоминают один др. или EMT. Др. фолликулярные клетки, напр., редуцируют межклеточную адгезию и расширяют область своих контактов с базальной мембраной, изменения обычно ассоциирующие в EMT. Всё же эти клетки не покидают эпителия, мигрируют на длительные расстояния или обмениваются соседями. Пограничные клетки, с др. стороны, экспрессируют более высокий уровень E-cadherin, чем squamous передние фолликулярные клетки (21) сохраняют апикально-базальную полярность (22), свойство, обычно связанное со стационарными эпителиальными клетками. Всё же они проникают в соседнюю группу питающих клеток, покидая эпителий фолликулярных клеток и мигрируя.
Эмбрионы позвоночных также обладают коллективными клеточными перемещениями, которые не напоминают классический EMT. Одним из драматических примеров является миграция боковой линии рыбок данио. Боковая линия это группа клеток из ~ 100 клеток, которые мигрируют вдоль длины эмбрионов рыбок данио (Fig. 1D). Небольшая группа лидирующих клеток задает направление последователям, несмотря на то, что большинство клеток активно подвижны (23).
Периодически в тылу массы группа клеток срастается, останавливает движение и покидает границы, чтобы сформировать сенсорный орган. Подвижные клетки боковой линии обладают некоторыми характеристиками эпителиальных клеток, включая апикально/базальную полярность и некоторые характеристики мезенхимных клеток, такие как филоподиальные выпячивания (7).
Некоторые клетки, такие как клетки нервного гребня и предшественников мышц конечностей (24), подвергаются полному EMT, но как проиллюстрировано на примере, представленном выше, EMT не предоставляет адекватную концептуальную основу для понимания коллективных клеточных перемещений. Как же действуют группы клеток, некоторые со свойствами как эпителиальных, так и мезенхимных клеток, организуя самих себя разнообразным и сложным способом? Ответ может заключаться в сложившихся вариациях механических свойств клеток.
Core Mechanical Properties Control Cell Geometry, Sorting, and Motility
Чтобы понять коллективные клеточные перемещения, необходимо рассмотреть форму, расположение и подвижность клеток. Два свойства клеток, которые постоянно встречаются как критические детерминанты клеточной формы, геометрии упаковки и сортировки являются межклеточной адгезией и клеточной сократимостью (25-30). Уже давно было оценено, что количественные и качественные различия в межклеточной адгезии способствуют сортировке в самостоятельные типы клеток in vitro (31). Напр., когда клетки, экспрессирующие два разных типа молекул межклеточной адгезии (такие как E-cadherin и N-cadherin) перемешиваются, то они рассортировываются одна от другой. Однако теперь становится ясным, что поверхностное натяжение, свойство, которое зависит от оппозитных сил как межклеточной адгезии, так и сократимости кортикального цитоскелета, скорее всего является фундаментальным детерминантом клеточной формы, упаковки и сортировки (26, 30, 32).
В униформном, неделящемся эпителии клетки обнаруживают тенденцию формировать гексогональные массивы, которые можно смоделировать математически, исходя из сил межклеточной адгезии и кортикальной сократимости, действующих противоположным образом (28). В то время как контрактильность (стягивающая сила, осуществляемая миозином на кортикальном F-актиновом цитоскелете) действует, чтобы минимизировать контактирующую клеточную поверхность с соседями, эффект межклеточной адгезии заключается в её увеличении. Упорядоченный гексогональный массив клеток представляет собой базовое состояние и энергетический минимум, при которых силы сбалансированы (28, 29). На молекулярном уровне cadherins вносят существенный вклад в общую межклеточную адгезию во многих эмбриональных типах клеток, а кортикальный F-актин и ассоциированный с ним миозин являются основными детерминантами контрактильности. Недавние измерения атомных сил у эмбрионов рыбок данио предоставили прямые доказательства этому (30).
Внесение асимметрии или в адгезию или контрактильность д. нарушать упорядоченный в гексагональные массивы эпителий. Это безусловно механизм, который управляет направленной интеркаляцией клеток во время элонгации зародышевого диска дрозофилы. Клетки у ранних эмбрионов дрозофилы первоначально формируют регулярные ряды (Fig. 2A) с симметричной локализацией миозина {33, 34), F-актина и E-cadherin (8). Однако во время элонгации зародышевого диска миозин оказывается сконцентрированным специфически на передней и задней поверхности и исчезает с дорсальной и вентральной клеточной поверхности (Fig. 2B). Такое асимметричное накопление миозина обеспечивает направленные контрактильные силы, которые предпочтительно сжимают определенные стороны каждой клетки (33) (Fig. 2C) и увеличивают беспорядок эпителия (8). В результате вместо чрезвычайно униформного гексогонального массива клеток, клетки удлиняющегося зародышевого диска обнаруживают разные полигональные формы, некоторые из которых формируют кластеры из 4-7 клеток, каждая из которых встречается с др. в общей точке (vertex). Эти временные структуры последовательно разрешаются направленным способом так, что это способствует общему удлинению и сужению клеточного слоя. Эти клеточные перестройки невозможны в отсутствие активности миозина или при униформном его распределении {33). Т.о., усиление контрактильности в одном регионе клетки по сравнению с др. приводит к направленной перестройке клеток в плоскости эпителия.
Конкурирующие силы межклеточной адгезии и кортикальной контрактильности также определяют определенную форму конусных и пигментных клеток в глазах Drosophila. Глаза состоят из повторяющихся единиц, определяемых количеством клеток. Внутри каждой единицы при определенной плоскости поперечного среза две первичные пигментные клетки окружают 4 центральных конусных клеток и в свою очередь заключаются в рамку с помощью вторичных и третичных пигментных клеток в виде высоко воспроизводимого паттерна. Начиная со случайных форм, компьютерное моделирование, которое позволяет клеткам реорганизоваться так, чтобы достичь энергетического минимума, воспроизводит в точности клеточные формы, найденные к глазах дикого типа {27). Моделирование, базирующееся на математической модели, которая учитывает баланс сил, создаваемый дифференциальной межклеточной адгезией и контрактильностью клеточного кортекса. Такая модель воспроизводит как прекрасный регулярный паттерн дикого типа (Fig. 3) , так и измененные формы при некоторых мутантных условиях {26). Напротив, модели, которые объясняются только межклеточной адгезией, без привлечения натяжения мембран, обусловливаемого контрактильностью подлежащего кортикального цитоскелета, не воспроизводят соотв. паттернов. В будущем мы можем надеяться, что математическое моделирование и компьютерное моделирование станут достаточно мощными, чтобы объяснить относительные расположения клеток в кластере (в дополнение к формам клеток), начиная со случайных значений.
У ранних эмбрионов рыбок данио силы межклеточной адгезии и кортикальной контрактильности были измерены непосредственно для трех различных типов клеток,
 Fig. 2. Localized myosin drives cell shape changes and germband elongation. (A) At stage 6, before germband elongation, the epithelium is uniform, as are myosin (red) and bazooka (green). (B) During germband elongation, myosin II (red) accumulates specifically in anterior and posterior (vertical) membranes and is depleted from dorsal and ventral (horizontal) membranes. Bazooka localizes in a complementary pattern. (C) Membranes rich in myosin (red) shrink.
Fig. 2. Localized myosin drives cell shape changes and germband elongation. (A) At stage 6, before germband elongation, the epithelium is uniform, as are myosin (red) and bazooka (green). (B) During germband elongation, myosin II (red) accumulates specifically in anterior and posterior (vertical) membranes and is depleted from dorsal and ventral (horizontal) membranes. Bazooka localizes in a complementary pattern. (C) Membranes rich in myosin (red) shrink.
используя atomic force микроскопию (30, 35). Более того, эти измеренные значения были использованы в математических моделях, чтобы предсказать поведение клеточной сортировки. Как
in vitro, так и
in vivo тестах модель подтвердила, что собственно закладка слоев из эктодермальных, мезодермальных и энтодермальных клеток предшественников может быть предсказана на базе их известных адгезивных и контрактильных свойств, также как и внеэмбриональных клеток, которые обычно присутствуют в эмбрионе и включаются в моделирование (30).
В то время как изменчивость в межклеточной адгезии и кортикальной контрактильности достаточна, чтобы предопределить геометрию и рассортировку по типам клеток в глазах
Drosophila и эмбрионов рыбок данио, активная клеточная подвижность нуждается в дополнительном свойстве, таком как выпячивания. Способность выпускать и убирать выпячивания является очевидным признаком мигрирующих пограничных клеток, трахеальных кончиковых клеток и мигрирующей боковой линии, даже если все эти клетки сохраняют свой эпителиальный характер. Напротив клетки в зародышевом диске дрозофилы не выпускают выпячиваний, также как и клетки развивающихся глаз. Трахейные клетки, которые не находятся на кончике, не выпускают явных выпячиваний, не делают этого и клетки розеток. которые прекращают миграцию в боковой линии рыбок данио. Пограничные клетки, трахейные кончиковые и клетки мигрирующей боковой линии
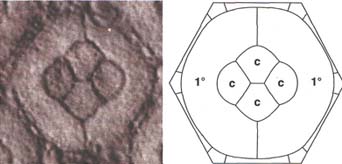 Fig. 3. Computer simulation reproduces cell shapes in the fly eye. (Left) Micrograph of a single unit in the Drosophila eye. (Right) Result of a computer simulation that starts with random cell shapes. Cells are allowed to change shape according to competing forces of cell-cell adhesion and cortical contractility. Four cone cells (c) are surrounded by two primary pigment cells (1°) that are, in turn, framed by secondary and tertiary pigment cells.
Fig. 3. Computer simulation reproduces cell shapes in the fly eye. (Left) Micrograph of a single unit in the Drosophila eye. (Right) Result of a computer simulation that starts with random cell shapes. Cells are allowed to change shape according to competing forces of cell-cell adhesion and cortical contractility. Four cone cells (c) are surrounded by two primary pigment cells (1°) that are, in turn, framed by secondary and tertiary pigment cells.
мигрируют активно и направлено в соседние ткани, тогда как типы клеток, лишенные выпячиваний, не делают этого. Следовательно, хотя клетки и кажутся способными подвергаться локальным перестройкам в плоскости эпителия в отсутствии выпячиваний, направленная миграция сильно скоррелирована с этим свойством. Вариации во взаимодействиях между матриксом и клетками также очевидны при разных коллективных перемещениях клеток. В яйцевой камере, напр., имеется базальная мембрана, продуцируемая фолликулярными клетками, которая окружает всю структуру (Fig. 1C). Пограничные клетки отсоединяются от неё и прекращают продукцию матричных белков, таких как коллаген IV и laminin {36). Напротив, squamous клетки увеличивают область своего контакта с базальной мембраной и они распластываются, а цилиндрические фолликулярные клетки уменьшают область своего контакта с базальной мембраной, но остаются прикрепленными.
Diversity from Combinatorial Use of Protrusion, Contractility, Cell-Cell Adhesion, and Cell-Matrix Adhesion Modules
На молекулярном уровне межклеточная адгезия, адгезия между клетками и матриксом, кортикальная контрактильность и клеточные выпячивания являются модулярными свойствами, контролируемыми крупными отличающимися наборами молекул. Выпячивания управляются полимеризацией актина (37). Межклеточная адгезия контролируется cadherins (38) и различными др. молекулами. Слипчивость между клетками и матриксом регулируется прежде всего за счет взаимодействий integrins и их лигандов (39), хотя др. матричные компоненты и рецепторы определенно вносят вклад. Myosin и его регуляторы (такие как Rho kinase) контролируют контрактильность. Имеются доказательства взаимодействия между этими модулями (40, 41) посредством актинового цитоскелета, который, по-видимому, важен для координации этих механических свойств; однако ясно, что каждая характеристика может варьировать независимо в разных типах клеток (30).
Имеются многочисленные примеры в биологии, когда небольшие количества модулярных компонентов используются комбинаторно для генерации усложнений. Этим способом 4 нуклеотида (в комбинациях по три), генерирует 64 кодона и 20 аминокислот, комбинирующихся вместе в различных количествах для создания сотен тысяч (а потенциально возможных ещё более) белков. Сходным образом, клетки могут использовать относительно небольшие количества модулярных механических свойств в разных комбинациях чтобы создавать разные морфологии, устройства и движения. Короче вариации из 4-х свойств количественно и качественно и пространственно могут давать сотни комбинаций, создавая достаточную сложность, чтобы объяснить
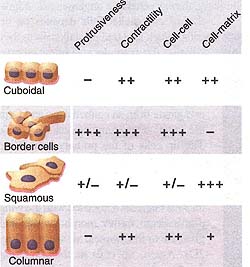 Fig. 4. Distinct combinations of mechanical properties characterize follicle cells with different shapes and behaviors. The relative strengths of the indicated properties are deduced from experimental observation of the cells' interactions with each other, the distribution of cadherins, and genetic evidence. They have not been measured directly. Cell-cell and cell-matrix refer to adhesiveness.
Fig. 4. Distinct combinations of mechanical properties characterize follicle cells with different shapes and behaviors. The relative strengths of the indicated properties are deduced from experimental observation of the cells' interactions with each other, the distribution of cadherins, and genetic evidence. They have not been measured directly. Cell-cell and cell-matrix refer to adhesiveness.
разнообразие наблюдаемых клеточных геометрий, топологий и движений.
Разные типы фолликулярных клеток в яичниках дрозофилы иллюстрируют концепцию комбинаторного использования механических свойств для создания различных коллективных поведений клеток (Fig. 4). Все эти клетки стартуют как униформные, кубоидальные, гексагональные множества. Пограничные клетки увеличивают свою экспрессию E-cadherin , так что начинают слипаться более сильно др. с др. (21). Они выпускают длинные выпячивания и нуждаются в активности миозина, чтобы убирать их (42, 43) и они подавляют экспрессию матричных белков (36). Напротив, squamous клетки подавляют экспрессию множественных молекул межклеточной адгезии, включая E-cadherin, так чтобы меньше слипаться одна с др., что является обязательным условием для изменения их формы (19). Эти клетки одновременно расширяют свои контакты с базальной мембраной, подтверждая усиление слипчивости между клетками и матриксом. Их уплощенная форма указывает на уменьшение кортикального натяжения, но это ещё предстоит протестировать. Цилиндрические фолликулярные клетки обладают иной комбинацией свойств: экспрессия E-cadherin значительнее, чем в squamous клетках и меньше, чем в пограничных клетках (19), контакты между клетками и матриксом меньше, чем в squamous клетках, но больше, чем в пограничных клетках и отсутствуют доказательства образования выпячиваний. Наблюдаемые различия в экспрессии cadherin, формы клеток и подвижности согласуются с идеей, что каждый тип клеток обладает характерной комбинацией адгезивных, контрактильных и протрузивных механических свойств (Fig. 3). В принципе, это предсказание может быть протестировано непосредственно, используя измерения атомных сил, как это было проделано с клетками ранних эмбрионов рыбок данио
(30).
Conclusion
The great diversity of collective cell movements observed throughout development and organogenesis may result from combinatorial use of a small number of modular mechanical properties. EMTs represent a morphogenetic program that converts cells from one particular cell type (stationary columnar epithelial cells) into another cell type (individual mesenchymal cells). This particular transition involves a loss of cell-cell adhesion, up-regulation of cell-matrix adhesion, and increased protrusiveness and contractility. However, many other combinations of properties are possible, allowing cells to achieve a great diversity of individual cell shapes, as well as collective arrangements and movements. Cells with some properties of epithelial cells and some properties of mesenchymal cells may simply possess unique combinations of mechanical properties distinct from epithelial cells, mesenchymal cells, and other tissues. вж
Many interesting questions remain to be reviewed and investigated further. Key questions include how the myriad molecules and signaling pathways that regulate collective cell migration affect the core mechanical properties described here. It is probably generally the case that signaling pathways governing cell polarity (apical/ basal, leading/lagging, and planar polarity) function to localize mechanical forces asymmetrically within cells. By definition, an asymmetry in force will cause dynamics. The mechanisms by which cell forces are coordinated in space and time represent another fascinating topic. By considering the effects of specific molecules and signaling pathways on the magnitude and direction of mechanical forces within and between cells, it may be possible to explain how individual cell shapes are achieved as well as how groups of cells sort and move, which, taken together, should go a long way toward explaining organ and tissue morphogenesis. Were he alive today, D'Arcy Thompson would probably be thrilled at the prospect of unifying molecular and cell biology with mechanics.
1 Kari Barlan, Maureen Cetera, Sally Horne-Badovinac. Fat2 and Lar Define a Basally Localized Planar Signaling System Controlling Collective Cell Migration.
Developmental Cell, 2017; 40 (5): 467
Когда индивидуальные клетки нуждаются в перемещении, они выпускают выпячивания из своего ведущего края и подтягивают задний край безо всякого представление о том, что делают окружающие клетки. Но если клетки объединяются вместе в слой ткани или эпителий, то они координируют свои перемещения со своими соседями. Проталкиваясь через толпу, вы общаетесь с др., говоря ("Pardon me") или трогая их плечо. Клетки делают то же самое, но вместо словестных сигналов и жестов они используют белки, чтобы передавать сигналы др. др.
Такого типа скоординированная миграция важна во время эмбрионального развития, когда клетки мигрируют, чтобы сформировать органы, во время заживления ран и , к сожалению, во время распространения многих раковых опухолей. Ученые уже знают о некоторых белках, участвующих в этом процессе, но исследователи из University of Chicago идентифицировали новую сигнальную систему, с помощью которой эпителиальные клетки координируют свои индивидуальные перемещения и эффективно перемещают ткани.
Sally Horne-Badovinac с колл. описали, как два белка клеточных мембран работают совместно, чтобы координировать миграцию эпителия у Drosophila. Один, наз. Fat2, располагается на задней кромке клетки; др., наз. Lar, располагается на ведущем крае клетки, когда клетка мигрирует, Fat2 передает сигналы к Lar в заднюю часть клетки, это приводит к тому, что клетка простирает свой ведущий край, подворачивая (tucking) его под клетку по фронту. В ответ Lar передает сигнал обратно к Fat2, чтобы она подтягивала свой задний край. Постепенно соседние клетки, работающие совместно подобным скоординированным образом, перемещают ткань целиком.
Horne-Badovinac и его группа использовали в качестве модели дрозофилу для выяснения сигнальных процессов. Когда развиваются эмбрионы самок, то камеры формирующие яйцевые камеры удлиняются и ротируют. Ученые установили, что Fat2 и Lar участвуют в этом процессе, но было неясно, мигрируют ли клетки благодаря ротации по окружности внутри кольцевой камеры, а не движутся по прямой линии от одной точки к другой.
 The Drosophila egg chamber rotates as it develops into an egg. This rotation occurs because the epithelial cells that form the egg chamber's outer layer outer collectively migrate along the extracellular matrix (green) that surrounds each organ-like structure.
The Drosophila egg chamber rotates as it develops into an egg. This rotation occurs because the epithelial cells that form the egg chamber's outer layer outer collectively migrate along the extracellular matrix (green) that surrounds each organ-like structure.
Используя новую технику культивирования клеток исследователи смогли выращивать яйцевые камеры отдельно внутри тел самок мух. Они установили, что когда Fat2 отсутствует на участве клетки с нормальной клеточной задней частью, то нормальные клетки оказываются неспособны осуществлять свои обычные выпячивания переднего края. Если отсутствует Lar на участке клетки позади обычного участка, то нормальные клетки не могли подтягивать свой задний край, чтобы двигаться. t
"Это кажется неожиданным, поскольку мы знаем, что белок [Fat2] оказывается на заднем конце клетки, но мы увидели эффект на ведущий край клетки. То, что казалось абсолютно бессмысленным.
Хорне-Бадовинац сказала, что у нее все еще есть много вопросов о том, как эти белки взаимодействуют друг с другом, и полагает, что могут быть другие вовлеченные белки, которые передают сигналы цитоскелетному механизму, который фактически обеспечивает клеточное перемещение.
" Это лишь верхушка айсберга работающей сигнальной системы," говорит она. "Изучая этот процесс на простейшей системе Drosophila, мы сможем получить информацию о происходящем, чтобы лучше понять заживление ран или распространение раковых клеток."
 Fig. 1. Morphogenetic cell movements are diverse. (A) Schematic representation of germband elongation in the early Drosophila embryo. Three rows of cells are marked with colored dots to highlight their changes in position and shape. (Right) The same cells 30 min later. Individual cells intercalate, and the group lengthens and narrows. (B) Schematic drawing of one branch of the developing Drosophila tracheal tree at three time points. Cells at the tip exhibit obvious, elaborate protrusions whereas others do not. (0 Schematic representation of Drosophila follicle cell rearrangements during egg chamber development. Follicle cell nuclei, dark blue; nurse cell nuclei, gray; basement membrane, pink. At stage 7 of development (left), follicle cells are uniformly cuboidal in morphology. At stage 9 (right), follicle cells in different regions (boxed) undergo different morphological transformations. (D) Migration of the zebrafish lateral line primordium. (Top) Schematic of a fish embryo showing the overall migration path. (Bottom) Micrograph of migrating cells and one rosette (white bracket) being left behind.
Fig. 1. Morphogenetic cell movements are diverse. (A) Schematic representation of germband elongation in the early Drosophila embryo. Three rows of cells are marked with colored dots to highlight their changes in position and shape. (Right) The same cells 30 min later. Individual cells intercalate, and the group lengthens and narrows. (B) Schematic drawing of one branch of the developing Drosophila tracheal tree at three time points. Cells at the tip exhibit obvious, elaborate protrusions whereas others do not. (0 Schematic representation of Drosophila follicle cell rearrangements during egg chamber development. Follicle cell nuclei, dark blue; nurse cell nuclei, gray; basement membrane, pink. At stage 7 of development (left), follicle cells are uniformly cuboidal in morphology. At stage 9 (right), follicle cells in different regions (boxed) undergo different morphological transformations. (D) Migration of the zebrafish lateral line primordium. (Top) Schematic of a fish embryo showing the overall migration path. (Bottom) Micrograph of migrating cells and one rosette (white bracket) being left behind.  Fig. 2. Localized myosin drives cell shape changes and germband elongation. (A) At stage 6, before germband elongation, the epithelium is uniform, as are myosin (red) and bazooka (green). (B) During germband elongation, myosin II (red) accumulates specifically in anterior and posterior (vertical) membranes and is depleted from dorsal and ventral (horizontal) membranes. Bazooka localizes in a complementary pattern. (C) Membranes rich in myosin (red) shrink.
Fig. 2. Localized myosin drives cell shape changes and germband elongation. (A) At stage 6, before germband elongation, the epithelium is uniform, as are myosin (red) and bazooka (green). (B) During germband elongation, myosin II (red) accumulates specifically in anterior and posterior (vertical) membranes and is depleted from dorsal and ventral (horizontal) membranes. Bazooka localizes in a complementary pattern. (C) Membranes rich in myosin (red) shrink.  Fig. 3. Computer simulation reproduces cell shapes in the fly eye. (Left) Micrograph of a single unit in the Drosophila eye. (Right) Result of a computer simulation that starts with random cell shapes. Cells are allowed to change shape according to competing forces of cell-cell adhesion and cortical contractility. Four cone cells (c) are surrounded by two primary pigment cells (1°) that are, in turn, framed by secondary and tertiary pigment cells.
Fig. 3. Computer simulation reproduces cell shapes in the fly eye. (Left) Micrograph of a single unit in the Drosophila eye. (Right) Result of a computer simulation that starts with random cell shapes. Cells are allowed to change shape according to competing forces of cell-cell adhesion and cortical contractility. Four cone cells (c) are surrounded by two primary pigment cells (1°) that are, in turn, framed by secondary and tertiary pigment cells.  Fig. 4. Distinct combinations of mechanical properties characterize follicle cells with different shapes and behaviors. The relative strengths of the indicated properties are deduced from experimental observation of the cells' interactions with each other, the distribution of cadherins, and genetic evidence. They have not been measured directly. Cell-cell and cell-matrix refer to adhesiveness.
Fig. 4. Distinct combinations of mechanical properties characterize follicle cells with different shapes and behaviors. The relative strengths of the indicated properties are deduced from experimental observation of the cells' interactions with each other, the distribution of cadherins, and genetic evidence. They have not been measured directly. Cell-cell and cell-matrix refer to adhesiveness. 