Итак, кажется вполне возможным, что проекции во многие сенсорные органы могут быть облегчены пионерскими аксонами, которые могут повторять путь нейрональной миграции в обратном направлении назад на периферию. Однако, эта стратегия вряд ли благоприятствует тем аксонам, идущим в направлении наиболее обширных сенсорных органов, в частность заднего гребня. В данном случае локальное высвобождение хемоаттрактантов из сенсорных примордиев может служить как дально-действующий бакен для наведения аксона. есть ли доказательства, что такие аттрактивные сигналы испускаются зачатком заднего гребешка или откуда-нибудь ещё?
In vitro assays Первые доказательства аттрактантов во внутреннем ухе получены у классических
in vitro исследованиях, которые выявили, что отоцист испускает как топические (способствующие направленному росту) так и трофические (способствующие выживанию) факторы. Топический эффект сенсорного эпителия на нейриты SAG подтвержден с помощью непосредственного роста эмбриональных нейритов SAG эмбрионов кур в направлении отического эпителия в трехмерных культурах (Hemond and Morest, 1992). Совместное культивирование молодых SAG с молодым отическим эпителием, эксплантированном в то время когда возникают выросты
in situ (Hamburger-Hamilton stages 16-21; HH16-21) выявляет направленный рост в большинстве (79%) эксплантов. Кроме того, гетерохронические ко-культуры были получены с SAG (HH16-30) и отическим эпителием (HH16-35), чтобы определить. зависят ли выросты от стадии развития. Экспланты более молодых SAGs с более старым отическим эпителием обнаруживали направленный рост в 76% ко-культур. Сходные результаты были описаны для более старых SAG, культивируемых с более молодым отическим эпителием.
Т.о., независимо от стадии развития, отический эпителий осуществляет свой топический эффект на нейриты SAG. контрольные ко-культуры, содержащие SAG и не-отический эпителий, обнаруживали очень слабый направленный рост в половине случаев. Неожиданно, ко-культуры выявили, что нейроны отвечают непосредственно на эндолимфатический канал, который является несенсорной, не-иннервированной отической эпителиальной структурой. Это указывает на то, что как сенсорные,так и не-сенсорные территории отоциста могут оказывать топический эффект на нейроны SAG.
Трудно отделить тропический от трофического эффекты в подходах, которые не измеряют направленный рост, а вместо этого сравнивают количества аксонов, растущих радиально от культивируемого ганглия в присутсвии или отсутствии ткани или очищенных молекул кандидатов. Подходы ненаправленного роста аксонов сбивают с толку ещё тем фактом, что некоторые факторы, такие как neurotrophins, могут обнаруживать как топическую, так и трофическую активность. В подходах ненаправленного роста аксонов, система клеточной нумерации существенна для отличия между фактором, который способствует выростам и фактором, который, по-видимому, в основном делает это, т.к. большинство нейронов выживают благодаря трофическому эффекту. Не все из опубликованных работ, касающиеся топических факторов для SAG, учитывали количественно жизнеспособность нейронов. Когда жизнеспособность клеток тщательно учитывалась, то данные показывали, что отоцист и myelencephalon осуществляли свои трофические эффекты на SAG (Ard et al., 1985). Присутствие центральной ткани мишени не оказывало заметного аддитивного эффекта на жизнеспособность нейронов,
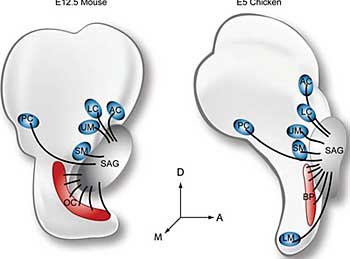 Fig. 1. Axon outgrowth has been studied in both mouse and chicken inner ears, shown schematically at a stage shortly after afferent axons reach their targets. In both species, axons arrive at their targets
when the sensory primordia are still in a primitive stage lacking mature
hair cells. Although the arrival of axons at the different sensory primordia
is not simultaneous, by E12.5 in mouse and E5 in chicken, at least some
axons have navigated to each organ. Abbreviations: A, anterior; AC,
anterior crista; BP, basilar papilla; D, dorsal; LC, lateral crista; LM, lagena
macula; M, medial; OC, organ of Corti; PC, posterior crista; SM, saccular
macula; UM, utricular macula.
Fig. 1. Axon outgrowth has been studied in both mouse and chicken inner ears, shown schematically at a stage shortly after afferent axons reach their targets. In both species, axons arrive at their targets
when the sensory primordia are still in a primitive stage lacking mature
hair cells. Although the arrival of axons at the different sensory primordia
is not simultaneous, by E12.5 in mouse and E5 in chicken, at least some
axons have navigated to each organ. Abbreviations: A, anterior; AC,
anterior crista; BP, basilar papilla; D, dorsal; LC, lateral crista; LM, lagena
macula; M, medial; OC, organ of Corti; PC, posterior crista; SM, saccular
macula; UM, utricular macula.
когда ко-культивировались с периферической мишенью, отоцистом. Онтогенетический ход времени происходящего из отоциста трофического (survival) фактора был исследован у эмбрионов кур и было установлено его отличие от хода времени для топической активности. Как отоцист на ст. E4, так и E4 otocyst-кондиционированная среда оказывали влияние на жизнеспособность SAGs в возрастных рамках E4-6 до E10-13. Однако, то же самое оказалось неверным для E9 отоцистов, т.к. трофическая активность, по-видимому, затухает (Bianchi and Cohan, 1991). Т.о., SAG нейроны сохраняют свою чувствительность к диффундирующим факторам жизнеспособности, высвобождаемыми отоцистом, даже после того, как нейриты достигают своих мишеней и отоцист онтогенетически подавляет такие факторы. Сходные результаты подтверждают, что ткань мишень оказывает трофический эффект на нейроны SAG у мышей (Van De Water, 1988), хотя в большинстве
in vitro исследований количественная оценка жизнеспособности нейронов была или косвенной (такой как процент эксплантов с дифференцированными нейронами) или вообще не учитывалась.
Отметим, что количество выживающих в культуре нейронов в культурах, где ткань мишень (или отоцист или myelencephalon) и
SAG эксплантировались одном куске, было более высоким, чем количество нейронов в культурах отдельно ткани мишени и SAG перед эксплантациями (Ard et al., 1985). Очевидно, что сигналы локального наведения, такие как те, что присутствуют вдоль путей проекций аксонов, могут влиять на способность нейритов достигать своих мишеней. чтобы получить трофическую поддержку. Когда физический путь между нейроном и его мишенью разорван. то аксоны д.стать более зависимы от растворимых факторов для нахождения пути и/ или выживания.
Hair cells vs. sensory primordia as the source of
chemoattractants
Одним из механизмов выяснения, высвобождают ли сенсорные органы аттрактанты для SAG нейронов, является выяснение, могут ли эктопические сенсорные участки становиться иннервированными. В таких ситуациях, если аксоны откланяются от своих обычных траекторий, чтобы иннервировать эктопические волосковые клетки или сенсорные участки, то можно предположить, что они делают это под влиянием хемоаттрактантов, действующих на расстоянии. Два недавних эксперимента подтвердили, что эктопические сенсорные участки обладают таким свойством во время развития. У грызунов, усиление неправильной экспрессии Atoh1, basic helix-loop-helix транскрипционного фактора, вызывает появление добавочных волосковых клеток на нейральной стороне нормального органа Корти (Zheng and Gao, 2000). Такие эксперименты были осуществлены на культивируемых сенсорных органах новорожденных крыс, с Atoh1 высвобождаемым посредством вирусного вектора. По причине иллюстративности, однако, исход показан схематически на интактном ухе Fig. 2A. Сегодня нет данных, показывающих, что слуховые аксоны обычно представлены в этом регионе при поиске мишеней. Т.о., иннервация сама по себе также эктопическая и может быть объяснена высвобождением хемотропного фактора из неправильно расположенных волосковых клеток. У кур эктопические вестибулярные сенсорные участки могут быть получены внутри канала улитки путем усиления эктопической экспрессии Wnt β-catenin сигналов (Stevens et al., 2003).
По крайней мере, небольшое количество таких эктопических волосковых клеток появляются, чтобы воспринимать
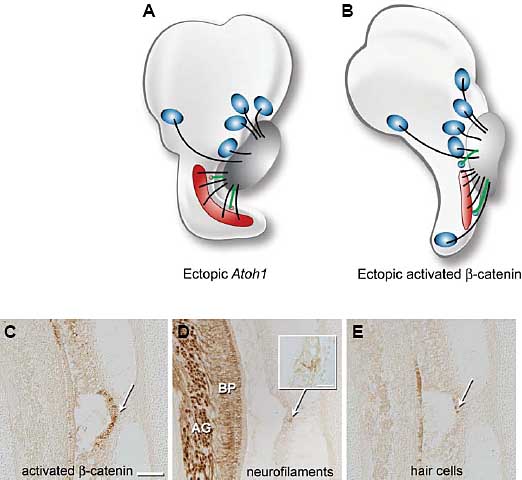 Fig. 2. Gain-of-function studies show that inner ear sensory organs can attract statoacoustic (SAG) neurites. (A) In rat, viral gene delivery of Atoh1 to neonatal organ of Corti isolated in culture generates ectopic hair cells. The extra hair cells were located adjacent to the neural side of the organ of Corti in a region called the greater epithelial ridge. Some of these hair cells become innervated, as shown in green (Zheng and Gao, 2000). Although the experiment was conducted in culture, the result is
schematically shown as it might appear in an intact ear to ease comparison with results from the chicken. (B) In the chicken cochlea, ectopic sensory patches containing hair cells can be induced by using retroviral vectors to force the misexpression of an activated form of β-catenin, a downstream signaling component of the canonical Wnt pathway (Stevens et al., 2003). Ectopic vestibular sensory patches can appear along the lateral wall of the cochlear duct. Neurofilament-positive axons can be followed into the misplaced sensory patches (shown in green). (C-E) Histological semi-serial sections showing innervation of ectopic hair cells in the E11 chicken cochlea. (C) A patch of -catenin-virus-infected cells (white arrow) on the nonsensory wall of the cochlear duct is identified using an antibody directed against a hemagglutinin tag on the activated
-catenin protein. Experimental details can be found in Stevens et al., 2003. (D) Nerve branches terminate within the infected patch (arrow and inset); the axon of origin could be traced from the ganglion around the anterior wall of the duct and into the patch. (E) Ectopic hair cells differentiate within the infected patch (arrow). The same section shows a normal array of hair cells along the medial wall of the duct; their proximity to the extreme anterior edge of the organ explains why the row appears to be discontinuous. Scale bar for (C-E) is 100 microns; scale bar for the high-power inset of (E) is 20 microns. Abbreviations: BP, basilar papilla; AG, acoustic ganglion.
Fig. 2. Gain-of-function studies show that inner ear sensory organs can attract statoacoustic (SAG) neurites. (A) In rat, viral gene delivery of Atoh1 to neonatal organ of Corti isolated in culture generates ectopic hair cells. The extra hair cells were located adjacent to the neural side of the organ of Corti in a region called the greater epithelial ridge. Some of these hair cells become innervated, as shown in green (Zheng and Gao, 2000). Although the experiment was conducted in culture, the result is
schematically shown as it might appear in an intact ear to ease comparison with results from the chicken. (B) In the chicken cochlea, ectopic sensory patches containing hair cells can be induced by using retroviral vectors to force the misexpression of an activated form of β-catenin, a downstream signaling component of the canonical Wnt pathway (Stevens et al., 2003). Ectopic vestibular sensory patches can appear along the lateral wall of the cochlear duct. Neurofilament-positive axons can be followed into the misplaced sensory patches (shown in green). (C-E) Histological semi-serial sections showing innervation of ectopic hair cells in the E11 chicken cochlea. (C) A patch of -catenin-virus-infected cells (white arrow) on the nonsensory wall of the cochlear duct is identified using an antibody directed against a hemagglutinin tag on the activated
-catenin protein. Experimental details can be found in Stevens et al., 2003. (D) Nerve branches terminate within the infected patch (arrow and inset); the axon of origin could be traced from the ganglion around the anterior wall of the duct and into the patch. (E) Ectopic hair cells differentiate within the infected patch (arrow). The same section shows a normal array of hair cells along the medial wall of the duct; their proximity to the extreme anterior edge of the organ explains why the row appears to be discontinuous. Scale bar for (C-E) is 100 microns; scale bar for the high-power inset of (E) is 20 microns. Abbreviations: BP, basilar papilla; AG, acoustic ganglion.
иннервацию опять же посредством траекторий, не обнаруживаемых у нормальных эмбрионов (Fig. 2 B-E). Хотя сенсорные характеристики (слуховые в противовес вестибулярным) нейронов, отвечающие за эктопическую иннервацию ещё предстоит определить, но тот факт, что смещенные сенсорные участки получают иннервацию, указывает на испускание chemotropin сенсорными зачатками.
Результаты этих экспериментов по избыточной функции ставят важный вопрос: если иннервация эктопических волосковых клеток результат хемоаттрактивной активности, то возникает ли она из волосковых клеток или из сенсорных примордиев, которые их продуцируют? Исходя из нормального времени роста аксонов, мы знаем, что аксоны, оказываются вблизи своих областей мишеней за несколько дней до дифференцировки волосковых клеток. Фактически аксоны обычно локализуются непосредственно позади сенсорного примордия ещё до того как "рождаются", т.е. до того как волосковые клетки подвергаются финальным митотическим делениям (Whitehead and Morest, 1985).
Поэтому кажется маловероятным, что волосковые клетки сами по себе ответственны за наведение аксонов. В самом деле, результаты, полученные на мутантных мышах, у которых волосковые клетки неспособны дифференцироваться, показывают относительно нормальный паттерн иннервации. Это наблюдается у нокаутных мышей по Pou4f3 (ранее наз. Brn3c) (Xiang et al., 2003) и Atoh1 (Fritzsch et al., 2005a), схематически показаны на Fig. 3. Т.о., данные по избыточности функции, по-видимому, указывают на то, что волосковые клетки не нужны.
Но что будет, если сенсорный орган отсутствует?
Fgf10 нулевые мыши полностью лишены заднего гребешка и всё же пучок аксонов, который действительно не отличим от дикого типа, следует в заднюю часть отоциста, где обычно локализуется задний гребешок (Pauley et al., 2003) (Fig. 3). Эти данные подтверждают идею, что ни сенсорный примордий, ни волосковые клетки не ответственны за chemoattraction SAG нейронов у нормальных животных.
Neurotrophins as candidates for chemoattraction
Два нейротрофина, brain-derived neurotrophic factor (BDNF)
и neurotrophin-3 (NT-3) являются кандидатами на роль хемотропных факторов для ведения SAG нейронов (rev. Fritzsch et al., 1999). Во-первых, они экспрессируются только во время раннего развития уха в областях, которые получают нейриты (Farinas et al., 2001). IУ мышей самые ранние нейриты, по-видимому, проецируются в направлении macular зачатков на ст. E10.5, а на E11.5 или эти же или дополнительные проекции достигают трех доменов экспрессии BDNF, которые д. в конечном итоге дифференцироваться в гребешки полукружных каналов (Figure 4A). Волокна, возглавляющие проход в направлении гребешков, д. обходить NT-3-экспрессирующие сенсорные зачатками maculae. Хотя просенсорные домены первоначально ограничены одиночным нейротрофином, они все начинают экспрессировать оба нейротрофина в течение нескольких дней. Зачатки гребешков продолжают экспрессировать BDNF, оставаясь фланкированными по экспрессии NT-3 в несенсорных территориях. Два macular зачатка, позитивно регулируют BDNF в небольших центральных доменах, которые соответствуют тонкой линии (striola). В то же самое время нейриты, распространяющиеся в NT-3-экспрессирующую улитку, включают её BDNF-экспрессирующий апикальный кончик (Figure 4B). Нокаут каждого из нейтрофинов оказывает выраженный эффект на жизнеспособность нейронов SAG (Ernfors et al., 1995); этот трофический эффект делает проблематичным изучение их роли в качестве топических факторов. Популяции нейронов, теряющиеся после удаления нейротрофина, варьируют в зависимости от того, какой фактор присутствует в их полях мишенях.
Большинство, если не все, нейроны SAG экспрессируют TrkB и TrkC
рецепторы для BDNF и NT-3, соотв. (Farinas et al., 2001), возникает вопрос, почему некоторые волокна (подобно тем, которые ведут к гребешкам) по-видимому, избирательны к одному, но не к др. нейротрофину. Из-за разнородности экспрессии рецепторов нейротрофинов возникает вопрос, что будет происходить с нахождением пути аксонами в случае, если один нейротрофин замещен др. В частности, будет ли ростовой конус привлекаться к "ошибочной" мишени, если эта мишень вынуждена экспрессировать "правильный" нейротрофин для определенного нейрона? Если так, то это указывает на топическую активность. Такая целенаправленная генетическая замена была проделана путем комбинированного нокаута локуса
Bdnf с помещением (knock-in) Bdnf в NT-3-null локус, т.е. получением генотипа NT-3
tgBDNF-/-;BDNF
-/- (Tessarollo et al., 2004). В этом случае выросты E11.5 аксонов в направлении сенсорных примордиев гребешков происходят нормально, даже когда ткань мишень не экспрессирует ни BDNF, ни NT-3 у мутантов (Figure 4C). Неожиданно, ростовые конусы не были поставлены в тупик во время своей навигации, проходя вблизи эктопических источников BDNF. Этот результат указывает на то, что иногда иные нежели BDNF ответственны за ведение аксонов в направлении их корректных мишеней (презумптивных гребешков). Также возможно, что BDNF территории, экспрессируется репелленты во время, когда аксоны проходят вблизи этих регионов, т.к. они огибали отоцист, чтобы достичь гребешка. Эта возможность обсуждается ниже. На ст. E12.5, нейриты, которые наводят на задний гребешок, днём раньше были неспособны достигать своих мишеней в мутантном NT-3
tgBDNF-/- ;BDNF
-/- ухе, а вместо этого отклонялись к др. сенсорным участкам, включая базальную часть улитки, как схематически представлено на Figure 4D (green lines). При рождении обнаруживаются дополнительные эктопические проекции в не-сенсорные территории. Вблизи гребешков терминальные веточки достигают задней части сенсорных территорий, возможно восстановленные за счет замещения NT-3 на
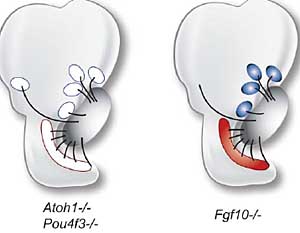 Fig. 3. Neither differentiated hair cells nor sensory primordia are required for statoacoustic (SAG) neurites to follow a normal axon
trajectory. Although hair cells fail to develop in Atoh1-null or Pou4f3-null
mice, axon outgrowth into the target regions is unaffected. The posterior
crista fails to arise in Fgf10-null mice and yet an initial axon tract grows
in the direction of the missing organ. Schematics are based on published
data (Fritzsch et al., 2005b, Pauley et al., 2003, Xiang et al., 2003).
Fig. 3. Neither differentiated hair cells nor sensory primordia are required for statoacoustic (SAG) neurites to follow a normal axon
trajectory. Although hair cells fail to develop in Atoh1-null or Pou4f3-null
mice, axon outgrowth into the target regions is unaffected. The posterior
crista fails to arise in Fgf10-null mice and yet an initial axon tract grows
in the direction of the missing organ. Schematics are based on published
data (Fritzsch et al., 2005b, Pauley et al., 2003, Xiang et al., 2003).
BDNF на несенсорных флангах. Эктопическая проекция в сайт, свободный от волосковых клеток между saccule и utricle также присутствует (Figure 4D, звездочка); это, как полагают, отражает позитивную регуляцию Bdnf с помощью NT-3 промотора, базируясь на домене слабой экспрессии NT-3, расположенном в сходном положении у NT-3-LacZ репортерных мышей
(Tessarollo et al., 2004). Изменение маршрута аксонов в эктопические BDNF-экспрессирующие территории строго указывает на то, что или сам BDNF или нечто ещё, действующее ниже его, оказывает тропный эффект на SAG нейроны.
Are repellents used to steer axons in the inner ear?
Semaphorins and neuropilins
Вполне возможно, что аттрактивные сигналы, направляют SAG нейриты к их сенсорным мишеням. Однако, отталкивающие сигналы могут играть столь же важную роль в генерации корректных паттернов иннервации. Данные по мутантным мышам указывают на один класс аксональных репеллентов, Semaphorins, предоставляющего стоп сигнал растущим SAG нейритам. чтобы предупредить от постоянного промахивания сенсорных мишеней и вступления в дорсальную часть отоциста и за него (Figure 5). Semaphorins являются классом аксональных репеллентов, которые были очищены. благодаря своей способности вызывать коллапс ростовых конусов. Передача сигналов Class 3 Semaphorin для отталкивания аксонов требует присутствия как лиганд-связывающего Neuropilin рецептора, так и сигнал-передающей субъединицы, Plexin ко-рецептора (rev. He et al., 2002). Во внутреннем ухе, PlexinA1 и PlexinA2, как сообщалось, экспрессируются в развивающихся SAG нейронах на ст. E16.5 (Murakami et al., 2001).
Чтобы осуществить функциональный анализ системы передачи сигналов Semaphorin-Neuropilin в нахождении пути аксонами, использовали целенаправленные мутации neuropilin-1 (Npn-1; наз. также Nrp-1), было необходимо избежать ранней летальности из-за пертурбаций в передаче сигналов VEGF-Neuropilin . Чтобы достигнуть этого, исследователи вызывали нокаут в локусе
Npn-1 аллеля. кодирующего 7 аминокислотных замен в Npn-1 рецепторе, что предупреждает его от соединения с Class 3 Semaphorins, но не с VEGF лигандами. Мыши, гомозиготные по этому аллелю, наз. npn-1
Sema1- , обнаруживают навигационные ошибки среди SAG нейронов. В частности некоторые аксоны были неспособны остановиться, когда они достигали сенсорных мишеней и продолжали рост в дорсальном направлении, достигая кожи (Gu et al., 2003). Источник таких аберрантных соединений был подтвержден с помощью ретроградного отслеживания от кожи назад к вестибулярному ганглию. Интересно, что новые отические территории, пересекаемые мутантными аксонами, чтобы достичь кожи, экспрессировали высокие уровни транскриптов Semaphorin 3e (Sema3e) у мышей дикого типа (Miyazaki et al., 1999). Очевидно. что отсутствие функциональных Npn-1 рецепторов делает ростовые конусы нечувствительными к отталкивающему сигналу Sema3e. Центральные проекции таких нейронов, были, по-видимому, не изменены
их измененными периферическими соединениями: по крайней мере, некоторые из афферентных волокон иннервирующих кожу, заканчивались с вестибулярных ядрах ствола мозга (Gu et al., 2003).
Ephs and ephrins
Ephrins являются большим классом ассоциированных с мембранами белков, которые взаимодействуют с Eph рецепторных тирозин-киназами, чтобы обеспечить межклеточные взаимодействия во время развития, особенно в нервной системе. В отличие от большинства комбинаций лиганд-рецептор, передача сигналов между Ephs и ephrins двунаправленная. В области ведения аксонов эта сигнальная система впервые была замечена благодаря её роли в топографическом картировании зрительной системы (rev. McLaughlin and O'Leary, 2005). Градиенты экспрессии Ephs
и ephrins присутствуют, когда клетки ретинальных ганглиев устанавливают соединения в tectum. Имеются существенные экспериментальные доказательства, указывающие, что нахождение путей вдоль nasal-temporal оси имеет отношение к репульсивным взаимодействиям между ephrins и Ephs. Репульсивное действие ephrins на нейриты не является универсальным,
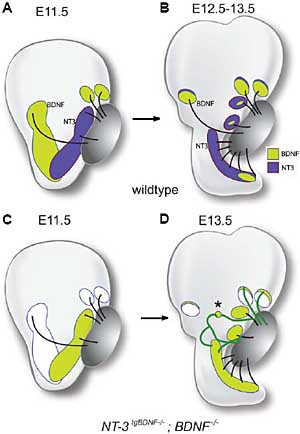 Fig. 4. Evidence for chemoattraction of sensory primordia and brain
derived neurotrophic factor (BDNF) during ear development. (A-B)
Schematic expression patterns of BDNF and neurotrophin-3 (NT-3) in the
otocyst at two developmental stages (based on Farinas et al., 2001). (C-
D) Results of axon trajectories in transgenic mice that are null at the Bdnf
locus and carry a knock-in of Bdnf into the NT-3 locus. (C) Axons initially
project to the crista primordia even when they are devoid of the
neurotrophin, BDNF, revealing that this cannot be the sole chemoattractant
for innervation of the cristae. Furthermore, the axons appear to ignore
more proximal sources of BDNF on their way to the cristae. (D) The
knock-in allele continues to force ectopic expression of Bdnf at sites
normally reserved for NT-3 expression. This leads to aberrant axonal
branches and projections (green lines). The asterisk denotes projections
into a region that does not contain sensory cells but that is presumed to
transiently expresses Bdnf under these conditions. Similarly, axons
project aberrantly into the cristae flanks, where BDNF is ectopically
expressed in domains normally specific for NT-3. Schematics are based
on published data (Tessarollo et al., 2004).
Fig. 4. Evidence for chemoattraction of sensory primordia and brain
derived neurotrophic factor (BDNF) during ear development. (A-B)
Schematic expression patterns of BDNF and neurotrophin-3 (NT-3) in the
otocyst at two developmental stages (based on Farinas et al., 2001). (C-
D) Results of axon trajectories in transgenic mice that are null at the Bdnf
locus and carry a knock-in of Bdnf into the NT-3 locus. (C) Axons initially
project to the crista primordia even when they are devoid of the
neurotrophin, BDNF, revealing that this cannot be the sole chemoattractant
for innervation of the cristae. Furthermore, the axons appear to ignore
more proximal sources of BDNF on their way to the cristae. (D) The
knock-in allele continues to force ectopic expression of Bdnf at sites
normally reserved for NT-3 expression. This leads to aberrant axonal
branches and projections (green lines). The asterisk denotes projections
into a region that does not contain sensory cells but that is presumed to
transiently expresses Bdnf under these conditions. Similarly, axons
project aberrantly into the cristae flanks, where BDNF is ectopically
expressed in domains normally specific for NT-3. Schematics are based
on published data (Tessarollo et al., 2004).
однако, т.к. Eph-ephrin взаимодействия, по-видимому, являются аттрактивными в обеспечении дорсо-вентральной ретинотектальной топографии (Holmberg and Frisen, 2002).
Во всяком случае имеется интерес в отношении того, могут или нет Ephs и ephrins участвовать в ведении аксонов во внутреннем ухе или в в его центральных проекциях (rev. Cramer, 2005, Webber and Raz, 2006). На эмбриональных стадиях выросты аксонов, спирального (auditory) ганглия нейриты путешествуют между двумя стенками EphA4-продуцирующих клеток на пути к зачатку органа Корти у мышей (van Heumen et al., 2000). Курьезно, но точный паттерн экспрессии EphA4, обнаруживаемый у мышей, не законсервирован у эмбрионов песчанок или морских свинок: у последнего из двух видов EphA4 экспрессируется в нейронах спирального ганглия, но не в фибробластах, выстилающих путь их проекции (Bianchi and Gale,
1998, van Heumen et al., 2000). У мышей, EphB2 и EphA4 оба оказывают отталкивающие эффекты на аксоны спирального ганглия на постнатальный день 3-5 in vitro (Bianchi and Gray, 2002, Brors et al., 2003). Поэтому время экстраполировать эти функциональные результаты из постнатального периода на эмбриональные стадии, чтобы сделать вывод, что Eph-ephrin взаимодействия на самом деле удерживают нейриты спирального ганглия на прямом и узком пути, когда они движутся в направлении сенсорной периферии. Отталкивающее действие EphA4 смягчается с помощью антител к ephrin-B2 и -B3 (Brors et al., 2003). В то время как нейроны спирального ганглия эмбрионов и/или постнатальных мышей в самом деле экспрессируют эти два ephrins, то они тактак же экспрессировать др ephrins и Eph рецепторы, что ещё больше усложнит картину (Bianchi and Gale, 1998, Rinkwitz-Brandt et al., 1996, van Heumen et al., 2000).
Вообще-то наиболее соблазнительным в терминах установления тонотопических карт является наблюдение оппозитных базально-апикальных градиентов иммунореактивности EphA4 и EphB2 в нейритах, проецирующихся вдоль развивающейся улитки птиц (Siddiqui and Cramer, 2005). Сходные градиенты ephrin в периферических мишенях слуховых нейронов пока не описаны.
Мыши, мутантные по EphB обнаруживают временные дефекты в своих эфферентных вестибулярных проекциях (Cowan et al., 2000). Т.к. эфферентные волокна улитки используют афферентные для нахождения пути (Fritzsch et al., 1998),
то дефектная эфферентная иннервация открывает возможность, что эфферентные волокна взаимодействуют с афферентными посредством передачи сигналов Eph-ephrin. Т.к. существует множество возможных взаимодействий между членами семейств Eph и ephrin, то перекрывание может быть маскирующим роль этих молекул в периферическом наведении аксонов во внутреннем ухе.
Slits and robos
Передача сигналов семейства Slit/Robo аксональных репеллентов может влиять на ведение аксонов, разветвление аксонов, образование пучков аксонов и миграцию клеток в разнообразных системах позвоночных и беспозвоночных (reviewed in Wong et al., 2002). Slit, секретируемый лиганд, впервые идентифицирован у Drosophila в качестве хеморепеллента, экспрессирующегося в клетках срединной линии ЦНС. Roundabout (Robo) белки, законсервированные члены сверхсемейства Ig, являются трансмембранными рецепторами для Slit. Сегодня идентифицированы два, two Robo гомолога и три Slit гомолога у кур (Bashaw and Goodman, 1999, Li et al., 1999, Vargesson et al., 2001). Была продемонстрирована экспрессия Slit2 и Slit3 в отоцисте кур (Holmes and Niswander, 2001), хотя детальная экспрессия в ухе не описана. Мы имеем предварительные данные для кур, показывающие, что Robo2 экспрессируется в клетках SAG , в то время как Robo1 и Robo2 присутствуют в сенсорном эпителии во время процесса нахождения пути на периферию. Мы также наблюдали все три Slit транскрипта в медиальной части отоциста во время, когда аксоны, начинают выходить из SAG (Campero and Fekete, 2007). У мышей этот регион д. приблизительно соответствовать крупному NT-3 домену в E10.5-E11.5 преддверии ( Figure 4A). Если мы экстраполируем эти находки на др. виды, то можем предположить, что соотв. присутствие Slit в NT-3 домене служит для отталкивания аксонов, которые во всем остальном отвечают на neurotrophin, объясняя тем самым, почему аксоны первоначально обходят этот просенсорный эпителий на своем пути к более удаленным гребешкам. Это может быть необходимо для аксонов, чтобы стать нечувствительными к Slits и/или к активированным TrkC рецепторам, чтобы сделать их способными к вступлению в этот просенсорный домен и иннервировать utricular и saccular maculae.
Предварительные данные показывают, что происходит экспрессия белка Robo1 в развивающемся спиральном ганглии мышей (Hackett et al., 2007). Т.о., лиганды и рецепторы присутствуют в соответствующее время и соотв. месте, чтобы повлиять на нахождение пути аксонами во время онтогенеза.
Future Directions
Morphogens as axon guidance candidates
На арену наведения аксонов выходят некоторые новые игроки. У позвоночных сюда входят Wnts, BMPs и Sonic hedgehog (Shh), которые традиционно рассматривались
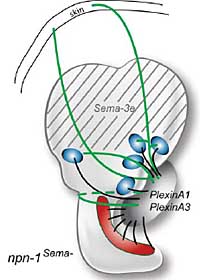 Fig. 5. Evidence for a Semaphorin-mediated stop signal in the dorsal
otocyst. One of the class 3 Semaphorin ligands, Sema-3e (formerly
SemaH), is expressed in the dorsal part of the mouse otocyst on E10.5
and E11.5 (grey stripes) and in the ampullae, but not the cristae of the
semicircular canals at E16.5. Two PlexinA family members, presumed to
function as Npn-1 coreceptors, are expressed in the statoacoustic gan-
glion (SAG) at similar stages. In mice where the Npn-1 receptor has been
modified to be insensitive to Sema3, SAG neurites project dorsally
beyond their normal targets and fail to stop upon reaching the Sema3
domain (shown in green). Schematics are based on published data (Gu et
al., 2003, Miyazaki et al., 1999, Murakami et al., 2001).
Fig. 5. Evidence for a Semaphorin-mediated stop signal in the dorsal
otocyst. One of the class 3 Semaphorin ligands, Sema-3e (formerly
SemaH), is expressed in the dorsal part of the mouse otocyst on E10.5
and E11.5 (grey stripes) and in the ampullae, but not the cristae of the
semicircular canals at E16.5. Two PlexinA family members, presumed to
function as Npn-1 coreceptors, are expressed in the statoacoustic gan-
glion (SAG) at similar stages. In mice where the Npn-1 receptor has been
modified to be insensitive to Sema3, SAG neurites project dorsally
beyond their normal targets and fail to stop upon reaching the Sema3
domain (shown in green). Schematics are based on published data (Gu et
al., 2003, Miyazaki et al., 1999, Murakami et al., 2001).
как морфогены, которые функционируют посредством концентрационных градиентов, чтобы контролировать формирование паттерна и спецификацию клеток в развивающихся эмбрионах (Charron and Tessier-Lavigne, 2005). Мы рассматриваем Wnts в нервной системе позвоночных как пример. Группа Yimin Zou's показала, что слабые градиенты лигандов Wnt присутствуют вдоль передне-задней оси спинного мозга (Liu et al., 2005, Lyuksyutova et al., 2003). Продольные аксоны, путешествующие или вверх или вниз спинного мозга, по-видимому, используют эти градиенты, чтобы предоставить информацию о направлении во время роста аксонов. Как привлекающие, так и отталкивающие взаимодействия с Wnt лигандами описаны в зависимости от определенного пути и комбинации Wnt лигандов и Frizzled или Ryk рецепторов (Schmitt et al., 2006).
Эта новая категория морфогенов в качестве потенциальных наводящих молекул д.быть исследована в контексте роста нейритов SAG. В нашей лаб. получены предварительные данные, показывающие, что имеются транскрипты для множества различных Wnt лигандов, Wnt рецепторов и Wnt ингибиторов, экспрессирующихся в отоцистах эмбрионов кур, SAG или нерве во время ключевой стадии роста нейритов (Sienknecht and Fekete, unpublished observations). Мутантные мыши были использованы. чтобы показать, что как Wnts, так и Shh необходимы для отического морфогенеза, особенно в контексте дорсо-вентральных градиентов лигандов, исходящих из тканей вне уха (Bok et al.,
2007, Riccomagno et al., 2002, Riccomagno et al., 2005). Предполагаемые концентрационные градиенты Wnt (high dorsally) и Shh (high ventrally) открывают возможность того, что нейроны SAG могут последовательно использовать одни и те же градиенты для установления тонотопических проекций вдоль улитки или для ведения вестибулярных афферентных волокон. BMP лиганды давно известны своим присутствием в отических сенсорных зачатках с самого раннего их появления; мы полагаем, что необходимо рассмотреть из потенциал как хемоаттрактантов, направляющих SAG аксоны к их мишеням. Сегодня необходимы функциональные исследования, предназначенные для разделения известных морфогенетических влияний Wnts, BMPs и Shh на внутреннее ухо, исходя из всех возможных их эффектов на ведение аксонов. f
Guidance cues for central navigation
Исследования наведения аксонов во внутреннем ухе имеют несомненно клиническое значение. Терапевтические подходы к регенерации волосковых клеток предполагают, что нейриты будут двигаться к новым волосковым клеткам, чтобы создать функциональные соединения. Поэтому становится важным идентифицировать как аттрактанты, так и репелленты для этого класса нейронов и убедиться, что какие-то из них всё ещё присутствуют или активируются во время регенерации волосковых клеток. Исследователей также интересует сохранение или замещение SAG нейронов, которые дегенерируют у глухих индивидов или как вторичное следствие потери факторов жизнеспособности, когда гибнут волосковые клетки, или из-за того, что потеря нейронов является наиболее первичным вкладом в глухоту. В любом случае терапия, имеющая целью восстановление количества нейронов, д. требовать, чтобы замещение нейронов сопровождалось образованием соотв. соединений как с периферией, так и с центром (Rubel and Fritzsch, 2002). Исследования по установлению и поддержанию центральных проекций находятся в тени периферических отростков, хотя сегодня может использоваться молекулярный уровень (Cramer, 2005) и мы надеемся на быстрый прогресс в этой области.
Сайт создан в системе
uCoz  Fig. 1. Axon outgrowth has been studied in both mouse and chicken inner ears, shown schematically at a stage shortly after afferent axons reach their targets. In both species, axons arrive at their targets
when the sensory primordia are still in a primitive stage lacking mature
hair cells. Although the arrival of axons at the different sensory primordia
is not simultaneous, by E12.5 in mouse and E5 in chicken, at least some
axons have navigated to each organ. Abbreviations: A, anterior; AC,
anterior crista; BP, basilar papilla; D, dorsal; LC, lateral crista; LM, lagena
macula; M, medial; OC, organ of Corti; PC, posterior crista; SM, saccular
macula; UM, utricular macula.
Fig. 1. Axon outgrowth has been studied in both mouse and chicken inner ears, shown schematically at a stage shortly after afferent axons reach their targets. In both species, axons arrive at their targets
when the sensory primordia are still in a primitive stage lacking mature
hair cells. Although the arrival of axons at the different sensory primordia
is not simultaneous, by E12.5 in mouse and E5 in chicken, at least some
axons have navigated to each organ. Abbreviations: A, anterior; AC,
anterior crista; BP, basilar papilla; D, dorsal; LC, lateral crista; LM, lagena
macula; M, medial; OC, organ of Corti; PC, posterior crista; SM, saccular
macula; UM, utricular macula.  Fig. 2. Gain-of-function studies show that inner ear sensory organs can attract statoacoustic (SAG) neurites. (A) In rat, viral gene delivery of Atoh1 to neonatal organ of Corti isolated in culture generates ectopic hair cells. The extra hair cells were located adjacent to the neural side of the organ of Corti in a region called the greater epithelial ridge. Some of these hair cells become innervated, as shown in green (Zheng and Gao, 2000). Although the experiment was conducted in culture, the result is
schematically shown as it might appear in an intact ear to ease comparison with results from the chicken. (B) In the chicken cochlea, ectopic sensory patches containing hair cells can be induced by using retroviral vectors to force the misexpression of an activated form of β-catenin, a downstream signaling component of the canonical Wnt pathway (Stevens et al., 2003). Ectopic vestibular sensory patches can appear along the lateral wall of the cochlear duct. Neurofilament-positive axons can be followed into the misplaced sensory patches (shown in green). (C-E) Histological semi-serial sections showing innervation of ectopic hair cells in the E11 chicken cochlea. (C) A patch of -catenin-virus-infected cells (white arrow) on the nonsensory wall of the cochlear duct is identified using an antibody directed against a hemagglutinin tag on the activated
-catenin protein. Experimental details can be found in Stevens et al., 2003. (D) Nerve branches terminate within the infected patch (arrow and inset); the axon of origin could be traced from the ganglion around the anterior wall of the duct and into the patch. (E) Ectopic hair cells differentiate within the infected patch (arrow). The same section shows a normal array of hair cells along the medial wall of the duct; their proximity to the extreme anterior edge of the organ explains why the row appears to be discontinuous. Scale bar for (C-E) is 100 microns; scale bar for the high-power inset of (E) is 20 microns. Abbreviations: BP, basilar papilla; AG, acoustic ganglion.
Fig. 2. Gain-of-function studies show that inner ear sensory organs can attract statoacoustic (SAG) neurites. (A) In rat, viral gene delivery of Atoh1 to neonatal organ of Corti isolated in culture generates ectopic hair cells. The extra hair cells were located adjacent to the neural side of the organ of Corti in a region called the greater epithelial ridge. Some of these hair cells become innervated, as shown in green (Zheng and Gao, 2000). Although the experiment was conducted in culture, the result is
schematically shown as it might appear in an intact ear to ease comparison with results from the chicken. (B) In the chicken cochlea, ectopic sensory patches containing hair cells can be induced by using retroviral vectors to force the misexpression of an activated form of β-catenin, a downstream signaling component of the canonical Wnt pathway (Stevens et al., 2003). Ectopic vestibular sensory patches can appear along the lateral wall of the cochlear duct. Neurofilament-positive axons can be followed into the misplaced sensory patches (shown in green). (C-E) Histological semi-serial sections showing innervation of ectopic hair cells in the E11 chicken cochlea. (C) A patch of -catenin-virus-infected cells (white arrow) on the nonsensory wall of the cochlear duct is identified using an antibody directed against a hemagglutinin tag on the activated
-catenin protein. Experimental details can be found in Stevens et al., 2003. (D) Nerve branches terminate within the infected patch (arrow and inset); the axon of origin could be traced from the ganglion around the anterior wall of the duct and into the patch. (E) Ectopic hair cells differentiate within the infected patch (arrow). The same section shows a normal array of hair cells along the medial wall of the duct; their proximity to the extreme anterior edge of the organ explains why the row appears to be discontinuous. Scale bar for (C-E) is 100 microns; scale bar for the high-power inset of (E) is 20 microns. Abbreviations: BP, basilar papilla; AG, acoustic ganglion.  Fig. 3. Neither differentiated hair cells nor sensory primordia are required for statoacoustic (SAG) neurites to follow a normal axon
trajectory. Although hair cells fail to develop in Atoh1-null or Pou4f3-null
mice, axon outgrowth into the target regions is unaffected. The posterior
crista fails to arise in Fgf10-null mice and yet an initial axon tract grows
in the direction of the missing organ. Schematics are based on published
data (Fritzsch et al., 2005b, Pauley et al., 2003, Xiang et al., 2003).
Fig. 3. Neither differentiated hair cells nor sensory primordia are required for statoacoustic (SAG) neurites to follow a normal axon
trajectory. Although hair cells fail to develop in Atoh1-null or Pou4f3-null
mice, axon outgrowth into the target regions is unaffected. The posterior
crista fails to arise in Fgf10-null mice and yet an initial axon tract grows
in the direction of the missing organ. Schematics are based on published
data (Fritzsch et al., 2005b, Pauley et al., 2003, Xiang et al., 2003).  Fig. 4. Evidence for chemoattraction of sensory primordia and brain
derived neurotrophic factor (BDNF) during ear development. (A-B)
Schematic expression patterns of BDNF and neurotrophin-3 (NT-3) in the
otocyst at two developmental stages (based on Farinas et al., 2001). (C-
D) Results of axon trajectories in transgenic mice that are null at the Bdnf
locus and carry a knock-in of Bdnf into the NT-3 locus. (C) Axons initially
project to the crista primordia even when they are devoid of the
neurotrophin, BDNF, revealing that this cannot be the sole chemoattractant
for innervation of the cristae. Furthermore, the axons appear to ignore
more proximal sources of BDNF on their way to the cristae. (D) The
knock-in allele continues to force ectopic expression of Bdnf at sites
normally reserved for NT-3 expression. This leads to aberrant axonal
branches and projections (green lines). The asterisk denotes projections
into a region that does not contain sensory cells but that is presumed to
transiently expresses Bdnf under these conditions. Similarly, axons
project aberrantly into the cristae flanks, where BDNF is ectopically
expressed in domains normally specific for NT-3. Schematics are based
on published data (Tessarollo et al., 2004).
Fig. 4. Evidence for chemoattraction of sensory primordia and brain
derived neurotrophic factor (BDNF) during ear development. (A-B)
Schematic expression patterns of BDNF and neurotrophin-3 (NT-3) in the
otocyst at two developmental stages (based on Farinas et al., 2001). (C-
D) Results of axon trajectories in transgenic mice that are null at the Bdnf
locus and carry a knock-in of Bdnf into the NT-3 locus. (C) Axons initially
project to the crista primordia even when they are devoid of the
neurotrophin, BDNF, revealing that this cannot be the sole chemoattractant
for innervation of the cristae. Furthermore, the axons appear to ignore
more proximal sources of BDNF on their way to the cristae. (D) The
knock-in allele continues to force ectopic expression of Bdnf at sites
normally reserved for NT-3 expression. This leads to aberrant axonal
branches and projections (green lines). The asterisk denotes projections
into a region that does not contain sensory cells but that is presumed to
transiently expresses Bdnf under these conditions. Similarly, axons
project aberrantly into the cristae flanks, where BDNF is ectopically
expressed in domains normally specific for NT-3. Schematics are based
on published data (Tessarollo et al., 2004).  Fig. 5. Evidence for a Semaphorin-mediated stop signal in the dorsal
otocyst. One of the class 3 Semaphorin ligands, Sema-3e (formerly
SemaH), is expressed in the dorsal part of the mouse otocyst on E10.5
and E11.5 (grey stripes) and in the ampullae, but not the cristae of the
semicircular canals at E16.5. Two PlexinA family members, presumed to
function as Npn-1 coreceptors, are expressed in the statoacoustic gan-
glion (SAG) at similar stages. In mice where the Npn-1 receptor has been
modified to be insensitive to Sema3, SAG neurites project dorsally
beyond their normal targets and fail to stop upon reaching the Sema3
domain (shown in green). Schematics are based on published data (Gu et
al., 2003, Miyazaki et al., 1999, Murakami et al., 2001).
Fig. 5. Evidence for a Semaphorin-mediated stop signal in the dorsal
otocyst. One of the class 3 Semaphorin ligands, Sema-3e (formerly
SemaH), is expressed in the dorsal part of the mouse otocyst on E10.5
and E11.5 (grey stripes) and in the ampullae, but not the cristae of the
semicircular canals at E16.5. Two PlexinA family members, presumed to
function as Npn-1 coreceptors, are expressed in the statoacoustic gan-
glion (SAG) at similar stages. In mice where the Npn-1 receptor has been
modified to be insensitive to Sema3, SAG neurites project dorsally
beyond their normal targets and fail to stop upon reaching the Sema3
domain (shown in green). Schematics are based on published data (Gu et
al., 2003, Miyazaki et al., 1999, Murakami et al., 2001).