Белок митохондриальной мембраны MTP18 является др. молекулой, которая, по-видимому, играет роль в делении митохондрий (Tondera et al., 2005). Топология этого белка ещё предстоит определить, но белок содержит три предполагаемых трансмембранных домена и не экспозируется наружу митохондрий. Избыточная экспрессия MPT18 ведет к фрагментации митохондрий, а подавление ведет к удлинению митохондрий. Было бы интересно проверить, взаимодействуют ли endophilin B1 или МТР18 c компонентами кухни деления. GDAP (ganglioside-induced Differentiation associated pritein), Miro (mitochondrial-Rho-GTPase)-1 и Miro-2 являются дополнительными молекулами, которые контролируют сорфологию митохондрий.
Исследования обусловленных вирусами и SNARE-обусловленным слияний мембран подчеркнули некоторые общие темы слияния биологических мембран (Bonifacino, Glick, 2004; Eckert, Kim, 2001). Во-первых, специфичность слияния мембран гарантируется с помощью образования специфических белковых комплексов в транс-положении между донорской и акцепторной мембранами. В случае покрытых оболочками вирусов субъединица вирусного гликопротеина соединяется с рецептором клеточной поверхности на клетке хозяине. При переносе пузырьков связывание Rab GTPases со своими эффекторными белками создает инициальную специфичность. Это связывание приводит к рыхлой ассоциации двух мембранных компартеменов. В последующей ступени, образование транс SNARE комплексов между R- и Q-SNAREs на двух мембранах создает дополнительный слой специфичности. Во-вторых, слияние мембран управляется с помощью образования очень стабильных спиральных пучков. Напр., при слиянии пузырьков, образование транс SNARE комплексов приводит к образованию очень стабильных четырех-спиральных пучков, которые непосредственно силой сводят донорский и ацепторный мембранные бислои в тесный контакт.
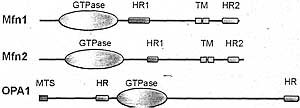
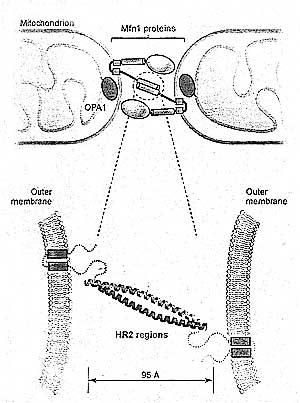
Слияние митохондрий, по-видимому, обладет этими двумя общими свойствами, а mitofusins, по-видимому, участвуют в обоих процессах. Mfn1 и Mfn2 необходимы для слияния митохондрий и они локализуются на наружной митохондриальной мембране, где они могут инициировать взаимодействие митохондрий др. с др. Важно, что mitofusins необходимы на соседних митохондриях по-видимому, время события слияния мембран (Koshiba et al., 2004). При изучении слияния митохондрий, митохондрии, лешеные mitofusins, не могут сливаться с митохондриями из клеток дикого типа. У дрожжей Fzo1 также необходим на обеих митохондриях in vitro (Meeusen et al. 2004). Более того, Mfn1 и Mfn2 формируют гомотипические и гетеротипические комплексы, которые могут быть обнаружены с помощью иммунопреципитации (Chen et al 2003; Eura et al., 2003). Гомотипические Mfn1 или Mfn2 комплексы или гетеротипические Mfn1-Mfn2 комплексы все компетентны к слиянию (Chen et al., 2005).
Очевидно, что mitofusins формируют комплексы в транс-положении, т.е. между соседними митохондриями (Рис. 3). Биохимические исследования указывают на то, что С-терминальная область Mfn1, содержащая гидрофобный рузефв repeat region HR2, может олигомеризоваться с собой и с аналогичной областью HR2 в Mfn2. Структурные исследования показывают, что Mfn1 HR2 формирует 95 Å в диаметре антипараллельную суперскрученную спираль с трансмембранными областями ка каждом из концов (Koshiba et al., 2004). В транс комплексе, такая структура должна приводить к тесному противополставлению митохондрий, но всё ещё д. оставаться существенный пробел. Такая структура фундаментально отлича от спиальных пучков. формируемых во время вызванного вирусами слияния и слияния пузырьков, при которых части мембран приводятся в непосредственное соприкосновение. Следовательно, Mfn1 кристаллическая структура скорее всего представляет собой конформацию Mfn1, участвующую в связывании митохондрий, но не в действительном слиянии. In vitro также подтверждена роль Mfn1 в связывании митохондрий (Ishihara et al., 2004). Слияние нуждается в конформационном изменении, которое обеспечивает более тесное сближение митохорндриальных мембран. Такое конформационное изменение может происходить путем зависимых от нуклеотидов изменений в GTPase домене или может использовать др. белки.
Слияние митохондрий использует смесь из матриксных содержимых, указывая тем самым, что и наружная и внутренняя мембраны д. сливаться скорординированно. Координация слияния наружных и внутренних мембран удивительно искусна, учитывая сложную геометрию внутренней мембрнаы, ЭМ томограйия показала. что внутренние структуры митохондрий очень изменчивы в зависимости от типа клеток и является более сложной, чем предполагалось инициальными моделями (Акунб Mannella, 2000). Часть внутренней мембраны (называемая внутренней пограничной мембраной) располагается в точности параллельно наружной мембране. Однако, внутренняя мембрана имеет многочисленные инвагинации (cristae), чья геометрия может варьировать от трубочек до сложных, взаимосвязанных пластинок. В целом эти инвагинации соединенич в внутренней пограничной мембраной с помощью узких трубочек, наз. crista junctions. Учитывая эти геометрические данные, слияние внутренней мембраны скорее всего д. происходить по-видимому, внутренней пограниченой мембране, т.к. эта часть внутренней мембраны лежит ближе всегтьо к наружной мембране.
Считается. что слияние наружной и внутренней мембраны тонко скоординированы. Однако, при экспериментальных манипуляциях два процесса могут быть несвязаны, указывая тем самым, что они механически отличны. In vitro при слиянии митохондрий дрожжей слияние наружных мембран нуждается в тесной ассоцииации митохондрий, в низких уровнях GTP и градиенте протонов поперек внутренней мембраны (Ьуугыут уе al., 2004). Напротив прогресс слияния внутренней мембраны нуждается в дополнительных GT^P и интактном электрическом градиенте поперек внутренней мембраны. Неясно, отражает ли потребность в мембранном потенциале базовый аспект механизма слияния или она является вторичной по-видимому, отношению к структурным эффектам на внутренней мембране. В культивируемых клетках млекопитающих слияние митохондрий нарушается с помощью Н+ или К+ ионофоров, которые нарушают потенциал мембран митохондрий (Ishihara et al., 2003; Legros et al., 2002; Mattenberger et al. 2003) При более тщательном изучении было установлено, что эти ионофоры делают возможным слияние наружной, но не внутренней мембраны (Malka et al., 2005). Удивительно, отсутствие связи может наблюдаться также в необработанных клетках, подтверждая, что слияние наружной и внутренней мембраны может быть не столь уже тонко скоординированным, как это предполагалдолсь (Malka et al., 2005).
Кухня, обеспечивающая слияние внутренней мембраны, неизвестна, но скорее всего, что ОРА1 играеть роль из-за своей важной роли в слиянии (Chen et al., 2005; Cipolat et al., 2004) и ассоцииации с внутренней мембраной (Griparic et al., 2005; Satoh et al., 2--3). Хотя ОРА1/Mgm1 не экспозируются в цитозоль, клетки, лишенные ОРА1, или дрожжи, лишенные Mgm1, не обнаруживают обнаружимого слияния наружной мембраны (Chen et al., 2005; Sesaki et al., 2003b). C этой точки зрения неясно, отражает ли дефкект слияния наружной мембраны врожденную роль в событии слияния или является скоре следствием обычной взаимосвязи наружной и внутренней мембран. Мало указаний на молекулярный механизм ОРА1. Гомология ОРА1 с dynamin семейством GTPases указывает на то. что он может участвовать в контроле изгибов или tubulation внутренней мембраны, и в самом деле, потеря ОРА1 ведет к тяжелым дефектам структуры крист (Griparic et al., 2004; Olichon et al., 2003).
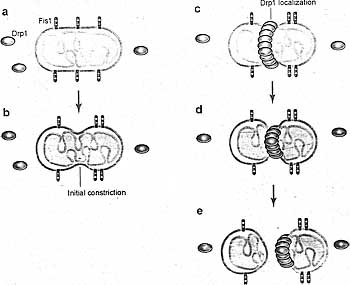
Рис.4. | Mitochondrial fission by Fisl and Drpl. (a) Fisl resides uniformly on the mitochondrial outer membrane; most of the protein faces the cytosol. Drpl {green ovals) exists both in the cytosol and on mitochondria in punctate spots (not shown). (b) Initial constriction of mitochondrial tubules occurs in a Drpl/Dnml-independent manner, (c) In some cases, this constriction coincides with Drpl localization, and (d) Drpl probably further constricts the mitochondrial tubule to mediate membrane fission, (e) After fission is completed, the Drpl complex is localized to the end of one of the daughter mitochondria prior to disassembly. Initial constriction of mitochondria and Drpl localization are independent events; the diagrams are not meant to imply that they occur sequentially. Only a subset of Drpl punctae on mitochondria proceeds to actual fission.
Fission Mechanism
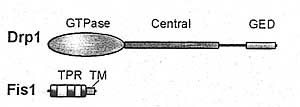
Хотя Fis1 и Drp1 безусловно неоходимы для деления митохондрий, мало известно об молекулярных механизмах их действия. Неясно, как Drp1 рекрутируется в митохондрии. Drp1 присутствует как в цитозоле, так и митохондриях, при этом митохондриальный пул располоагается точечно (Smirnova et al., 2001). Часть этих точек становится действительно местами делений и поэтому рекрутирование Drp1 в митохондрия является критической ступенью в инициации процесса деления. По аналогии с дрожжевым Dnm1, можно ожидать. что локализация Drp1 в митохондриях зависит от Fis1. Однако, эффективный нокдаун Fis1 не влияет не рекрутирование Drp1 (Lee et al., 2004).
Большая часть информации о механизме делений митохондрий получена в исследованиях на дрожжах. Даже в этой системе остаётся неясным, как Dnm1 локализуется в дискретных сайтах на митохондриях. Рекрутирование Dnm1 зависит от Fis1, который униформно распределяется понаружной мембране митохондрий (Ауллуы уе al., 2000; Mozdy et al., 2000; Tieu, Nunnari, 2000). Цитозаольная часть Fis1 имеет вогнутую поверхность, которая действует как поверхность для связывания (Karren et al., 2005; Suzuki et al., 2005). Mdv1 и Сфа4 действуют как молекулярные адапторы, соединяясь с Fis1 и Dnm1 (Griffin et al, 2005). Mdv1, по-видимому, способен существовать как униформно распределенным по-видимому, митохондриям, так и в виде дискретных точек, колокализуясь с точками Dnm1 (Cerveny et al., 2001; Griffin et al., 2005; Tieu, Nunnari, 2000). Неясно, как униформно распределенный Fis1 может рекрутировать Mdv1 или Dnm1 в дискретные точки. Единственная возможность. что Fis1 д. активироваться до того как он сможет рекрутировать Dnm1 и что активация происходит прерывистым образом. Вторая возможность заключается в том. что дополнительные факторы, иные чем Fis1/Mdv1/Caf4 используются для рекрутирования Dnm1. Низкий уровень рекрутирования Dnm1 отмечается в отсутствие Fis1, это указывает на врожденное сродство Dnm1 к митохондриальным мембранам. Вообще то Dnm1 способен ощущать структурные свойства митохондриальных мембран в дополнение к Mdv1 или Caf4 комплексам.
Остается решить, как Drp1/Dnm1 обеспечивают деление, будучи рекрутированными на митохондрии. Т.к. Drp1 является GTPase из семейства dynamin, то как полагают, она действует как механохимический энзим, который использует гидролиз GTP, чтобы вызывать сужение в месте деления митохондрий (Shaw, Nunnari, 2002; Smirnova et al., 2001). Этот способ действия аналогичен с предполагаемой ролью классического dynamin в констрикциях шеек инвагинирующих пузырьков во время claritin-обусловленного эндоцитоза (Зкфуаслуб McMahon, 2004). В самом деле, Dnm1 in vitro обнаруживает связанный со сборкой гидролиз GTP и способен собираться в спирали с измерениями, согласующимися с пережимаемыми митохондриальными трубочками (ingerman et al., 2005). Рекомбинантный Drp1 человека может tubulate искусственные липосомы (Yoon et al., 2001). Лишь небольшой субнабор Dnm1 точек участвует в действительном разделении митохондрий (Legesse-Miller et al., 2003) и прогрессия. по-видимому, зависит от факторов. контролирующих сборку и активацию Dnm1. Mdv1 скорее всего является одним из таких факторов, т.к. рекрутирование Dnm1 на митохондрии в отсутствие Mdv1 не способно стимулировать деление (Cerveny, Jensen, 2003; Fekkes et al., 2000; Tieu, Nunnari, 2000; Tieu et al., 2002).
Однако, модель Drp1/Dnm1 обусловленных констрикций, управляющих делением, осложняется наблюдением, что временные констрикции обычно происходят на дрожжевых митохондриальных трубочках в отсутствие Dnm1, указывая тем самым, что инициальные ступени деления не зависят от Dnm1 (Legesse-Miller et al., 2003). Изучение митохондриальных делений у красных водорослей Cyanidioschyzon merolae также подтвердили позднюю роль Drp1. У водроослей кухня деления состоит не только из dynamin-подобного белка, CmFtsZ1, ортолога белка деления бактерий FtsZ (Nishida et al., 2003). CmFtsZ1 является первым маркером митохондриального деления, формирующим кольцо со стороны матрикса на внутренней мембране митохондрий ещё до появления какого-либо сужения. После начала констрикции CmDnm1 рекрутируется на цитозольной поверхности наружной мембраны, где, как полагают, он завершает подготовну мембран. Этот способ деления митохондрий напоминает деления хлоропластов у растений, которые используют белки. сходные с FtsZ и Drp1, действующие сходным образом (Osteryoung, Nunnari, 2003). В этих случаях Drp1-подобные молекулы действуют поздно в делении органелл.
Ортологи FtsZ используются также в делении митохондрий у водоросли Mallomonas splendes и амеб Вшсенщыеудшгь dicoideum, но не выявлено Drp1- подобных молекул (Beech et al., 2000; Gilson et al., 2--3; Kiefel et al., 2004). Т.о., хотя большинство организмов используют Drp1 белки для деления митохондрий, имеется немного организмов, которые используют только FtsZ-подобные белки и пока известен только один организм (C. merolae), использующий и FtsZ- и Drp1-подобные белки. В случаях, в которых используются только Drp1, неясно замещает ли отдельный белок FtsZ-подобную функцию по-видимому, констрикции внутренней мембраны и необходим ли Drp1 только констрикции наружной мембраны. В подтверждение первой возможности imaging исследования у дрожжей показали, что подражделения матрикса, преимущественно отражают ремоделирование внутренней мембраны, происходящее в отсутствие Fis1 или Dnm1 (Jakobs et al. 2003). Кроме того, при определенных воздействиях химических веществ некоторые клетки млекопитащих сходным образом могут обнаруживать деление внутренней мембраны без деления наружной мембраны (Duncan et al., 1980).
Деления митохондрий безсомнения скоординированы с др. клеточными процессами. Митохондриальный геном организован в дискретные структуры, наз. nucleoids, а деления обычно происходят так, что дочерние митохондрии содержат, прпо-видимому, айней мере,по одному nucleoid, даже в клетках с сильно фрагментированными митохондриями (Legros et al., 2004; Margineantu et al., 2002). Это наблюдение указывает на то, что предопределение места деления каким-то образом связано с позицией nucleoid. Деление митохондрий может также быть связано с клеточным циклом. Морфологические исследования показали, что культивируемые клетки млекопитающих в поздних S и М фазах обычно имеют фрагментированые митохондрии (Barni et al., 1996; Margineantu et al., 2002). Следовательно, клетки могут делить свои митохондрии, чтобы облегчить их расхождение во время клеточных делений. Однако, исследования на дрожжах подтверждают, что наследование митохондрий может происходить в отсуствие делений митохондрий (Bleazard et al., 1999; Sesaki, Jensen, 1999).
Роль Fis1 и Drp1 в делениях органелл не ограничивается делением митохондрий. Оба белка локализуются также на пероксисомах, а нокдаун любого из них приводит к элонгации пероксисом (Koch et al 2005). Как и с митохондриями констрикции пероксисом, но не деление, могут происходить и в отсутствие Drp1 (Koch et al., 2004).
BIOLOGICAL SIGNIFICANCE
Cell Biology of Fusion and Fission
Разработано несколько подходов для прямого измерения слияний митохондрий. Наиболее распространенный методо связан с искусственным слиянием клеток с polyethylene glycol (PEG) или вирусом. Если две родительские клетки, содержащие флюоресцентно меченные митохондрии, слить, то слияние митохондрий может бытьоценено количественно в гибридных клетках оценивая колокализацию флюорофор (Chen et al. 2003; Ishihara et al., 2003; Legros et al., 2002; Mattenberger et al., 2003). В таких экспериментах экстенсивное слияние митохондрий обнаруживаетя спустя несколько часов после слияния клеток и обычно заканчивается спустя 8 ч. Этот метод концептуально сходен с зиготическим походом, используемым для анализа слияний митохондрий у дрожжей (Nunnari et al., 1997). Слияние митохондрий может быть оценено и с помощью использования митохондриально локализованных фотоактивируемых GFP (Karbowski et al., 2004a). Митохондрии в клетках, экспрессирующих такие конструкции, обладают слабой флюоресценцией, а лазер может использоваться для фотоактивирования GFP в небольших субнаборах митохондрий. Диффузия активированных GFP в соседние митохондрии и позволят измерять слияние митохондрий. Слияние митохондрий млекопитающих может быть воспроизведено in vitro, хотя этот подход разработан у дрожжей (Ьуугыут уе al., 2004).
Морфология митохондрий зависит от баланса между противоположными процессами слияния и деления. Несбалансированное деление ведет к фрагментации, а несбалансированное соделинение ведет к элонгации. В клетках со сниженным слиянием митохондрий митохондриальные трубочки могут быть восстановлены одновременным ингиирование делений (Chen et al., 2003). В нормальном развитии контроль этих процессов может менять форму митохондрий, чтобы удовлетворить определенные онтогенетические функции
Напр., онтогенетическая позитивная регуляция Fzo во время сперматогенеза у дрозофилы выдет к слиянию митохондрий, чтобы сформировать структуру Nebenkern, которая важна для фертильности самцов (Hales, Fuller, 1997).
Помимо конторля формы митохондрий, слияние и деление митохондрий также важны для биоэнергетической функции митохондрий. В клетках, лишенных mitofusins или ОРА1 функция митохондрий серьезно снижается (Chen et al., 2005). Митохондриальная популяция внетри индивидуальных клеток обнаруживает гетерогенность в отношении мембранного потенциала, и потребление кислорода может быть нарушено. Как результат клетки без слияния митохондрий растут намного медленнее, по-видимому, сравнению с контролем. Др. генетические манипуляции, которые ведут к фрагментации митохондрий не приводят к таким функциональным изменениям, следовательно, слияние per se помимо формы митохондрий, по-видимому, важны для функции митохондрий.
Почему слияние митохондрий так важно, пока неясно. Возможно, что благодаря слиянию митохондрии оказываются способными внутри клетки кооперировать др. сдр. (Chen et al., 2003). В клетках дикого типа высокая скорость слияния и деления постоянно меняют качественные особенности индивидуальных митохондрий. Дискретный митохондрион в определенной точке времени может быть изменен путем добавления нового митохондриального материала посредством слияния или путем удаления материала посредством деления. Следовательно, митохондрии не являются аутономными органеллами; во время своей жизни их границы постоянно переопределяются. В клетках, лишенных слияния митохондрий, митохондрии становятся автономными органеллами, которые неспособны взаимодействовать со своими соседями. В этом случае дефекты функции митохондрии - вообще-то обусловленные истощением субстрата, митохондриальной ДНК (mtDNA), или метаболитов - не могут быть восполнены слиянием со здоровыми митохондриями.
Слияние митохондрий может также защитить клетки от вредных эффектов мутаций mtDNA обеспечивая функциональную комплементацию mtDNA генных продуктов. Клеточные гибриды, формируемые при слиянии родительских клеток, несущих разные патогенетические мутации mtDNA, восстанавливают респираторную активность (Ono et al., 2001). По неизвестным причинам эта комплементация не происходит вплоть до приблизительно 2-х недель после слияния клеток, хотя с помощью метода PEG слияние митохондрий выявляется в течение нескольких часов. У животных моделей mtDNA болезней ткани не обнаруживают дефектных митохондрий вплоть до тех пор, пока груз патогенной mtDNA не станет очень высоким (Nakada et al., 2001). Важно, что в клетках с менее, чем 60% патогенных mtDNA, все митохондрии функциональны, указывая тем самым, что слияние защищает функцию популяции митохондрий.
Mitochondrial Dynamics in Development and Apoptosis
Слияние митохондрий является важным процессом у млекопитающих. Мыши, лишенные Mfn1 или Mfn2 погибают in utero на Е10.5-11.5 (Chen et al., 2003). Mfn2 мутантные эмбрионы развиваются нормально до тех пор, пока недостаточность плаценты не приведет к раздержке роста. В отсутствие Mfn2 nht[ckjqyfz структура плаценты разрушается. Возникающая в результате плацента имеет оченть мало трофобластных гигантских клеток, полиплоидных клеток, которые обеспечивают ряд клеточных функций, необходимых для поддержания эмбиона.
Хотя такие мутантные мыши не могут быть использованы для изучения более поздних онтогенетических функций mitofusins, очень вероятно, что слияние митохондрий играет также важную роль во взрослых клетках. В некоторых тканях ультраструктурные исследования морфологии митохондрий во время тканевой дифференцировки показали, что митохондрии подвергаются драматическим морфологическим переходам, включая увеличение длины трубочек и взаимных соединений, которые скорее всего обусловлены онтогенетически регуляируемыми слияниями (Chen, Chan, 2004). Т.к. нейродегенеративные болезни могут быть вызваны мутациями Mfn2 или OPA1 человека (Alexander et al., 2000; Delettre et al., 2000; Zuchner et al., 2004), то определенные нейроны, по-видимому, особенно чувствитеьны к нарушениям динамики митохондрий. В культурах клеток нейронов гиппокампа митохондрии, по-видимому, рекрутируются в активно растущие дендритные выпячивания, особенно когда нейроны активируются посредством деполяризации (Li et al., 2004). Пертурбации динамики митохондрий в этой системе приводят к редукции роста дендритных шипов (spine) и образования синапсов, указывая тем самым, что регулируемое рекрутирование митохондрий важно для структуры и пластичности дендритов.
Исслдования мутантов дрозофилы показали, почму митохондрии важны для нейронов. Мутации в Drp1 или Miro (mitochondrial-Rho-GTPase) авзываю серезные уменьшения количества митохондрий, которые могут достигать нервных окончаний (Guo et al., 2005; Verstreen et al., 2005). Miro является белком наружной мембраны митохондрий, который содержит тандемные домены GTPase и EF hands, Ca2+-связывающий мотивы. Млекопитающие содержат два гомолога, Miro-1 и Miro-2, которые регулируют морфологию митохондрий (Fransson et al., 2003). Дрожжевой ортолог, Gem1, также регулирует морфологию митохондрий благодаря пути, отдельному от слияния и деления митохондрий (Frederick et al., 2004). В случае дрозофилы мутанты Miro характеризуются отсутствием митохондрий в нейромышечных соединениях, что ведет к структурным дефектам синапсов (Guo et al., 2005). У Miro и Drp1 мутантов нейроны обнаруживают лишь легкие дефекты Ca2+ буфферинге, что осложняется продолжительной и высоко-интенсивной активностью (Guo et al, 2005; Verstreken et al., 2005). Первичный дефект, по-видимому, заключается в снижении количества доступного АТФ в нервных окончаниях.
Хотя у мышей мутации по-видимому, генам деления митохондрий не описаны, но скорее всего, что деление митохондрий также является важной функцией. У Caenorhabditis elegans нокдаун Drp1 с помощью RNAi ведет к очень ранней эмбриональной летальности (Labrousse et al., 1999). Кроме того, деление митохондрий играют важную роль в апоптозе. В некоторых моделях апоптоза образуются фрагменты митохондрий в начале клеточной гибели (Breckenridge et al., 2003; Desagher, Martinou, 2000; Frank et al., 2001). Эта фрагментация происходит приблизительно в то время, когда Bax, член проапоптического семейства Bcl2, транслоцируется в митохондрии перед активацией каспаз. Фрагментация зависит от активности Drp1 и Fis1, а ингибирование этих молекул редуцирует уровни апоптоза (Breckenridge et al., 2003; Frank et al,. 2001; Lee et al., 2004). Эти события. скорее всего имеют отношение к апоптическим событиям in vivo. У C.elegans онтогенетически регуляируемый апоптоз вызывает также фрагментацию митохондрий, которая зависит от Drp1 (Jagasia et al., 2005). Блокада функции Drp1 редуцирует эффективность клеточной гибели. Однако, проапоптическая роль делений митохондрий в клеточной гибели не универсальна. В индуцированной карамидами клеточной гибели Са2+ является ключевым эффектором, который перемещается от эндоплазматического ретикулема в митохондрии, приводя в конечном итоге к проницаемости митохондрий и активации каспаз. Эта обусловленная Са2+ передача сигналов усилоивается в клетках со взаимосвязанными митохондриями и поэтому усиление фрагментации митохондрий ведет к защите от клеточной гибели (Szabadkai et al., 2004).
В то время как деления митохондрий часто играют проапоптическую роль, слияния митохондрий. по-видимому, защищают клетки от клеточной гибели. Слияние митохондрий снижается вследствие индукции апоптоза (Karbowski et al., 2004), а избыточная экспрессия mitifusins может редуцировать уровень апоптоза (Sugioka et al., 2004). Истощение ОРА1 или mitofusins может редуцировать клеточный рост (Chen et al., 20050 и усиливать чувствительность к апоптическим стимулам (Lee et al., 2004; Olichon et al., 2003; Sugioka et al., 2004).
Mitochondrial Dynamics in Disease
Мутации в Mfn2 вызывают Charcot-Marie-Tiith sybtype 2A (СЬЕ2Ф)б периферическую нейропатию, характеризующуются мышечной слабостью и сенсорной потерей в дистальных частях конечностей (Zucher et al., 2004). Наиболее распространенная форма СМТ (СМТ1) вызывает дефекты Шванновских клеток, которые миэлинизируют периферические нервы (Kuhlenbaumer et al., 2002; Zucher, Vance, 2005). В результате дисфункции Шванновских клеток пациенты имеют пониженную скорвость проведения по-видимому, нервам и обнаруживают димеэлинизацию в биоптатах нервов. Напротив, пациенты с СМТ2А имеют нормальную скорость проведения по-видимому, нервам, а дефект периферических нервов связан с аксоналными или присущ моторным и сенсорным нейронам. Несмотря на патологические различия между двумя субтипами симптомы сходны и заключаются в слабости конечностей, икроножных мышц, рук и предплечий. Слабость ног вызывает отвислую стопу и характерную походку с высоким подниманием ног для компенсации. Долговременный дисбаланс ножных мышц ведет к аномально высокому своду и hyperextension большого пальца, деформации стоп pes cavus или когтеобразной стопе. Др. аксональный тип СМТ с ассоциированной оптической атрофией сцеплен с мутациями в Mfn2 (Zuchner et al., 2006).
Большинство Mfn2 мутаций, вызывающих СМТ2А, располагаются внутри или вблизи GTPase домена (Kijima et al., 2005; Lawson et al., 2005; Zuchner et al., 2004). Т.к. GTPase домен существенен для функции Mfn2, то СМТ2А может быть обусловлен гаплонедостаточностью Mfn2 (Zuchner at al., 2004). Однако, мыши. гетерозигоные по-видимому, по-видимому, Mfn2, не обладают нейромышечными дефектами (Chen et al., 2003). Неясно, почему жлинные моторные и сенсорные нейроны специфически повреждаются при CMT2A, учитывая, что Mfn2 широко экспрессируется в тканях взрослых.
GDAP1, ген, мутантный при СМТ4А, также может участвовать в контроле митохондриальной динамики (Niemann et al., 2005). Пациенты с СМТ4А обнаруживают демиэлинизацию и аксональную нейропатию, что согласуется с этой смешанной презентацией, GDAP1 экспрессируется как в Шванновских клетках, так и в нейронах. GDAP1 содержит два glutathione-S-transferase домены и локализуется на наружной мембране митохондрий. Избыточная экспрессия GDAP1 ведет к фрагментации митохондрий, которая зависит от Drp1, указывая тем самым на вовлечение обычной кухни деления. Снижение экспрессии GDAP1 ведет к элонгации митохондриальных трубок, подтверждая, что GDAP1 участвует в делении митохондрий. Вызывающие болезнь аллели GDAP1 или предупреждают митохондриальную локализацию или снижают активность GDAP1 по фрагментации митохондрий
Наиболее распространенной формой наследственной оптической атрофии является аутосомная dominant optic atrophy (DOA), при которой пациенты обнаруживают двухстророннюю атрофию зрительного нерва из-за потери ганглиолярных клеток сетчатки (Delettre et al., 2002). Некоторые генетические локусы сцеплены с этой болезнью; ОРА1 является наиболее часто повреждаемым геном (Alexander et al., 2000; Delettre et al., 2000). В одной из ОРА1 родословных, моноциты от пациентов имели дефект в распределении митохондрий, митохондрии собирались в глыбки вместо дисперсии по-видимому, всей клетке (Delettre et al., 2000). К сожалению ультраструктурные исследования митохондрий в ганглиолярных клетках сетчатки от пациентов не описаны. Однако, нокдаун ОРА1 в культивируемых ганглиолярных клетках сетчатки приводил к агрегации митохондрий (Kamei et al., 2005). Как и ожидалось, ОРА1 экспрессируется в сетчатке, хотя остается неясным, хотя неясно насколько широко или ограниченно только ганглиолярными клетками (Ju et al., 2005; Kamei et al., 2005; Pesch et al., 2004).
Учитывая аутосомно доминантную природу DOA и наблюдения, что некоторые ОРА1 болезненные аллели сильно укорочены, гаплонедостаточность ОРА1 скорее всего объясняет некоторые случаи DOA (Delettre et al., 2002). Большинство болезнь вызывающих аллелей ОРА1, однако, содержат менее тяжелые укорочения или имеют точковые мутации в GTPase или центральном домене (http://lbbma.univ-angers.fr/eOPA1/). В таких случаях остается определить, могут ли эти аллели оказывать доминантные эффекты на оставшийся аллель дикого типа
Lh/ dynamin семейство GTPases, как было показано собирается в олигомеры, а мутации с укорочениями или точковыми мутациями часто имеют доминантно-негативные эффекты (Praefcke, McMahon, 2004).
Было предположено на базе известной роли ОРА1 в регуляции митохондриальной динамики, чт о ОРА1-типа DOA является митохондриальной болезнью (Delettere et al., 2002). Недавно получены доказательства, что болезнь может иметь дополнительные параллели с классической митохондриальной encephalomyopathy. В некоторых родословных DOA, вызываемый ОРА1 мутациями, ассоциирует с нейросенсорной потерей слуха, птозом и ophthalmoplegia (Payne et al., 2004). Учитывая частое появление миопатии при митохондриальных нарушениях было бы интересно определить, обусловлены ли птоз и офтальмоплегия мышечными дефектами. Интересны метаболические исследования ОРА1-типа DOA пациентов, подтверждающие дефицит митохондриальной функции в скелетных мышйах (Lodi et al., 2004).
PERSPECTIVES
Although it was an obscure subject a few years ago, mitochondrial dynamics has emerged as a fundamental cell biological process with clearly important roles in mammalian biology. With key components of the fusion and fission machinery in hand, biologists have begun to make advances in understanding the molecular mechanisms of these membrane remodeling events. To make further progress, detailed structural and biochemical knowledge will be required.
Mitochondrial dynamics is important not only for control of the shape but also the function of mitochondria. We must devise new methods to understand how mitochondria interact with each other and why such interactions are important for the health of the aggregate mitochondrial population within a cell. An appreciation of this feature of mitochondrial biology will be important for understanding why certain cell types, for example neurons, are particularly dependent on mi to-, chondrial dynamics. Given that perturbations in mitochondrial fusion result in neurodegenerative disease, such approaches hold promise for the improvement of human health.
SUMMARY POINTS
Mitochondria are dynamic organelles whose morphologies are controlled by fusion and fission.
Mitochondrial fusion and fission are essential for normal mitochondrial function, implying that mitochondria do not function well as autonomous organelles.
The mitofusins Mfnl and Mfn2, key components of the mammalian mitochondrial fusion machinery, are localized to the outer membrane and mediate tethering of mitochondria during the fusion process.
The mammalian mitochondrial fission machinery consists of the outer membrane protein Fisl and the dynamin-related GTPase Drpl.
Mitochondrial dynamics plays important roles in vertebrate development and programmed cell death.
Mutations in the mitochondrial fusion machinery lead to two human neurodegenerative disorders, Charcot-Marie-Tooth subtype 2A and autosomal dominant optic atrophy.
Сайт создан в системе
uCoz