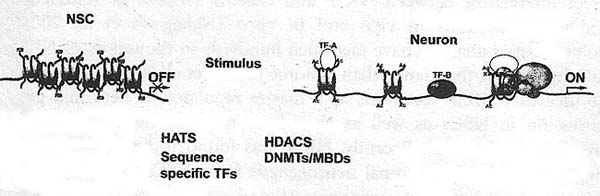
Имеется множество примеров как эпигенетическая регуляция контролирует клон-специфическую экспрессию генов во время развития в время нейрогенеза у взрослых; Однако, эпигенетические контролирующие механизмы также выполняют важную роль в зрелых постмитотических нейронах в головном мозге. Как сообщалось выше, метилирование ДНК может обеспечивать молчание за счет помех в связывании транскрипционных факторов с генами мишенями за счет метилирования CpG сайтов. Др. механизм, с помощью которого метилирование дНК ведет к транскрипционному молчанию генов, это связывание methyl-CpGs с помощью methyl-CpG-binding proteins (MBDs), которые затем рекрутируют HDAC репрессорные комплексы, приводящие к образованию репрессивного хроматина. MBDs представляют семейство белков, два из которых (MeCP2 и MBD1), а возможно и больше, в свою очередь играют важные роли в нервной системе. MeCP2 обнаруживается на высоком уровне в постмитотических нейронах (Zoghbi 2003), а мутации в MeCP2 сцеплены с нейрологическим нарушением Rett синдромом (Guy et al. 2001; Jung et al. 2003). Rett синдром характеризуется нормальным развитием до 1 года, наиболее часто встречается у женщин и сопровождается быстрой деградацией, с потерей речи и моторных навыков, микроцефалией, судорогами, аутизмом, атаксией и стереотипическими wringing рук (Rett 1966). Хотя точная роль MeCp2 в нейронах неясна, но растут указания, что MeCP2 является ключевым регулятором важных белков головного мозга, brain-derived neurotrophic factor (BDNF) (West et al. 2002), но может регулировать значительно больше генов мишеней, пока ещё не установленных. Интересно, что обработка нейронов повышенными уровнями внеклеточного калия ведет к фосфорилированию MeCP2 и дерепрессии транскрипции промотора BDNF (Chen et al. 2003; Martinowich et al 2003). Фосфорилирование MeCP2 по специфическому аминокислотному остатку, S421, как недавно было показано, происходит избирательно в нервной системе и является важным для регуляции роста дендритов и созревания шипов (spine) и для объяснения, по крайней мере частично, нейрон-специфической патологии при синдроме Rett (Zhou et al. 2006). Др. MBD также могут играть роль в головном мозге, в частности во время нейрогенеза у взрослых. MBD1 нокаутные мыши обнаруживают уменьшенный нейрогенез в гиппокампе, дефекты пространственного обучения и снижение долговременной потенциации в зубчатом гирусе гиппокампа (Zhao et al. 2003).
Др. широко распространенный наследственный синдром умственной отсталости это синдром Fragile X. Пациенты обнаруживают экспансию CGG последовательности от 5'UTR (untranslated region) в гене Fmr1 , это ведет к замалчиванию транскрипции гена. Когда число повторов превосходит 200, то область гиперметилируется, предупреждая связывание транскрипционного аппарата. Воздействие лекарствами, деметилирующими ДНК, ведет к снижению метилирования гистона H3 по остатку Lys-9, увеличению ацетилирования H3 и H4и к снижению метилирования гистона H3 по Lys-4, это ведет к активации Fmr1 (Tabolacci et al. 2005). Эта находка строго подтверждает роль ремоделирования хроматина в замалчивании
. Очевидно, что MeCP2 и Brm могут ассоциировать и совместно вызывать молчание гена Fmr1. RNA interference (RNAi) нокдаун MeCP2 и Brm ведет к усилению транскрипции мРНК Fmr1. Это указывает на то, что эпигенетические факторы вносят вклад в нейрологические нарушения, такие как синдром Rett и Fragile X умственная отсталость и открывают новый путь к терапевтическим мишеням.
Эпигенетические механизмы были также предположены, как лежащие в основе определенных форм памяти и нейральной пластичности, особенно после стрессовых сигналов, некоторые из которых физиологические, а остальные патологические (Fig. 2). Экспериментальные доказательства указывают на гистоновые модификации и хроматин-ремоделирующие факторы у животных моделей с пагубной привычкой к лекарствам, а также при определенных типах обучения (Colvis et al. 2005). Т.к. лекарственное привыкание имеет
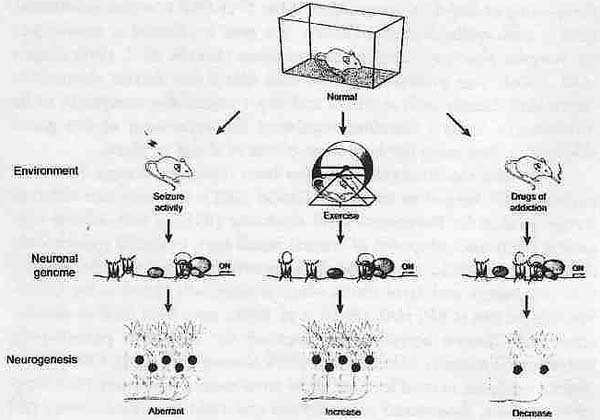 Figure 2. Signaling to the genome through diverse epigenetic regulatory mechanisms is critical to neurogenesis and brain function. Environmental or behavioral stimulation, both physiological (such as voluntary exercise) and pathological (such as seizure induction or drugs of addiction), can lead to global changes in histone modifications and chromatin remodeling of target genes controlling the neuronal genome. These context-dependent alterations in chromatin structure and transcriptional activity could produce acute changes in neuronal stem cell proliferation, differentiation, and survival of cells (neurogenesis), as well as cause a long term sustained effect. The epigenetic machinery could then serve as a key mediator acting at the cellular and molecular levels, sensing perturbations in the environment and triggering long-lasting changes in gene expression associated with various disease or pathological states.
Figure 2. Signaling to the genome through diverse epigenetic regulatory mechanisms is critical to neurogenesis and brain function. Environmental or behavioral stimulation, both physiological (such as voluntary exercise) and pathological (such as seizure induction or drugs of addiction), can lead to global changes in histone modifications and chromatin remodeling of target genes controlling the neuronal genome. These context-dependent alterations in chromatin structure and transcriptional activity could produce acute changes in neuronal stem cell proliferation, differentiation, and survival of cells (neurogenesis), as well as cause a long term sustained effect. The epigenetic machinery could then serve as a key mediator acting at the cellular and molecular levels, sensing perturbations in the environment and triggering long-lasting changes in gene expression associated with various disease or pathological states.
долговременно удерживаемый эффект, то доказательства ведут к альтерациям в структуре хроматина клеток головного мозга как возможного механизма, обусловливающего долговременные изменения в экспрессии генов, ассоциируемых с состоянием лекарственного привыкания, c-fos и AFosB, членами семейства Fos транскрипционных факторов, участвующими в поведенческих реакциях и синаптической пластичности, индуцируемых неправильно эксплуатируемыми лекарствами. Интересно, что кокаин может индуцировать ацетилирование H4 и фосфоацетилирование H3 в промоторе гена
c-fos в striatum после острого применения, но это десенсибилизируется после повторного воздействия кокаина (Kumar et al. 2005). Как и в случае FosB промотора, H3 ацетилирование всё ещё наблюдается после хронического воздействия кокаина. AFosB, продукт гена
fosH , также, как известно, накапливается при хроническом воздействии кокаина, увеличивая связывание Brg-1 (a компонента комплекса SWI-SNF, упомянутого ранее) с cyclin-dependent kinase 5, геном, участвующим в нейрогенезе, синаптической пластичности, обучении и памяти (Nikolic et al. 1996; Angelo et al. 2006). Эти доказательства указывают на то, что AFosB может рекрутировать хроматин-ремоделирующие факторы, такие как HATs и Brg-1-содержащие комплексы, на их нижестоящие мишени, регулируя тем самым экспрессию ключевых генов, участвующих в поддержании долговременных эффектов злоупотребления лекарствами.
Эпигенетические модификации связаны также с изменениями в нейральной пластичности и долговременной памяти (Kandel 2001). Недавно две разные мышиные модели для синдрома Rubinstein-Taybi (RTS), хорошо охарактеризованного врожденного синдрома, состоящего из умственной отсталости, недостаточного постнатального роста, микроцефалии, специфических лицевых характеристик, широких больших пальцев рук и ног (Rubinstein and Taybi 1963), который генетически сцеплен с CREB-binding protein (CBP) HAT (Petrij et al. 1995), были использованы для демонстрации, что ацетилирование гистонов необходимо для долговременной потенциации, обучения и памяти (Alarcon et al. 2004; Korzus et al. 2004). CBP гетерозиготы имеют нормальные уровни кратковременной памяти; однако их долговременная память, определяемая как контекстуальная и нацеленная на устранение страха (fear conditioning) и задачи распознавания новых объектов object recognition tasks, была очень аномальна. Интересно, что когда HDAC ингибитор suberoylanilide hydroxamic acid вводился внутрь желудочков CBP гетерозигот, то мыши обнаруживали улучшение contextual fear conditioning. Во второй мышиной модели, несущей гиппокамповую CA1- и dentate-gyrus-специфическую индуцибельную форму мутантного CBP, лишенного активности HAT, то отмечался дефицит долговременной памяти, хотя кратковременная память оставалась неизменной. Сходным образом, когда был использован HDAC ингибитор trichostatin A или когда трансген оказывался выключенным, то дефицит памяти мог быть устранен, указывая тем самым. что фармакологические манипуляции с активностью HAT могут быть потенциальным терапевтическим подходом для лечение RTS. Вообще-то более важны находки, что гены, такие как CBP и MeCP2, которые обладают такими глобальными эффектами на экспрессию генов, могут иметь такие специфические фенотипические последствия в головном мозге, указывают на то, что эпигенетические механизмы могут представлять неисследованную область для понимания и лечения когнитивных нарушений (Hong et al. 2005).
REGULATORY SMALL RNAs IN THE BRAIN
Открытие малых не кодирующих РНК революционизировало наше понимание механизмов, которые регулируют экспрессию генов во всех клетках (Novina and Sharp 2004), включая и клетки головного мозга млекопитающих (Cao et al. 2006). Их малые размеры и комплементарность последовательностей делает возможным чрезвычайное разнообразие мишеней мРНК для репрессии или активации экспрессии генов или модификации структуры хроматина генов мишеней. Двунитчатые РНК первоначально были обнаружены в молчащих генах благодаря направлению ими мРНК промежуточных образований на деградацию, но в последние годы дальнейшие механизмы действия малых РНК были открыты и выявлены потенциальные новые классы таких РНК. Малые РНК распадаются, по крайней мере, на четыре класса. Small interfering RNAs (siRNAs) и microRNAs (miRNAs) , обе замалчивают экспрессию генов; siRNAs обычно направляют мРНК на деградацию за счет комплементраности последовательностей одиночного сайта, тогда как miRNAs распознают многочисленные частично комплементарные сайты связывания, которые действуют синергично внутри мишеней мРНК, они широко распространены в постнатальном головном мозге, указывая тем самым, что они выполняют важные роли в функции нейронов. Из приблизительно 250 miRNAs у млекопитающих, кажется, что по крайней мере 125 miRNAs экспрессируется в головном мозге на разных уровнях (Krichevsky et al. 2003; Sempere et al. 2004). Некоторые из этих miRNAs, обнаруженных в головном мозге, это miR9, miR29, miR124, miR125a, miR125b, miRl27, miR128, miR132, miR137, miR138 и miR139, среди все увеличивающегося списка. Недавно CREB-индуцированная miRNA (miR132) , как было установлено, регулирует морфогенез нейронов в культивируемых кортикальных нейронах (Vo et al. 2005). Др. miRNA , участвующая в функционировании в головном мозге, это miR134, которая локализуется в дендритах и участвует в контроле размеров шипов (spine) (Schratt et al. 2006).
Недавно было продемонстрировано. что класс малых РНК может участвовать в хроматин-ремоделирующих факторах, чтобы регулировать взрослые NSCs из гиппокампа грызунов. В этом исследовании, малые не кодирующие РНК конкурируют за связывание последовательностей
NRSF, упомянутых выше, называемых NRSE small modulatory RNA (или smRNA), они могут эффективно запускать нейрогенез (Kuwabara et al. 2004). Эта smRNA по-видимому, обеспечивает свою функцию совершенно новым способом, отличным от siRNAs или miRNAs: она взаимодействует с NRSF белком и индуцирует нейрон-специфическую экспрессию. Ясно, что пока это только начало, учитывая большое количество малых РНК в головном мозге в норме и при болезнях.
CONCLUSIONS
The genome is no longer considered a static and privileged storage depot of genetic information; rather, it is now recognized to be a highly dynamic entity that undergoes profound structural and functional changes in response to extrinsic signals. Epigenetic and transcriptional regulation of the neuronal genome during adult neurogenesis has emerged as one of the best and most useful paradigms to study the role of chromatin modification in cell-fate specification. After cell-fate decisions are triggered, the next step is to determine how master regulators of the neuronal genome interact with their cognate binding partners at sequence-specific binding sites in a context-dependent manner to regulate downstream events controlling neuronal differentiation, maturation, and synaptic plasticity in an ever-changing environment. The fact that many epigenetic processes in the cell can act in a reversible and gene-specific manner allows the precise control of gene expression that is critical for brain development and function. Moreover, epigenetic processes in developing and mature neuronal cells appear to be targeted by a number of pathophysiological stimuli, including seizure activity and drugs such as cocaine. Although these studies are good starting points for studying epigenetic and transcriptional regulation of neuronal target genes, much work is still needed to fully understand the role of master regulators of the neuronal genome such as NRSF. Indeed, small chemical compounds and/or ribonucleic acids would provide excellent tools to begin gaining insight into these regulatory mechanisms and could be the starting points for novel neurological drugs.
Сайт создан в системе
uCoz