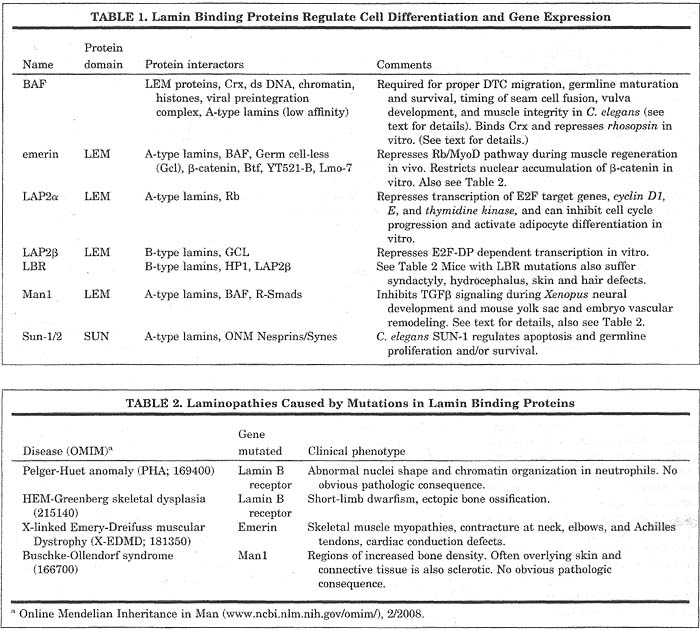
Некоторые белки ядерной ламины могут непосредственно опосредовать экспрессию, регулируя перенос сигналов и репрессируя транскрипцию генов, иногда действуя как ко-репрессоры (Table 1). Важно, что действия этих генов могут влиять на клеточную дифференцировку и онтогенетические события.
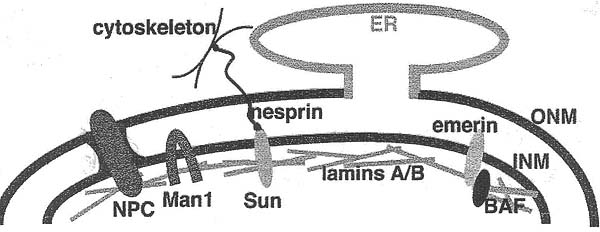
Мутации ламин-связывающих белков и в гене, кодирующем lamin A (LMNA), вызывают генетические болезни, классифицируемые как laminopathies (Tables 2, 3). Патологии при этих болезнях послужили первым указанием на то, что эти гены могут действовать в определенное время и/или затрагивать специфические типы тканей. Тканеспецифические функции могут осуществляться посредством взаимодействий с различными белками нуклеоплазмы и INM.

GIVE ME AN EXAMPLE OF HOW A NUCLEAR LAMINA PROTEIN REGULATES DEVELOPMENT
Man1 является белком INM, который содержит ~40aa LEM (LAP2, Emerin, and Man1) домен, законсервированный мотив, обнаруживаемый у некоторых белков INM и нуклеоплазмы. Man1 связывает A- и B-типа lamins in vitro,и необходим ламинам для локализации на INM.
Xenopus XMAN1 действует как нейральный индуктор за счет ингибирования судьбы вентральной мезодермы, индуцируемой с помощью transforming growth factor-beta (TGFβ) сверхсемейства лигандов и bone morphogenetic protein-4 (BMP-4; Osada et al., 2003; Raju et al., 2003). На молекулярном уровне Man1 соединяется и ингибирует фосфорилирование и накопление в ядре эффекторов нижестоящего TGFβ пути, R-Smads (Smad-1, 2, 3 являются нижестоящими по отношению к TGFβ/activin; Smads 5, 8 являются нижестоящими относительно BMPs), тем самым предупреждая активацию генов мишеней. Эти результаты указывают на то, что ядерная оболочка может служить платформой, с которой регулируются сигнальные пути.
Позднее было открыто, что трансгенные мыши, лишенные Smad-связывающей области в Man1, обнаруживают нарушения ремоделирования сосудов у эмбрионов и в желточном мешке (Ishimura et al., 2006; Cohen et al., 2007). Man1 недостаточность усиливает экспрессию компонентов extracellular matrix (ECM), которые являются транскрипционными мишенями передачи сигналов TGFβ. Это событие, как полагают, ведет к усилению отложения ECM, это ингибирует пролиферацию и миграцию эндотелиальных клеток, необходимых для ремоделирования сосудов. В противоположность находкам у Xenopus, ранняя спецификация нейрулы у таких мышей, по-видимому, нормальна. Эти находки подтверждают, что существуют видо-специфические роли у Man1.
Интересно, что мыши, которые обладают lamin A H222P missense мутацией, найденной и в семьях с EDMD-2, обнаруживают повышенное внутриядерное накопление фосфорилированных Smad 2/3 в дегенерирующих сердечной и скелетных мышцах (Arimura et al., 2005). Неизвестно, затрагивают ли эти специфические мутации функцию MAN1.
THAT WAS A GOOD STORY-TELL ME ANOTHER
BAF первоначально был идентифицирован как клеточный белок, который предупреждает аутоинтеграцию вирусной ДНК в геном хозяина. Новый белок, который высоко консервативен у многоклеточных. играет также роль в организации хроматина и сборке ядра. В соответствии с этими функциями было показано, что он взаимодействует с хроматином. гистонами, dsDNA, LEM доменовыми белками и A-типа lamin, хотя и с довольно низким сродством. Дополнительная функция, которая была выявлена недавно, заключается в том, что BAF может непосредственно регулировать экспрессию онтогенетических генов. Две находки это подтверждают.
Во-первых, BAF был идентифицирован как партнер по связыванию для Crx (Cone-rod homeobox) у дрожжей при двугибридном скрининге и репрессирует Crx-обусловленную трансактивацию глазного фоторецепторного гена, rhodopsin (Wang et al., 2002). Будучи тестирован in vitro, BAF1 также иммунопреципитировался с гомеобоксными белками, участвующими в развитии глаз: Chx10, Otx1/2 и Pax-6. Пока ещё неизвестно, играет ли BAF генеральную роль в развитии глаз.
Во-вторых, у Caenorhabditis elegans мутация потери функции BAF-1, only zygotic BAF-1 is deleted, приводит к дефектам во многих тканях many tissue-specific defects (Margalit et al, 2007). Эти черви обнаруживают аномалии развития вульвы, миграции distal tip cell (DTC) во время формирования гонад и в созревании и выживании зародышевой линии. Эти находки указывают на то, что BAF-1 регулирует экспрессию генов, участвующих в этих постэмбриональных онтогенетических процессах.
Это предположение вытекает из находок, что BAF-1-дефицитные черви обладают также преждевременным слиянием seam клеток. Seam клетки являются специализированными эпителиальными клетками, которые формируют синцитий вдоль лефой и працой срединной линии гиподермы или "кожи." In vitro, BAF-1 соединяется и репрессирует активацию генов, которые регулируют слияние seam клеток, aff-1 и eff-1, скорее всего в соответствии с наблюдаемыми дефектами seam клеток.
Др. интригующий дефект у червей проявляется в и изнашивании мышц тела и хвоста. Этот фенотип напоминает тот, что наблюдается у пациентов с E-DMDs, мышечными дистрофиями, вызываемыми мутациями в BAF связывающих партнерах, A-type lamin и emerin (Tables 2, 3). Остается определить, может ли неправильная регуляция генов, стоящих ниже BAF, участвовать в этиологии EDMDs.
WHAT DO THE EXPERTS HAVE TO SAY?
...
Сайт создан в системе
uCoz Образование ламиновых полимеров
Образование ламиновых полимеров