Ядра клеток предшественников в развивающемся нервной эпителии изменяют свое положение в ходе процесса, наз. interkinetic nuclear migration. Del Bene et al. (2008) сообщают, что дефекты в аппарате, контролирующем этот процесс ведут к измению проявления сигналов Notch и системным эффектам на нейрогенез в сетчатке.
В пролиферативной зоне развивающихся нервных структур нейральные предшественники образуют цитоплазматические соединения как междщу апикальными, так и базальными сторонами нервного эпителия, тогда как положение ядра вдоль апико-базальной оси варьирует в зависимости от ст. клеточного цикла. Этот феномен имеет отношение к процессу, известному как interkinetic nuclear migration (INM) (Figure 1). INM была описана во множественных системах, включая развивающийся спинной мозг, кору головного мозга и сетчатку. В сетчатке тела клеток и ядро находятся на апикальной строне нейроэпителия вблизи пигментного эпителия во время взождения в G1. Прохождение через G1 совпадает с перемещением ядра к базальной стороне нейроэпителия, ближайшей к месту облазования хрусталика. После завершения этой базовой миграции клетки вступают в S фазу и в начале G2, клеточные тела и ядра начинают обратную миграцию в направление апикальной стороны. Завершение этой ядерной миграции характеризуется митозом и повторением всего процесса дочерними клетками предшественниками (Baye and Link, 2008) (Figure 1A). Хотя этот феномен описан свыше 70 лет назад (Sauer, 1935), клеточные механизмы. которые регулируют INM остаются неуловимыми. Остается неясно, почему нейральные предшественники подвергаются этому процессу, хотя предполагается, что это способствует разнообразию клеточных судеб (Baye and Link, 2008).
Baier с коллегами сообщают, что мутация у рыбок данио (наз. mikre oko, moks309) , которая изменяет пролиферативную способность цилиарной маргинальной зоны сетчатки также вызывает дефекты в INM и эмбриональном нейрогенезе (Del Bene et al., 2008; Wehman et al., 2005). Рыбки данио
moks309 обладают
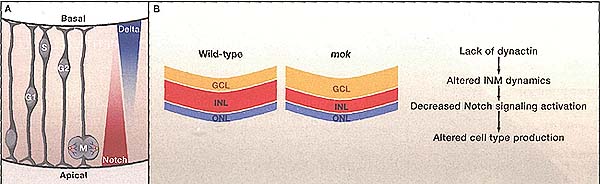 Figure 1. Interkinetic Nuclear Migration and Notch Influence Neurogenesis
(A) Progenitors coordinate interkinetic nuclear migration (INM) with passage through specific phases of the cell cycle. From left: Cells enter the cell cycle on the apical side of the retina. Cell nuclei move toward the basal side of the retinal neuroepithelium as they pass through G1. Cells enter S phase at the end of this basal migration, and nuclei move back toward the apical side during G2. Cells enter mitosis (M) on the apical side. Notch expression and Notch signaling activity increase nearer the apical side of the neuroepithelium. Delta ligands of the Notch receptor are expressed in a gradient with the opposite orientation. Yellow circles represent centrosomes. Red lines represent mitotic spindle microtubules. Blue lines represent chromosomes.
(B) Wild-type progenitors give rise to cells of the ganglion cell layer (GCL), inner nuclear layer (INL), and outer nuclear layer (ONL) in a 3:5:2 ratio (left). mok'm cells placed in a wild-type environment give rise to cells of the same layers in a 5:3:2 ratio (right). The changes in retinal cell type production observed in the mokaoa retina coincide with altered Notch signaling activation. Decreased levels of dynactin result in alterations in INM that affect progenitor exposure to the Notch gradient.
Figure 1. Interkinetic Nuclear Migration and Notch Influence Neurogenesis
(A) Progenitors coordinate interkinetic nuclear migration (INM) with passage through specific phases of the cell cycle. From left: Cells enter the cell cycle on the apical side of the retina. Cell nuclei move toward the basal side of the retinal neuroepithelium as they pass through G1. Cells enter S phase at the end of this basal migration, and nuclei move back toward the apical side during G2. Cells enter mitosis (M) on the apical side. Notch expression and Notch signaling activity increase nearer the apical side of the neuroepithelium. Delta ligands of the Notch receptor are expressed in a gradient with the opposite orientation. Yellow circles represent centrosomes. Red lines represent mitotic spindle microtubules. Blue lines represent chromosomes.
(B) Wild-type progenitors give rise to cells of the ganglion cell layer (GCL), inner nuclear layer (INL), and outer nuclear layer (ONL) in a 3:5:2 ratio (left). mok'm cells placed in a wild-type environment give rise to cells of the same layers in a 5:3:2 ratio (right). The changes in retinal cell type production observed in the mokaoa retina coincide with altered Notch signaling activation. Decreased levels of dynactin result in alterations in INM that affect progenitor exposure to the Notch gradient.
nonsense мутацией в локусе Dynactin-1 (
Dnct1), который элиминирует С конец белка и мутанты экспрессируют низкие уровни dynactin вообще. Dynein комплекс, с которым ассоциирует dynactin, играет критическую роль в поперечном связывании микротрубочек с ядерной оболочкой и обеспеичвает перемещения ядра (Tsai and Gleeson, 2005), ключевом аспекте interkinetic nuclear migration. Предыдущие исследования выявили неправильное позиционирование ядер фоторецепторных клеток у др.
mok мутантов и этот фенотип неправильного позиционирования ассоциирует со снижением жизнеспособности фоторецепторных клеток (Doerre and Malicki, 2001; Tsujikawa et al., 2007).
Del Bene et al. (2008) нашли, что moks309 мутантные рыбки данио продуцируют больше недавно возникших нейронов сетчатки, ганглиолярных клеток сетчатки. У moks309 мутантов временной интервал для продукции клеток ретинальных ганглиев увеличен, как показывает экспрессия atoh7, транскрипционного фактора. который способствует приобретению судьбы ретинальных ганглиолярных клеток. Избыточная продукция ретинальных ганглиолярных клеток, по-видимому, происходит за счет Miiller глиии и биполярных клеток, которые обычно продуцируются позднее в ретиногенезе. Авт. полагают, что эти изменения в генерации различных типов ткани происходят клеточно-автономным образом, т.к. нейральные предшественники у mok*309 мутантов продолжают избыточно продуцировать ретинальные ганглиолярные клетки даже, когда трансплантированы в стечатку дикого типа (Figure 1B). Интересно, что хотя и имеется четкий дефект нейрогенеза у moks309 мутантных животных. инициальная продукция некоторых типов клеток сетчатки остается неизменной. Учитывая, что все типы нейрональных клеток сетчатки генерируются из одного пула предшественников, интригует, что затрагивается только один определенный тип клеток. в
Эксперименты по менчению аналогом тимидина, осуществленные на moks309 животных во время раннего ретинального нейрогенеза демонстрируют, что многие клетки выходят из клеточного цикла преждевременно во время инициальной волны нейрогенеза. Это наблюдение объясняет, почему moks309 животные, которые имеют в среднем более маленькие глаза, содержат большую популяцию клеток ретинальных ганглиев, чем животные дикого типа; преждевременый выход из клеточного цикла заставляет популяцию предшественников дифференцироваться в наиболее ранние из возможных судеб, ретинальные ганглиолярные клетки, и одновременно истощает пул предшественников, необходимый для более позднего нейрогенеза.
Del Bene et al. оказались способны связать мутацию dynactin с дефектом нейрогенеза, благодаря наблюдению, что INM изменяется у мутантных предшественников сетчатки. В частности, ядра мутантных клеток мигрируют к базальной стороне нейроэпителия глубже и быстрее, в то же время движутся более медленно в апикальном направлении, чем клетки дикого типа. Кроме того, базальные митозы происходят более часто в сетчатке moks309. В предыдущих исследованиях было показано, что степень базальной миграции ядер является показателем нейрогенных в противовес пролиферативным делениям—значительные расстояния базальной миграции коррелируют с нейрогенными делениями (Baye and Link, 2007). Т.о., измененная динамика INM вызывается мутацией moks309 и может вызывать преждевременный выход из клеточного цикла и избыточную продукцию ретинальных ганглиолярных клеток в этой системе. в
Т.к. INM зависит от связи ядер с цитоскелетом, то дефекты белков ядерной облочки, которые обеспечивают ассоциацию посредством комплекса dynactin, также д. затрагивать нейрогенез. В согласии с этой гипотезой экспрессия одного из доменов белка ядерной оболочки Syne2a и нокдаун Syne2a , как было установлено, изменяет положение ядра и жизнеспособность фоторецепторных клеток (Tsujikawa et al., 2007). Экспрессия того же самого домена во время раннего нейрогенеза приводит к избыточной продукции ретинальных ганглиолярных клеток и к снижению продукции поздно появляющихся типов клеток. Хотя и не показано прямо, это скорее всего обусловлено дефектами в INM.
Хотя мутации, которые влияют на INM, могут быть связаны с измененным нейрогенезом, предыдущая работа не объясняла, почему раунды INM, которые распространяются более базально, д. приводить к нейрогенным митозам. Одной из возможностей является то, что степень ядерной миграции д. изменят подверженность клеток воздействию внеклеточных сигналов. Одной из молекул кандидатов, которые играют роль в регуляции пролиферации предшественников в противовес выходу из клеточного цикла, является Notch, активация которого может ингибировать выход из клеточного цикла и нейрональную дифференцировку. Кстати, Notch экспрессируется в виде апикально-базального градиента в ряде тканей, включая и сетчатку (Murciano et al., 2002). Авт. показали, что более значительная базальная миграция ядер уменьшает воздействие сигналов Notch и активацию пути Notch. Более того, скрещивание moks309 рыбок данио с линией, в которой выход из клеточного цикла задержан, или избыточная экспрессия активированного Notch в мутантных клетках может восстанавливать продукцию клеточных типов, которые обычно истощены у мутантов moks309 . Это убедительно демонстрирует, что изменение передачи сигналов Notch является причиной дефекта нейрогенеза, наблюдаемого у этих животных.в
Работа Del Bene с сотр. может быть связана с др. недавним исследованием значения INM в кортикальном нейрогенезе. Xie et al. (2007) продемонстрировали, что истощение или Cep120 или TACC белков, которые ассоциируют с центросомой и микротубулярной решеткой, которая связывает центросомы и ядро, приводит к изменению INM и нейрогенеза. Подобно снижению экспрессии Dynactin или Syne2a , истощение уровней белка Cep120 или TACC ведет к увеличению выхода из клеточного цикла, повышению продукции нейронов, к более базальным митозам и более медленному базально-апикальному перемещению ядер. Xie et al. обнаружили белки, которые связывают центросому с решоткой из микротрубочек, тогда как в данном исследовании основное внимание было уделено противоположному концу соединения этого цитоскелета, интерфейсу цитоскелета и ядерной оболочки. В обоих случаях, однако общий эффект потери эти х соединений сходен. Единственным предостережением является то, что Xie с коллегами не рассматривали эффект кондауна Cep120 или TACCна продукцию специфических классов нейронов. Следовательно, неясно может ли нокдаун Cep120 или TACC приводить к глобальным альтерациям кортикальных типов клеток или только специфического красса нейронов. Наконец, учитывая, что кора головного мозга обладает сходным градиентом экспрессии Notch (Murciano et al., 2002), было бы интересно посмотреть, приложимы ли уроки, извлекаемые из данного исследования, к дефектам INM и в этой системе.
Сайт создан в системе
uCoz  Figure 1. Interkinetic Nuclear Migration and Notch Influence Neurogenesis
(A) Progenitors coordinate interkinetic nuclear migration (INM) with passage through specific phases of the cell cycle. From left: Cells enter the cell cycle on the apical side of the retina. Cell nuclei move toward the basal side of the retinal neuroepithelium as they pass through G1. Cells enter S phase at the end of this basal migration, and nuclei move back toward the apical side during G2. Cells enter mitosis (M) on the apical side. Notch expression and Notch signaling activity increase nearer the apical side of the neuroepithelium. Delta ligands of the Notch receptor are expressed in a gradient with the opposite orientation. Yellow circles represent centrosomes. Red lines represent mitotic spindle microtubules. Blue lines represent chromosomes.
(B) Wild-type progenitors give rise to cells of the ganglion cell layer (GCL), inner nuclear layer (INL), and outer nuclear layer (ONL) in a 3:5:2 ratio (left). mok'm cells placed in a wild-type environment give rise to cells of the same layers in a 5:3:2 ratio (right). The changes in retinal cell type production observed in the mokaoa retina coincide with altered Notch signaling activation. Decreased levels of dynactin result in alterations in INM that affect progenitor exposure to the Notch gradient.
Figure 1. Interkinetic Nuclear Migration and Notch Influence Neurogenesis
(A) Progenitors coordinate interkinetic nuclear migration (INM) with passage through specific phases of the cell cycle. From left: Cells enter the cell cycle on the apical side of the retina. Cell nuclei move toward the basal side of the retinal neuroepithelium as they pass through G1. Cells enter S phase at the end of this basal migration, and nuclei move back toward the apical side during G2. Cells enter mitosis (M) on the apical side. Notch expression and Notch signaling activity increase nearer the apical side of the neuroepithelium. Delta ligands of the Notch receptor are expressed in a gradient with the opposite orientation. Yellow circles represent centrosomes. Red lines represent mitotic spindle microtubules. Blue lines represent chromosomes.
(B) Wild-type progenitors give rise to cells of the ganglion cell layer (GCL), inner nuclear layer (INL), and outer nuclear layer (ONL) in a 3:5:2 ratio (left). mok'm cells placed in a wild-type environment give rise to cells of the same layers in a 5:3:2 ratio (right). The changes in retinal cell type production observed in the mokaoa retina coincide with altered Notch signaling activation. Decreased levels of dynactin result in alterations in INM that affect progenitor exposure to the Notch gradient.