Как упоминалось выше, клетки развиваю9щегося внутреннего уха подвергаются ряду решений по спецификации клеточных судеб, чтобы создать все разнообразные типы клеток из одного отического эпителия, а типы клеток д. возникать в правильном пространственном положении по отношению др. к др. Можно предположить, что это происходит сходным образом с соседним задним мозгом, где формирование компартментов и установление позиционных качественных особенностей управляет спецификацией клеточных судеб (Schneider-Maunoury et al., 1998; and see below). Базирующаяся на компартментах модель в самом деле была предложена для спецификации клеток во внутреннем ухе (Brigande et al., 2000a; Brigande et al., 2000b). Однако, как устанавливаются оси отоциста и откуда исходят позиционные сигналы?
Молекулярные асимметрии предшествуют морфологическим асимметриям; на ст. отического пузырька, несколько доменов генной экспрессии компартментализуют отоцист вдоль его трех осей. Гены, которые экспрессируются внутри раннего отоциста, как полагают специфицируют будущие регионы уха (rev. Fekete and Wu, 2002) и обычно кодируют транскрипционные факторы. В отношении некоторых из этих генов предприняты функциональные исследования, которые позволили
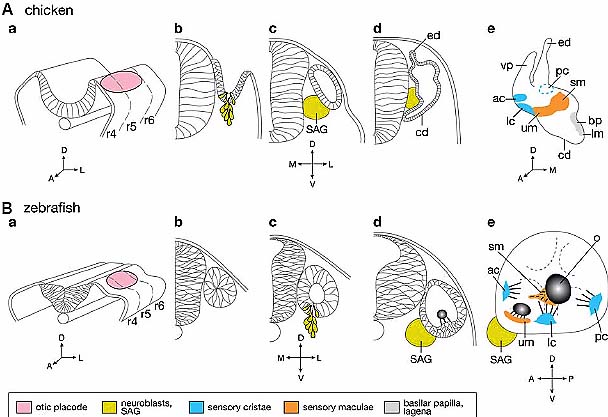 Fig. 2. Early development of the inner ear.Schematic drawings of the development of the inner ear in chicken (A) and zebrafish (B). The
development of the mouse inner ear is similar to that of chicken. (a) 3D representations of a transverse segment of the head region. (b-d) Transverse sections at otic level. (e) Diagrammatic representations of the chick inner ear at E5 and of the zebrafish larval ear. The otic placode is pink, the neuroblasts and SAG are yellow, the sensory cristae are blue, the sensory maculae are orange and the basilar papilla and lagena are grey. Abbreviations: ac, anterior crista; bp, basilar papilla; cd, cochlear duct; ed, endolymphatic duct; lc, lateral crista; lm, lagenar macula; o, otolith; pc, posterior crista; r, rhombomere; SAG, statoacoustic ganglion; sm, saccular macula; um, utricular macula; vp, vertical pouch (semicircular canal primordium). The dotted lines in (Be) represent the epithelial protrusions that will form the semicircular canals; Stages in (A) are: 10 s (a), 19 s (b), 30 s (c), E3.5 (d) and E5 (e).
Stages in (B) are: 10s (14 hpf) (a); 14 s (16 hpf) (b); 26s (22 hpf) (c); 30 hpf in (d), 120 hpf in (e). hpf means hours post-fertilization at 28°C. The embryonic axes are indicated underneath each drawing. Axes in A and B are the same.
Fig. 2. Early development of the inner ear.Schematic drawings of the development of the inner ear in chicken (A) and zebrafish (B). The
development of the mouse inner ear is similar to that of chicken. (a) 3D representations of a transverse segment of the head region. (b-d) Transverse sections at otic level. (e) Diagrammatic representations of the chick inner ear at E5 and of the zebrafish larval ear. The otic placode is pink, the neuroblasts and SAG are yellow, the sensory cristae are blue, the sensory maculae are orange and the basilar papilla and lagena are grey. Abbreviations: ac, anterior crista; bp, basilar papilla; cd, cochlear duct; ed, endolymphatic duct; lc, lateral crista; lm, lagenar macula; o, otolith; pc, posterior crista; r, rhombomere; SAG, statoacoustic ganglion; sm, saccular macula; um, utricular macula; vp, vertical pouch (semicircular canal primordium). The dotted lines in (Be) represent the epithelial protrusions that will form the semicircular canals; Stages in (A) are: 10 s (a), 19 s (b), 30 s (c), E3.5 (d) and E5 (e).
Stages in (B) are: 10s (14 hpf) (a); 14 s (16 hpf) (b); 26s (22 hpf) (c); 30 hpf in (d), 120 hpf in (e). hpf means hours post-fertilization at 28°C. The embryonic axes are indicated underneath each drawing. Axes in A and B are the same.
скоррелировать домены экспрессии ранних генов с функциями этих генов в формировании отического паттерна, с клеточными судьбами и/или жизнеспособностью и пролиферацией клеток.
У мышей и кур молекулярная асимметрия вдоль DV оси наблюдается рано (Figure 3Aa). Вентральные клетки отического пузырька маркированы экспрессией Otx1, Otx2 и Pax2, тогда как дорсальные клетки экспрессируют
Hmx2, Hmx3 (первоначально названы Nkx5.1),
Dlx5 и Gbx2 (Lin et al., 2005; rev. Brigande et al., 2000). Инактивация этих генов у мышей подтверждает, что они участвуют в установлении дорсальных (вестибулярных) и вентральных (cochlea) компонентов в основном благодаря контролю жизнеспособности и пролиферации клеток во время морфогенеза уха. Напр., мутантны
Pax2 обнаруживают агенез улитки и спирального (auditory) ганглия (Torres et al., 1996) благодаря редукции клеточной пролиферации (Burton et al., 2004). Потеря Otx1 и Otx2 также затрагивает улитку, а также развитие и финальное положение некоторых сенсорных органов во внутреннем ухе мышей (Morsli et al., 1999). Напротив, дорсально экспрессируемые гены
Dlx5, Hmx2 и Hmx3 являются важными для вестибулярного морфогенеза (Wang et al., 1998; Wang et al., 2001; Merlo et al., 2002). Gbx2 обладает клеточно-автономным эффектом на развитие эндолимфатического протока и вестибулярные структуры (Lin et al., 2005).
У рыбок данио молекулярная асимметрия вдоль трех осей очевидна перед 20 hpf (Figure 3B). Ген
nkx5.1/hmx3, первый асимметрично экспрессирующийся ген, индуцируется в большой передней области плакоды и пузырька со ст. 14 ss (16 hpf) и далее (Adamska et al., 2000). Позднее некоторые маркеры специфически экспрессируются в преденей (pax5, fgf8), задней (follistatin, bmp7), медиальной (pax2a), дорсальной (dacha и dlx3b) и вентральной (otx1, eya1, six1) областях пузырька (Krauss et al., 1991; Akimenko et al., 1994; Bauer and Goetz, 1998; Pfeffer et al., 1998; Reifers et al., 1998; Sahly et al., 1999; Mowbray et al., 2001; Hammond et al., 2002; Bricaud and Collazo, 2006). Функция некоторых из этих генов была исследована с помощью инъекций morpholino и/или у мутантов. Интересно, что они не только участвуют в формировании паттерна уха, но также в регуляции пролиферации и апоптоза клеток. Потеря функции pax5 ведет к нарушению вестибулярной функции из-за гибели волосковых клеток в utricular macula (Kwak et al., 2006).
Анализ
dog-eared мутантов (
dog) показал, что
eya1 участвует в жизнеспособности сенсорных волосковых клеток, в частности в гребешке (cristae) (Kozlowski et al., 2005). Экспрессия six1 в вентральной части отического пузырька обладает противоположной ролью в клонах нейронов и волосковых клеток: она способствует формированию волосковых клеток за счет усиления клеточной пролиферации и ингибирует образование нейронов за счет индукции апоптоза (Bricaud and Collazo, 2006).
Неудивительно, что гены. участвующие в спецификации судеб клеток также экспрессируются в виде регион-специфических паттернов. У амниот спецификация некоторых клеток отоциста, таких как нейробласты на ст. отического бокала, вообще являются самыми ранними выборами клеточных судеб, которые происходят в ухе (Figure 3Ab) (Ma et al., 1998). У кур, Fgf10 предшествует экспрессии пронейральных генов
ngn1 и neuroD в нейрогенном домене, соответствующего вентральному антерио-медиальному квадранту отического зачатка. Экспрессия
Fgf10 в этом регионе необходима для образования нейронов (Alsina et al., 2004) хотя это не единственный игрок, т.к.
Fgf10 нулевые мыши обладают нормальным инициальным морфогенезом
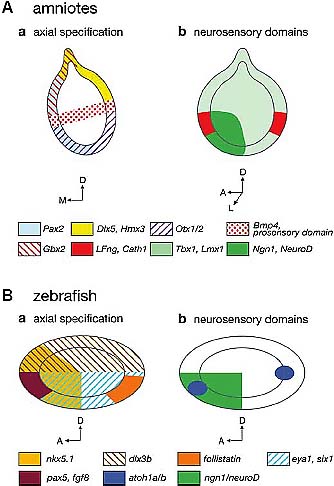 Fig. 3. Early regionalization and cell fate specification markers in the otocyst of amniotes and zebrafish. (A) Schematic drawings of amniotes otic vesicles. (Aa) represents a transverse section at E2-3 in chick and (Ab) shows a lateral view at E2-3. (B) Schematic lateral views of the zebrafish otic vesicle at 24 hpf. (Ba) represents gene expression domains regionalized along the AP and DV axes; (Bb) shows early markers of neurogenic and sensory specification. Gene expression domains that prefigure different regions of the inner ear, as well as cell fate markers are color-coded. Embryonic axes are indicated.
Fig. 3. Early regionalization and cell fate specification markers in the otocyst of amniotes and zebrafish. (A) Schematic drawings of amniotes otic vesicles. (Aa) represents a transverse section at E2-3 in chick and (Ab) shows a lateral view at E2-3. (B) Schematic lateral views of the zebrafish otic vesicle at 24 hpf. (Ba) represents gene expression domains regionalized along the AP and DV axes; (Bb) shows early markers of neurogenic and sensory specification. Gene expression domains that prefigure different regions of the inner ear, as well as cell fate markers are color-coded. Embryonic axes are indicated.
(Pauley et al., 2003). У мышей
Tbx1 экспрессируется в заднем регионе отического бокала и пузырька и необходим для вычленения нейрогенного домена (Raft et al., 2004; Xu et al., 2007). Маркеры судьбы сенсорных клеток у амниот появляются позднее, чем таковые нейральной судьбы, и маркируются с помощью экспрессии нейротрофинов BDNF и NT-3, Bmp4, LFng, Ser1 и Cath1 (Figure 3A, Figure 2Ae) (Wu et al., 1998; Cole et al., 2000; Fariсas et al., 2001; Pujades et al., 2006).
У рыбок данио сенсорный и нейрональный клоны возникают из вентральной части пузырька, а гены, участвующие в формировании сенсорных и нейральных предшественников, экспрессируются очень рано в вентральной области отоциста (Figure 3Bb). Пронейральные гены
ngn1 и neuroD, которые маркируют клетки нейральных предшественников и являются необходимыми для образования SAG, экспрессируются в антерио-вентральной области отоциста (Andermann et al., 2002), тогда как atoh1a/b, маркирующий клетки сенсорных предшественников, экспрессируется вскоре после стадии плакоды в группе клеток, одной впереди и одной позади, предопределяя utricular и saccular maculae, соотв. Ген
atoh1a/b необходим для формирования всех сенсорных участков, тем самым он играет классическую роль пронейральных генов в ухе (Millimaki et al., 2007). Cristae возникает позднее и маркируется экспрессией членов bmp пути (Mowbray et al., 2001).
Temporal programme of otic patterning
Можно предположить, что ранняя молекулярная асимметрия предопределяет позднейшее формирование паттерна уха, а в некоторых случаях это подтверждается анализом мутантных мышей. Однако, существование асимметрии (морфологической или молекулярной) на ранних стадиях не говорит о том, что судьбы клеток уже предопределены. Во-первых, дисперсия клеток и/или активная миграция могут предупреждать эту региональную спецификацию или могут менять позицию клеточных групп относительно оси. Во-вторых, предопределяющая региональная спецификация может зависеть от различных сигналов, действующих в течение крупного временного окна. Следовательно, возникают вопросы: 1) где и когда ограничиваются дисперсия и миграция в отоцисте и 2) когда оси во внутреннем ухе оказываются фиксированными во время развития?
Чтобы попытаться ответить на первый вопрос, были получены карты судеб отического примордия у разных видов и на разных стадиях (Brigande et al., 2000; Lang and Fekete, 2001; Kil and Collazo, 2001; Streit, 2002; Kozlowski et al., 1997; Satoh and Fekete, 2005; Abello et al., 2007; reviewed in Kil and Collazo, 2002). Однако, полученные результаты не дали четкой картины. Напр., у
Xenopus, карта судеб сенсорных органов оказывается сформированной на ст. отоциста, как показывает высокая степень дисперсии клеток вдоль AP и DV осей (Kil and Collazo, 2001), тогда как у кур карта судеб края отического бокала выявляет клональные границы, что ведет к модели компартментов для формирования паттерна внутреннего уха (Brigande et al., 2000b; Satoh and Fekete, 2005). Было предпринято множество экспериментов, чтобы определить, во-первых, на какой стадии дисперсия клеток ограничивается в отоцисте у разных видов, и во-вторых, если установление клональных границ является важным событием в регионализации внутреннего уха, то как это происходит во время сегментации соседнего заднего мозга.
Время спецификации отических осей было исследовано у эмбрионов кур с помощью аксиальных ротаций отического бокала и пузырька. эти исследования подтвердили, что DV ось устанавливается позднее, чем AP ось (Wu et al., 1998; Bok et al., 2005). Более того, AP ось, по-видимому, устанавливается раньше для сенсорных структур, чем для не-сенсорных структур. Хотя эти данные необходимо расширить, используя больше и/или более ранние маркеры разных ушных структур, они говорят в пользу многоступенчатости процесса закладки осей, действующего в течение относительно длительного временного промежутка и возможно с вовлечением множества различных сигналов.
Caudal hindbrain patterning
Во время нейруляции у позвоночных задний мозг временно подразделяется вдоль AP оси на серию из 7/8 сегментов, ромбомеров, которые являются компартментами ограничения клеточных клонов. Этот процесс сегментации закладывает стереотипический паттерн спецификации нейронов в стволе головного мозга. Он также участвует в миграции клеток нервного гребня в виде трех потоков в направлении фарингеальных дуг, влияя тем самым на черепно-лицевой морфогенез. Ряд регуляторных генов экспрессируется в специфических ромбомерах и многие из них участвуют в разных ступенях процесса сегментации (rev.
Schneider-Maunoury et al., 1998). Здесь мы рассмотрим молекулярные механизмы образования ромбомеров 4 - 6, области заднего мозга, непосредственно соседствующей с развивающимся отоцистом (Figure 4), с особым вниманием к генам, функциональные исследования которых указывают на роль заднего мозга в формировании паттерна внутреннего уха.
Формирование паттерна заднего мозга под действием двух основных сигнальных путей, FGF и ретиноидного путей. FGFs синтезируются в области границы между средним и задним мозгом, а также в разных ромбомерах и играют роль в спецификации соседних доменов. Retinoic acid (RA) синтезируется в передней сомитной мезодерме и играет существенную роль в закладке AP позиционной информации в заднем мозге (rev. Glover et al.,
2006). RA контролирует непосредственно и опосредованно экспрессию нескольких генов в заднем мозге, среди которых некоторые Hox гены,
vhnf1 и MafB. В частности, они непосредственно контролируют Hox гены групп паралогов 1 и 4 (Marshall et al., 1994; Gould et al., 1998). В последние 15 лет молекулярные механизмы формирования паттерна заднего мозга изучались очень активно на мышах посредством нокаутных мутантов и transgenesis. Эти исследования идентифицировали Hox гены в качестве основных активаторов в контроле AP характеристик в заднем мозге и фарингеальных дугах (rev. Schneider-Maunoury et al., 1998; Trainor and Krumlauf, 2001). 4 первые группы Hox паралогов (1-4) экспрессируются в заднем мозге с временным и пространственным паттерном, который зависит от их позиции в кластере. Один из Hox генов,
Hoxa1, играет раннюю и центральную роль в формировании каудальной части заднего мозга, что иллюстрируется строгой редукцией r4 и r5 у мутантов
Hoxa1 (Dolle et al., 1993; Helmbacher et al., 1998). Др. важным геном для формирования каудальной части заднего мозга является
MafB, который кодирует bZIP транскрипционный фактор и экспрессируется в проспективных r5 и r6. Фенотип потери функции
MafB впервые изучен на мутантных мышах
kreisler, названных в соответствии с их circling поведением. В заднем мозге мутантов
kreisler обнаруживается исчезновение r5 и неправильная спецификация r6 (McKay et al., 1994; Sadl et al., 2003).
kreisler не является нулевой мутацией MafB, а скорее нарушает регуляцию, в результате чего устраняется экспрессия
MafB в r5/r6 и активируется в r3 (Eichmann et al., 1997; Giudicelli et al., 2003). Недавно важность функции MafB в регуляции поддержания и экспансии r5 и спецификации r6 была подтверждена с использованием мутантных мышей (Sadl et al., 2003) и рыбок данио, у которых были получены некоторые мутантные аллели
valentino (val), гена
MafB рыбок данио (Moens et al., 1998; Prince et al., 1998). Среди др. регуляторных функций, MafB необходим для экспрессии в r5 гена
krox20, гена, необходимого для формирования и спецификации r3 и r5 (Schneider-Maunoury et al., 1993; Schneider-Maunoury et al., 1997; Voiculescu et al., 2001).
Недавние исследования идентифицировали на эмбрионах рыбок данио ранние события формирования паттерна каудальной части заднего мозга. В частности, они открыли важные функции транскрипционного фактора vhnf1 и передачи сигналов FGF для спецификации каудальной части заднего мозга.
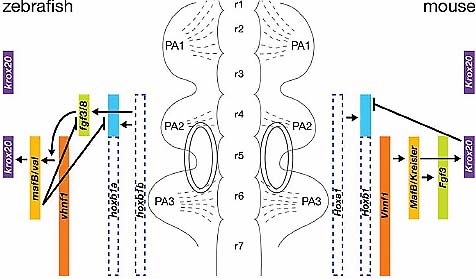 Fig. 4. Caudal hindbrain patterning. A schematic vertebrate hindbrain region is presented, with rhombomeres (r1-r7), the three first pharyngeal arches (PA1-3), the three streams of migrating neural crest cells (dotted lines) and the bilateral otic vesicles. Crest cells from r1-r2 migrate into PA1, crest cells from r4 migrate into PA2 and crest cells from r5 and r6 migrate into PA3. The expression patterns of regulatory genes are indicated and color-coded on the left for zebrafish and on the right for the mouse. The dotted lines for Hox genes indicate a transient expression, which is downregulated before the onset of morphologic segmentation: Hoxa1 (hoxb1b in zebrafish ) and its paralogue Hoxb1 (hoxb1a in zebrafish ) are activated at mid-gastrulation and present an anterior limit in the neural plate in the prospective hindbrain region, which later coincides with the r3/r4 boundary. Contrary to Hoxa1, Hoxb1 is maintained in r4 after the end of gastrulation and this expression in r4 requires Hoxa1 function. Regulatory interactions between the different genes are indicated. Arrows represent positive regulations and vertical bars represent negative regulations. Some of these regulatory interactions, but not all, have been shown to be direct. Note that some expression patterns (e.g. for Fgf genes) and regulatory interactions are different in these two species. Anterior is to the top.
Fig. 4. Caudal hindbrain patterning. A schematic vertebrate hindbrain region is presented, with rhombomeres (r1-r7), the three first pharyngeal arches (PA1-3), the three streams of migrating neural crest cells (dotted lines) and the bilateral otic vesicles. Crest cells from r1-r2 migrate into PA1, crest cells from r4 migrate into PA2 and crest cells from r5 and r6 migrate into PA3. The expression patterns of regulatory genes are indicated and color-coded on the left for zebrafish and on the right for the mouse. The dotted lines for Hox genes indicate a transient expression, which is downregulated before the onset of morphologic segmentation: Hoxa1 (hoxb1b in zebrafish ) and its paralogue Hoxb1 (hoxb1a in zebrafish ) are activated at mid-gastrulation and present an anterior limit in the neural plate in the prospective hindbrain region, which later coincides with the r3/r4 boundary. Contrary to Hoxa1, Hoxb1 is maintained in r4 after the end of gastrulation and this expression in r4 requires Hoxa1 function. Regulatory interactions between the different genes are indicated. Arrows represent positive regulations and vertical bars represent negative regulations. Some of these regulatory interactions, but not all, have been shown to be direct. Note that some expression patterns (e.g. for Fgf genes) and regulatory interactions are different in these two species. Anterior is to the top.
Ген
vhnf1 (Hnf1βl/Tcf2) кодирует гомеодоменовый транскрипционный фактор. В нервной пластинке
vhnf1 экспрессируется с конца гаструляции и далее с границей передней экспрессии на проспективной границе r4/r5. Исследования инсерционных мутаций
vhnf1 у рыбок данио показали участие этого фактора в формировании каудальной части заднего мозга (Sun and Hopkins, 2001). У
vhnf1 гомозиготных эмбрионов экспрессия
val в r5-r6 и экспрессия
krox20 в r5 сильно редуцированы или отсутствуют. Заметим, что r4 маркеры, такие как hoxb1a и fgf3 расширяют свою экспрессию каудально, как у
val мутантов. Следовательно, vhnf1 участвует в спецификации r5-r6 и репрессии качественных особенностей r4 (Wiellette and Sive, 2003; Hernandez et al., 2004).
Передача сигналов FGF существенна для формирования паттерна каудальной части заднего мозга. У рыбок данио два fgf гена, fgf3 и fgf8, экспрессируются в проспективном r4. Исследования с потерей функции у этих видов показали, что fgf3 и fgf8 необходимы для активации экспрессии val в r5-r6 и экспрессии krox20 в r5 (Maves et al., 2002; Walshe et al., 2002). Более того, сигналы FGF из r4 , как было показано, действуют синергично с vhnf1 для этой активации (Wiellette and Sive, 2003; Hernandez et al., 2004). Т.о., с помощью FGF сигналов, r4 формирует сигнальный центр, участвующий в формировании паттерна каудальной части заднего мозга, в частности в активации val и krox20. Хотя паттерны экспрессии генов Fgf в заднем мозге амниот отличаются от такового у рыбок данио (see below), передача сигналов FGF у эмбрионов кур также участвует в формировании паттерна заднего мозга, в особенности в регуляции экспрессии MafB и Krox20 (Marin and Charnay, 2000; Aragon et al., 2005).
Функциональные данные, полученные на разных позвоночных могут быть скомбинированы в регуляторную иерархию, участвующую в формировании каудальной части заднего мозга (Figure 4). Однако, следует упомянуть, что некоторые данные были получены только на одном из видов позвоночных. Более того, в некоторых случаях были обнаружены различия в паттернах генной экспрессии и/или в функциональных данных у амниот и рыбок данио. Одно важное различие заключается в экспрессии fgf3 и его регуляции с помощью генов сегментации. У мышей Fgf3 экспрессируется на ранней сомитной стадии в r4 и в поверхностной эктодерме, включая проспективную область отических плакод. Позднее домен его высокого уровня экспрессии в заднем мозге ограничивается r5 и r6 (Mahmood et al., 1996). MafB необходим для экспрессии Fgf3 в r5-r6 домене (McKay et al., 1996). Напротив у рыб fgf3 экспрессируется в r4 (Maves et al., 2002; Walshe et al., 2002) и его экспрессия у val и vhnf1 мутантов распространяется каудально (Kwak et al., 2002; Wiellette and Sive, 2003; Hernandez et al., 2004; Lecaudey et al., 2007). Т.о., каудальная часть заднего мозга рыбок данио у мутантов MafB/val экспрессирует эктопически fgf3, в то время как у MafB/kreisler мутантных мышей каудальная часть заднего мозга обнаруживает пониженные уровни Fgf3 (McKay et al., 1996).
В дополнение к формированию AP паттерна, задний мозг, кроме того, регионализуется вдоль своей DV оси. Механизмы формирования DV паттерна нервной трубки активно исследовались на спинном мозге (Lee and Jessell, 1999; Jessell, 2000) и сходные механизмы, как полагают, действуют в заднем мозге. В частности, передача сигналов Hh из хорды и донной пластинки и передача сигналов Wnt и BMP из эктодермы, дорсальной части нервной трубки и верхней (roof) пластинки, контролируют гнездовую экспрессию серии транскрипционных факторов вдоль DV оси в спинном мозге. Эти транскрипционные факторы посредством сложных регуляторных взаимодействий устанавливают самостоятельные домены предшественников нейронов. Недавние данные показали, что в заднем мозге происходит интеграция AP и DV молекулярных сигналов, создается двумерная сетка координат для спецификации предшественников двигательных нейронов (Samad et al., 2004).
Hindbrain segmentation and otic development: insights
from functional data
Тканевое окружение внутреннего уха, такое как задний мозг, мезодерма и эктодерма, участвуют в обеспечении сигналами, необходимыми для развития внутреннего уха (Giraldez, 1998; Fekete, 1999; Kiernan et al., 2002). Важность функций заднего мозга продемонстрирована при анализе мутантов регуляторных генов, экспрессирующихся в этой ткани - но не в отической ткани - и генов, участвующих в сегментации каудальной части заднего мозга, таких как MafB, vHnf1 и Hoxa1. Вклад этих функциональных исследований суммирован ниже (Figure 5). Во всех случаях дефекты внутреннего уха были связаны с дефектами ромбомеров 4 - 6, с областью заднего мозга, примыкающей к развивающемуся отоцисту (Figure 2). Несмотря на имеющиеся некоторые расхождения между результатами, полученными у разных видов, все данные подчеркивают существенную роль передачи сигналов от заднего мозга и в частности передача сигналов FGF, для отической регионализации.
У мышей важная информация о сигналах из заднего мозга получена при анализе мутантов kreisler, у которых экспрессия гена MafB в r5 и r6 исчезает. Мыши kreisler глухи, характеризуются circling поведением и обнаруживают множество дефектов в отическом развитии. Т.к. MafB не экспрессируется в отоцисте, то было предположено, что дефицит передачи сигналов FGF3 является главной причиной отических дефектов, обнаруживаемых у kreisler (McKay et al., 1996). У таких мышей дорсо-медиальные маркеры, такие как Gbx2 и Wnt2b теряются, в то время как вентральный Otx2 домен расширяется. Позднее улитка расширяется, а эндолимфатический проток и мешок отсутствуют, подтверждая роль заднего мозга в спецификации дорсо-медиальных структур внутреннего уха (Choo et al., 2006). Роль FGF3 в качестве сигналов из заднего мозга для формирования паттерна уха согласуется с анализом мутантов Hoxa1, у которые проявление дефектов паттерна уха коррелирует с потерей экспрессии Fgf3 в заднем мозге (Pasqualetti et al., 2001).
В противоположность ситуации у мышей мутация MafB/val у рыбок данио вызывает в основном дефекты формирования AP паттерна (Kwak et al.,
2002). Домены др. маркеров, таких как hmx3, расширяются в каудальном направлении, в то время как каудальные маркеры редуцируются или отсутствуют. Мутанты val также характеризуются избытком воло, эктопически продуцируемых между передней и задней maculae (Kwak et al., 2002). Неожиданно, хотя мутация val обнаруживает четкое влияние на формирование AP паттерна уха, это не ведет к увеличению размеров SAG, указывая тем самым, что образование SAG находится под тонким, независимым от заднего мозга контролем. Как упоминалось выше мутация val приводит к экспансии в каудальном направлении экспрессии fgf3 в заднем мозге. Снижение уровней fgf3 РНК у val с использованием morpholinos устраняет некоторые отические дефекты, строго указывая на то, что у рыбок данио как и у мышей FGF3 является главным сигналом, стоящим ниже MafB, участвующим в формировании паттерна уха.
Анализ мутантов
vhnf1 рыбок данио делает картину ещё более сложной. Как было показано раньше vhnf1 позитивно контролирует экспрессию
val в заднем мозге. Как и ожидалось фенотипы нарушения формирования AP паттерна наблюдались во внутреннем ухе мутантов
vhnf1, которые обнаруживали экспансию или удвоение передних отических маркеров, таких как hmx3, fgf8 и pax5. Однако, мутанты
vhnf1 обнаруживали также дефекты формирования DV паттерна, с экспансией вентральных маркеров за счет
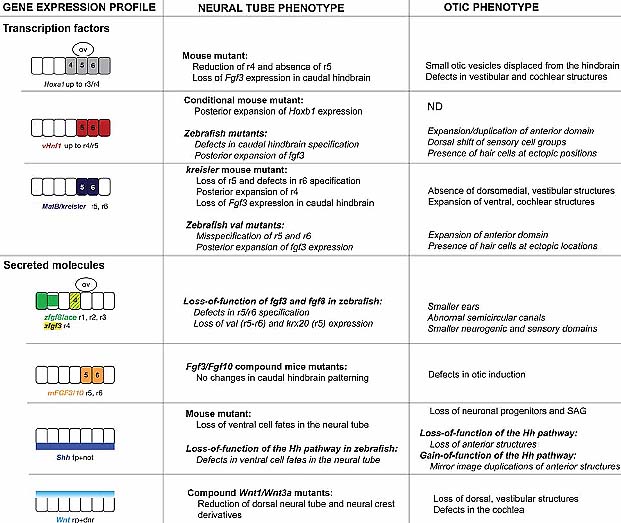 Fig. 5. Neural tube mutations affecting otic development. The first column shows gene expression profiles in the neural tube of mice and zebrafish embryos. The second column indicates the hindbrain phenotype observed in the corresponding mutants. The third column summarizes the otic phenotypes described for those mutations. Genes are organized depending if they code for transcription factors or secreted molecules. Results obtained in zebrafish are indicated in italics. All the summarized data correspond to references quoted all along the review except for Sirbu et al., 2005. In schemes in the first column, anterior is to the left.
Fig. 5. Neural tube mutations affecting otic development. The first column shows gene expression profiles in the neural tube of mice and zebrafish embryos. The second column indicates the hindbrain phenotype observed in the corresponding mutants. The third column summarizes the otic phenotypes described for those mutations. Genes are organized depending if they code for transcription factors or secreted molecules. Results obtained in zebrafish are indicated in italics. All the summarized data correspond to references quoted all along the review except for Sirbu et al., 2005. In schemes in the first column, anterior is to the left.
дорсальных маркеров и дорсального сдвига промежуточных маркеров, таких как atoh1a, которые маркируют будущую maculae. Наиболее вероятно, что следствием этих дефектов формирования паттерна является образование волосковых клеток в эктопических позициях в центре пузырька (Lecaudey et
al., 2007). После этого исследования мы повторно исследовали формирование DV паттерна у мутантов
val и выявили дефекты, сходные с теми. что были найдены у мутантов
vhnf1 (Lecaudey et al., 2007; S. Schneider-Maunoury and C. Pujades, unpublished results).
Итак, анализ мутантов для разных генов сегментации заднего мозга у рыбок данио и мышей подчеркивает роль передачи сигналов из заднего мозга, находящихся ниже этих генов. Однако, существуют четкие различия между двумя видами. Главные дефекты, наблюдаемые у мышей, располагаются вдоль DV оси, тогда как у рыбок данио дефекты обнаруживаются преимущественно вдоль AP оси. Однако, эти различия могут быть только кажущимися, т.к. более тщательная проверка этих мутантов позволяет выявить дефекты формирования DV паттерна у мутантов
vhnf1 и val рыбок данио.
The hindbrain as a source of instructing molecules for
otic regionalization
Три основных сигнальных пути, Hedgehog (Hh), Wnt и FGF пути, участвуют в формировании отического паттерна из соседнего заднего мозга. Hh гены экспрессируются в донной пластинке и подлежащей хорде. Wnt гены, в особенности Wnt1 и Wnt3a, присутствуют в дорсальной части нервной трубки у всех позвоночных. Как упоминалось выше, некоторые Fgf гены экспрессируются в заднем мозге в виде видо-специфических паттернов.
Функция FGFs в отическом развитии активно исследовалась. Как у амниот, так и у рыб потеря функции Fgf генов ведет к очень маленьким и уродливым отическим пузырькам, это их демонстрирует роль fв отической индукции (Represa et al., 1991; Vendrell et al., 2000; Adamska et al., 2000; Phillips et al., 2001; Leger and Brand, 2002; Maroon et al., 2002; Alvarez et al., 2003; Wright and Mansour, 2003; Liu et al., 2003; Hans et al., 2004; Phillips et al., 2004; Millimaki et al., 2007). Эта функция в основном приписывается сигналам FGF из заднего мозга у рыбок данио, тогда как у амниот др. окружающие ткани, такие как мезенхима и энтодерма, также являются источниками FGFs (Ladher et al., 2006). Гены мишени для FGF экспрессируются в отическом эпителии, указывая на разный эффект этого сигнального пути (Chambers et al., 2000; Raible and Brand, 2001; F. Aragon and C. Pujades, unpublished results). Перекрывание между разными FGFs и их роль в отической индукции затруднена для анализа из-за их роли в регионализации отоциста. Т.о., лучшим указанием на функцию FGF в формировании отического паттерна является анализ мутантов по генам сегментации заднего мозга, таких как MafB, Hoxa1 и vHnf1. Как упоминалось выше, у этих мутантов имеется строгая корреляция между потерей функции или избыточностью функции FGF в заднем мозге и дефектами формирования отического паттерна. Более того, у мутантов val часть дефектов, по-видимому, устраняется за счет истощения функции fgf3.
Передача сигналов Shh из хорды и донной пластинки является важной для формирования паттерна уха у мышей (Riccomagno et al., 2002). Исследования мутантов Shh показали, что что этот сигнальный путь необходим для образования улитки, структуры, возникающей из вентральной части отоциста. У мутантных Shh эмбрионов вентральная экспрессия Otx1/2 редуцируется, а дорсальная экспрессия Dlx5 расширяется вентрально. Медиальная экспрессия Pax2 также теряется. Т.к. сенсорная спецификация не затрагивается, то экспрессия пронейральных генов строго снижается и отсутствует SAG. Противоположный фенотип наблюдается после эктопической экспрессии Shh в отоцисте у трансгенных мышей: дорсальные вестибулярные структуры теряются, а вентральные, аудиторные клеточные судьбы увеличивают свой ареал.
Соответственно, Pax2 расширяется латерально, а дорсальная экспрессия Dlx5 и Hmx3 теряется. Интересно, что нейрогенез как бы усиливается и SAG становится крупнее. Эти результаты привели авт. к предположению, что Shh детерминирует вентральные судьбы, но дифференциально вдоль AP оси: впереди он активирует Ngn1 и NeuroD, способствуя нейрогенезу, тогда как позади он активирует Pax2 и Otx1/2 и детерминирует cochlear судьбу (Riccomagno et al., 2002). Мишени для передачи сигналов Hh, Gli1 и Ptc1 экспрессируются широко в отическом эпителии, подтверждая, что передача сигналов Hh может действовать непосредственно. Недавно подтверждено, что разные уровни активности Shh обеспечивают образование структур внутреннего уха, при этом Gli3 репрессор необходим дорсально для образования преддверия, а Gli активаторы действуют вентрально, чтобы сформировать cochlear проток (Bok et al., 2007).
Неожиданно манипуляции с передачей сигналов Hh у рыбок данио, не вызывали дефектов DV или ML, но вызывали дефекты формирования AP паттерна (Hammond et al., 2003). Две сильные мутации пути Hh обнаруживали удивительные частичные зеркальные удвоения некоторых передних отических маркеров и передних сенсорных структур, таких как utricular macula,
одновременно с потерей задних отических доменов. SAG, однако, не удваивался. Передачу сигналов Hh из донной пластинки и хорды необходимо устранить, чтобы получить такой фенотип. Противоположный фенотип, а именно, экспансия задних структур за счет передних, наблюдается, когда путь Hh постоянно активирован за счет избыточной экспрессии
Shh или за счет инъекций доминантно негативной формы PKA. Исходя из паттернов экспрессии
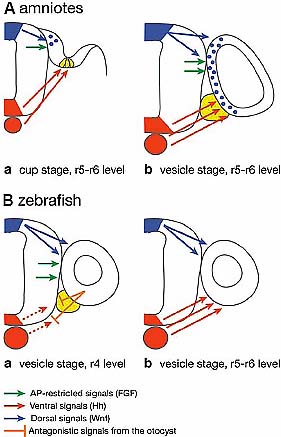 Fig. 6. Hindbrain signals involved in inner ear patterning in zebrafish and amniotes: current models. (A) In amniotes, the otic cup is positioned close to the dorsal half of the neural tube. At early stages of otic
development, only the dorsomedial half of the cup makes intimate contact with the hindbrain (Aa). As invagination proceeds, medial otic cells that at otic cup stage were in contact with the dorsal part of the hindbrain and were Wnt-responsive cells (blue dots in Aa), are now located in more ventral position (blue dots in Ab) and receive signals from the ventral aspect of the neural tube. Hh signals from the notochord and floorplate (red arrows) are received in the ventral part of the otic cup, directly, or indirectly through a relay mechanism involving the mesenchyme and are essential for cochlear specification and SAG formation. Putative FGF signals (green arrows) downstream of r5-r6 segmentation genes are received in dorsomedial otic tissue and are essential for vestibular fate. (B) In zebrafish, the otic vesicle receives dorsalising signals from the neural tube (presumably Wnt signals, blue arrows). Hh signals from the notochord and floorplate are received in the posteroventral otic vesicle (facing r5-r6) (Bb), where they specify posterior fate. In the anterior otocyst (facing r4) (Ba) FGF signaling is active and specifies anterior fate. Possibly as a consequence, Shh signal is antagonized (orange).
Fig. 6. Hindbrain signals involved in inner ear patterning in zebrafish and amniotes: current models. (A) In amniotes, the otic cup is positioned close to the dorsal half of the neural tube. At early stages of otic
development, only the dorsomedial half of the cup makes intimate contact with the hindbrain (Aa). As invagination proceeds, medial otic cells that at otic cup stage were in contact with the dorsal part of the hindbrain and were Wnt-responsive cells (blue dots in Aa), are now located in more ventral position (blue dots in Ab) and receive signals from the ventral aspect of the neural tube. Hh signals from the notochord and floorplate (red arrows) are received in the ventral part of the otic cup, directly, or indirectly through a relay mechanism involving the mesenchyme and are essential for cochlear specification and SAG formation. Putative FGF signals (green arrows) downstream of r5-r6 segmentation genes are received in dorsomedial otic tissue and are essential for vestibular fate. (B) In zebrafish, the otic vesicle receives dorsalising signals from the neural tube (presumably Wnt signals, blue arrows). Hh signals from the notochord and floorplate are received in the posteroventral otic vesicle (facing r5-r6) (Bb), where they specify posterior fate. In the anterior otocyst (facing r4) (Ba) FGF signaling is active and specifies anterior fate. Possibly as a consequence, Shh signal is antagonized (orange).
Hh генов мишеней в этом экспериментальном контексте, был предположен прямой эффект передачи сигналов Hh на задние отические клетки (Hammond et al., 2003).
Роль канонической передачи сигналов Wnt из дорсальной части нервной трубки, изучалась на мышах (Riccomagno et al., 2005). Неожиданно, несмотря на то, что Wnt-чувствительные клетки распределены вдоль дорсо-медального отического бокала и позднее ограничиваются дорсальным аспектом отического пузырька, как вестибулярные, так и кохлеарные структуры редуцированы у двойных мутантов
Wnt1/Wnt3a (Riccomagno et al., 2005). Чтобы объяснить эти конфликтующие наблюдения, авт. предприняли клональный анализ, используя индуцибельные генетические маркеры Wnt-чувствительных клеток. Они установили, что предшественники улитки воспринимают Wnt сигналы, демонстрируя, что эти вентральные клетки происходят из дорсо-медиальной части отического бокала. Это исследование подчеркивает вклад миграции клеток и формогенетических движений в процессы формирования отического паттерна: группы отических клеток, первоначально локализованные вблизи дорсальной части нервной трубки в конце концов оказываются вентральными после отической инвагинации. Исследования с избыточной функцией подтвердили роль канонического Wnt пути в формировании преддверия и показали взаимную репрессию между Wnt и Shh путями в формировании DV паттерна уха. Однако сигналы Wnt не могут быть единственными участвующими сигналами, т.к. вентральные отические детерминанты соотв. образом экспрессируются у двойных мутантов по
Wnt1 и Wnt3a (Riccomagno et al., 2005). Др. дорсальные секретируемые сигналы, такие как BMPs, д. играть роль в этом процессе.
Otic patterning in amniotes and zebrafish: similarity or
specificity?
Современные данные предоставляют контрастирующие доказательства роли сигналов из заднего мозга в спецификации отических осей у разных позвоночных. Это обусловлено неполными экспериментальными данными или действительными различиями в механизмах формирования паттерна уха? Имеются аргументы в пользу второй гипотезы: напр., основная структура специфицируемая с помощью передачи сигналов Shh у мышей, это улитка, этому отсутствует какой-либо аналог у рыбок данио. Можно предположить, что структуры, специфицируемые с помощью передачи сигналов Hh у рыбок данио и амниот функционально сходны: задняя или (saccular) macula у рыбок и вентральная часть улитки у амниот, обе участвуют в восприятии звуков. Сходным образом дорсальные структуры у амниот и передняя (utricular) macula у рыбок данио обладают vestibular функцией. Следовательно, сходные паттерн-формирующие механизмы д. использоваться у разных видов позвоночных, чтобы специфицировать сходные функциональные части внутреннего уха. Figure 6 суммирует сигналы, предположительно участвующие в формировании паттерна отоциста у рыб и амниот и разные структуры, специфицируемые этими сигналами. У амниот имеющиеся данные показывают, что задний мозг участвует в формировании DV паттерна уха. У кур устранение вентральной пластинки и хорды ведет к потере вентральных структур, тогда как устранение нервной трубки ведет к потере вестибулярных структур (Bok et al., 2005). С др. стороны, ротация области r4-r7 заднего мозга вдоль AP оси на ст., когда AP ориентация отоциста всё ещё пластична, не влияет на установление AP оси уха. Это строго указывает на то, что у этого вида качественные особенности ромбомеров несущественны для формирования AP паттерна уха. Однако, интересно отметить, что эта ротация не изменяет позиции в заднем мозге источника FGF3 относительно отического пузырька. Всё это указывает на то, что задний мозг (и хорда) передают сигналы, участвующие в основном в формировании DV паттерна внутреннего уха, что согласуется с функциональным анализом у мышей. Они также подтверждают гипотезу, что пространственное распределение сигнальных молекул вдоль AP оси заднего мозга не существенно для собственно формирования паттерна. Это говорит о том, что если передача сигналов FGF из r5-r6 играет роль в формировании паттерна уха, то важен её глобальный уровень скорее, чем её распределение. Соответственно, уровень экспрессии гена Fgf3 в каудальной части заднего мозга находится под контролем генов сегментации, таких как MafB и Hoxa1 (Figure 4). Нельзя целиком исключить, что сигналы из заднего мозга влияют также на раннее подразделение на нейрогенный (anterior) в противовес не нейрогенному (posterior) домену. В самом деле, (C. Vбzquez-Echeverrнa and C. Pujades, in prepa-
ration) показали, что мутанты kreisler характеризуются экспансией отической нейрогенной области в результате изменений в ранней экспрессии отических паттерн-формирующих генов, таких как LFng и Lmx1. Т.о., помимо описанных дефектов формирования DV и ML паттернов, мутанты kreisler обладают ранними дефектами формирования AP паттерна, затрагивающими главным образом решение судеб в пользу нейрогенной или не-нейрогенной судьбы, или др. аспекты формирования AP паттерна уха, которые невозможно тщательно проанализировать.
Ситуация совершенно иная у рыбок данио: изучение
vhnf1 и val мутантов четко показывает участие сигналов заднего мозга в формировании AP паттерна. FGF, как предполагается, является главным сигналом. участвующим в формировании отического AP паттерна, расположен иерархически ниже этих генов сегментации заднего мозга, но сигналы Hh также играют роль в этом процессе. Интригующий вопрос, как вентральный сигнал, такой как Hh, который обнаруживает равномерное распределение вдоль AP оси может специфицировать формирование AP паттерна отического пузырька. Можно предложить несколько гипотез. Во-первых, задняя часть уха может получать больше сигналов, чем его передняя часть. Это может достигаться за счет наклона ранних осей отического пузырька относительно нервной трубки. Во-вторых, Shh сигнал может взаимодействовать с AP ограничивающими сигналами. Сигналы FGFs из заднего мозга являются прекрасными кандидатами на роль локального ограничения дифференциальных реакций на передачу сигналов Hh из вентральных отических клеток. Контроль продукции FGF и Hh независимы: продукция FGF сигнала не нарушается у Hh мутантов (Hammond et al., 2003), а экспрессия hh у сегментационных для заднего мозга мутантов не затрагивается (our unpublished data). Следовательно, взаимодействие может действовать на уровне воспринимающих клеток уха (Riccomagno et al., 2002). Недавно установлено, сто формирование DV паттерна затрагивается также у
vhnf1 и val мутантов. Однако, сигнальные пути, участвующие в формировании этого DV паттерна, еще не идентифицированы. Экспрессия
Wnt1 и Wnt3a снижена в r5 и r6 у мутантов
vhnf1, это указывает на то, что сигналы Wnt могут участвовать в некоторых аспектах формирования DV паттерна уха у рыбок данио (Lecaudey et al., 2007).
Future directions
In this review we have discussed the current view on the role
of hindbrain signals in axial specification of the inner ear. Essen-
tial information has been brought by the analysis of mutants of
hindbrain segmentation genes, as well as by the functional
analysis of some signaling pathways. As we mentioned, the
available information is still fragmentary. In particular, more
complete fate maps and lineage studies must be performed in
different vertebrate species and at different stages of develop-
ment. It would also be helpful to know with better precision when
the different structures, sensory and non-sensory, of the inner ear
are specified in each species.
Hindbrain signals may have additional functions in otic pattern-
ing. For instance, it is intriguing that both in zebrafish and
amniotes, sensory markers appear at anterior and posterior
extremities of the otic vesicle. In zebrafish val and vhnf1 mutants,
where r5 is absent, tether cells of the maculae are specified at
ectopic positions along the otic AP axis, correlating with the extent
of krox20 reduction (Lecaudey et al., 2007). These data suggest
that a signal from r5 restricts sensory cell specification. To test this
hypothesis, it would be useful to analyze the inner ear of mice and
fish with a loss of function of krox20, a gene involved in the
formation of r3 and r5.
To gain a better understanding of the issue, the involvement of
different signaling pathways has to be studied in greater detail. In
that respect, the potential function of BMP signals is an interesting
question to address. Indeed, BMP pathway genes are expressed
in the dorsal neural tube and surrounding dorsal ectoderm and
BMP antagonists display a rhombomere-specific pattern
(Seitanidou et al., 1997).
Finally, signals from surrounding tissues may be involved in
other aspects of ear patterning. As an example, none of the
hindbrain mutants examined so far display changes in AP position
of the SAG, suggesting that it is under the tight control of
hindbrain-independent signals. Another signaling pathway in-
volved in ear patterning is the retinoid pathway. Both in mice and
humans, variations in retinoid levels have profound effects on ear
formation. Furthermore, the defects seen in ear formation in
mouse Hoxa1 mutants are rescued by treatment with non terato-
genic doses of RA (Pasqualetti et al., 2001). At placode and early
otocyst stages, RA is synthesized in the somitic mesoderm and
may act, not only by controlling segmental gene expression in the
hindbrain and, in consequence, FGF3 signaling, but also directly
on the otocyst (for review Romand, 2003; Romand et al., 2006).
The identification of other signals and their integration with
hindbrain-derived signaling pathways will lead to a more com-
plete picture of the mechanisms of inner ear patterning.
Сайт создан в системе
uCoz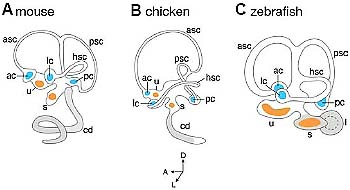 Fig. 1. Structure of the adult inner ear. Morphology of the membranous labyrinth in three vertebrate species: mouse (A), chicken (B) and
zebrafish (C). The vestibular (dorsal) part of the membranous labyrinth contains five sensory organs: the three cristae (blue) located at the basis of the three semicircular canals and the utricular and saccular maculae (orange), surrounded by otoliths. The ventral, auditory part of the inner ear (grey) is highly variable in morphology and complexity in different vertebrates. In the mouse, the cochlear duct, a coiled structure, contains a finely patterned sensory organ, the organ of Corti. In chicken, the auditory organ, the basilar papilla, is also contained in the cochlear duct. In zebrafish, there is no ventral cochlear duct and the auditory function is carried by the saccular and lagenar maculae. The endolymphatic sac and duct (not represented) produce the endolymph, which circulates in the membranous labyrinth. ac: anterior crista; asc: anterior semicircular canal; cd: cochlear duct; hsc: horizontal semicircular canal; l: lagena; lc: lateral crista; pc: posterior crista; psc: posterior semicircular canal; s: saccule; u: utricle. The embryonic axes are indicated at the bottom.
Fig. 1. Structure of the adult inner ear. Morphology of the membranous labyrinth in three vertebrate species: mouse (A), chicken (B) and
zebrafish (C). The vestibular (dorsal) part of the membranous labyrinth contains five sensory organs: the three cristae (blue) located at the basis of the three semicircular canals and the utricular and saccular maculae (orange), surrounded by otoliths. The ventral, auditory part of the inner ear (grey) is highly variable in morphology and complexity in different vertebrates. In the mouse, the cochlear duct, a coiled structure, contains a finely patterned sensory organ, the organ of Corti. In chicken, the auditory organ, the basilar papilla, is also contained in the cochlear duct. In zebrafish, there is no ventral cochlear duct and the auditory function is carried by the saccular and lagenar maculae. The endolymphatic sac and duct (not represented) produce the endolymph, which circulates in the membranous labyrinth. ac: anterior crista; asc: anterior semicircular canal; cd: cochlear duct; hsc: horizontal semicircular canal; l: lagena; lc: lateral crista; pc: posterior crista; psc: posterior semicircular canal; s: saccule; u: utricle. The embryonic axes are indicated at the bottom. 
 Fig. 3. Early regionalization and cell fate specification markers in the otocyst of amniotes and zebrafish. (A) Schematic drawings of amniotes otic vesicles. (Aa) represents a transverse section at E2-3 in chick and (Ab) shows a lateral view at E2-3. (B) Schematic lateral views of the zebrafish otic vesicle at 24 hpf. (Ba) represents gene expression domains regionalized along the AP and DV axes; (Bb) shows early markers of neurogenic and sensory specification. Gene expression domains that prefigure different regions of the inner ear, as well as cell fate markers are color-coded. Embryonic axes are indicated.
Fig. 3. Early regionalization and cell fate specification markers in the otocyst of amniotes and zebrafish. (A) Schematic drawings of amniotes otic vesicles. (Aa) represents a transverse section at E2-3 in chick and (Ab) shows a lateral view at E2-3. (B) Schematic lateral views of the zebrafish otic vesicle at 24 hpf. (Ba) represents gene expression domains regionalized along the AP and DV axes; (Bb) shows early markers of neurogenic and sensory specification. Gene expression domains that prefigure different regions of the inner ear, as well as cell fate markers are color-coded. Embryonic axes are indicated.  Fig. 4. Caudal hindbrain patterning. A schematic vertebrate hindbrain region is presented, with rhombomeres (r1-r7), the three first pharyngeal arches (PA1-3), the three streams of migrating neural crest cells (dotted lines) and the bilateral otic vesicles. Crest cells from r1-r2 migrate into PA1, crest cells from r4 migrate into PA2 and crest cells from r5 and r6 migrate into PA3. The expression patterns of regulatory genes are indicated and color-coded on the left for zebrafish and on the right for the mouse. The dotted lines for Hox genes indicate a transient expression, which is downregulated before the onset of morphologic segmentation: Hoxa1 (hoxb1b in zebrafish ) and its paralogue Hoxb1 (hoxb1a in zebrafish ) are activated at mid-gastrulation and present an anterior limit in the neural plate in the prospective hindbrain region, which later coincides with the r3/r4 boundary. Contrary to Hoxa1, Hoxb1 is maintained in r4 after the end of gastrulation and this expression in r4 requires Hoxa1 function. Regulatory interactions between the different genes are indicated. Arrows represent positive regulations and vertical bars represent negative regulations. Some of these regulatory interactions, but not all, have been shown to be direct. Note that some expression patterns (e.g. for Fgf genes) and regulatory interactions are different in these two species. Anterior is to the top.
Fig. 4. Caudal hindbrain patterning. A schematic vertebrate hindbrain region is presented, with rhombomeres (r1-r7), the three first pharyngeal arches (PA1-3), the three streams of migrating neural crest cells (dotted lines) and the bilateral otic vesicles. Crest cells from r1-r2 migrate into PA1, crest cells from r4 migrate into PA2 and crest cells from r5 and r6 migrate into PA3. The expression patterns of regulatory genes are indicated and color-coded on the left for zebrafish and on the right for the mouse. The dotted lines for Hox genes indicate a transient expression, which is downregulated before the onset of morphologic segmentation: Hoxa1 (hoxb1b in zebrafish ) and its paralogue Hoxb1 (hoxb1a in zebrafish ) are activated at mid-gastrulation and present an anterior limit in the neural plate in the prospective hindbrain region, which later coincides with the r3/r4 boundary. Contrary to Hoxa1, Hoxb1 is maintained in r4 after the end of gastrulation and this expression in r4 requires Hoxa1 function. Regulatory interactions between the different genes are indicated. Arrows represent positive regulations and vertical bars represent negative regulations. Some of these regulatory interactions, but not all, have been shown to be direct. Note that some expression patterns (e.g. for Fgf genes) and regulatory interactions are different in these two species. Anterior is to the top. 
 Fig. 6. Hindbrain signals involved in inner ear patterning in zebrafish and amniotes: current models. (A) In amniotes, the otic cup is positioned close to the dorsal half of the neural tube. At early stages of otic
development, only the dorsomedial half of the cup makes intimate contact with the hindbrain (Aa). As invagination proceeds, medial otic cells that at otic cup stage were in contact with the dorsal part of the hindbrain and were Wnt-responsive cells (blue dots in Aa), are now located in more ventral position (blue dots in Ab) and receive signals from the ventral aspect of the neural tube. Hh signals from the notochord and floorplate (red arrows) are received in the ventral part of the otic cup, directly, or indirectly through a relay mechanism involving the mesenchyme and are essential for cochlear specification and SAG formation. Putative FGF signals (green arrows) downstream of r5-r6 segmentation genes are received in dorsomedial otic tissue and are essential for vestibular fate. (B) In zebrafish, the otic vesicle receives dorsalising signals from the neural tube (presumably Wnt signals, blue arrows). Hh signals from the notochord and floorplate are received in the posteroventral otic vesicle (facing r5-r6) (Bb), where they specify posterior fate. In the anterior otocyst (facing r4) (Ba) FGF signaling is active and specifies anterior fate. Possibly as a consequence, Shh signal is antagonized (orange).
Fig. 6. Hindbrain signals involved in inner ear patterning in zebrafish and amniotes: current models. (A) In amniotes, the otic cup is positioned close to the dorsal half of the neural tube. At early stages of otic
development, only the dorsomedial half of the cup makes intimate contact with the hindbrain (Aa). As invagination proceeds, medial otic cells that at otic cup stage were in contact with the dorsal part of the hindbrain and were Wnt-responsive cells (blue dots in Aa), are now located in more ventral position (blue dots in Ab) and receive signals from the ventral aspect of the neural tube. Hh signals from the notochord and floorplate (red arrows) are received in the ventral part of the otic cup, directly, or indirectly through a relay mechanism involving the mesenchyme and are essential for cochlear specification and SAG formation. Putative FGF signals (green arrows) downstream of r5-r6 segmentation genes are received in dorsomedial otic tissue and are essential for vestibular fate. (B) In zebrafish, the otic vesicle receives dorsalising signals from the neural tube (presumably Wnt signals, blue arrows). Hh signals from the notochord and floorplate are received in the posteroventral otic vesicle (facing r5-r6) (Bb), where they specify posterior fate. In the anterior otocyst (facing r4) (Ba) FGF signaling is active and specifies anterior fate. Possibly as a consequence, Shh signal is antagonized (orange).