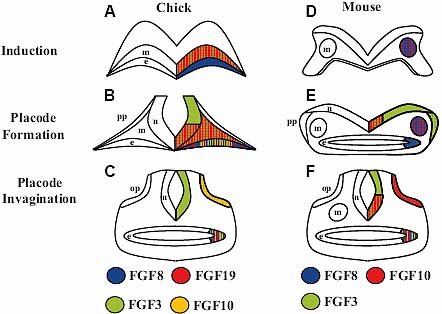
на ст. HH8 в поверхностной эктодерме интактного эмбриона, который неспособен индуцировать эктопические плакоды (Vendrell et al., 2000; Y. Alvarez and T.S., unpublished observations). Однако, имплантация кусочков FGF2 в мезодерму вблизи будущих отических плакод на ст. HH8
вызывает образование маленьких эктопических плакод с низкой частотой (V. Vendrell and T.S., unpublished observations). Сходным образом FGF2 индуцирует маленькие эктопические плакоды вблизи эндогенного отического пузырька после имплантации кусочков на ст. HH10 HH11 (Adamska et al. , 2001). Эта активность снова может отражать способность FGF2 активировать изоформы всех 4-х FGF рецепторов и тем самым способствовать также образованию эктопических отических плакод, хотя в меньшей степени, чем FGF3. FGF2 и FGF8 кусочки имплантированные в мезодерму также повышают экспрессию генов отических маркеров и размер нормального отического пузырька (Adamska et al. , 2001). Эти результаты могут отражать паттен-формирующую функцию передачи сигналов FGF в отическом пузырьке, что было также подтверждено на рыбках данио (Leger and Brand, 2002).
Достаточность FGFs из развивающегося заднего мозга для индукции эктопических отических плакод тестировалась на трансгенных мышах (Alvarez et al. , 2003). Разные члены семейства FGF эктопически экспрессировали в r3 и избыточно экспрессировали в r5 со ст. 3ss (Theil et al., 1998; Alvarez et al., 2003). Неправильная экспрессия Fgf3, чье эндогенное начало экспрессии в заднем мозге совпадает с этой стадией (Wright and Mansour, 2003a) обнаруживала лишь очень ограниченную способность индуцировать эктопические отические пузырьки (Alvarez et al., 2003). Напротив, неправильная экспрессия Fgf10, чье эндогенное начало экспрессии в заднем мозге происходило чуть позднее на ст. 5ss, приводило соответственно к образованию эктопических пузырьков рядом с r3-r5, которые также экспрессировали некоторые отические маркеры (Alvarez et al., 2003). Интересно, что сравнительно недавний анализ этих трансгенных животных показал, что эктопическая экспрессия Fgf8 сопровождает неправильно экспрессирующих Fgf10 эмбрионов, но не следует за эктопической экспрессией Fgf3, указывая тем самым на позитивную роль FGF8 во время индукции эктопических отических плакод (Zelarayan et al., 2007). Однако, эктопическая экспрессия Fgf8 в r3 и r5 ведет к ранней эмбриональной летальности и тем самым препятствует анализу трансгенных эмбрионов во время отической индукции (Alvarez et al., 2003 and unpublished observations). Сходным образом нулевые мутанты по Fgf8 выявили существенную роль для этого гена во время гаструляции и поэтому обнаруживающего раннюю эмбриональную летальность (Meyers et al., 1998). Т.о., поскольку трудно оценить специфическую роль раннего паттерна экспрессии Fgf8 в мезодерме и энтодерме на ст. E7-E8 во время отической индукции (Ladher et al. , 2005). Мутантные мыши, несущие гипоморфный или условный аллель, который инактивируется мозаично, начиная с E7 и далее, рядом с Fgf8 нулевым аллелем, формируют отические пузырьки (Ladher et al., 2005; Zelarayan et al., 2007). Следовательно, пока не получены доказательства уникальной потребности в FGF8 во время индукции внутреннего уха. Ткане-специфическая инактивация Fgf8 в мезодерме или энтодерме может обходить раннюю летальность и показывать уникальную потребность в FGF8 в этих тканях во время индукции внутреннего уха.
Мышиные мутанты по изоформе FGF receptor 2 IIIb, с которой соединяются FGF3 и FGF10 с высоким сродством, также формируют маленькие отические пузырьки (Pirvola et al., 2000). Наконец, хотя мышиный FGF15 достаточен для индукции отических маркеров на ст. 4/5 в ростральной эктодерме кур, Fgf15 нулевые мутантные эмбрионы мышей формируют нормальные отические пузырьки (Wright et al., 2004). Сходным образом, фенотипы внутреннего уха отсутствуют у нулевых мутантов FGF рецептору 4, с которым соединяется FGF15 с высоким сродством (Weinstein et al., 1998).
Двойные мутанты по Fgf3 и Fgf8 дают сходный фенотип ч двойными мутантами to Fgf3-/-/Fgf10-/- (Ladher et al., 2005; Zelarayan et al., 2007). Мутантные эмбрионы, несущие гипоморфный и нулевой аллель Fgf8 на гомозиготном нулевом мутантном Fgf3 фоне
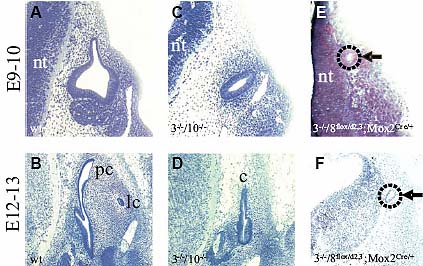
(Fgf3-/-/Fgf8neo/neo) не образуют отических пузырьков и лишены экспрессии отических маркеров в дорсальной части плакодной эктодермы (Ladher et al., 2005). Интересно, что эти мутантны обнаруживают также подавление экспрессии Fgf10 в мезодерме во время индукции внутреннего уха, указывая тем самым, Fgf3 и Fgf8 перекрываются в своей необходимости для нормальной экспрессии Fgf10. Сходным с Fgf3-/-/Fgf8neo/neo мутантами образом эмбрионы, несущие нулевой аллель и мозаично делетированный условный аллель Fgf8 на гомозиготном нулевом Fgf3 мутантном фоне ( Fgf3-/-/Fgf8flox/d2,3;Mox2Cre/+) также обнаруживают тяжелый фенотип, который возникает в результате образования микропузырьков, которые находятся в аномальном дорсальном положении вблизи нервной трубки (Fig. 2E; Zelarayan et al., 2007). Эти микропузырьки обнаруживают отсутствие или аномальную экспрессию отических маркеров. На более поздних стадиях эти микропузырьки неспособны дифференцироваться или полностью теряют отическую ткань (Fig. 2F; Zelarayan et al., 2007). Всё это вместе со сравнением фенотипов Fgf3-/-/Fgf10-/- и Fgf3/Fgf8 двойных мутантных комбинаций, указывает, что последние мутанты имеют несколько более тяжелые фенотипические изменения во внутреннем ухе (Ladher et al., 2005; Zelarayan et al., 2007). Это подтверждает более выраженную роль FGF8 скорее, чем FGF10 во время индукции внутреннего уха, возможно благодаря более ранней и более широко распространенной экспрессии Fgf8 в некоторых тканях, участвующих в отической индукции. Инактивация и Fgf8 и Fgf10 д. приводить к ещё более тяжелому фенотипу, т.к. Fgf8 и Fgf10 экспрессируются прежде Fgf3 и скорее всего, чтобы инициировать отическую индукцию в качестве ранних энтодермальных и/или мезодермальных сигналов.
Проверка заднего мозга у Fgf3
-/-/Fgf10
-/- and Fgf3
-/-/Fgf8
neo/neo мутантных эмбрионов показала отсутствие изменений в экспрессии маркеров заднего мозга, указывающее, что FGFs не действуют непосредственно на отическую индукцию посредством котроля за формированием паттерна заднего мозга, как это предполагается у рыбок данио (Wright and Mansour, 2003a; Ladher et al. , 2005). Т.к. рецепторы высокого сродства для FGF3 и FGF10 экспрессируются в преплакодной эктодерме, то по крайней мере, эти два FGFs могут действовать непосредственно, чтобы устанавливать экспрессию отических маркеров в будущей отической плакоде (Wright and Mansour, 2003a). Интересно, что более недавние исследования выявили. что эктопическая экспрессия
Fgf10 из заднего мозга достаточна, чтобы нормализовать развитие отических пузырьков у Fgf3
-/-/Fgf10
-/- мутантных эмбрионов (Zelarayan et al., 2007). Это указывает на то, что FGF сигнал из нервной ткани (заднего мозга) может инструктировать по-новому плакодную эктодерму у этих мутантов, чтобы формировать отические пузырьки. Т.к. формирование плакодной ткани лишь частично нарушается у мутантных Fgf3
-/-/Fgf10
-/- эмбрионов, то инициальные ступни индукции плакод д. поддерживаться за счет экспрессии
Fgf8, который присутствует в различных тканях во время ранней отической индукции (Ladher et al. , 2005). Fgf3 и Fgf10 т.о., возможно, усиливают и поддерживают индукцию внутреннего уха, инициируемую с помощью Fgf8.
Functional analysis of FGFs in zebrafish, medaka and
Xenopus inner ear induction
Эффекты потери FGF3 или FGF8 на индукцию внутреннего уза у рыбок данио были тестированы у мутантов и с помощью morpholino нокдауна. Используя оба подхода, наблюдали уменьшение размеров отических пузырьков вместе с уменьшением или потерей отических маркеров (Phillips et al., 2001; Leger and Brand, 2002; Maroon et al., 2002; Liu et al., 2003). Размеры отических пузырьков у Fgf8 morphants выглядели несколько меньшими, чем у Fgf3 morphants, возможно из-за непрекрываемой потребности в FGF8 во время формирования паттерна заднего мозга, влияющего на отическую индукцию (Wiellette and Sive, 2004). Центральная роль заднего мозга во время индукции внутреннего уха также подчеркивается тем фактом, что только клетки заднего мозга дикого типа восстанавливают экспрессию Pax2 у Fgf8 мутантных эмбрионов в экспериментах с трансплантациями клеток (Leger and Brand, 2002).
Более того эктопическая экспрессия Fgf3 или Fgf8 индуцирует отические маркеры и формирование эктопических отических пузырьков у рыбок данио, Medaka и Xenopus (Lombardo et al. , 1998; Phillips et al. , 2001; Bajoghli et al. , 2004; Hans et al. , 2004; Phillips et al. , 2004; Solomon et al., 2004). Первоначально косвенный способ для эктопической экспрессии и Fgf3 и Fgf8 был достигнут обработкой рыбок данио дикого типа ретиноевой кислотой (Phillips et al., 2001). Это приводило к экспансии доменов экспрессии Fgf3 и Fgf8 и отического маркера Pax8 и приводило к образованию эктопических пузырьков. Однако, обработка ретиноевой кислотой может оказывать плейотропные эффекты в таких экспериментах, т.к. нервная пластинка posteriorized и область заднего мозга расширяется (Phillips et al. , 2001).
Более недавние эксперименты были использованы для демонстрации, что FGF-зависимая отическая индукция с помощью ретиноевой кислоты может также происходить без нарушения формирования паттерна нервной пластинки (Hans et al. , 2007). Сходным образом, плазмидой обусловленная эктопическая экспрессия Fgf3 или Fgf8 на 8-клеточной стадии ведет к эктопической или расширенной экспрессии отических маркеров Pax8, Pax2a и Dlx3b без экспансии нервной пластинки (Phillips et al., 2004; Solomon et al., 2004). Чтобы лучше контролировать время эктопической экспрессии FGF во время отической индукции у эмбрионов, использовали индуцируемые теплом промоторы для Fgf8 у Medaka и недавно у рабок данио (Bajoghli
et al. , 2004; Hans et al. , 2007). В последнем случае ранняя эктопическая экспрессия Fgf8 вплоть до ст. средней гаструлы, как было установлено, действительно редуцирует количество отической ткани, возможно из-за её эффектов на формирование дорсо-вентрального паттерна, что негативно влияет на экспрессию Foxi1 и Dlx3b, которые необходимы в качестве факторов компетентности для FGF-зависимой отической индукции. Напротив, более крупные отческие пузырьки получались, когда эктопическая экспрессия Fgf8 осуществлялась между концом гаструлы и ранними стадиями сегментации, возможно благодаря индукции более крупной области компетентной эктодермы, чтобы принять отическую судьбу (Hans et al., 2007). Эксперименты по выявлению перекрываемости FGF3 и FGF8 при формировании отических плакод продемонстрировали это в некоторых исследованиях (Phillips et al., 2001; Leger and Brand, 2002; Maroon et al., 2002; Liu et al. , 2003). Все исследования согласуются, что мутанты или морфанты рыбок данио, лишенные FGF3 и FGF8 обнаруживают тяжелую потерю или отсуствие отических тканей и маркеров. Однако, существуют некоторые расхождения относительно присутствия или отсутствия самых ранних маркеров, указывающих на отическую судьбу, Pax8, у Fgf3/Fgf8 двойных мутантов. В то время как большинство исследований описывает тяжелую редукцию или отсутствие этого маркера (Phillips et al., 2001; Leger and Brand, 2002; Liu et al., 2003) в одном исследовании сообщается, что поддержание нормальной экспрессии Pax8 снижено наполовину у двойных мутантных эмбрионов (Maroon et al., 2002). В сходном эксперименте эти авт. продемонстрировали также неизменную экспрессию Pax8 после блокирования передачи сигналов через FGF рецепторы с помощью SU5402. Напротив, Leger and Brand (2002) отмечали отсутствие экспрессии Pax8 при использовании даже более низких концентраций SU5402, чем у Maroon et al. (2002). Больше согласуются оба исследования относительно отсутствия отического маркера Pax2 после обработки SU5402 до сегментации, но отличаются опять же по эффектам SU5402 на поддержание Pax2 на более поздних стадиях (Leger and Brand, 2002; Maroon et al., 2002). Оставшаяся отическая ткань у некоторых Fgf3/Fgf8 двойных мутантов, как было показано, согласуется только с немногими рассеянными плакодными клетками, указывая, что способность формировать плакодный эпителий потеряна (Liu et al., 2003). В случае двойных мутантных эмбрионов, у которых экспрессия Pax8 не обнаруживалась, не наблюдались и морфологические признаки образования отических плакод, поэтому можно сделать вывод, что достигается полная потеря индукции отической плакоды.
Потеря FGF3 и FGF8 затрагивает также развитие задней части заднего мозга (Maves et al. , 2002; Walshe et al. , 2002), где мишени для передачи сигналов через FGF рецепторы подавлены в заднем мозге и отической области (Maroon et al. , 2002). Следовательно, область заднего мозга, где ко-экспрессируются Fgf3 и Fgf8 играет важную роль в индукции внутреннего уха у рыбок данио. Однако, оба FGFs экспрессируются также в др. тканях, участвующих в индукции внутреннего уха, таких как цефалическая параксиальная мезодерма (Mendonsa and Riley, 1999; Phillips et al., 2001; Thisse et al. , 2001; Nechiporuk et al. , 2007). Мутанты или морфанты рыбок данио по one-eyed pinhead (oep), которые лишены мезоэнтодермальной ткани, расположенной под отической плакодой, обнаруживают потерю Fgf3 и Fgf8 из их мезоэнтодермальных доменов экспрессии (Phillips et al. , 2001; Leger and Brand, 2002; Nechiporuk et al., 2007). В обоих случаях экспрессия в заднем мозге Fgf3 и Fgf8 не затрагивалась во время индукции внутреннего уха. Однако, всё же в одном исследовании сообщается о нормальной экспрессии отических маркеров, включая Pax8 (Leger and Brand, 2002), Phillips et al. (2001) показали, что экспрессия этого отического маркера снижена, что указывает на возможную потребность в FGF3 и/или FGF8 для индукции внутреннего уха у заднего мозга.
Следовательно, сегодня неясно, какие домены экспрессии Fgf3 и Fgf8 необходимы для индукции внутреннего уха у рыбок данио. Модель, которая рассматривает передачу сигналов FGF в кооперации с Wnt8 во время индукции отических плакод, первоначально была предложена при анализе эмбрионов кур была детализирована на рыбках данио(Ladher et al. , 2000; Phillips et al. , 2004). Эктопическая экспрессия Fgf3 или Fgf8, как было показано, достаточна для индукции эктопических отических плакод в отсутствие Wnt8. Однако, глобальная эктопическая экспрессия Wnt8 также индуцирует эктопическую отическую ткань, но этот эффект, как было установлено, зависит от экспансии доменов экспрессии Fgf3 и Fgf8. Наконец, отическая индукция и экспрессия Fgf3 и Fgf8 оказывалась задержанной у морфантов Wnt8. Напротив, экспрессия Wnt8 в заднем мозге также была редуцирована у двойных мутантов Fgf3/Fgf8, это позволяет постулировать существование позитивной петли обратной связи, которая гарантирует своевременную экспрессию Fgf3 и Fgf8 в заднем мозге, которая затем действует непосредственно на преплакодные клетки, индуцируя отические судьбы(Phillips et al., 2004).
В некоторых исследованиях были проанализировано взаимодействие передачи сигналов FGF3 и FGF8 с транскрипционными факторами, экспрессирующимися во время индукции внутреннего уха в преплакодной поверхностной эктодерме. Foxi1, как было показано, необходим для индукции экспрессии Pax8, обеспечиваемой с помощью передачи сигналов FGF (Hans et al. , 2004; Solomon et al. , 2004; Hans et al. , 2007). Foxi1 поэтому был назван как фактор компетентности для FGF3 и FGF8, который делает возможным приобретение отической судьбы преплакодыми клетками, что демонстрируется экспрессией Pax8 (Nissen et al. , 2003; Hans et al., 2004; Solomon et al., 2004; Hans et al. , 2007). С др. стороны, Pax8 morphants обнаруживают более выраженные дефекты во время индукции внутреннего уха на Fgf8 мутантном фоне, чем в присутствии Fgf3 morpholinos, снова указывая на более доминантную роль FGF8 по сравнению с FGF3 (Wiellette and Sive, 2004; Mackereth et al. , 2005). Вторая пара факторов компетентности для передачи сигналов FGF, Dlx3b и Dlx4b, необходима для собственно инициации экспрессии Pax2a на более поздних стадиях (Hans et al., 2004; Mackereth et al., 2005). Экспрессия Sox9a, как установлено, зависит от передачи сигналов FGF посредством экспрессии Pax8, а позднее поддержание экспрессии Sox9a зависит от Pax2a (Hans et al. , 2004). Наконец, у рыбок данио Atoh1b, гомолог Atoh1, который необходим для дифференцировки волосковых клеток у мышей (Woods et al., 2004), как недавно было показано, необходим в преплакодной эктодерме рыбок данио (Millimaki et al. , 2007). Atoh1b ко-экспрессируется с Pax8 в преплакодной эктодерме во время ранней сегментации и нуждается в передаче сигналов FGF. Более детальные схемы взаимодействия транскрипционных факторов и предачи сигналов FGF во время отической индукции можно найти в исследованиях Hans et al., (2004), Solomon et al. (2004) и Millimaki et al. (2007).
У
Xenopus, экспрессия доминантно негативного FGF рецептора выявляет редукцию экспрессии
Sox9 (Saint-Germain et al. ,
2004). Morpholinos, направленные против
Sox9 ведут к отсутствию экспрессии
Pax8, а отические пузырьки не образуются. Это привело к предположению, что Sox9 может быть иерархически выше Pax8, но это можно объяснить и позитивной петлей обратной связи между генами, чтоб поддерживать экспрессию один другого (Liu et al. , 2003; Hans et al. , 2004).
Summary and outlook
The expression studies of different FGF members during inner
ear induction confirm their sequential presence in endomesodermal
and neural tissue during inner ear induction. Direct evidence for
the necessity of a single FGF member during the initiation of inner
ear induction (before otic specification) only currently exists for
FGF8 in the chicken endoderm (Ladher et al., 2005). Moreover,
the sufficiency and necessity of FGF8 to induce FGF19 in the
overlying mesoderm indicates that this event represents an
important step during chicken inner ear induction. However, at
present direct evidence for the necessity of FGF19 for inner ear
induction is lacking. Since Fgf3 is induced by FGF19 and both are
coexpressed in the mesoderm (Ladher et al. , 2000; Kil et al. ,
2005) the necessity and sufficiency of FGF3 in the mesoderm for
the early phase of inner ear induction is certainly worth testing.
The significance of the early mesodermal and/or endodermal
expression of Fgf8 together with Fgf10 in mouse or Fgf3 in
zebrafish during inner ear induction has not yet been directly
addressed. Tissue-specific inactivation of Fgf8 or Fgf10 in a Fgf3
homozygous null mutant background during this phase will pro-
vide useful information on the necessity of these expression domains for otic induction in the mouse. The second phase of
inner ear induction (after otic specification and before otic commit-
ment) is clearly defined by the conserved expression of Fgf3 in the
developing hindbrain in all vertebrates. Since in the mouse, Fgf3
expression is not present in endoderm or mesoderm at or before
this stage, the effects on inner ear induction seen in Fgf3-/-/Fgf10-/- and Fgf3/Fgf8 double knockout mice have to be attributed
entirely to the loss of hindbrain Fgf3 expression. Interestingly, at
this stage Fgf10 and Fgf19 which are initially expressed in the
mesoderm are now present in the ventral part of the hindbrain in
mouse and chicken, respectively, from where they may partici-
pate in otic induction (Ladher et al., 2000; Alvarez et al., 2003).
Knockdown of Fgf3 in chick hindbrain interferes with placode
invagination but more severe phenotypes may be obtained upon
inactivation at an earlier stage (Zelarayan et al., 2007).
Fgf3/Fgf8 double mutants in zebrafish have a more severe
phenotype than both Fgf3-/-/Fgf10-/- and Fgf3/Fgf8 double mutants in mouse. While the zebrafish mutants often completely lack
placodal tissue (Phillips et al. , 2001; Leger and Brand, 2002),
mouse mutants usually still form some placodal ectoderm or
microvesicles (Alvarez et al., 2003; Wright and Mansour, 2003a;
Ladher et al. , 2005). These phenotypes may be caused by a
complete loss of Pax8 expression in the zebrafish double mu-
tants, whereas this marker is reduced but still present in the
double mouse mutants. In contrast, Pax2 expression which is
activated after Pax8 expression during otic development, is more
consistently absent from placodal tissue in both zebrafish and
mouse FGF double mutants. The residual Pax8 expression at
(and possibly before) E8 in mouse FGF double mutants may be
sufficient for the formation of some placodal tissue. However, by
analogy to the zebrafish, absence of Pax2 and Dlx genes then
may also lead to the loss of responsiveness to FGF signalling in
the murine otic placode and thus to the formation of microvesicles
or complete absence of otic tissue at later stages.
It has been suggested that the ventral part of the placodal
ectoderm, which continues to express some otic genes in FGF
double mouse mutants, may contribute to the epibranchial pla-
codes (Groves, 2005). In zebrafish it has recently been shown
that Sox3 defines the common primordium of the otic and
epibranchial placodes (Sun et al. , 2006; Nikaido et al. , 2007). This
Sox3-positive primordium then segregates into a Pax2a-positive
medial area and a Pax2a-negative lateral area, giving rise to the
otic and epibranchial placodes, respectively. Disruption of FGF
signalling in FGF zebrafish mutants or by using SU5402 leads to
a loss of Sox3 expression and a failure to form the epibranchial
placodes (Sun et al., 2006; Nechiporuk et al., 2007; Nikaido et al.,
2007). It will thus be interesting to further define the differential
requirements for the induction of the otic placode versus the
epibranchial placode, for example by examining expression of
Sox3 and the formation of the epibranchial placode in mouse FGF
double mutants.
Сайт создан в системе
uCoz